- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аліциклічні вуглеводні презентация
Содержание
- 1. Аліциклічні вуглеводні
- 2. Аліциклічні вуглеводні ще називаються циклопарафінами, циклоалканами або,
- 3. 2. Ансамблі кілець
- 4. 3. Спіранові вуглеводні Мають один спільний атом
- 5. 4. Місткові вуглеводні Це сполуки, які
- 6. 5. Поліциклічні вуглеводні містять три-, чотири- і
- 7. ІЗОМЕРІЯ АЛІЦИКЛІЧНИХ ВУГЛЕВОДНІВ 1. Ізомерія розміру
- 8. 3. Геометрична (цис-, транс-)ізомерія
- 9. СПОСОБИ ОДЕРЖАННЯ У промисловості більшість аліциклічних
- 10. До головних лабораторних методів одержання циклоалканів відносять
- 11. Для одержання макроциклічних вуглеводнів (що містять в
- 12. 3. Естерна конденсація естерів двоосновних кислот (за
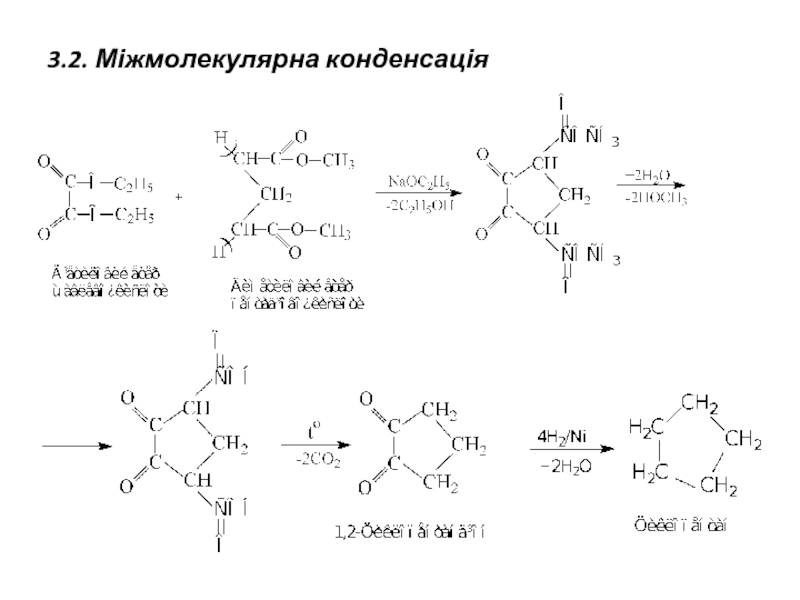
- 13. 3.2. Міжмолекулярна конденсація
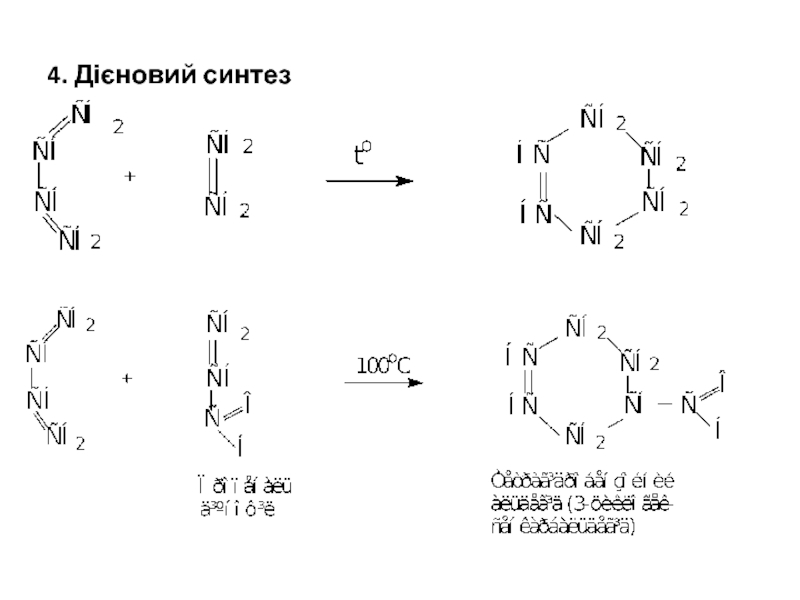
- 14. 4. Дієновий синтез
- 15. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Циклоалкани (С3-С4)
- 16. Відносну стійкість циклоалканів Байєр пояснював напругою,
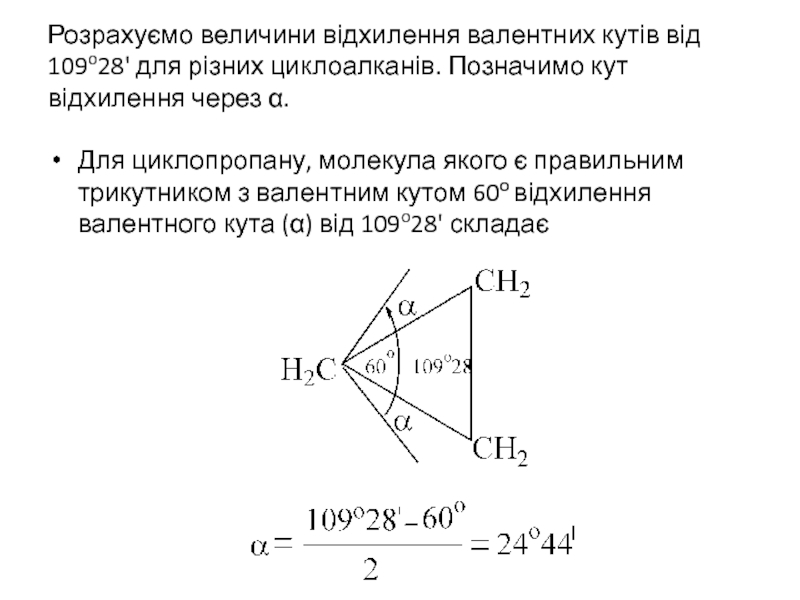
- 17. Розрахуємо величини відхилення валентних кутів від 109o28'
- 18. Для циклобутану
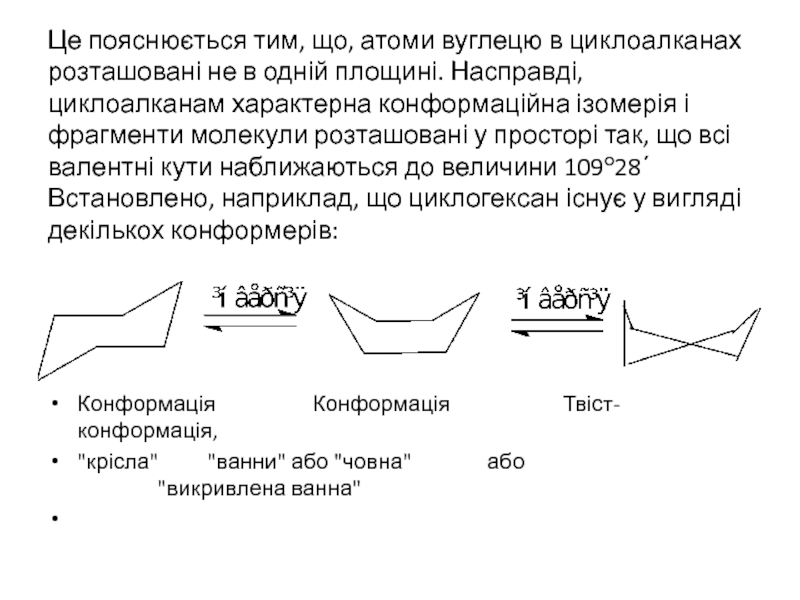
- 19. Це пояснюється тим, що, атоми вуглецю в
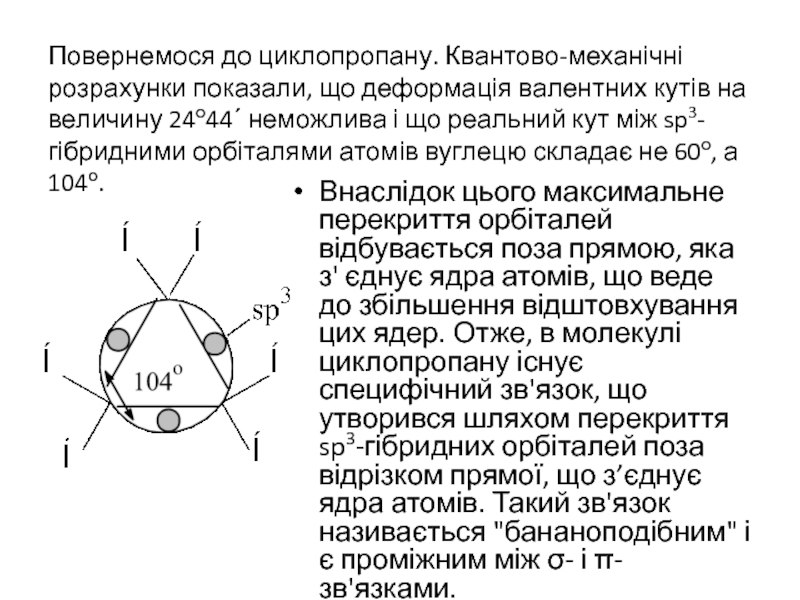
- 20. Повернемося до циклопропану. Квантово-механічні розрахунки показали, що
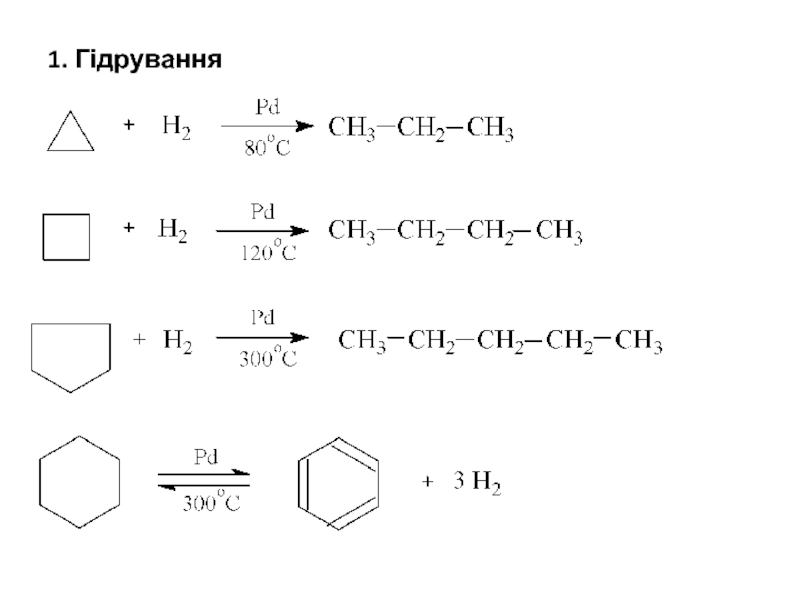
- 21. 1. Гідрування
- 22. Як видно зі схеми, циклопропан гідрується
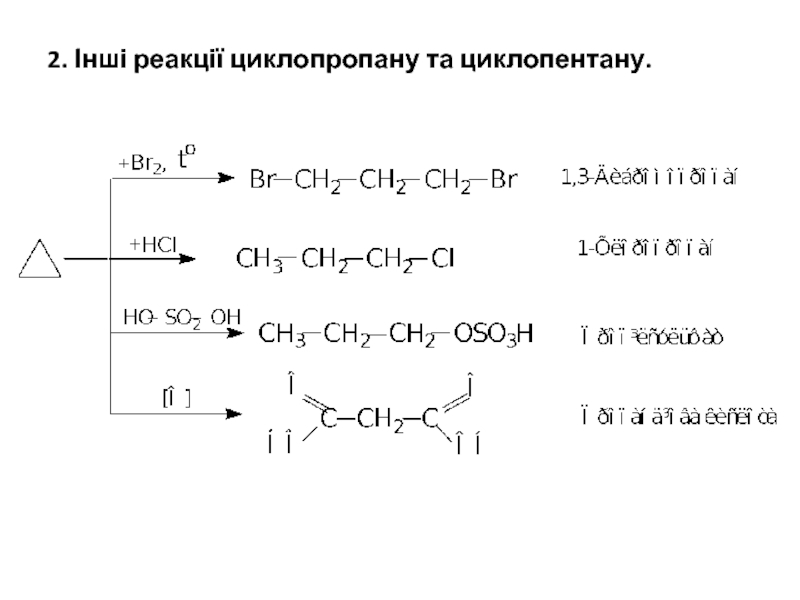
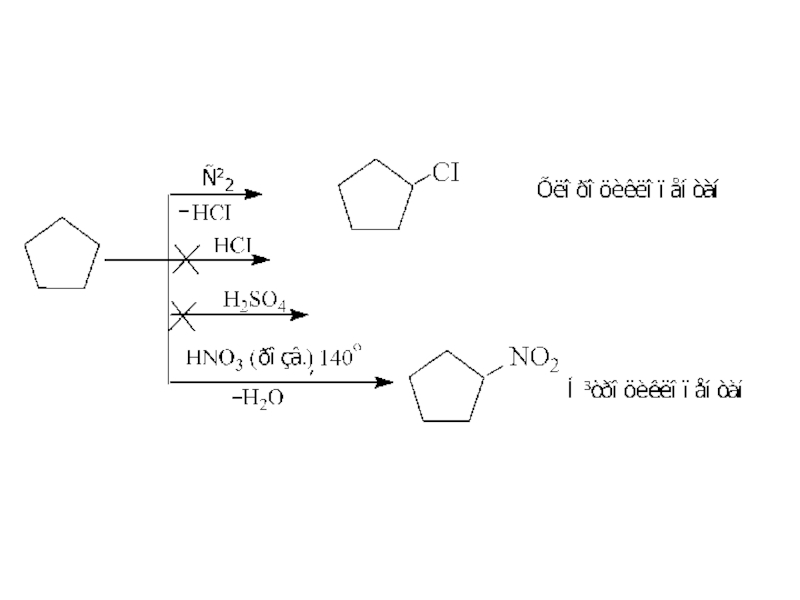
- 23. 2. Інші реакції циклопропану та циклопентану.
- 25. Порівняння цих двох схем показує, що
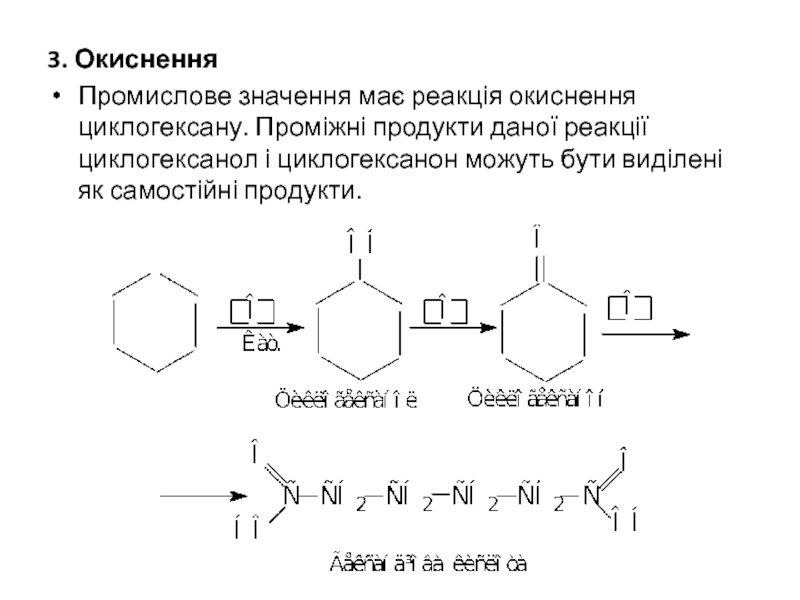
- 26. 3. Окиснення Промислове значення має реакція
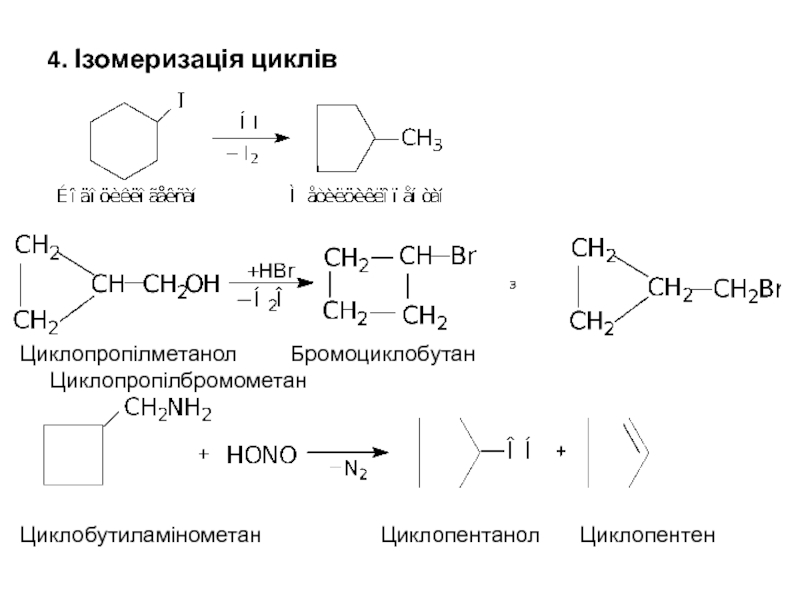
- 27. 4. Ізомеризація циклів
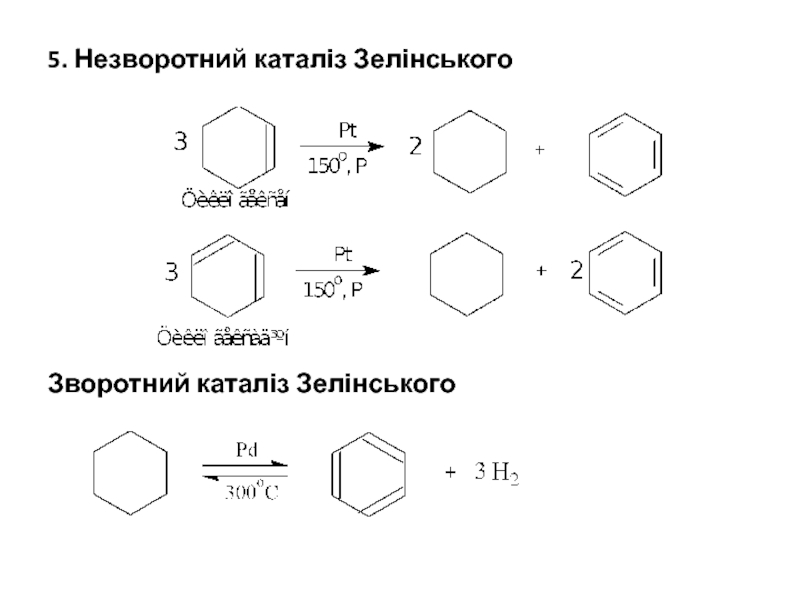
- 28. 5. Незворотний каталіз Зелінського Зворотний каталіз Зелінського
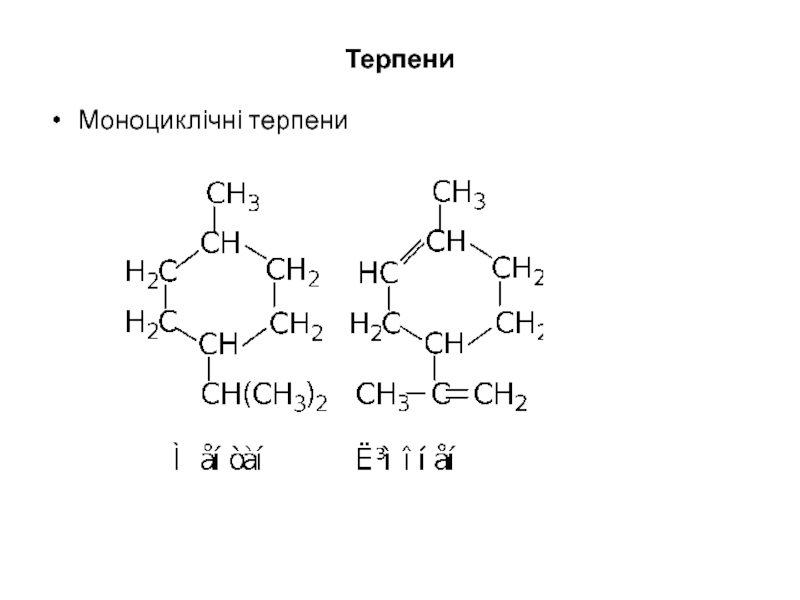
- 29. Терпени Моноциклічні терпени
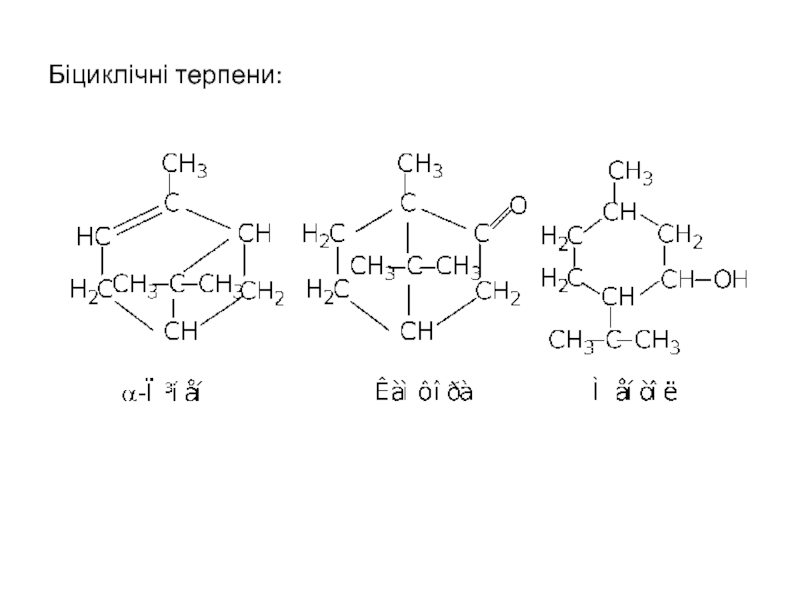
- 30. Біциклічні терпени:
Слайд 1АЛІЦИКЛІЧНІ ВУГЛЕВОДНІ
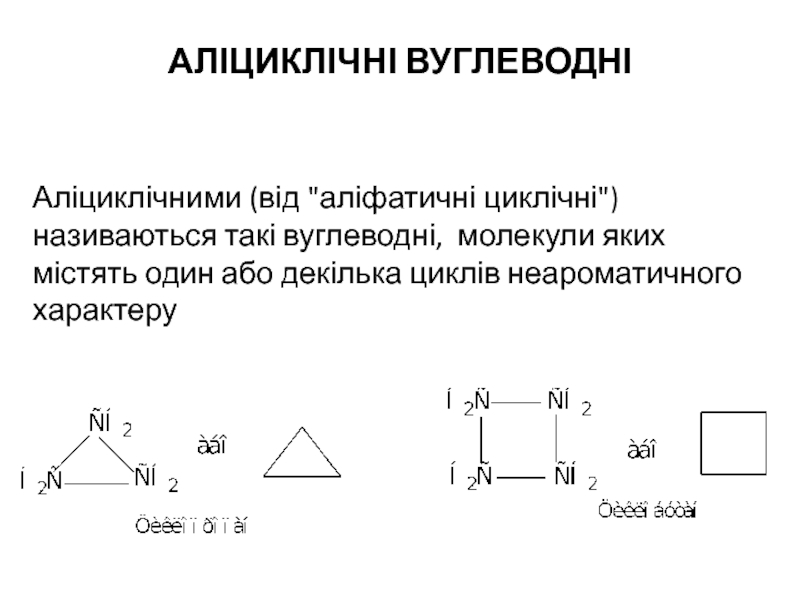
Аліциклічними (від "аліфатичні циклічні") називаються такі вуглеводні, молекули яких містять
Слайд 2Аліциклічні вуглеводні ще називаються циклопарафінами, циклоалканами або, якщо вони містять в
За аналогією до вуглеводнів з відкритим ланцюгом, серед аліциклічних також можна виділити циклоалкани (нема кратних зв'язків), циклоалкени (один подвійний зв'язок), циклоалкіни (один потрійний зв'язок) тощо.
Назви аліциклічних вуглеводнів утворюють додаванням до назви відповідного ациклічного вуглеводня префікса цикло-.
За іншою класифікацією аліциклічні вуглеводні поділяються на моно-, бі-, три- та поліциклічні - залежно від числа циклів в їх молекулах.
Слайд 3
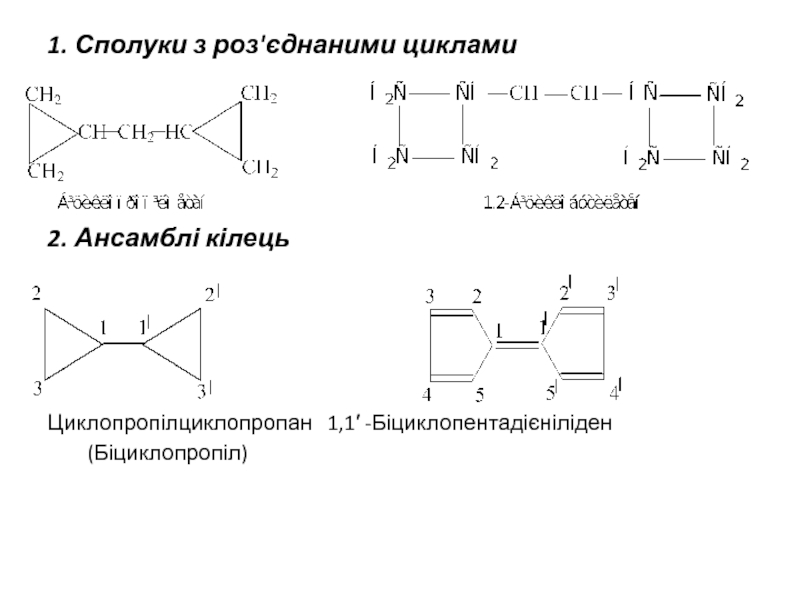
2. Ансамблі кілець
Циклопропілциклопропан 1,1′ -Біциклопентадієніліден
(Біциклопропіл)
1. Сполуки з роз'єднаними циклами
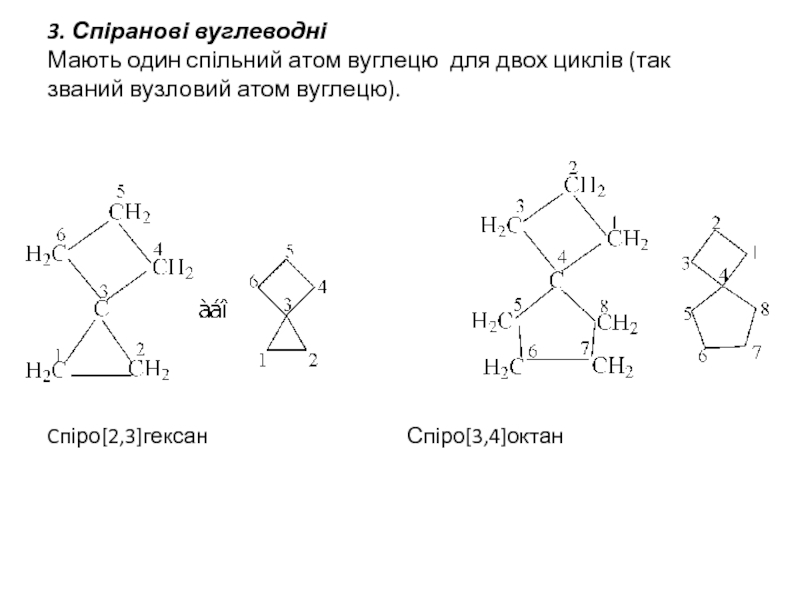
Слайд 43. Спіранові вуглеводні Мають один спільний атом вуглецю для двох циклів (так
Cпіро[2,3]гексан Спіро[3,4]октан
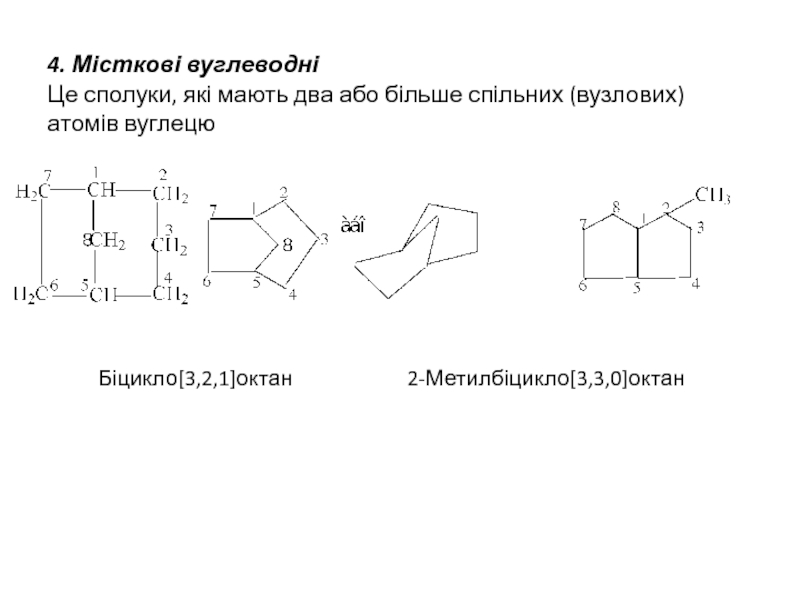
Слайд 5 4. Місткові вуглеводні Це сполуки, які мають два або більше спільних (вузлових)
Біцикло[3,2,1]октан 2-Метилбіцикло[3,3,0]октан
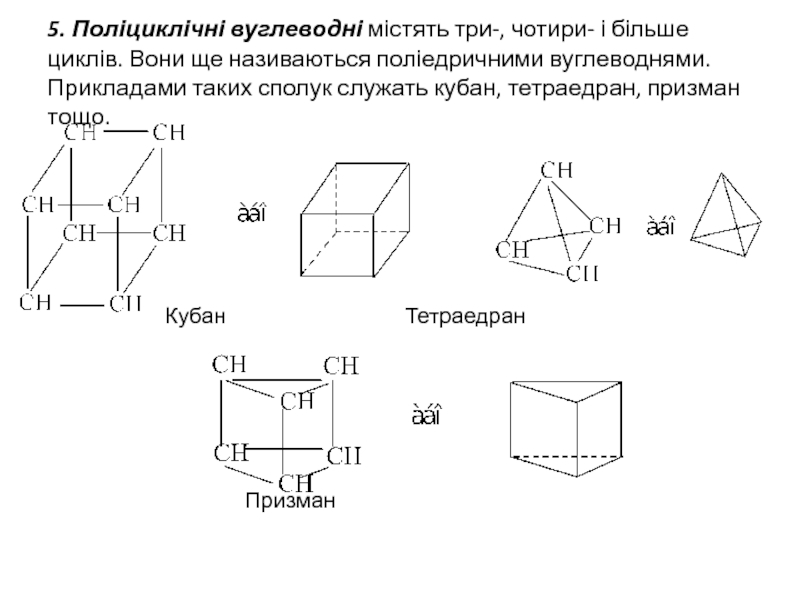
Слайд 65. Поліциклічні вуглеводні містять три-, чотири- і більше циклів. Вони ще
Кубан Тетраедран
Призман
Слайд 7ІЗОМЕРІЯ АЛІЦИКЛІЧНИХ ВУГЛЕВОДНІВ
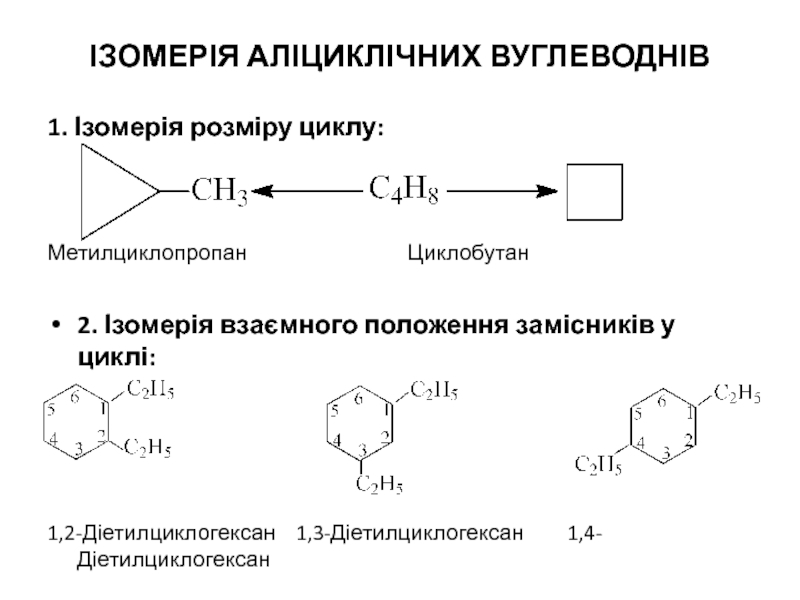
1. Ізомерія розміру циклу:
Метилциклопропан Циклобутан
2. Ізомерія взаємного положення замісників у
1,2-Діетилциклогексан 1,3-Діетилциклогексан 1,4-Діетилциклогексан
Слайд 8
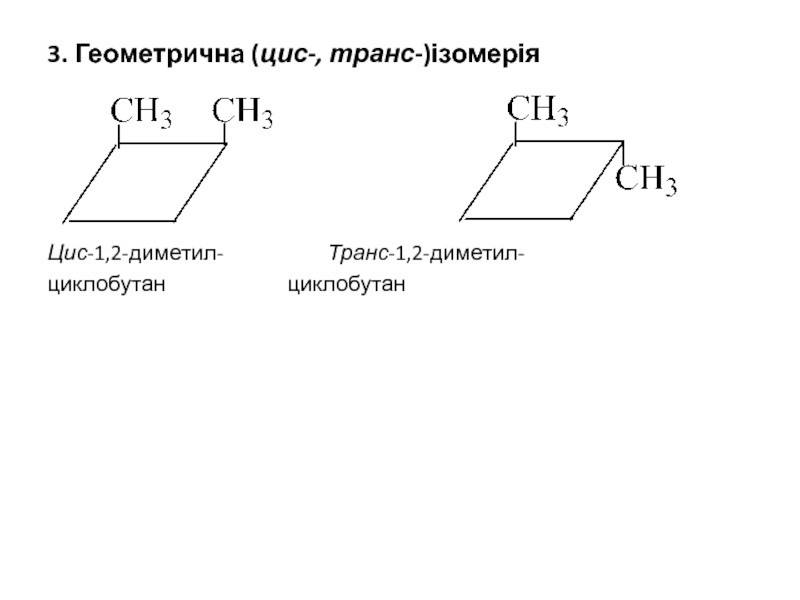
3. Геометрична (цис-, транс-)ізомерія
Цис-1,2-диметил- Транс-1,2-диметил-
циклобутан циклобутан
Слайд 9СПОСОБИ ОДЕРЖАННЯ
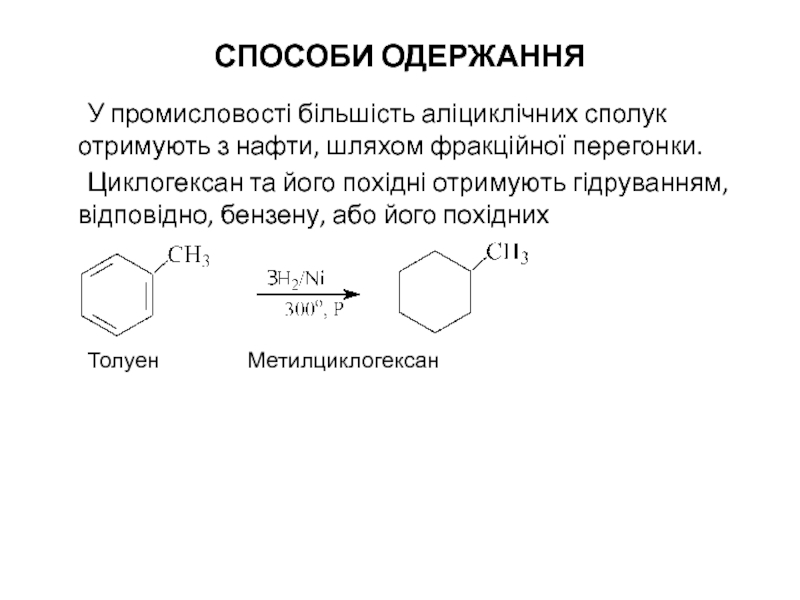
У промисловості більшість аліциклічних сполук отримують з нафти, шляхом фракційної
Циклогексан та його похідні отримують гідруванням, відповідно, бензену, або його похідних
Толуен Метилциклогексан
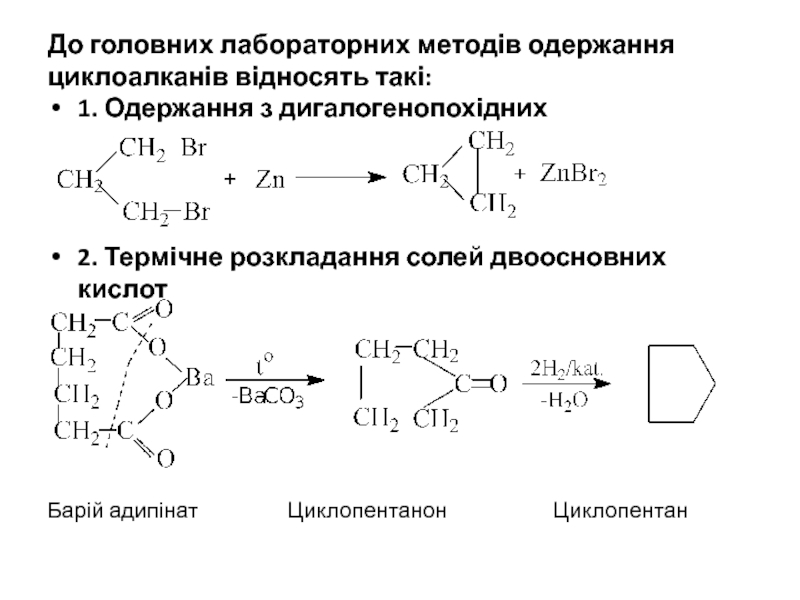
Слайд 10До головних лабораторних методів одержання циклоалканів відносять такі:
1. Одержання з дигалогенопохідних
2.
Барій адипінат Циклопентанон Циклопентан
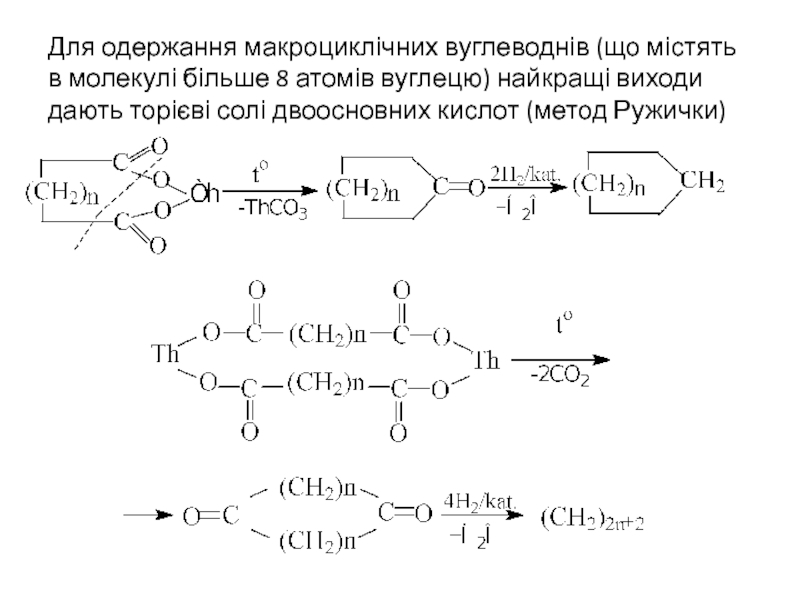
Слайд 11Для одержання макроциклічних вуглеводнів (що містять в молекулі більше 8 атомів
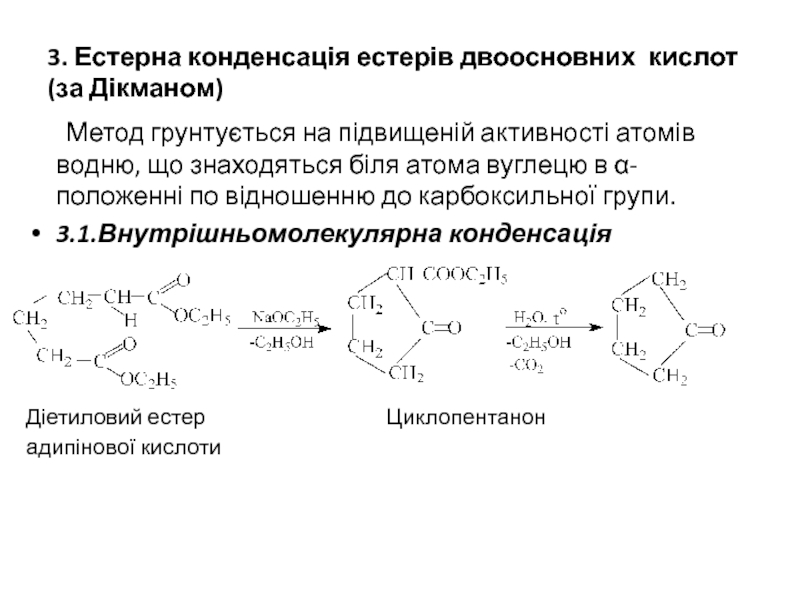
Слайд 123. Естерна конденсація естерів двоосновних кислот (за Дікманом)
Метод грунтується на підвищеній
3.1.Внутрішньомолекулярна конденсація
Діетиловий естер Циклопентанон
адипінової кислоти
Слайд 15ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Циклоалкани (С3-С4) - це гази, (С5-С10) - безбарвні
Хімічні властивості циклопарафінів в значній мірі залежать від розмірів їх циклів. Так циклопропан, який має найменший цикл, здатний до реакцій приєднання з розривом циклу і за своїми хімічними властивостями нагадує алкени. Для циклобутану також характерні реакції приєднання з розривом циклу, але їх протікання вимагає жорсткіших умов. Найбільшу стійкість мають п'яти- та шестичленні цикли. Останні не розщеплюються при дії на холоді брому, озону, перманганату калію тощо і в цьому плані вони більше нагадують алкани.
В чому ж причина такої різної поведінки циклоалканів?
Слайд 16
Відносну стійкість циклоалканів Байєр пояснював напругою, що виникає в циклі при
Слайд 17Розрахуємо величини відхилення валентних кутів від 109o28' для різних циклоалканів. Позначимо
Для циклопропану, молекула якого є правильним трикутником з валентним кутом 60о відхилення валентного кута (α) від 109o28' складає
Слайд 18Для циклобутану
Для циклопентану α = 0o4', для циклогексану (α =
Слайд 19Це пояснюється тим, що, атоми вуглецю в циклоалканах розташовані не в
Конформація Конформація Твіст-конформація,
"крісла" "ванни" або "човна" або "викривлена ванна"
Слайд 20Повернемося до циклопропану. Квантово-механічні розрахунки показали, що деформація валентних кутів на
Внаслідок цього максимальне перекриття орбіталей відбувається поза прямою, яка з' єднує ядра атомів, що веде до збільшення відштовхування цих ядер. Отже, в молекулі циклопропану існує специфічний зв'язок, що утворився шляхом перекриття sp3-гібридних орбіталей поза відрізком прямої, що з’єднує ядра атомів. Такий зв'язок називається "бананоподібним" і є проміжним між σ- і π-зв'язками.