- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические свойства алкенов презентация
Содержание
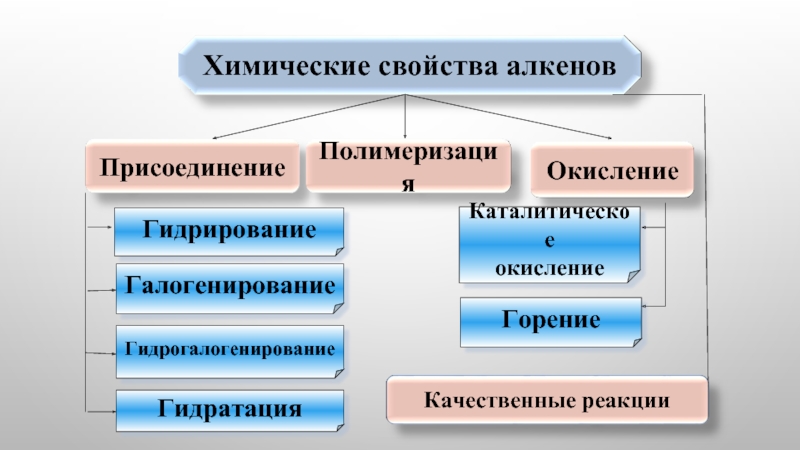
- 1. Химические свойства алкенов
- 2. Гидрирование Галогенирование Гидрогалогенирование Гидратация Горение Каталитическое окисление
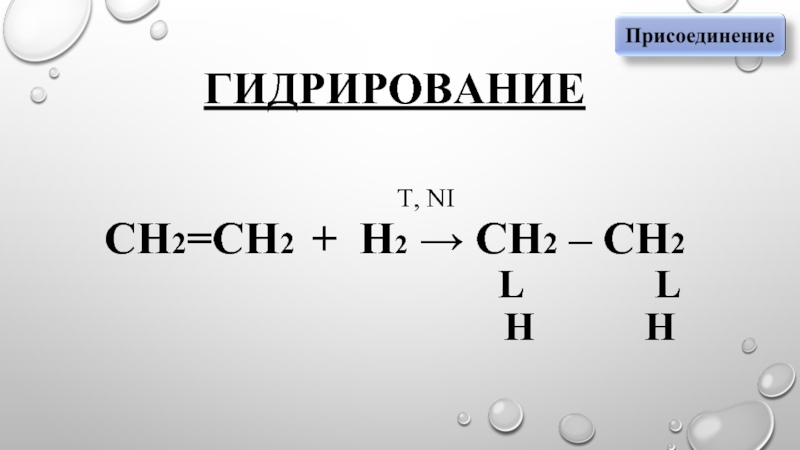
- 3. ГИДРИРОВАНИЕ
- 4. ГАЛОГЕНИРОВАНИЕ СН2=СН2 + CI2
- 5. ГИДРОГАЛОГЕНИРОВАНИЕ СН3–СН=СН2 + Н:CI→
- 6. ГИДРАТАЦИЯ
- 7. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ n(СН2 = СН2)
- 8. КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ 1. В ПРИСУТСТВИИ ХЛОРИДОВ
- 10. СН2=СН2 + BR2 → СН2–СН2
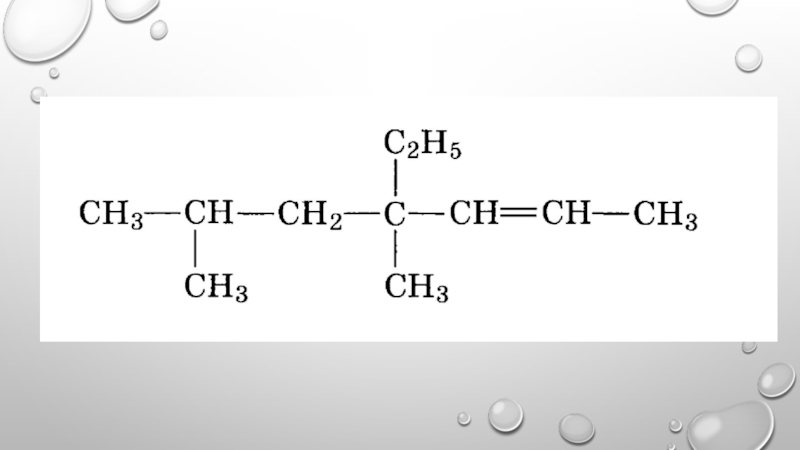
- 12. 3,3- ДИМЕТИЛПЕНТЕН-1 2,4-ДИМЕТИЛГЕКСЕН-2 2,4,4-ТРИМЕТИЛПЕНТЕН-2
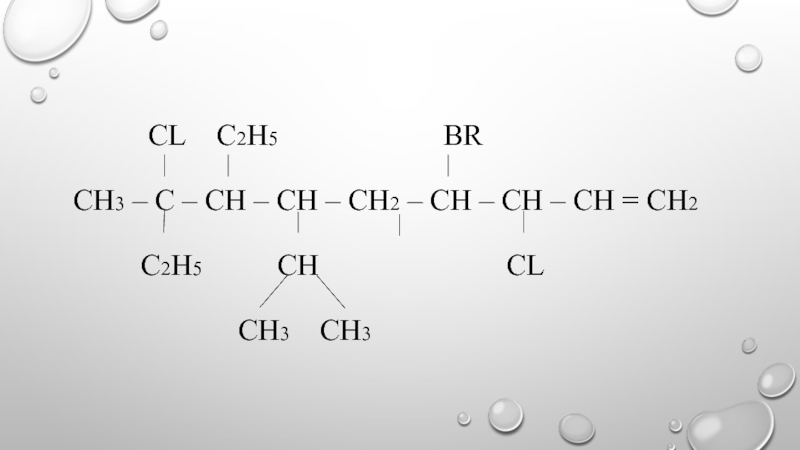
- 15. 2,3,4,6-ТЕТРАМЕТИЛ-2,7-ДИХЛОР-5,6-ДИЭТИЛОКТЕН-4 2,8,8-ТРИБРОМ-3,9,9-ТРИМЕТИЛ-5-ИЗОПРОПИЛ-6-ХЛОРДЕЦЕН-1
- 16. CL
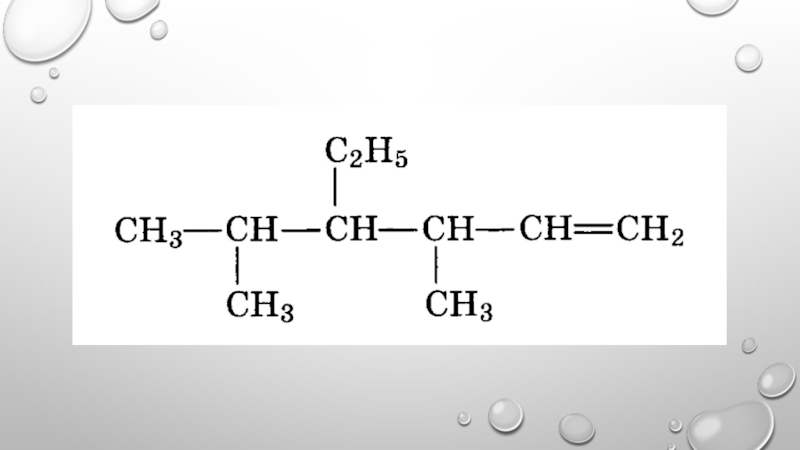
- 17. 4-МЕТИЛ-3,3-ДИЭТИЛПЕНТЕН-1 2-БРОМБУТЕН-2 2,4-ДИБРОМ- 3,5- ДИМЕТИЛ- 4- ЭТИЛГЕНСЕН-1
Слайд 5ГИДРОГАЛОГЕНИРОВАНИЕ СН3–СН=СН2 + Н:CI→ СН3–СН–СН2
L L
Н CI
1-ХЛОРПРОПАН
ПРАВИЛО МАРКОВНИКОВА
ПРИСОЕДИНЕНИЕ ВОДОРОДА ПРОИСХОДИТ К НАИБОЛЕЕ ГИДРИРОВАННОМУ АТОМУ УГЛЕРОДА ПРИ ДВОЙНОЙ УГЛЕРОД-УГЛЕРОДНОЙ СВЯЗИ.
Слайд 7РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
n(СН2 = СН2) → (- СН2 – СН2 -)n
кat,t,p
этилен
полиэтилен
мономер структурное звено полимера
мономер структурное звено полимера
Слайд 8КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ 1. В ПРИСУТСТВИИ ХЛОРИДОВ МЕДИ И ПАЛЛАДИЯ:
КАТ.
2 СН2=СН2 + О2 → 2 СН3–СОН
2.В ПРИСУТСТВИИ СЕРЕБРА, ПРИ T 150-350 С
КАТ.
2 СН2=СН2 + О2 → 2 СН2–СН2
О
Слайд 9
РЕАКЦИЯ ВАГНЕРА
3СН2=СН2 + 4Н2О + 2KMNO4
3СН2OH-СН2OH +2MNO2 + 2KOH
ЭТИЛЕНГЛИКОЛЬ
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА КРАТНУЮ СВЯЗЬ – ОБЕСЦВЕЧИВАНИЕ ВОДНОГО РАСТВОРА ПЕРМАНГАНАТА КАЛИЯ
(ОТКРЫТА Е.Е.ВАГНЕРОМ В 1888 Г)
Слайд 10 СН2=СН2 + BR2 → СН2–СН2
L L
BR BR
ДИБРОМЭТАН
БРОМНАЯ ВОДА, ИМЕЮЩАЯ ЖЕЛТУЮ ОКРАСКУ ОБЕСЦВЕЧИВАЕТСЯ