- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролит және бейэлектролит ерітінділерінің коллигативтік қасиеттері презентация
Содержание
- 1. Электролит және бейэлектролит ерітінділерінің коллигативтік қасиеттері
- 2. Ерiтiндiлер. Ағза тiршiлiгiндегi ерiтiндiлердiң маңызы. Бейэлектролит
- 3. Мақсаты: Сұйық ерiтiндiлердiң ерiген заттың санына
- 4. Ерітінділер туралы ілімнің дәрігерлер үшін ерекше мәні
- 5. Медицина үшін ең маңыздысы – сұйық
- 7. Әсер етеді
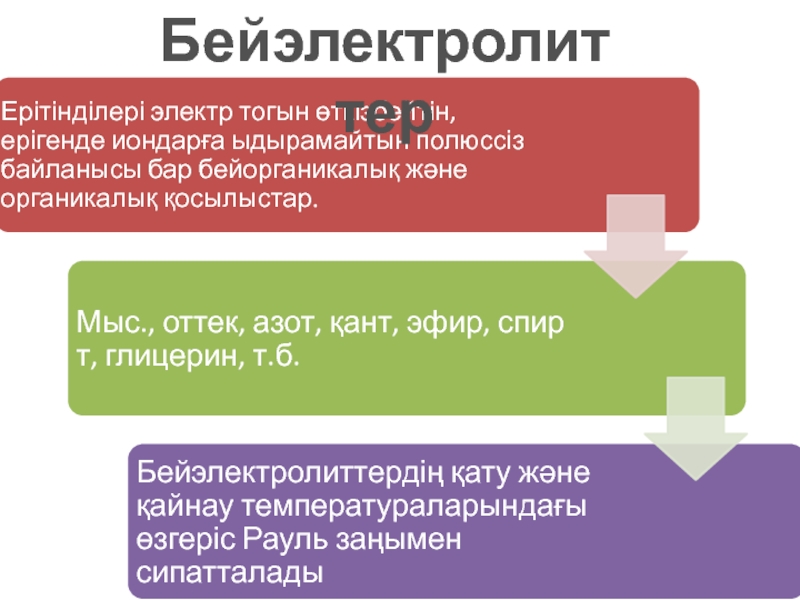
- 8. Бейэлектролиттер
- 9. Ерітінді қасиеті құрамындағы жекеленген бөліктердің қасиетінен
- 10. ЕРІТІНДІЛЕРДІҢ КОЛЛИГАТИВТІК ҚАСИЕТТЕРІ Ерітінділердің
- 11. Рауль заңы: Сұйылтылған бейэлектролит ерітіндісінің бетіндегі
- 12. Рауль заңынан туындайтын бірінші салдар:
- 13. Рауль заңынан туындайтын екінші салдар:
- 14. Шала өткізгіш арқылы бір бағытта жүретін
- 15. Осмос қысымы ерітілген зат бөлшектерінің тегіне
- 16. Бірдей температурада концентрациясы бірдей екі ерітіндінің осмос
- 17. Берілген температурада сұйылтылған ерітіндінің осмостық
- 18. ( грек. lysіs – еру, ыдырау) Электролиттер
- 19. Ғылым мен техникада элекртролиттердің маңызы зор. Тірі организмдер денесіндегі барлық сұйықтар электролиттер болып саналады.
- 20. Электролит ерітінділері коллигативтік қасиеттерді сипаттайтын шама
- 21. Электролитті изотонды ерітінділер ағзадағы және сұйық
- 22. Бейэлектролит және электролит ерітінділерінің коллигативтік қасиетін сипаттайтын
- 25. Ә. Қ. Патсаев, С.А Шитываев, Г.А.
Слайд 1
Қабылдаған: Төлешова.Э.
Орындаған: Болатбек.Н.
CӨЖ
Электролит және бейэлектролит ерітінділердің коллигативтік қасиеттері
Слайд 2
Ерiтiндiлер. Ағза тiршiлiгiндегi ерiтiндiлердiң маңызы.
Бейэлектролит ерітінділерінің коллигативті қасиеттері.
Рауль заңы және оның
Осмос. Осмостық және онкотикалық қысым. Вант-Гофф заңы.
Электролит ерiтiндiлерiнiң коллигативтiк қасиеттерi.
Қорытынды.
Пайдаланылған әдебиеттер.
ЖОСПАР:
Слайд 3
Мақсаты: Сұйық ерiтiндiлердiң ерiген заттың санына тәуелдi – коллигативтi қасиеттерiн қарау
Слайд 4Ерітінділер туралы ілімнің дәрігерлер үшін ерекше мәні бар, себебі негізгі биологиялық
Дәрілік заттар тек ерітінді немесе ағзада еріген күйге көшкен кезде ғана пайдалы
Ерiтiндiлер. Ағза тiршiлiгiндегi ерiтiндiлердiң маңызы.
Слайд 5
Медицина үшін ең маңыздысы – сұйық ерітінділер. Тірі ағзаның массасы 50-90%
Су тіршілік процестерінде, атап айтқанда ісіну, осмос т.б. белсенді роль атқарады, қанда және ұлпаларда онкотикалық қысымның белгілі бір шамасын құрайды;
Күнделікті судың қажеттілігі 1 кг дене салмағына ересек адам үшін 35 г, сәби үшін 100-130 г құрайды;
Адам ағзасы 20% суды жоғалтқанда жасушаларда болатын қайтымсыз өзгерістердің нәтижесінде адам қазаға ұшырайды.
Слайд 9
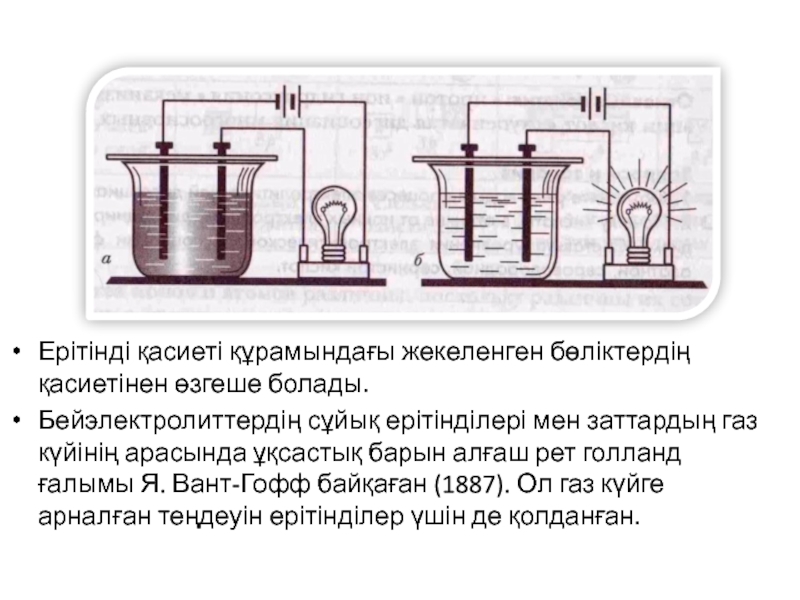
Ерітінді қасиеті құрамындағы жекеленген бөліктердің қасиетінен өзгеше болады.
Бейэлектролиттердің сұйық ерітінділері
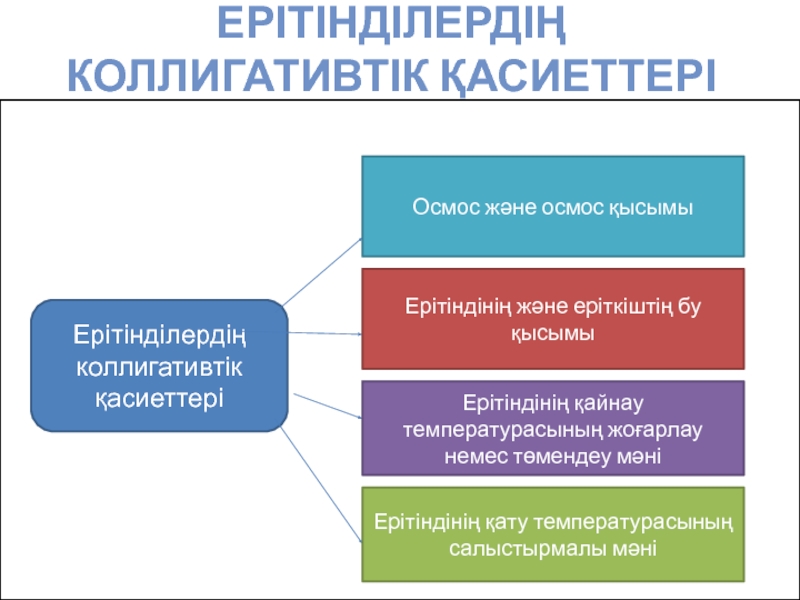
Слайд 10ЕРІТІНДІЛЕРДІҢ
КОЛЛИГАТИВТІК ҚАСИЕТТЕРІ
Ерітінділердің коллигативтік қасиеттері
Осмос және осмос қысымы
Ерітіндінің және еріткіштің
Ерітіндінің қайнау температурасының жоғарлау немес төмендеу мәні
Ерітіндінің қату температурасының салыстырмалы мәні
Слайд 11Рауль заңы:
Сұйылтылған бейэлектролит ерітіндісінің бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі
Δp = p0 - p
p0 – таза еріткіштің үстіндегі қаныққан бу қысымы, Па;
р – ерітіндінің үстіндегі еріткіштің қаныққан бу қысымы, Па;
χ(x) – еріген заттың мольдік үлесі;
n – еріген зат мөлшері, моль;
N – еріткіштің зат мөлшері , моль.
Слайд 12Рауль заңынан туындайтын
бірінші салдар:
Ерітіндінің қату температурасының еріткіштің қату температурасына
ΔТқату = К.в(х),
мұндағы :
в(х) – ерітіндідегі еріген заттың моляльдық концентрациясы, моль/кг;
К – еріткіштің криоскопиялық тұрақтысы, К.кг/моль;
ΔТқату = Тқату(ер-ді) –Тқату(ер-ш)
Слайд 13Рауль заңынан туындайтын
екінші салдар:
Ерітіндінің қайнау температурасының еріткіштің қайнау температурасына
ΔТқайнау = Е.в(х),
мұндағы:
в(х) – ерітіндідегі еріген заттың моляльдық концентрациясы, моль/кг;
Е – еріткіштің эбуллиоскопиялық тұрақтысы, К.кг/моль;
ΔТқайнау = Тқайнау(ер-ді) – Тқайнау(ер-ш)
Слайд 14
Шала өткізгіш арқылы бір бағытта жүретін диффузияны осмос дейді (осмос-итеру, басу).
Осмос. Осмостық және онкотикалық қысым. Вант-Гофф заңы.
Слайд 15
Осмос қысымы ерітілген зат бөлшектерінің тегіне емес, олардың санына тәуелді болады.
Осмостық қысым (π) – осмосты тоқтату үшін ерітіндіге қажет қысым, яғни, осмос құбылысын туғызатын күш
Росм (адам қанының) = const және 370С-та 740 – 780 кПа-ға немесе 7,4-7,8 атм –ға тең
Ағзадағы биологиялық сұйықтықтардығы жоғары молекулалық компоненттердің (мысалға ақуыз) осмостық қысымы онкотикалық қысым (2,5 – 4 кПа) деп аталады
Слайд 16Бірдей температурада концентрациясы бірдей екі ерітіндінің осмос қысымы да тең болса
Росм (ер-ді) > Росм (плазма), ерітінді гипертонды болады
Росм (ер-ді) < Росм (плазма), ерітінді гипотонды болады
Гемолиз – гипотоникалық ерітіндіде эритроцит жасушаларының ісініп, жарылуы. Плазмолиз – гипертоникалық ерітіндіде жасушаның солуы.
Физиологиялық ерітінділер
Слайд 17
Берілген температурада сұйылтылған ерітіндінің осмостық қысымы еріген заттың молярлық концентрациясына тура
π = R* C(x)* T
R – Универсал газ тұрақтысы = 8,31 кПа * л/моль * К немесе 0,083 атм * л/моль *К
Т – абсолютті температура по К (СО + 273);
С(х) – молярлық концентрация (моль/л) –1 л ерітіндідегі еріген заттың моль саны.
Вант-Гофф заңы:
Слайд 19 Ғылым мен техникада элекртролиттердің маңызы зор. Тірі организмдер денесіндегі барлық
Слайд 20
Электролит ерітінділері коллигативтік қасиеттерді сипаттайтын шама мәнінің жоғарылауын береді. Оларға да
Электролит диссоциациясы бірдей молярлық концентрацияда ерітіндідегі еріген зат (молекула, ион) бөлшектерінің жалпы саны бейэлектролит ерітіндісімен салыстырғанда жоғарылауына әкеледі.
Бірдей молярлық концентрацияда электролит ерітіндісіндегі бөлшек саны бейэлектролит ерітіндісімен салыстырғанда неше есе артқанын изотоникалық коэффициент i көрсетеді. Изотоникалық коэффициент электролиттік диссоциацияға тәуелді:
i =1-α(n-1),α - электролиттік диссоциация дәрежесі, n –диссоциация нәтижесінде электролит ыдырағандағы ион саны
Электролит ерітінділерінің коллигативтік қасиеті:
Слайд 21
Электролитті изотонды ерітінділер ағзадағы және сұйық жетіспеушілігінен туындайтын сусыздану жағдайларында (ұзақ
Қорытынды:
Слайд 22Бейэлектролит және электролит ерітінділерінің коллигативтік қасиетін сипаттайтын заңдардан ерітіндінің изотоникалық коэффициентін
Слайд 25
Ә. Қ. Патсаев, С.А Шитываев, Г.А. Төребекова, “Физиологиялық және коллоидтық химия”
Жылысбаева
http://surgeryzone.net/medicina/elektrolity-natrij-i-kalij.html
http://www.km.ru/referats/BBBFF652AD9046ACBC1A93C199A02E62
http://us-in.net/ph-balance.php
http://docplayer.ru/35879806-Veshchestva-elektrolity-neelektrolity-veshchestva-vodnye-rastvory-ili-rasplavy-kotoryh-provodyat-elektricheskih-tok.html
ПАЙДАЛАНЫЛҒАН ӘДЕБИЕТТЕР: