- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Характеристика металу Алюміній презентация
Содержание
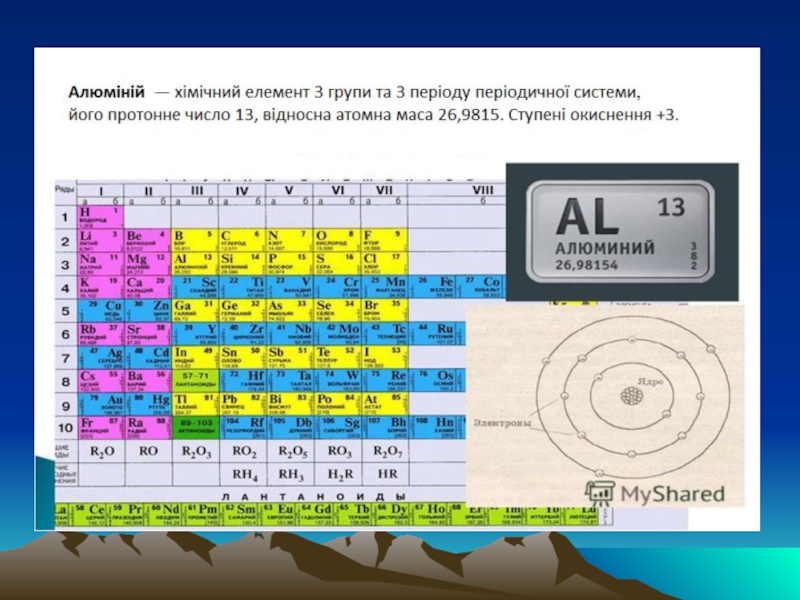
- 1. Характеристика металу Алюміній
- 3. У 1827 р. видатний німецький лікар і
- 4. Алюміній найпоширеніший у природі металічний елемент. Вміст
- 5. Фізичні властивості Алюміній – сріблясто-білий легкий метал,
- 6. Хімічні властивості 1. Взаємодія з киснем. Якщо з
- 7. Хімічні властивості 2. Взаємодія з водою. При звичайних
- 8. Хімічні властивості 3. Взаємодія з кислотами. Алюміній
- 9. Хімічні властивості 4. Взаємодія з неметалами.
- 10. Хімічні властивості 6. Взаємодія з солями. Металічний алюміній
- 11. Добування В промисловості: Отримання алюмінію включає виробництво
- 12. Застосування Основна маса алюмінію йде на виготовлення
- 13. Найпоширеніші сполуки з Al. Найважливіші природні сполуки
- 14. Дякую за увагу!
Слайд 3У 1827 р. видатний німецький лікар і хімік Фрідріх Велер отримав
Тільки в 1886 р. американський студент Чарльз Хопп і французький інженер П’єр Еру розробили способ виділення А1 електролізом глинозему, розчиненого в розтопленому кріоліті. Але й кріоліт був дефіцитом, тому А1 залишався дефіцитним металом, поки в 1900 р. не був розроблений синтетичний спосіб отримання кріоліту.
Відкриття Аl
Слайд 4Алюміній найпоширеніший у природі металічний елемент. Вміст його у земній корі
Поширення у природі
Слайд 5Фізичні властивості
Алюміній – сріблясто-білий легкий метал, дуже пластичний, міцний, добрий провідник
Слайд 6Хімічні властивості
1. Взаємодія з киснем. Якщо з алюмінієвого дроту зняти захисну оксидну
Слайд 7Хімічні властивості
2. Взаємодія з водою. При звичайних умовах на алюмінієві вироби вода
Слайд 8Хімічні властивості
3. Взаємодія з кислотами. Алюміній активно взаємодіє з багатьма кислотами, особливо
Слайд 9Хімічні властивості
4. Взаємодія з неметалами. Алюміній реагує з сіркою, галогенами, вуглецем,
5. Взаємодія з оксидами. Алюміній взаємодіє з оксидами більшості металів. Реакція проходить з виділенням великої кількості теплоти:
Cr2O3 + 2Al = 2Cr + Al2O3 + Q;
3Fe3O4 + 8Al = 4Al2O3 + 9Fe + Q.
Процес відновлення металів з їх оксидів називається алюмінотермією. Цей метод використовується у металургії для добування тугоплавких металів (титану, вольфраму, молібдену, ванадію, цирконію).
Слайд 10Хімічні властивості
6. Взаємодія з солями. Металічний алюміній легко вступає в реакції з
7. Взаємодія з лугами. На відміну від багатьох металів на алюміній дуже сильно діють розчини лугів, тому в алюмінієвому посуді не можна зберігати луги та лужні розчини. 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2
Слайд 11Добування
В промисловості:
Отримання алюмінію включає виробництво глинозему з алюмінієвих руд електролітичне отримання
Na3[AlF6] ↔ 3Na+ + 2F− + AlF−4
AlF−4 ↔ F− + AlF3
AlF3 ↔ F− + AlF+2
AlF+2 ↔ F− + AlF2+
AlF2+ ↔ F− + Al3+
Al2O3 ↔ AlO+ + AlO−2, AlO−2 ↔ Al3+ + 2O2−
AlO+ ↔ Al3+ + O2−, Al3+ + 3e → Al
2O2− — 4e → O2