- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биохимия ферментов и кинетика презентация
Содержание
- 1. Биохимия ферментов и кинетика
- 2. Ферменты Бактериальное брожение Физиологическая
- 3. Фермент Молекулярная
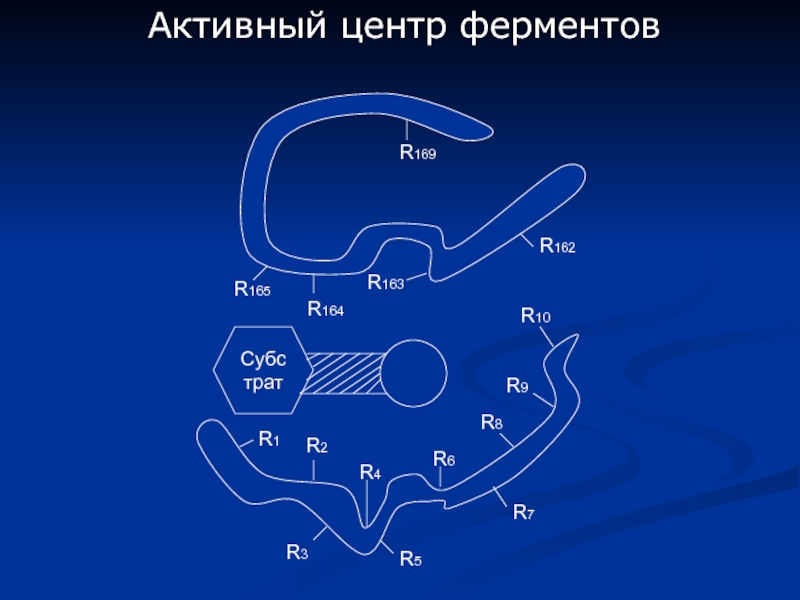
- 4. Активный центр ферментов Субстрат
- 5. Распределение и относительные количества изоферментов
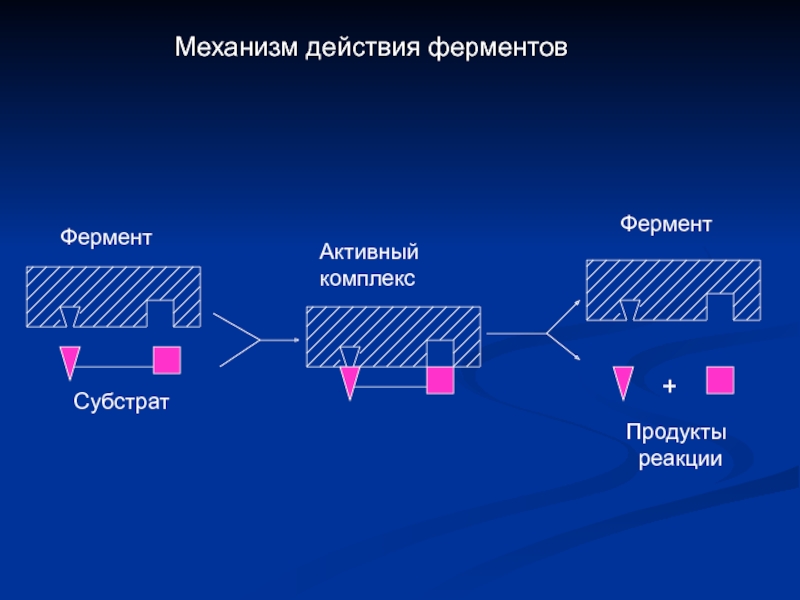
- 6. Механизм действия ферментов Субстрат
- 7. - - - - - -
- 8. - - - - - -
- 9. - - -
- 10. Уравнение Михаэлиса - Ментен VMAX
- 11. - - - - - -
- 12. Определение численного значения Кm Если
- 13. График Лайнувера – Берка. 1 vmax
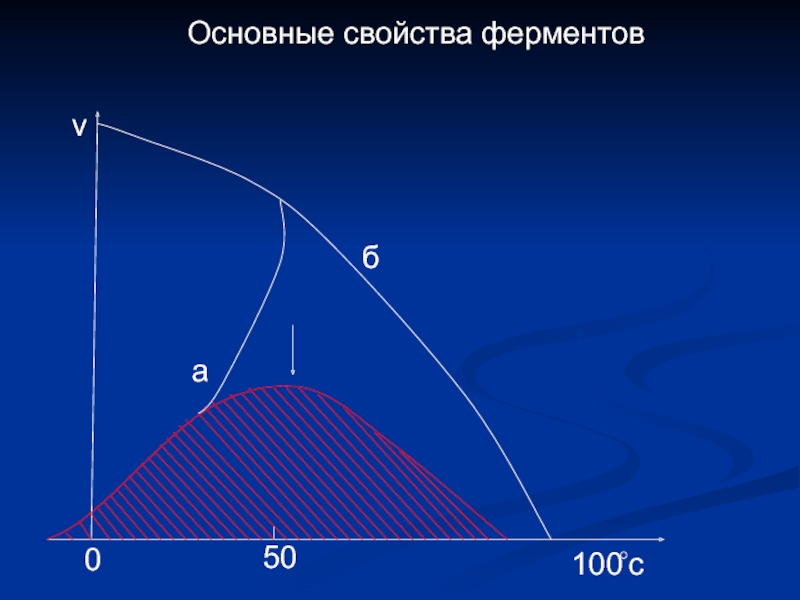
- 14. Основные свойства ферментов а б v 100 0 c 50
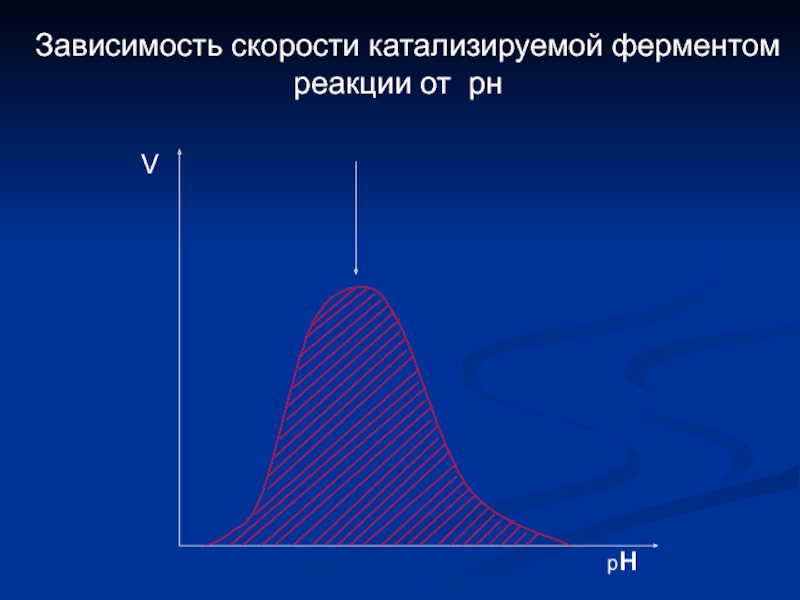
- 15. Зависимость скорости катализируемой ферментом
- 16. Оптимальные значения рН для некоторых ферментов Фермент
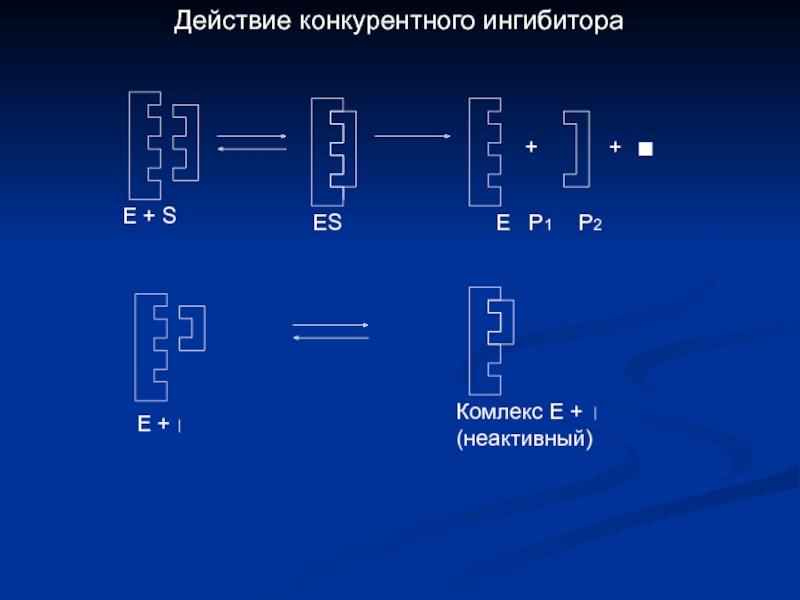
- 17. Торможение активности СДГ малоновой кислотой + +
- 18. + + Е +
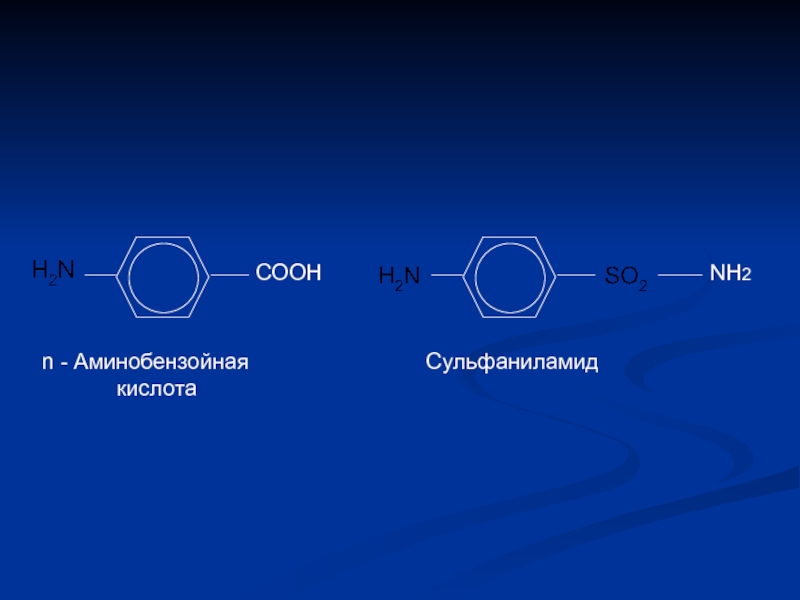
- 19. СООН NH2 n
- 20. - - - - - -
- 21. - - - - - -
- 22. - - - - - -
- 23. - - - - - -
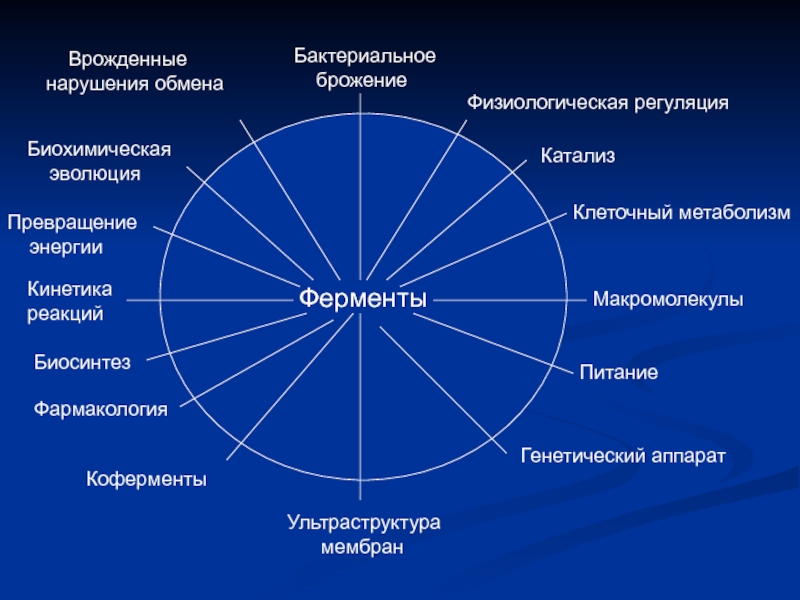
Слайд 2Ферменты
Бактериальное
брожение
Физиологическая регуляция
Катализ
Клеточный метаболизм
Макромолекулы
Питание
Генетический аппарат
Ультраструктура
мембран
Коферменты
Фармакология
Биосинтез
Кинетика
реакций
Превращение
Биохимическая
эволюция
Врожденные
нарушения обмена
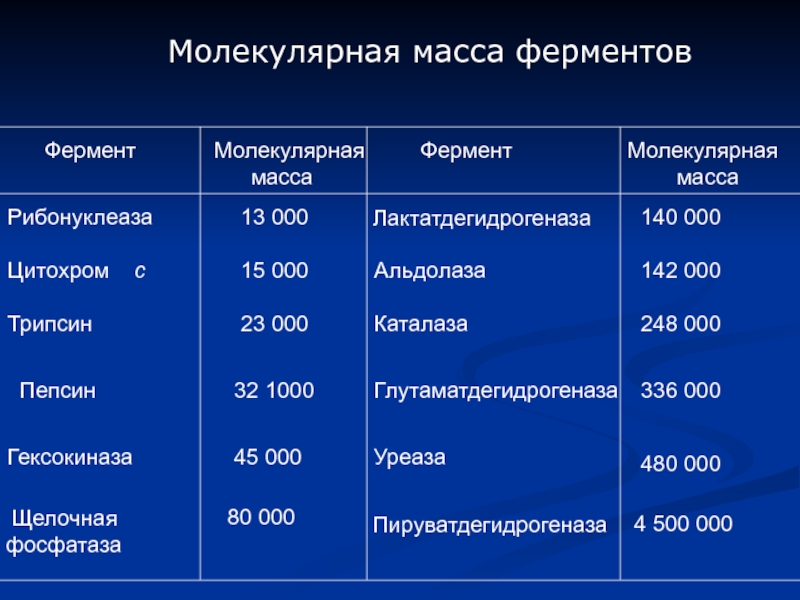
Слайд 3 Фермент
Молекулярная
масса
Фермент
Молекулярная
масса
Рибонуклеаза
13
Лактатдегидрогеназа
140 000
Цитохром с
15 000
Альдолаза
142 000
Трипсин
23 000
Каталаза
248 000
Пепсин
32 1000
Глутаматдегидрогеназа
336 000
Гексокиназа
45 000
Уреаза
480 000
Щелочная
фосфатаза
80 000
Пируватдегидрогеназа
4 500 000
Молекулярная масса ферментов
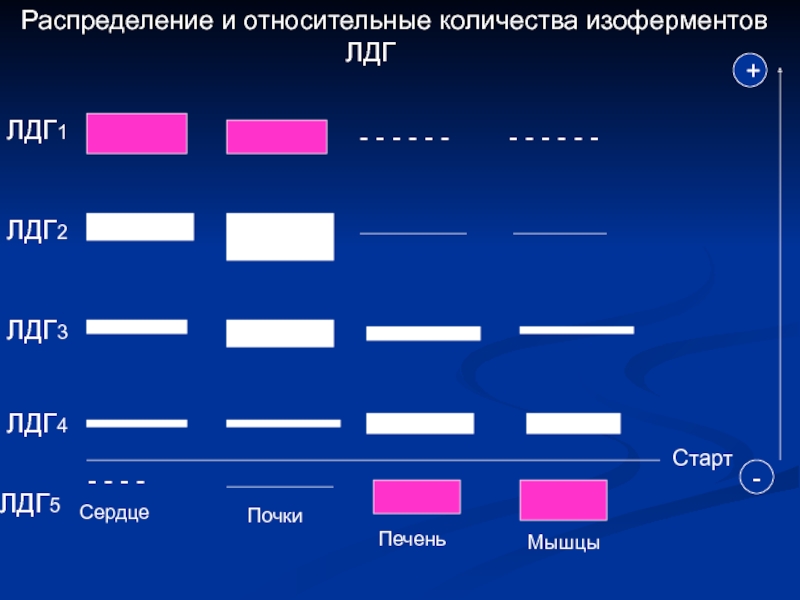
Слайд 5Распределение и относительные количества изоферментов
ЛДГ1
- - - - - - - - - - - -
ЛДГ2
ЛДГ3
ЛДГ4
Старт
+
-
ЛДГ5
- - - -
Сердце
Почки
Печень
Мышцы
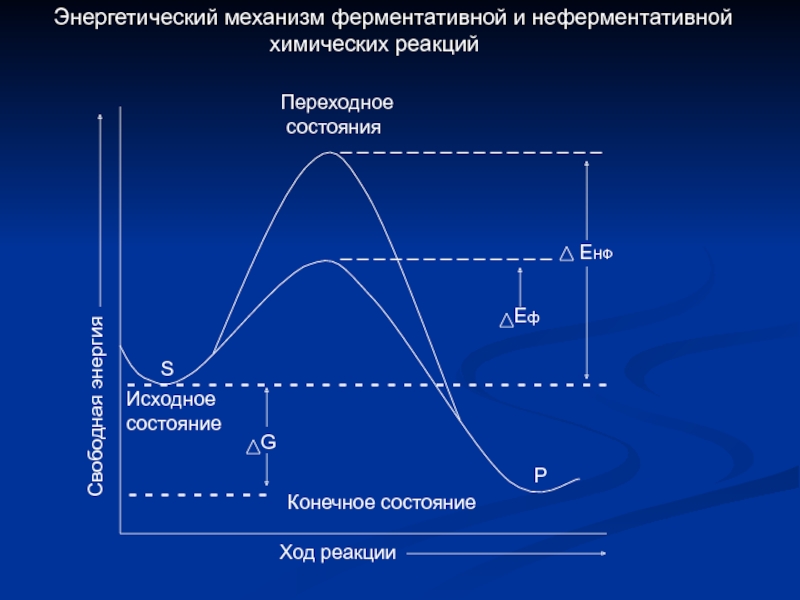
Слайд 7 - - - - - - - - -
-
G
Исходное
состояние
_ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
ЕНФ
Еф
Р
Переходное
состояния
Конечное состояние
Ход реакции
Свободная энергия
S
Энергетический механизм ферментативной и неферментативной
химических реакций
Слайд 8- - - - - -
- - - -
1
Km
1
Kmi
=
1
v
2
1
[
1
-
1
Vi
1
vmax
График зависимости скорости ферментативной реакции от
концентрации субстрата в присутствии неконкурентного ингибитора
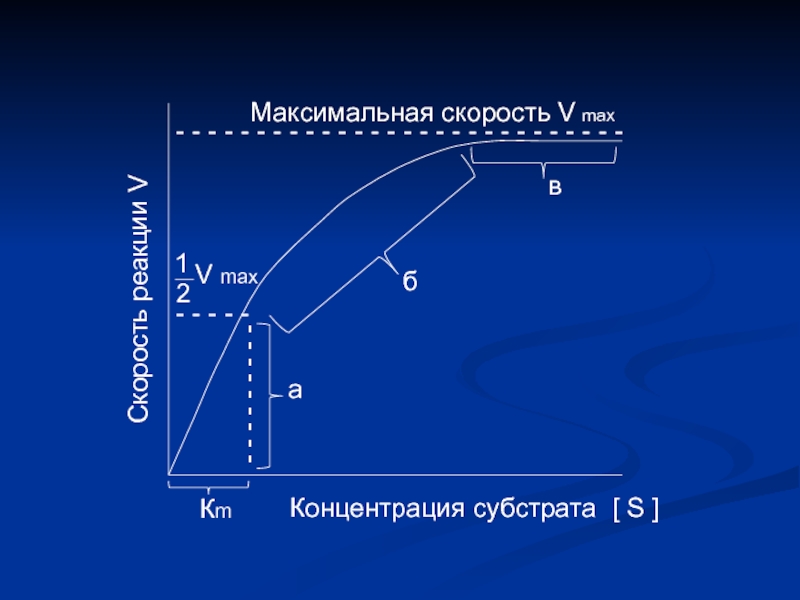
Слайд 9
- - - - - - - - -
Максимальная скорость V max
- - - - -
- - - - - - - - -
1
2
V max
а
б
в
Кm
Концентрация субстрата
[ S ]
Скорость реакции V
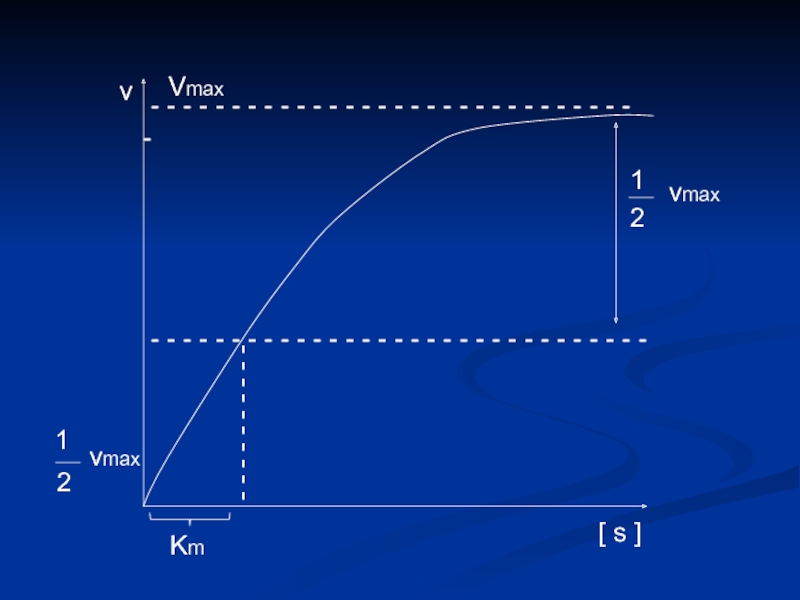
Слайд 11 - - - - - - - - - -
- - - - - - - - - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
[ s ]
v
1
2
vmax
Vmax
1
2
vmax
Km
Слайд 12Определение численного значения Кm
Если v = ½ vmax
V max
2
=
V max
.
[ s ]
Кm + [ s ]
1
2
=
s
Km
+
[ s ]
или
Km
+ [ s ] = 2 [ s ]
Km = [ s ]
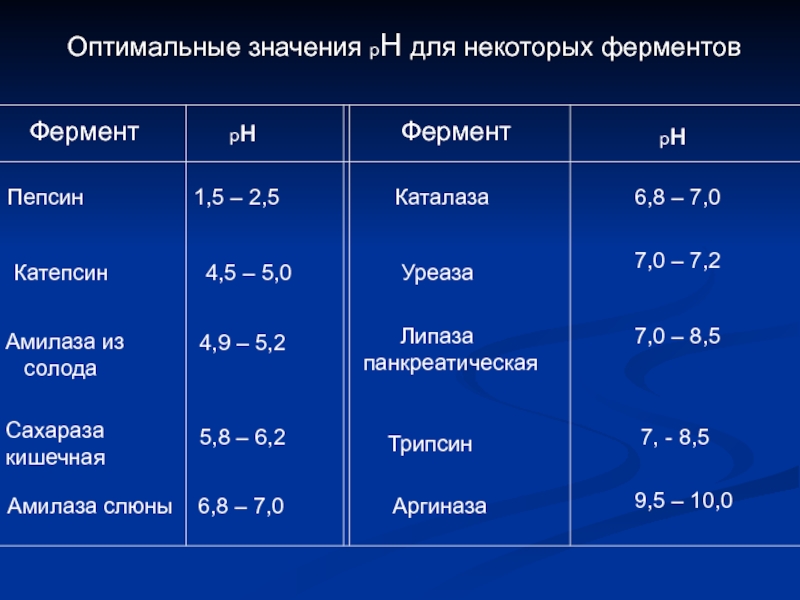
Слайд 16Оптимальные значения рН для некоторых ферментов
Фермент
рн
Фермент
рн
Пепсин
1,5 – 2,5
Каталаза
6,8 – 7,0
Катепсин
Уреаза
7,0 – 7,2
Амилаза из
солода
4,9 – 5,2
Липаза
панкреатическая
7,0 – 8,5
Сахараза
кишечная
5,8 – 6,2
Трипсин
7, - 8,5
Амилаза слюны
6,8 – 7,0
Аргиназа
9,5 – 10,0
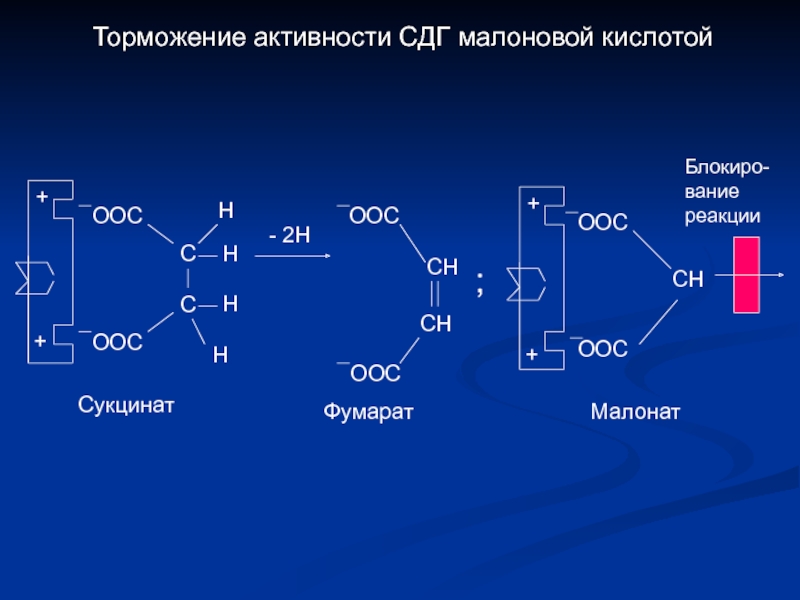
Слайд 17Торможение активности СДГ малоновой кислотой
+
+
ООС
ООС
С
С
Н
Н
Н
Н
- 2Н
ООС
СН
СН
ООС
;
+
+
ООС
ООС
СН
Блокиро-
вание
реакции
Сукцинат
Фумарат
Малонат
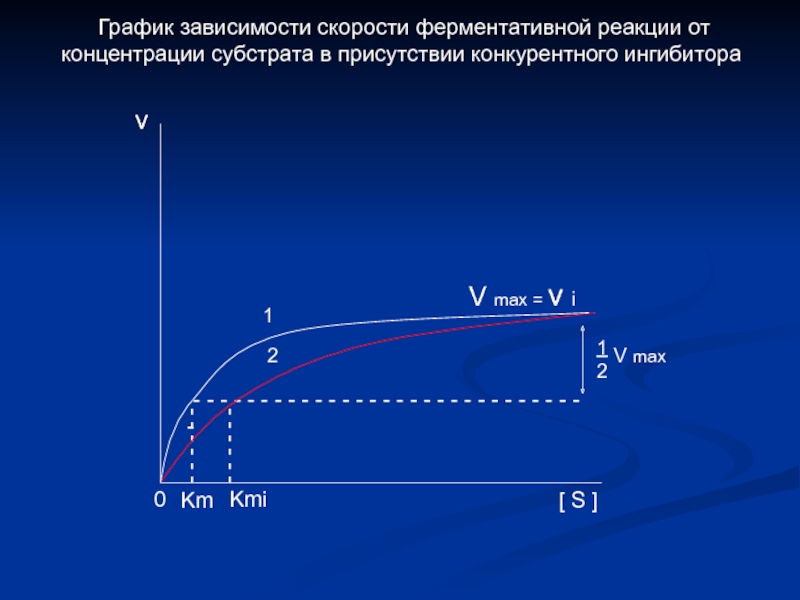
Слайд 20- - - - - -
- - - - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
1
2
V max
2
1
0
v
V max = v i
Km
Kmi
[ S ]
График зависимости скорости ферментативной реакции от
концентрации субстрата в присутствии конкурентного ингибитора
Слайд 21- - - - - -
- - - -
vmax
=
1
vi
1
Km
1
Kmi
-
1
v
2
1
[ S ]
1
-
График зависимости скорости ферментативной реакции от
концентрации субстрата в присутствии конкурентного ингибитора.
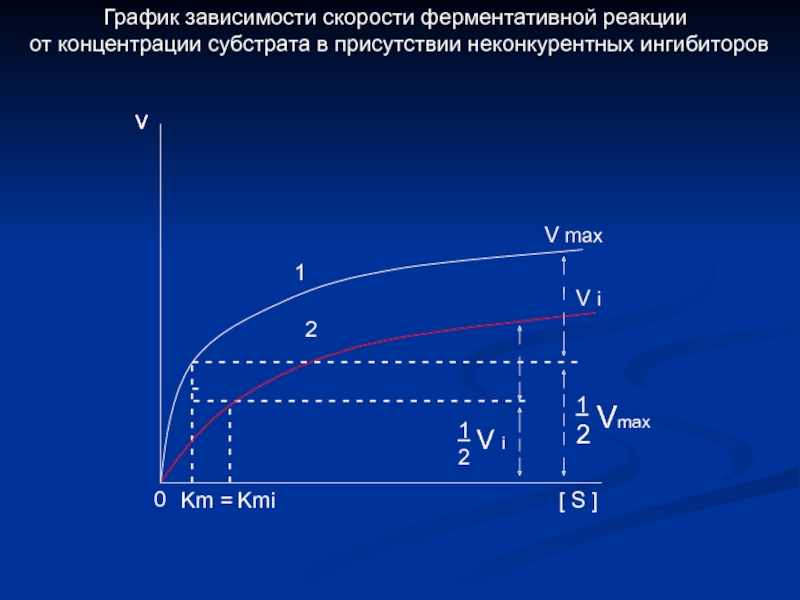
Слайд 22- - - - - -
- - - - -
- - - - - - - - - - - - - - - - - - - - - - - - -
0
v
Km =
Kmi
[ S ]
- - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
1
2
Vmax
1
2
V i
2
1
V max
V i
График зависимости скорости ферментативной реакции
от концентрации субстрата в присутствии неконкурентных ингибиторов
Слайд 23- - - - - -
- - - -
1
Km
1
Kmi
=
1
v
2
1
[
1
-
1
Vi
1
vmax
График зависимости скорости ферментативной реакции от
концентрации субстрата в присутствии неконкурентного ингибитора

![- - - - - - - - - - 1Km1Kmi=1v21[ S ]1-1Vi 1vmax](/img/tmb/4/390590/eb60c383c2153e3ec0c9116921e0a5ad-800x.jpg)
![Уравнение Михаэлиса - Ментен VMAX ..[ s ]Кs+[ s ]v =](/img/tmb/4/390590/18be10b9b5e35df9fefa3b344f829e14-800x.jpg)

![График Лайнувера – Берка.1vmax1KmНаклон = К mV max1v1[s]](/img/tmb/4/390590/7700cc3096731c068e49004210be8f9c-800x.jpg)
![- - - - - - - - - - 1vmax= 1vi1Km1Kmi-1v21[ S ]1-](/img/tmb/4/390590/555e5d7d72412eeb0ee8221fb78dc628-800x.jpg)
![- - - - - - - - - - 1Km1Kmi=1v21[ S ]1-1Vi 1vmax](/img/tmb/4/390590/15c636bb1bd32cd041f0099425231a65-800x.jpg)





