- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гетероциклічні ароматичні сполуки презентация
Содержание
- 1. Гетероциклічні ароматичні сполуки
- 2. П'ЯТИЧЛЕННІ ГЕТЕРОЦИКЛИ З ОДНИМ ГЕТЕРОАТОМОМ
- 3. ρ-Обіталь гетероатома, на якій розташована неподілена пара
- 4. Цікаво відмітити, що в результаті спряження
- 5. ФУРАН ТА ЙОГО ПОХІДНІ Фуран
- 6. Фурфурол і пірослизову кислоту одержують, відповідно, з
- 7. Хімічні властивості Фуран під дією кислот легко
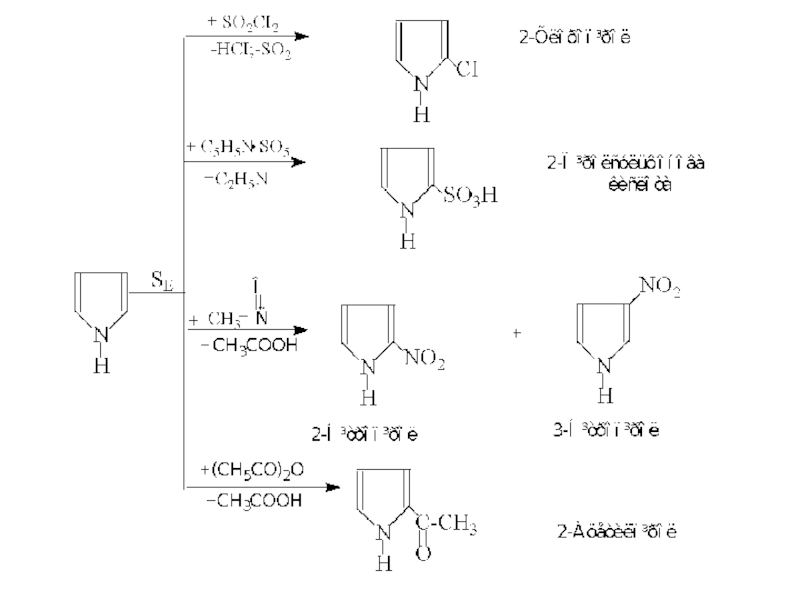
- 8. Реакції електрофільного заміщення Незважаючи на низьку стабільність
- 9. 1. Галогенування Безпосередня взаємодія з бромом може
- 10. 3. Сульфування Комплекс піридину з сірка(VI)оксидом є
- 11. Реакції приєднання При каталітичному гідруванні фуран перетворюється
- 12. ТІОФЕН ТА ЙОГО ПОХІДНІ
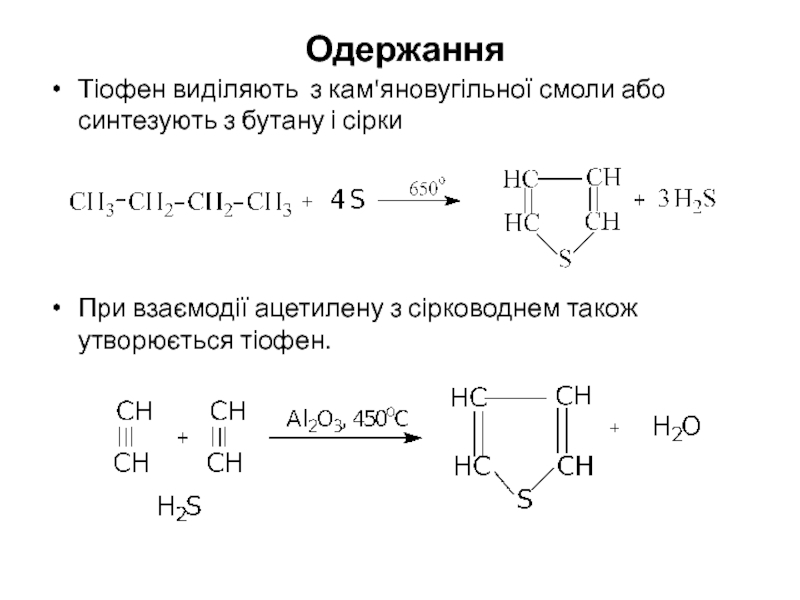
- 13. Одержання Тіофен виділяють з кам'яновугільної смоли
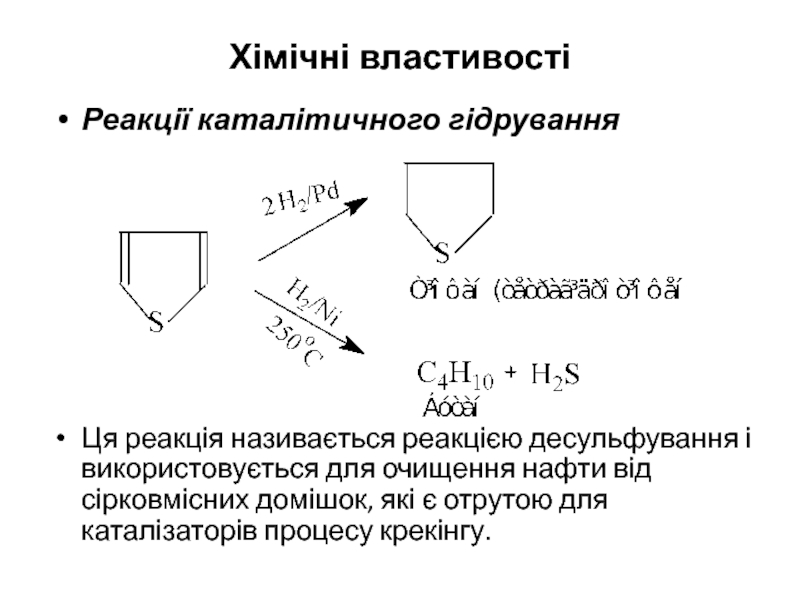
- 14. Хімічні властивості Реакції каталітичного гідрування
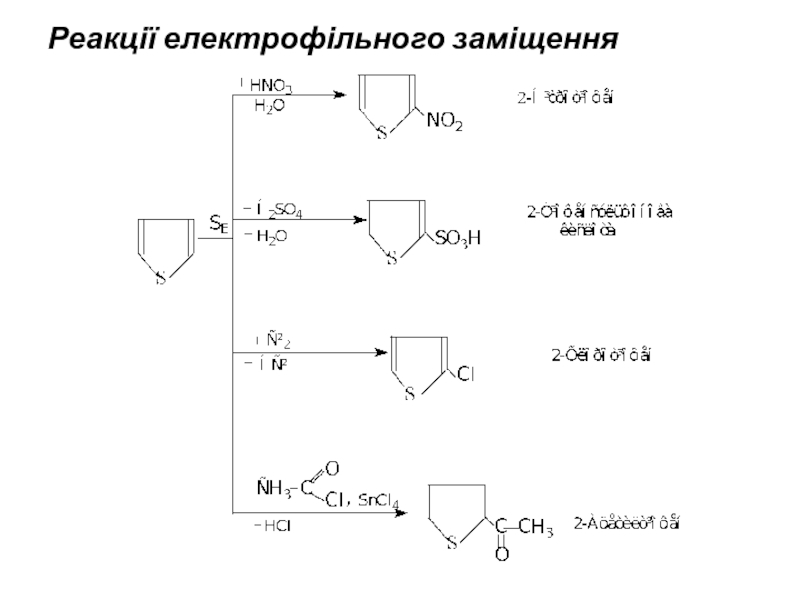
- 15. Реакції електрофільного заміщення
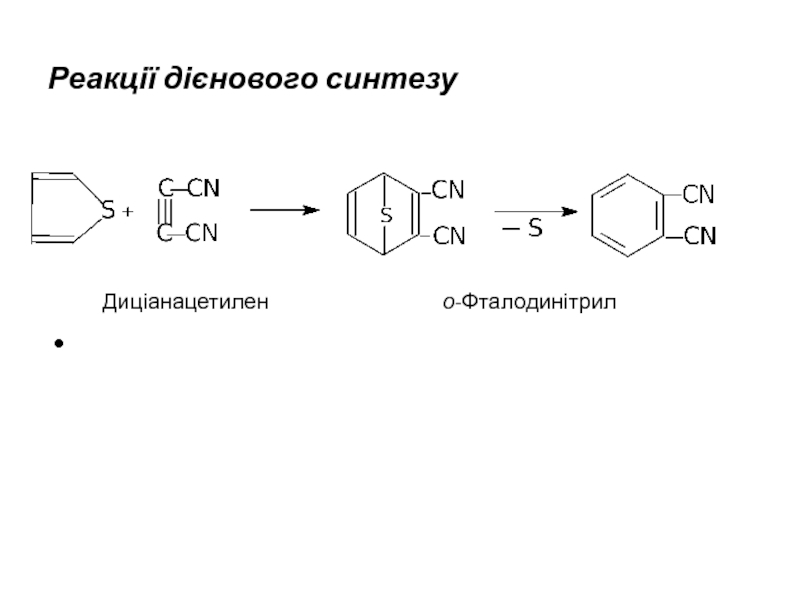
- 16. Реакції дієнового синтезу
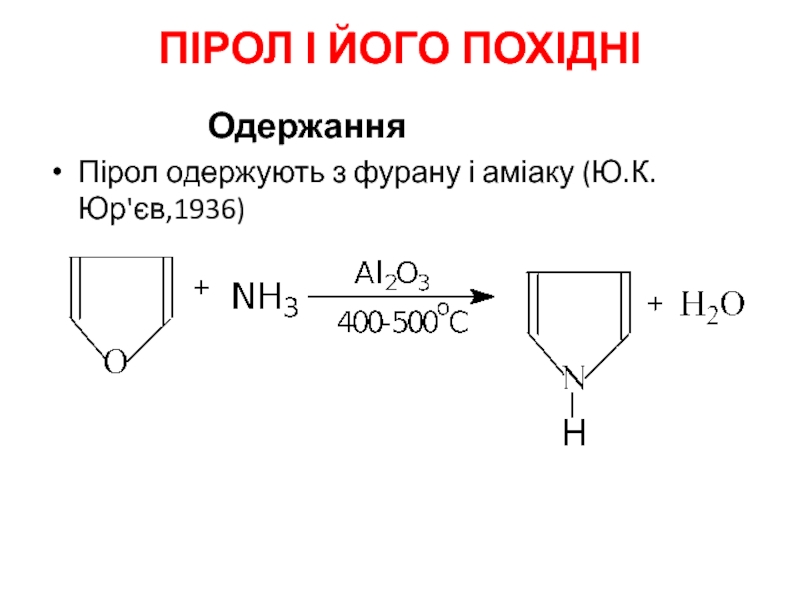
- 17. ПІРОЛ І ЙОГО ПОХІДНІ Одержання Пірол одержують з фурану і аміаку (Ю.К.Юр'єв,1936)
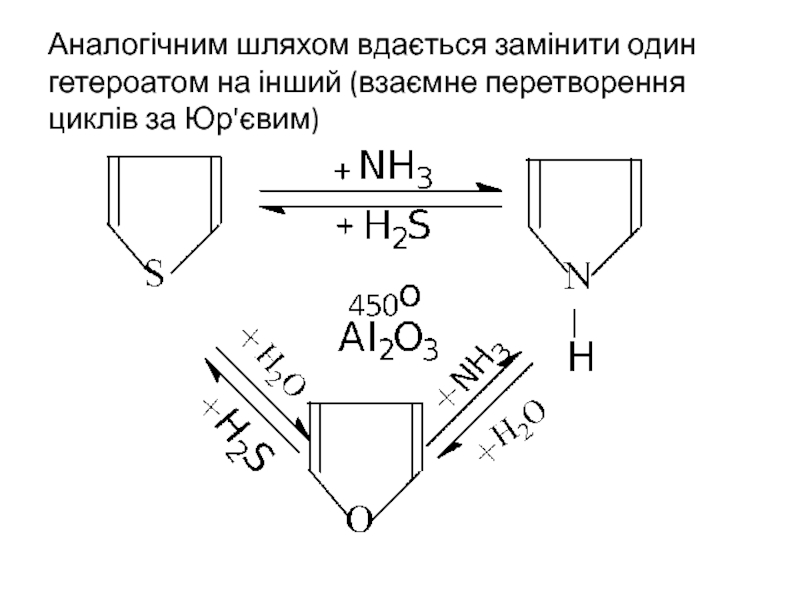
- 18. Аналогічним шляхом вдається замінити один гетероатом на інший (взаємне перетворення циклів за Юр'євим)
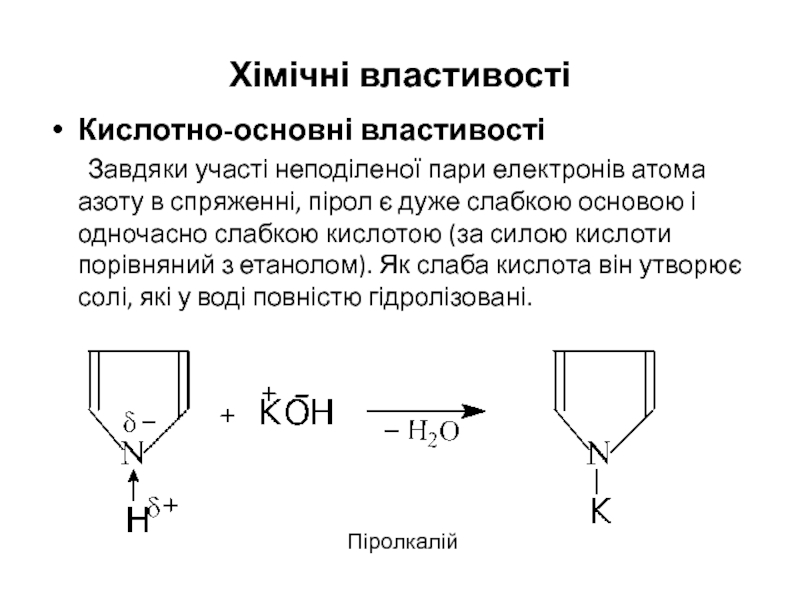
- 19. Хімічні властивості Кислотно-основні властивості Завдяки участі неподіленої
- 20. Ацидофобні властивості Пірол
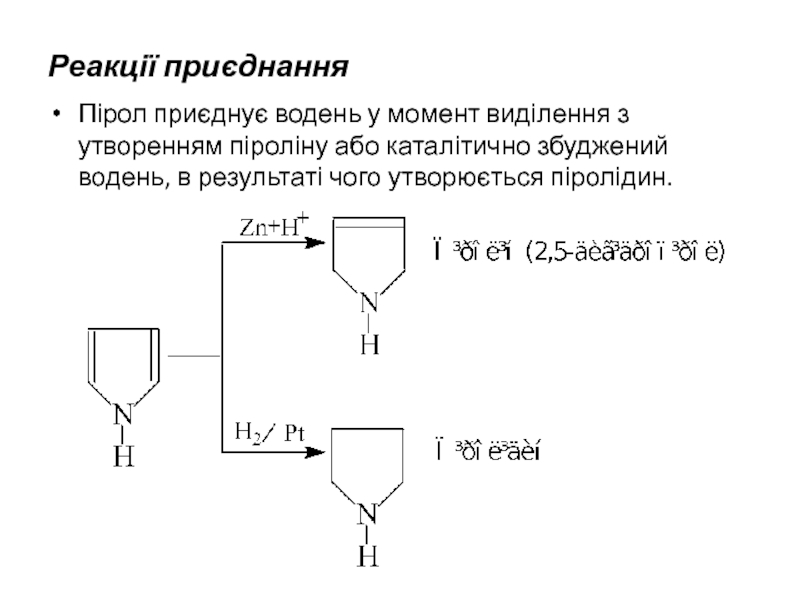
- 22. Реакції приєднання Пірол приєднує водень у момент
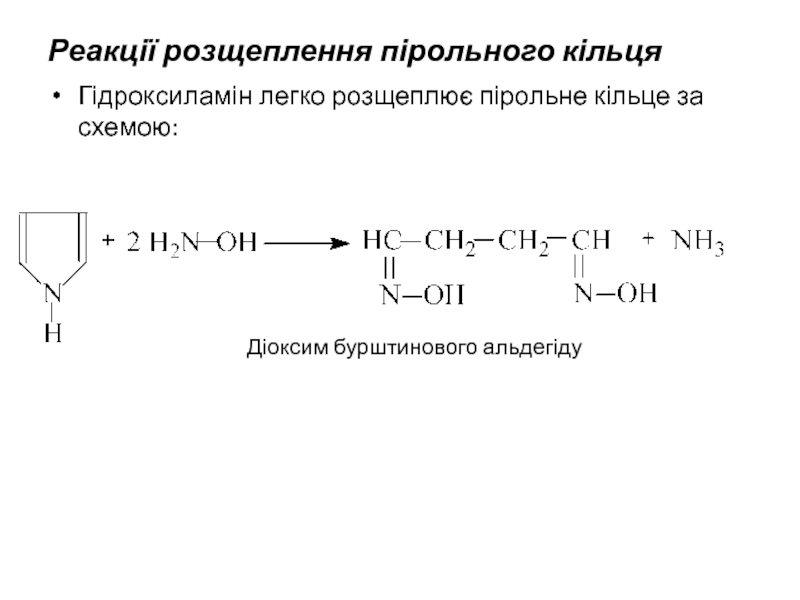
- 23. Реакції розщеплення пірольного кільця Гідроксиламін
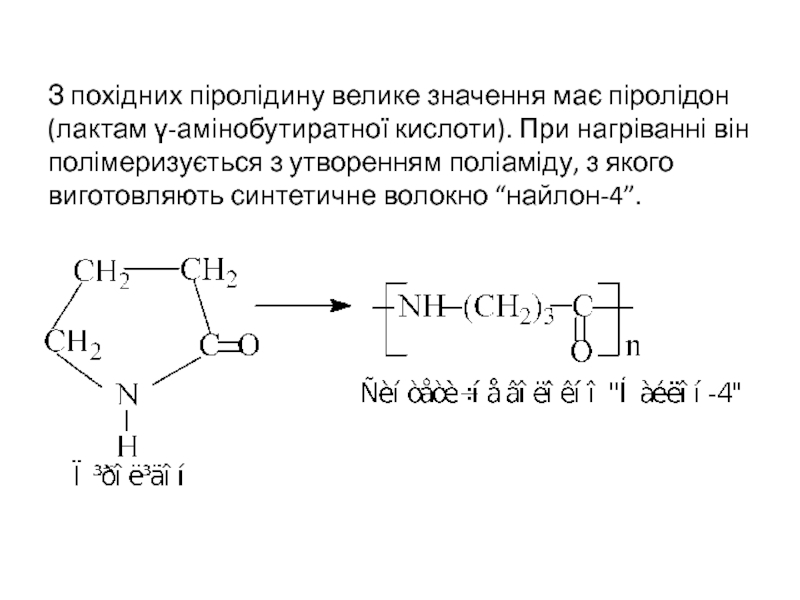
- 24. З похідних піролідину велике значення має
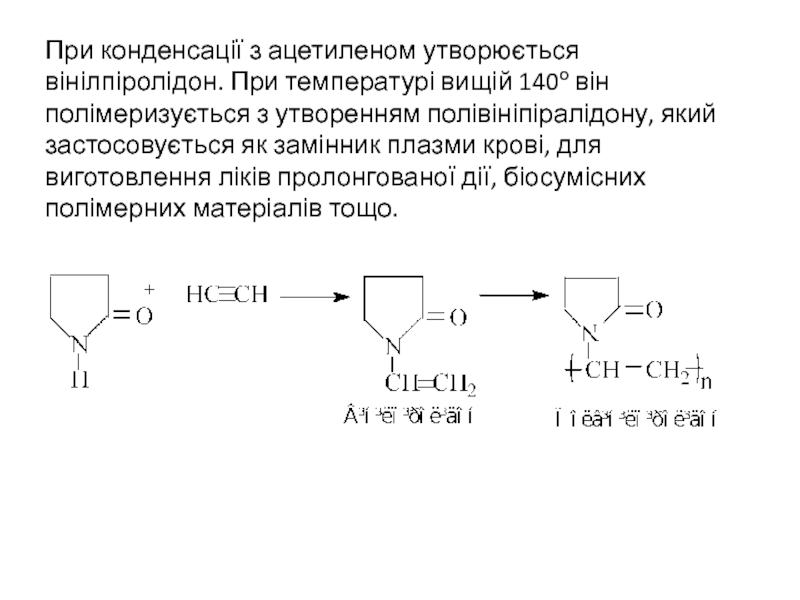
- 25. При конденсації з ацетиленом утворюється вінілпіролідон. При
- 26. П'ятичленні гетероцикли з конденсованими ядрами
- 27. ІНДОЛ Одержання Індол міститься у кам'яновугільній
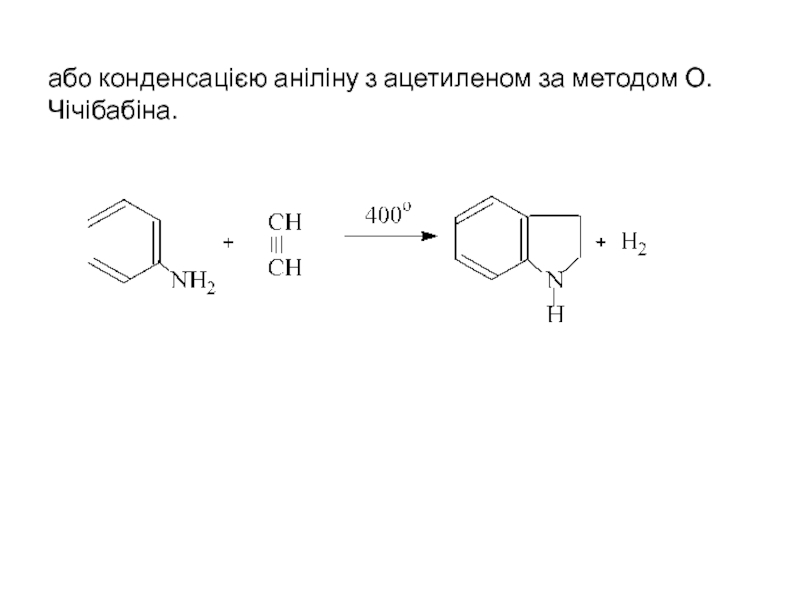
- 28. або конденсацією аніліну з ацетиленом за методом О.Чічібабіна.
- 29. Хімічні властивості За своєю будовою і властивостями
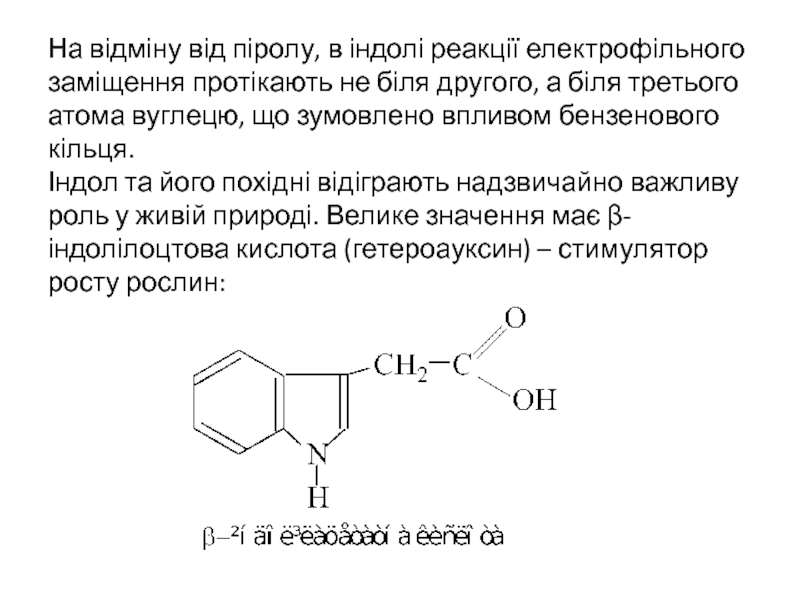
- 30. На відміну від піролу, в індолі реакції
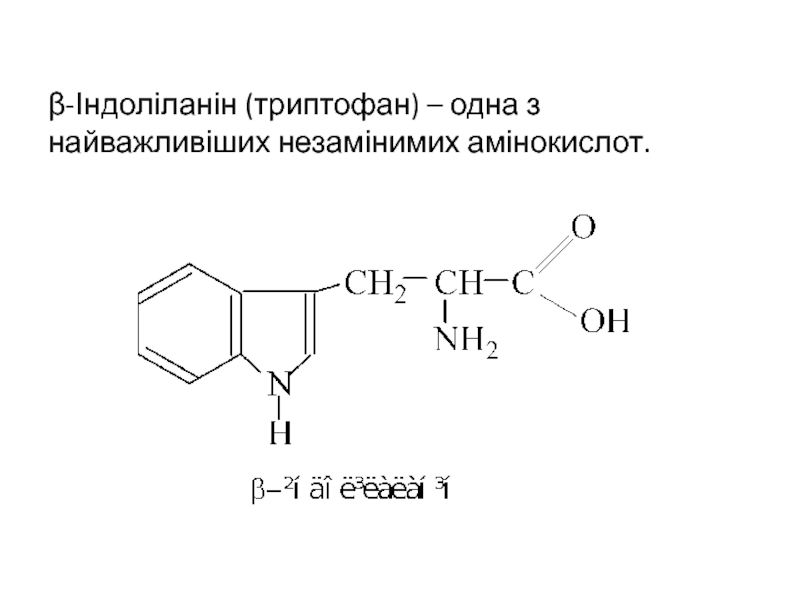
- 31. β-Індоліланін (триптофан) – одна з найважливіших незамінимих амінокислот.
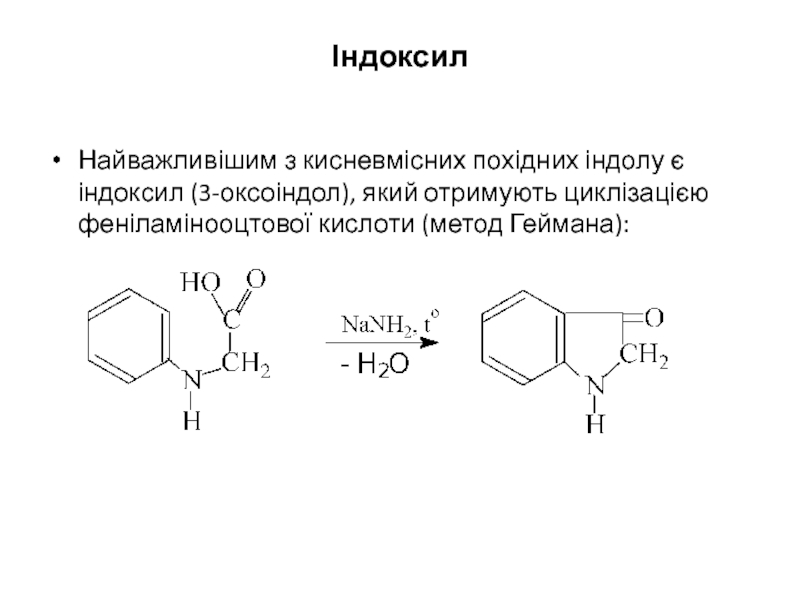
- 32. Індоксил Найважливішим з кисневмісних похідних індолу
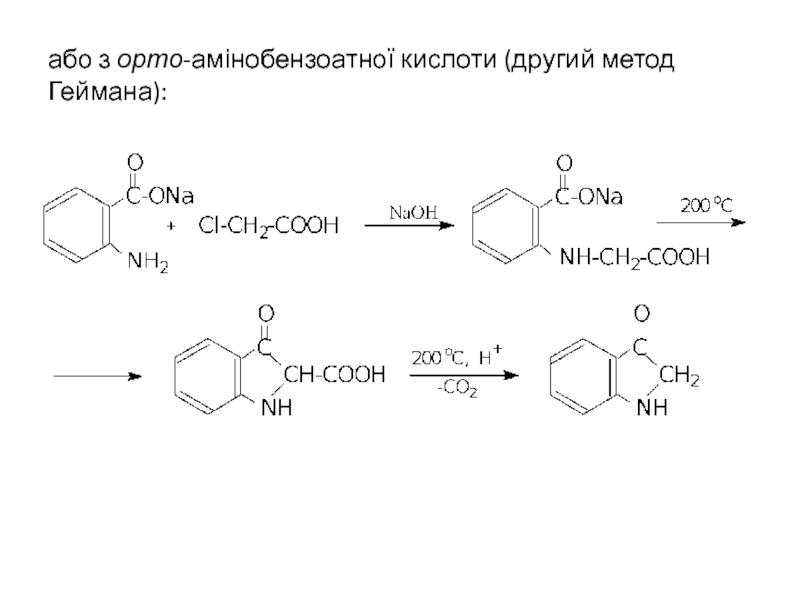
- 33. або з орто-амінобензоатної кислоти (другий метод Геймана):
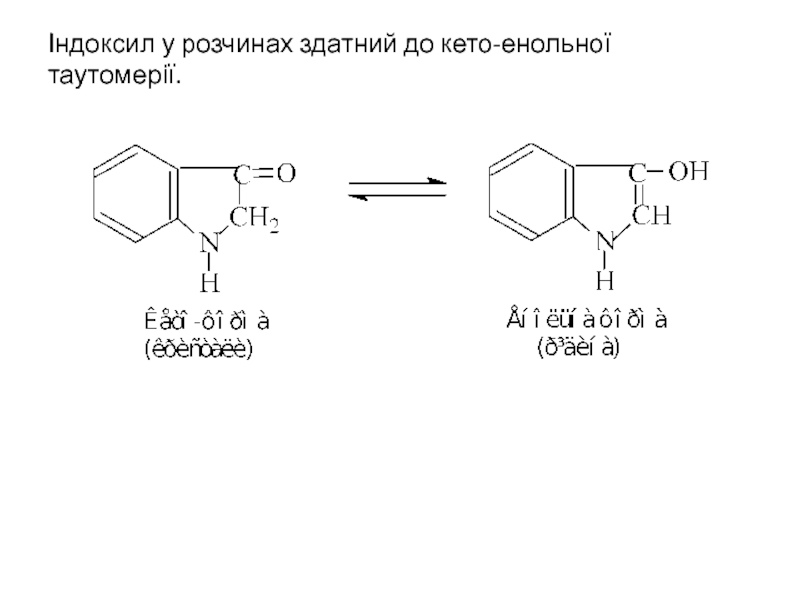
- 34. Індоксил у розчинах здатний до кето-енольної таутомерії.
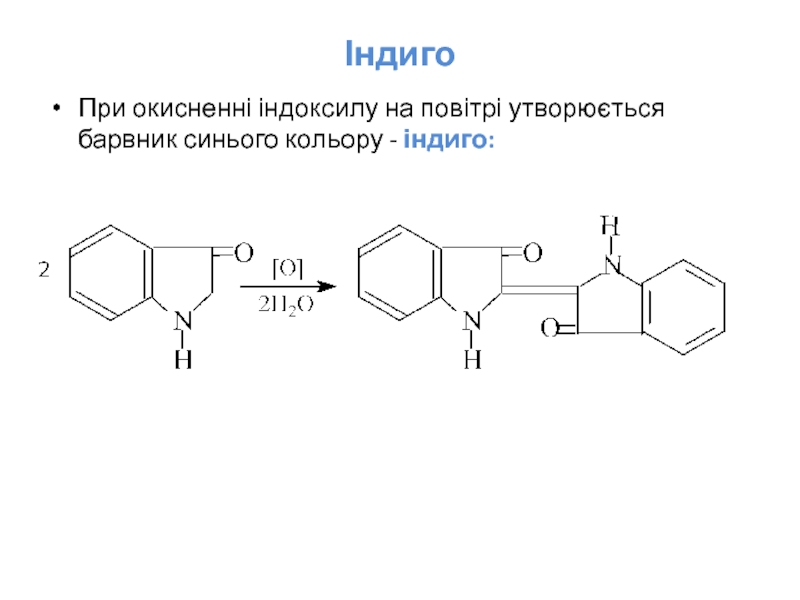
- 35. Індиго При окисненні індоксилу на повітрі утворюється барвник синього кольору - індиго:
- 36. Раніше індиго добували з тропічної рослини
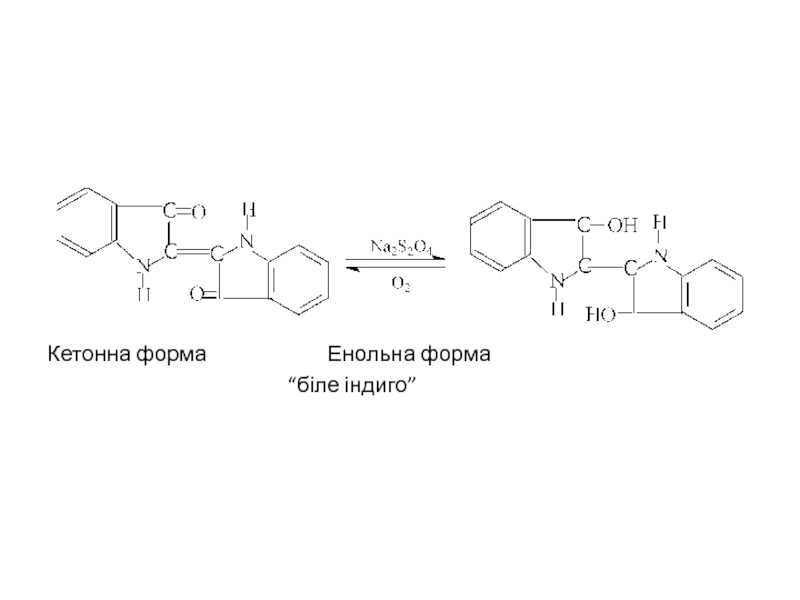
- 37. Кетонна форма Енольна форма “біле індиго”
Слайд 1ГЕТЕРОЦИКЛІЧНІ АРОМАТИЧНІ СПОЛУКИ
Гетероциклічні сполуки - речовини, що містять у молекулах цикли,
Їх класифікують:
1. За загальним числом атомів у циклі (три-, чотири-, п’ятичленні, тощо);
2. За кількістю гетероатомів (1, 2, 3 тощо);
3. За природою гетероатомів
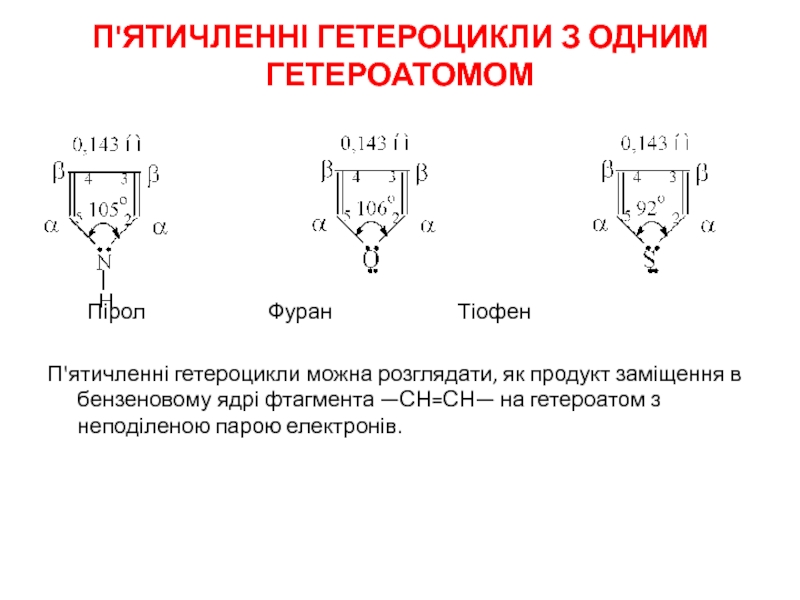
Слайд 2П'ЯТИЧЛЕННІ ГЕТЕРОЦИКЛИ З ОДНИМ ГЕТЕРОАТОМОМ
Пірол Фуран
П'ятичленні гетероцикли можна розглядати, як продукт заміщення в бензеновому ядрі фтагмента —СН=СН— на гетероатом з неподіленою парою електронів.
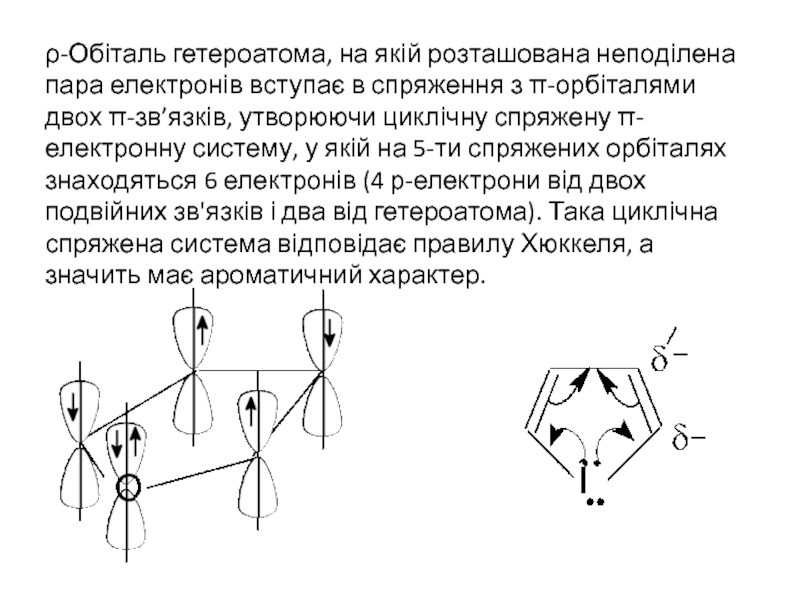
Слайд 3ρ-Обіталь гетероатома, на якій розташована неподілена пара електронів вступає в спряження
Слайд 4 Цікаво відмітити, що в результаті спряження електронної пари азоту пірол
Вказані гетероцикли мають досить високу енергію резонансної стабілізації, хоч і меншу, ніж у бензену. Так, енергія спряження для тіофону складає приблизно 120 кДж/моль, піролу 110, а для фурану – 80 кДж/моль. Нагадаємо, що енергія спряження бензену становить 152 кДж/моль.
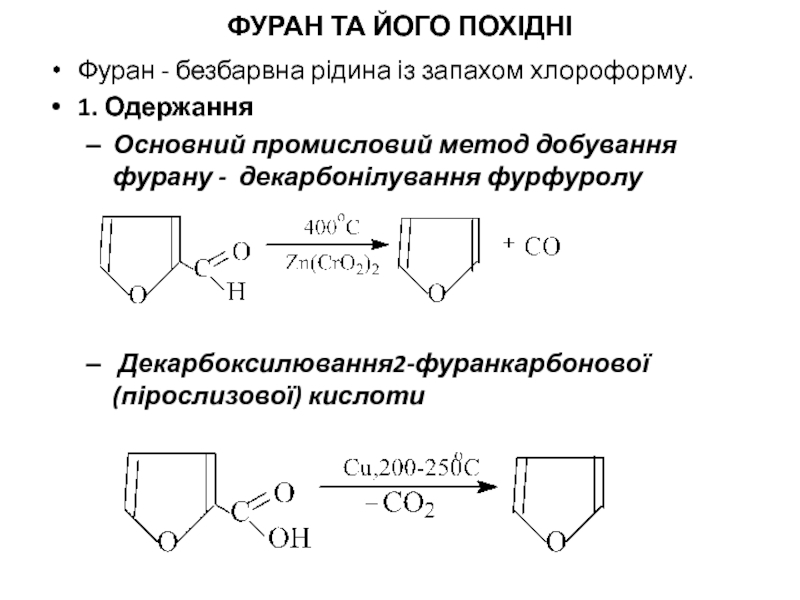
Слайд 5ФУРАН ТА ЙОГО ПОХІДНІ
Фуран - безбарвна рідина із запахом хлороформу.
1. Одержання
Основний
Декарбоксилювання2-фуранкарбонової (пірослизової) кислоти
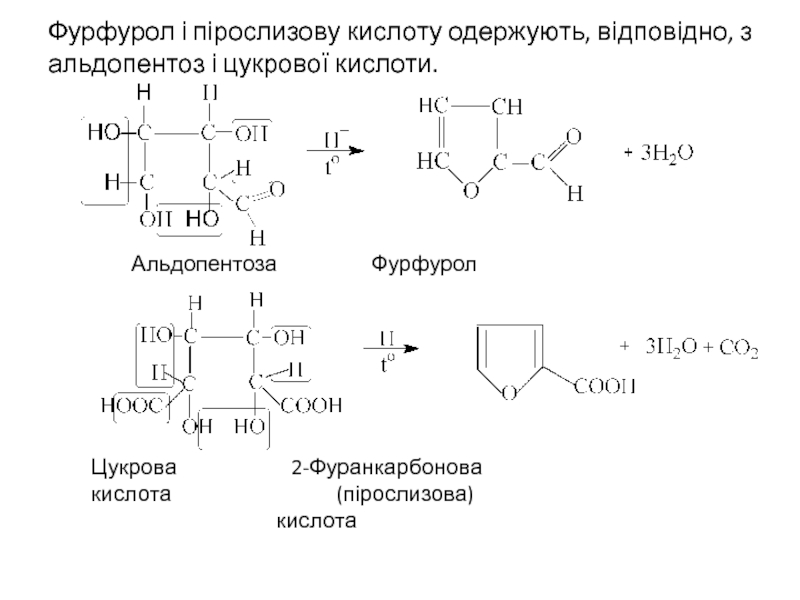
Слайд 6Фурфурол і пірослизову кислоту одержують, відповідно, з альдопентоз і цукрової кислоти.
Альдопентоза Фурфурол
Цукрова
кислота (пірослизова)
кислота
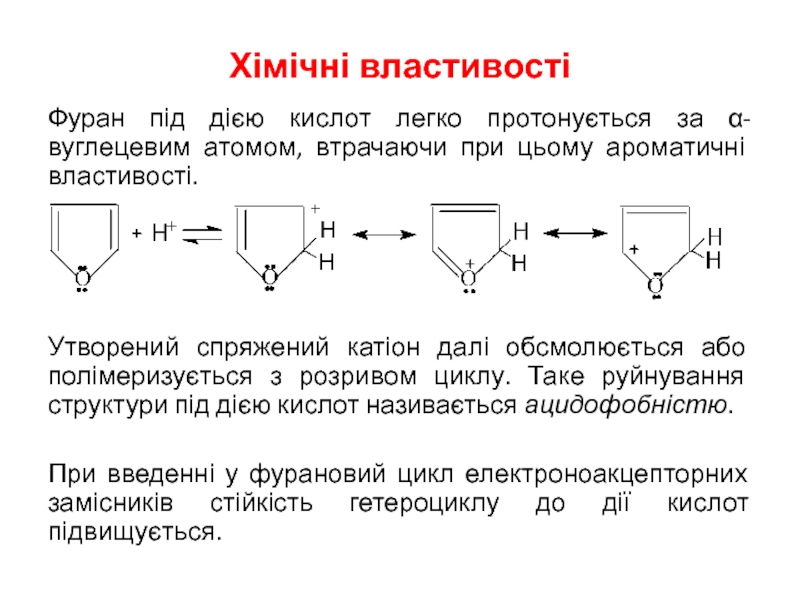
Слайд 7Хімічні властивості
Фуран під дією кислот легко протонується за α-вуглецевим атомом, втрачаючи
Утворений спряжений катіон далі обсмолюється або полімеризується з розривом циклу. Таке руйнування структури під дією кислот називається ацидофобністю.
При введенні у фурановий цикл електроноакцепторних замісників стійкість гетероциклу до дії кислот підвищується.
Слайд 8Реакції електрофільного заміщення
Незважаючи на низьку стабільність фуран здатний до реакцій електрофільного
Як уже зазначалось, у α,α′-положеннях фурану спостерігається підвищена електронна густина. Тому в реакціях SE утворюються переважно α-похідні.
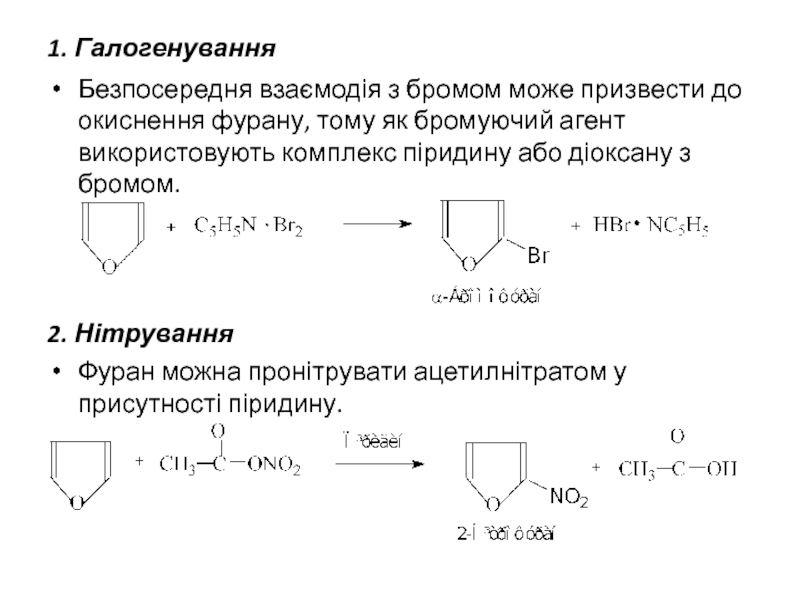
Слайд 91. Галогенування
Безпосередня взаємодія з бромом може призвести до окиснення фурану, тому
2. Нітрування
Фуран можна пронітрувати ацетилнітратом у присутності піридину.
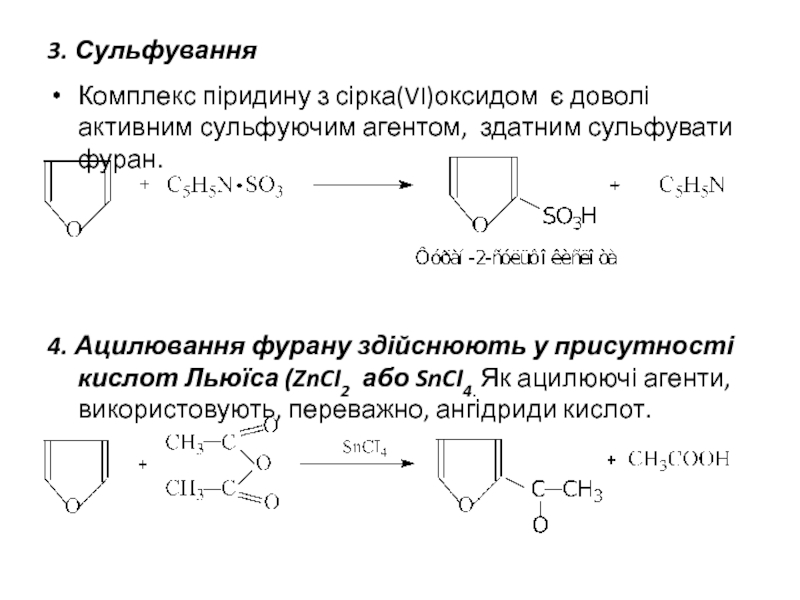
Слайд 103. Сульфування
Комплекс піридину з сірка(VI)оксидом є доволі активним сульфуючим агентом, здатним
4. Ацилювання фурану здійснюють у присутності кислот Льюїса (ZnCI2 або SnCI4. Як ацилюючі агенти, використовують, переважно, ангідриди кислот.
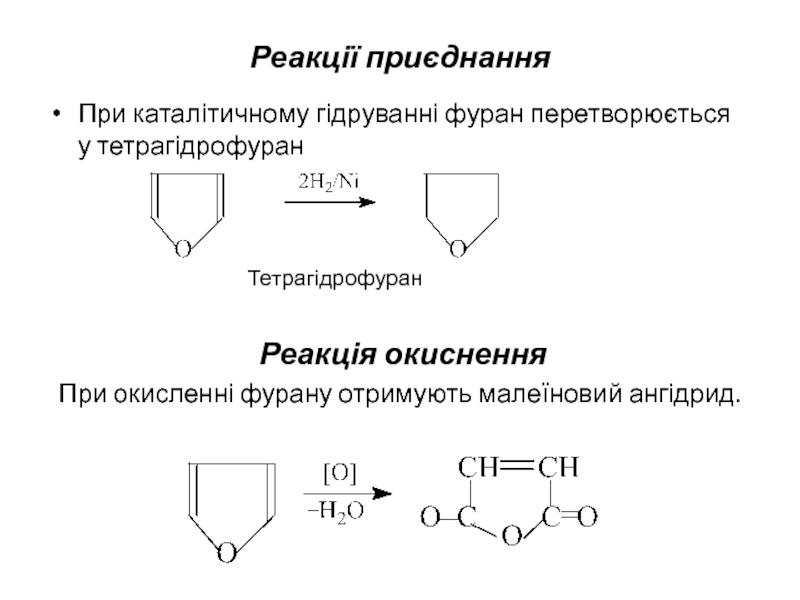
Слайд 11Реакції приєднання
При каталітичному гідруванні фуран перетворюється у тетрагідрофуран
Тетрагідрофуран
Реакція окиснення
При окисленні фурану
Слайд 12
ТІОФЕН ТА ЙОГО ПОХІДНІ
Тіофен є найстійкішим із п'ятичленних гетероциклів. Він не
Підвищена стабільність тіофену пояснюється здатністю атома сірки надавати вакантні d-орбіталі для делокалізації π-електронів, а також великим атомним радіусом атома сірки, завдяки чому утворюється цикл з меншими викривленнями валентних кутів, а значить і з меншим напруженням циклу.
Слайд 13 Одержання
Тіофен виділяють з кам'яновугільної смоли або синтезують з бутану і
При взаємодії ацетилену з сірководнем також утворюється тіофен.
Слайд 14Хімічні властивості
Реакції каталітичного гідрування
Ця реакція називається реакцією десульфування і використовується для
Слайд 18Аналогічним шляхом вдається замінити один гетероатом на інший (взаємне перетворення циклів
Слайд 19Хімічні властивості
Кислотно-основні властивості
Завдяки участі неподіленої пари електронів атома азоту в спряженні,
Піролкалій
Слайд 20 Ацидофобні властивості
Пірол ацидофобний. Він легко протонується, що веде до
Реакції електрофільного заміщення
Слайд 22Реакції приєднання
Пірол приєднує водень у момент виділення з утворенням піроліну або
Слайд 23Реакції розщеплення пірольного кільця
Гідроксиламін легко розщеплює пірольне кільце за схемою:
Діоксим бурштинового
Слайд 24 З похідних піролідину велике значення має піролідон (лактам γ-амінобутиратної кислоти). При
Слайд 25При конденсації з ацетиленом утворюється вінілпіролідон. При температурі вищій 140о він
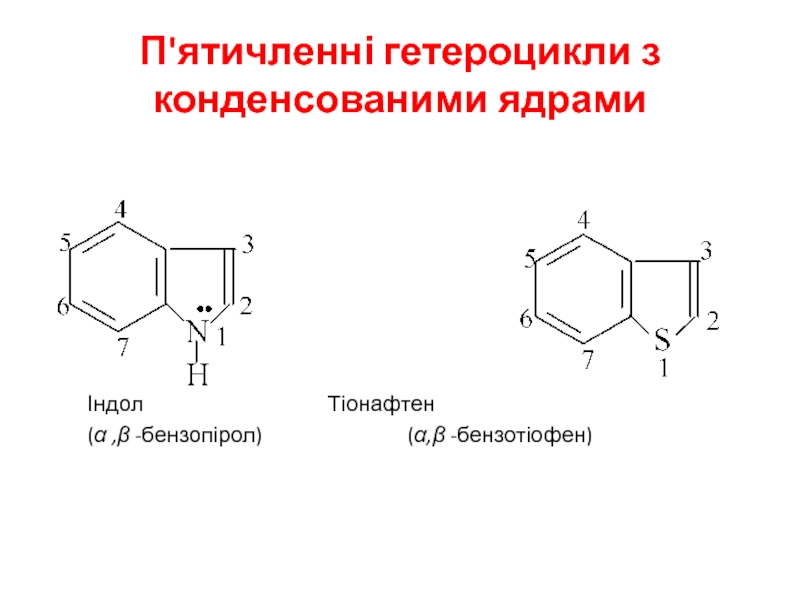
Слайд 26П'ятичленні гетероцикли з конденсованими ядрами
Індол Тіонафтен
(α ,β -бензопірол) (α,β -бензотіофен)
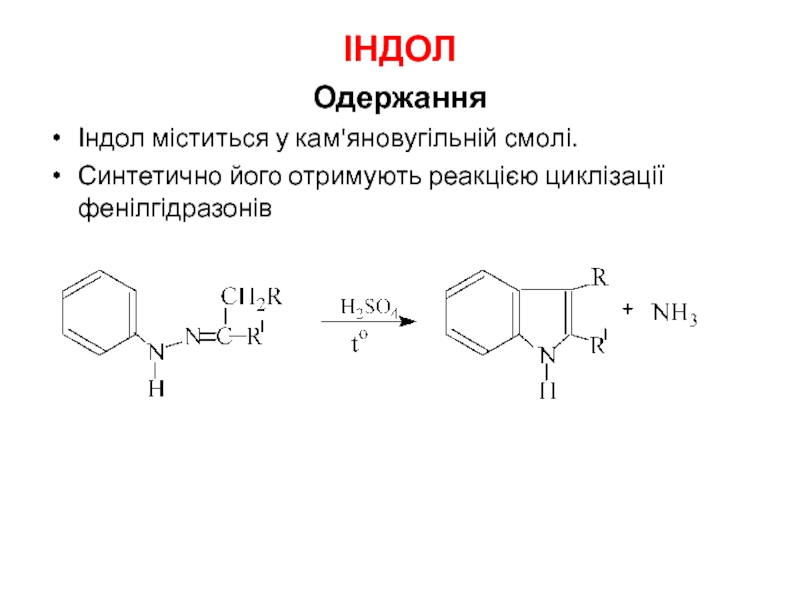
Слайд 27ІНДОЛ
Одержання
Індол міститься у кам'яновугільній смолі.
Синтетично його отримують реакцією циклізації фенілгідразонів
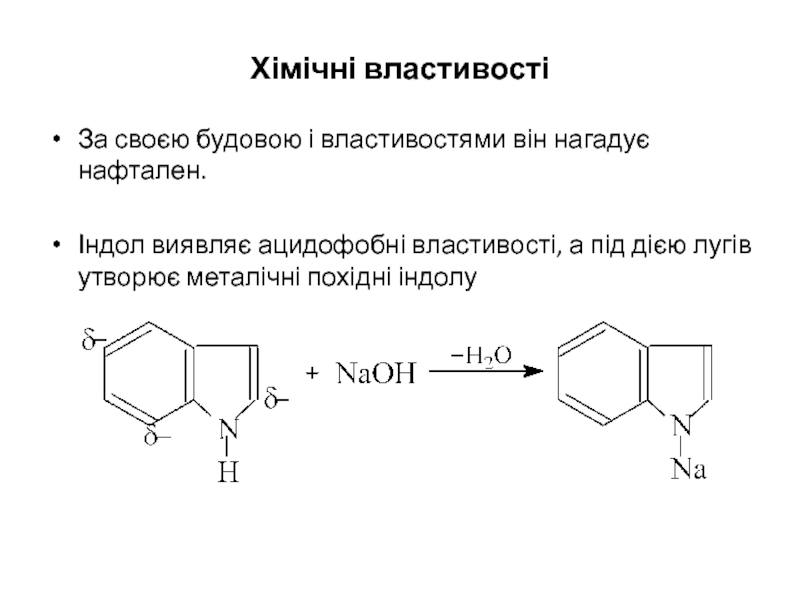
Слайд 29Хімічні властивості
За своєю будовою і властивостями він нагадує нафтален.
Індол виявляє ацидофобні
Слайд 30На відміну від піролу, в індолі реакції електрофільного заміщення протікають не
Слайд 32Індоксил
Найважливішим з кисневмісних похідних індолу є індоксил (3-оксоіндол), який отримують циклізацією
Слайд 36
Раніше індиго добували з тропічної рослини “indigofera”. Він здавна відомий, але
Індиго не розчиняється у воді. Тому, щоб пофарбувати ним волокно, треба перевести його у водорозчинну форму. Для цього індиго відновлюють і одержують розчинну у воді безбарвну форму – “біле індиго”. Волокно просочують розчином “білого індиго” і потім сушать на повітрі. Під дією кисню повітря “біле індиго” окиснюється до “синього індиго” і волокно набуває забарвлення. Такий процес фарбування, при якому нерозчинний барвник переводять у розчинну форму, наносять у вигляді розчину на тканину або волокно і потім знову роблять нерозчинним – називають кубовим фарбуванням.