- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Производные пиридин-4-карбоновой кислоты презентация
Содержание
- 1. Производные пиридин-4-карбоновой кислоты
- 2. Изониазид (Isoniazidum)
- 3. Фтивазид (Phthivazidum) 3-метокси-4-оксибензилиденгидразид
- 4. Ниаламид (Nialamidum)
- 5. Этионамид (Ethionamidum) Тиоамид
- 6. Протионамид (Prothionamidum) Тиоамид
- 7. Изониазид и фтивазид относятся к п/туберку-лезным препаратам
- 8. Этионамид и протионамид также проявляют п/туберкулезную
- 9. Получение
- 10. Аналогично получают ниаламид из изониазида, присоединяя соответствующий
- 11. У фтивазида:
- 12. Качественный анализ По Т плавления 2. СПФ
- 13. Реакции подлинности: 1. Реакции на пиридиновый цикл
- 14. 3. На остаток гидразина (обуславливает вос-становительные свойства)
- 15. 3.2. Реакция серебряного зеркала:
- 16. 3.3. С р-вом Фелинга → Cu2O↓ (красный)
- 17. Частные р-ции Изониазид 1. С нитропруссидом натрия
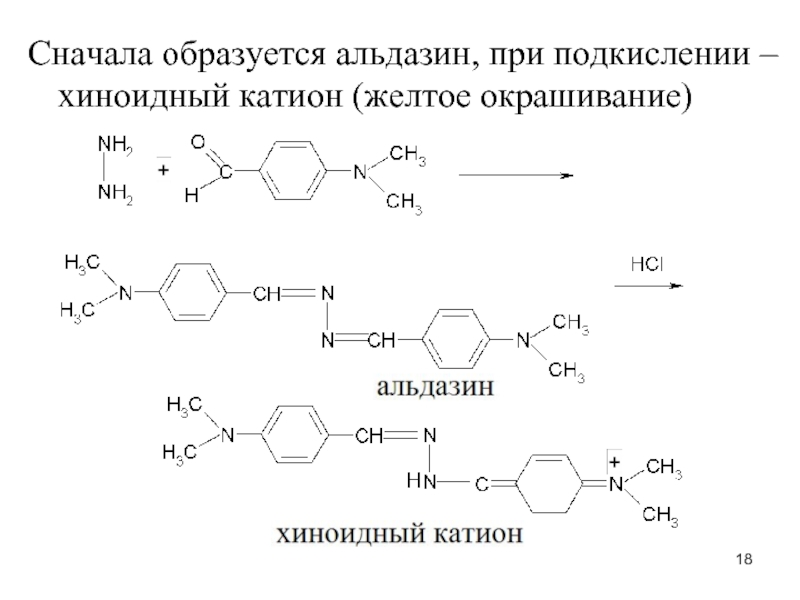
- 18. Сначала образуется альдазин, при подкислении – хиноидный катион (желтое окрашивание)
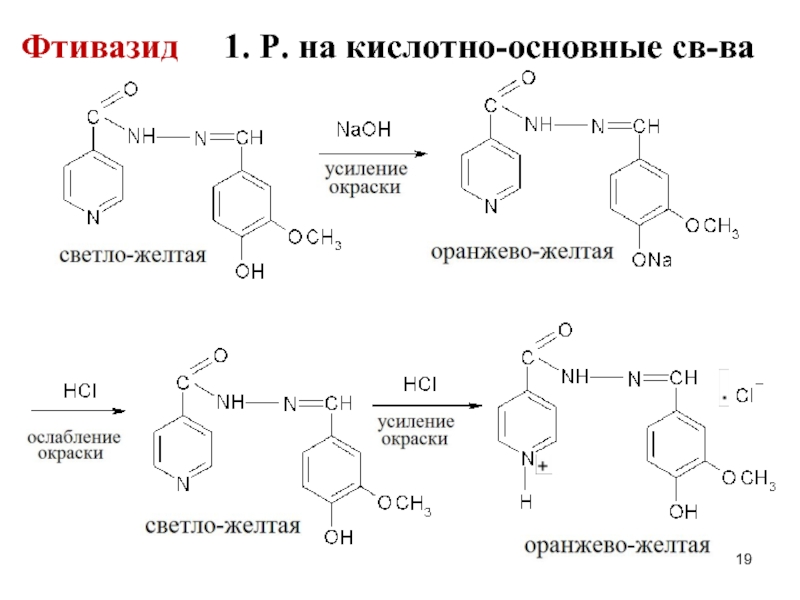
- 19. Фтивазид 1. Р. на кислотно-основные св-ва
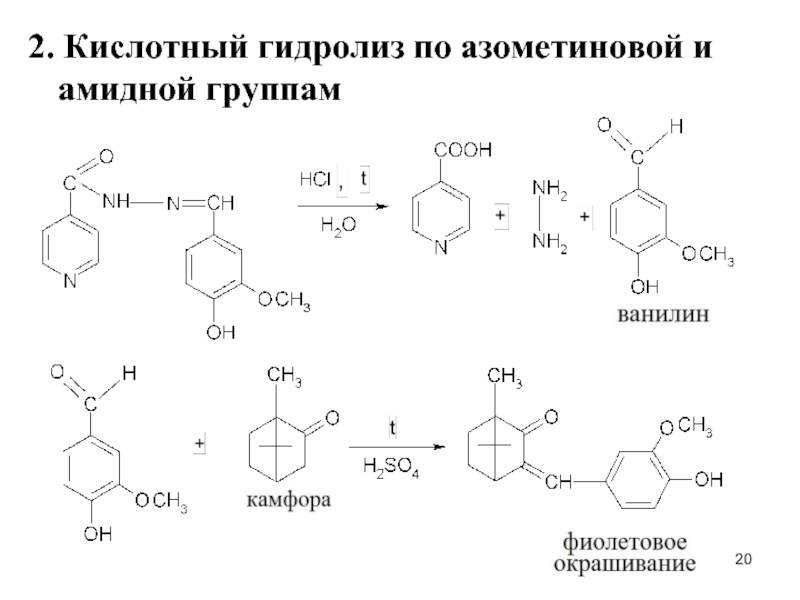
- 20. 2. Кислотный гидролиз по азометиновой и амидной группам
- 21. 3. Образование хиноидного катиона после гидролиза (на
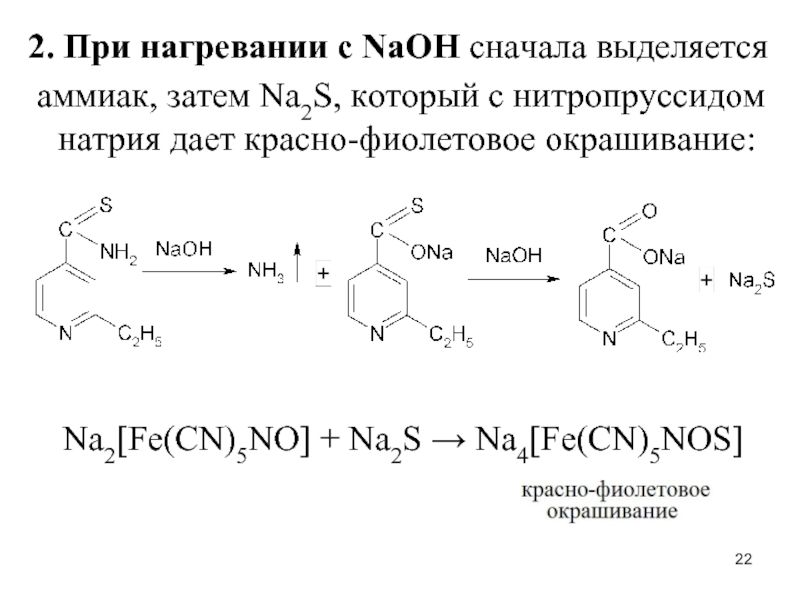
- 22. 2. При нагревании с NaOH сначала выделяется
- 23. Примеси Фтивазид, ниаламид – не допустима примесь
- 24. Если нет азида изоник.к-ты, то NaNO2 реагирует
- 25. Изониазид – примесь гидразина (доп),
- 26. Количественное определение 1. КОТ в НС
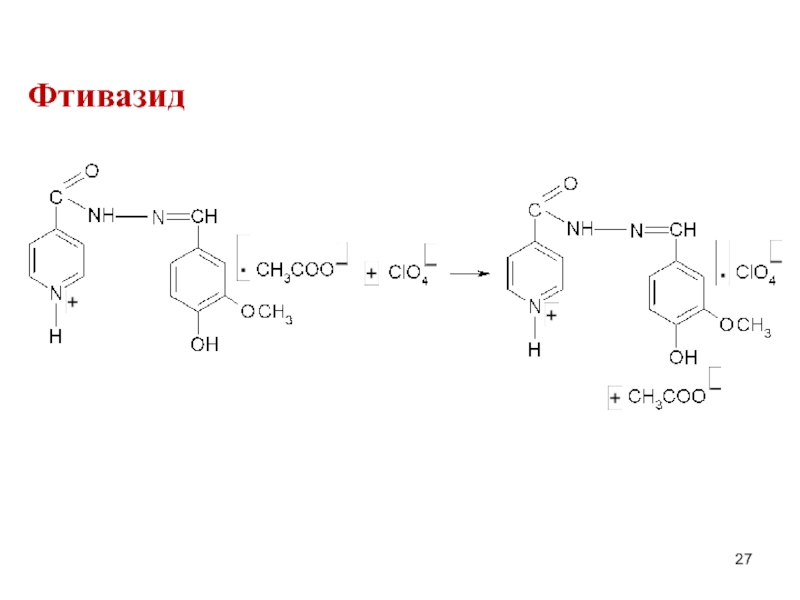
- 27. Фтивазид
- 28. Этионамид, протионамид Титрант –
- 29. 2. Нитритометрия Изониазид
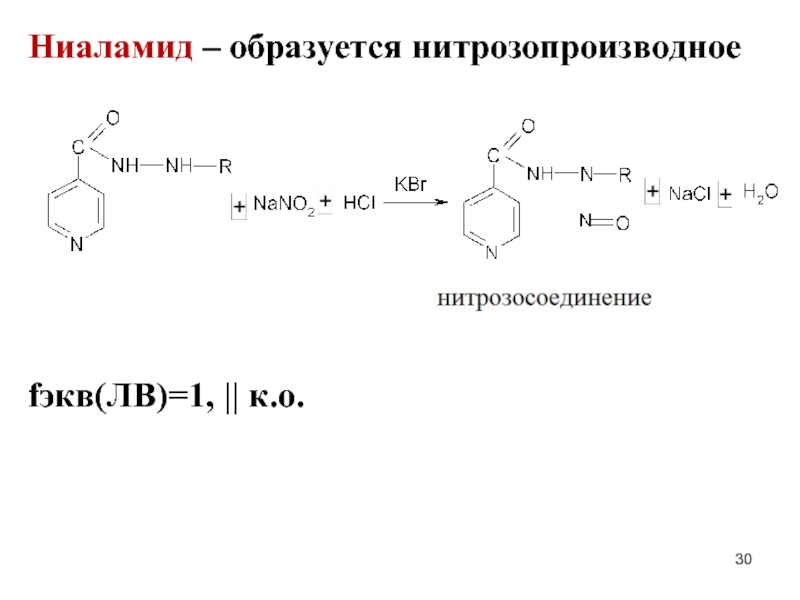
- 30. Ниаламид – образуется нитрозопроизводное fэкв(ЛВ)=1, || к.о.
- 31. 3. Ок-вос.методы (за счет остатка гидразина) Изониазид
- 32. Фактически окислителем является NaIO, кот-й образуется при
- 33. 3.2. Обратная броматометрия KBrO3 + 5KBr +
- 34. 3.3. Обратная цериметрия
- 35. Частные методы 1. Инъекционный р-р изониазида 5%,
- 36. 2. Фтивазид – иодатометрия (после гидролиза) Сначала
- 37. Суммарная реакция: NH2−NH2 + KIO3
- 38. Хранение Сп. Б, в ХУТ, прохл, защищ.
- 39. и
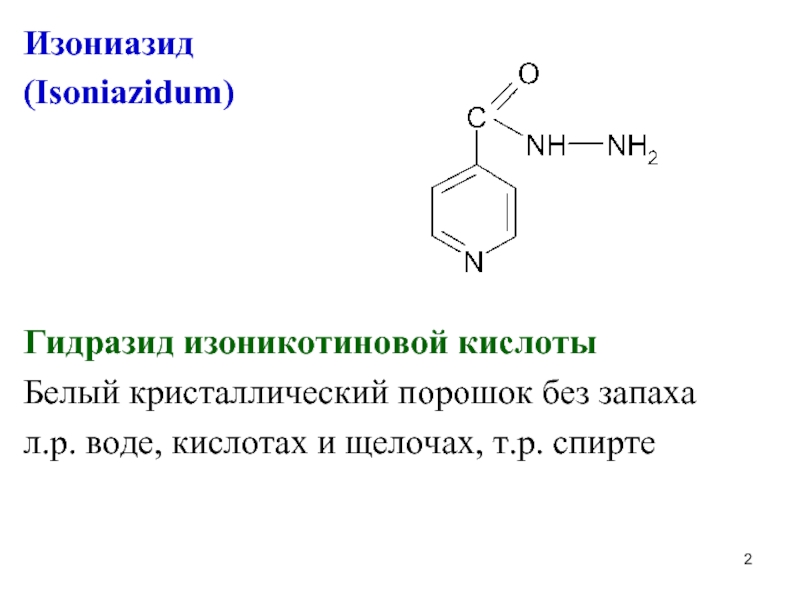
Слайд 2Изониазид
(Isoniazidum)
Гидразид изоникотиновой кислоты
Белый кристаллический порошок без запаха
л.р. воде, кислотах и
щелочах, т.р. спирте
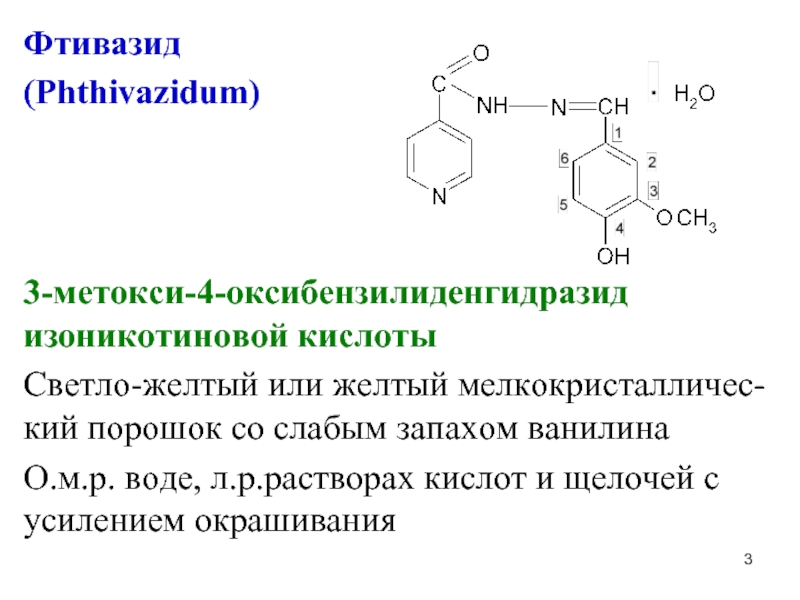
Слайд 3Фтивазид
(Phthivazidum)
3-метокси-4-оксибензилиденгидразид изоникотиновой кислоты
Светло-желтый или желтый мелкокристалличес-кий порошок со слабым запахом
ванилина
О.м.р. воде, л.р.растворах кислот и щелочей с усилением окрашивания
О.м.р. воде, л.р.растворах кислот и щелочей с усилением окрашивания
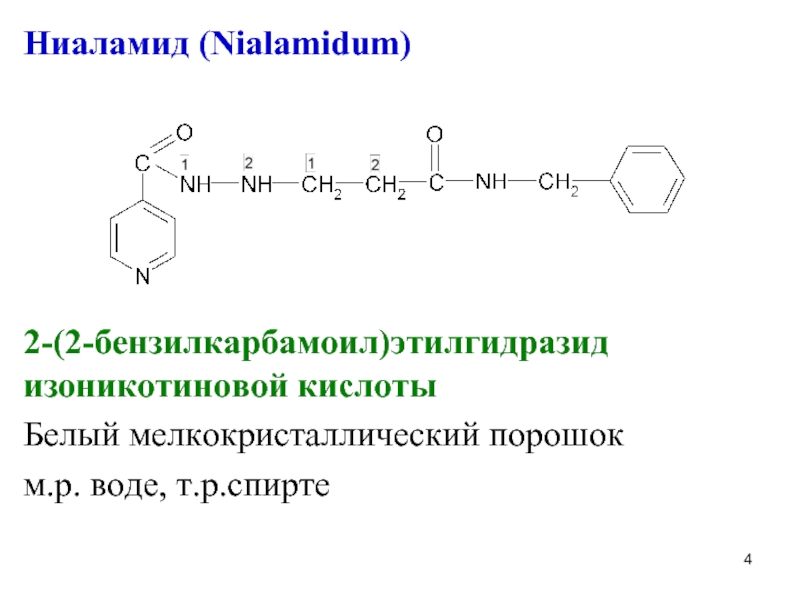
Слайд 4Ниаламид (Nialamidum)
2-(2-бензилкарбамоил)этилгидразид изоникотиновой кислоты
Белый мелкокристаллический порошок
м.р. воде, т.р.спирте
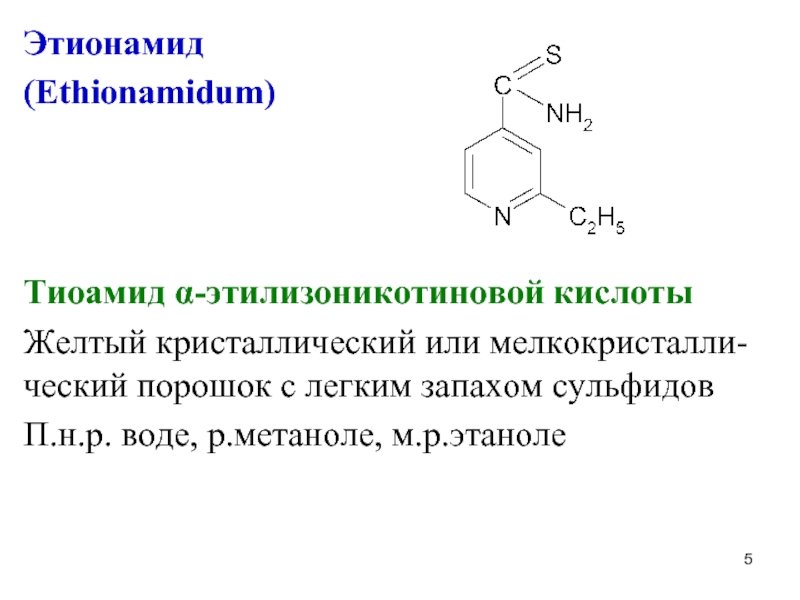
Слайд 5Этионамид
(Ethionamidum)
Тиоамид α-этилизоникотиновой кислоты
Желтый кристаллический или мелкокристалли-ческий порошок с легким запахом
сульфидов
П.н.р. воде, р.метаноле, м.р.этаноле
П.н.р. воде, р.метаноле, м.р.этаноле
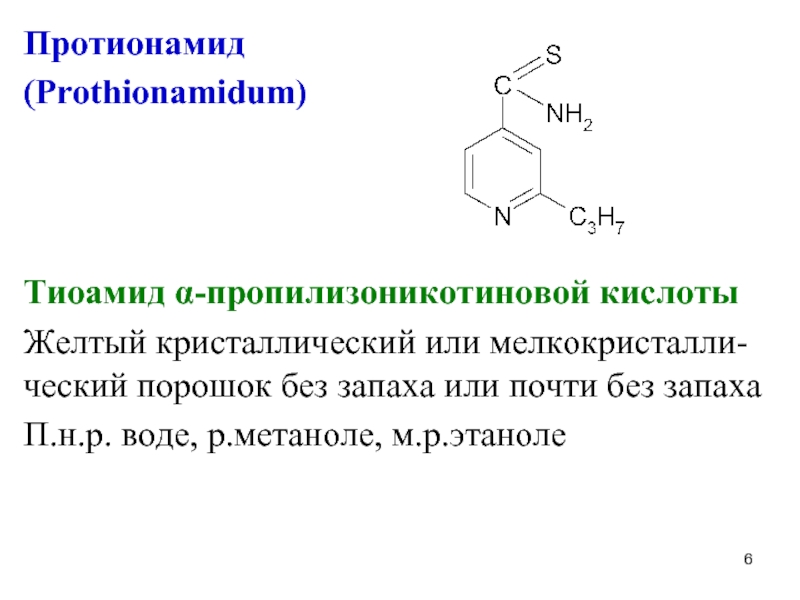
Слайд 6Протионамид
(Prothionamidum)
Тиоамид α-пропилизоникотиновой кислоты
Желтый кристаллический или мелкокристалли-ческий порошок без запаха или
почти без запаха
П.н.р. воде, р.метаноле, м.р.этаноле
П.н.р. воде, р.метаноле, м.р.этаноле
Слайд 7Изониазид и фтивазид относятся к п/туберку-лезным препаратам 1-го ряда. Наличие гидразид-ной
группы позволяет проникать внутрь туб. палочки, образуя хелатные соединения с ионами т.м., т.обр., угнетая деятельность ферментов и п рекращая жизнь туб.бактерии. Изоник.к-та – удачный носительгидразидной группы: с одной стороны она обеспечивает проникновение препарата в микобактерию туберкулеза с другой – малотоксична для организма. Т.обр., изониазид и фтивазид проявляют бактерицидный эффект.
Слайд 8
Этионамид и протионамид также проявляют п/туберкулезную активность
Ниаламид – антидепрессант, игибитор моноаминооксидазы,
которая дезаминирует моноамин и т.обр. инактивирует дофамин, норадреналин, серотонин. Под влиянием ингибиторов МАО замедляется их метаболизм и они накапливаются в мозге. Ф/кологичекое действие ниаламида связано с наличием карбамидной группы в молекуле препарата.
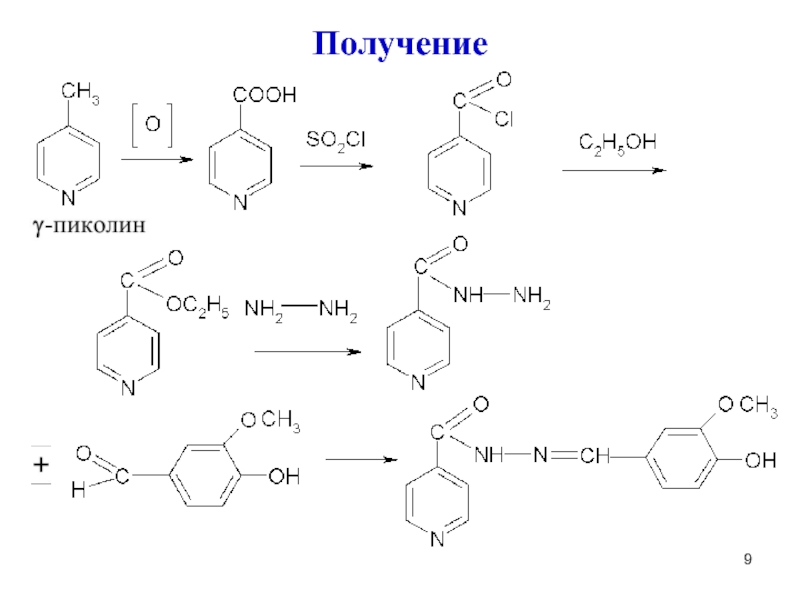
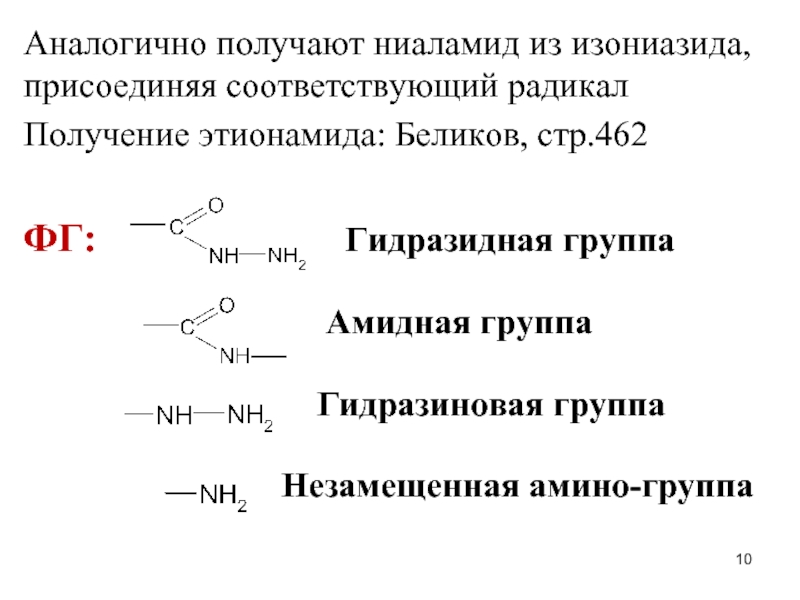
Слайд 10Аналогично получают ниаламид из изониазида, присоединяя соответствующий радикал
Получение этионамида: Беликов, стр.462
ФГ:
Гидразидная группа
Амидная группа
Гидразиновая группа
Незамещенная амино-группа
Амидная группа
Гидразиновая группа
Незамещенная амино-группа
Слайд 11
У фтивазида:
азометиновая группа
фенольный гидроксил
У этионамида и протионамида:
тиоамидная группа
У всех – пиридиновый цикл
фенольный гидроксил
У этионамида и протионамида:
тиоамидная группа
У всех – пиридиновый цикл
Слайд 12Качественный анализ
По Т плавления
2. СПФ в УФ-области спектра
3. ИК-спектроскопия
4. ТСХ,
ВЭЖХ
Изониазид и фтивазид являются амфолитами: пиридин.цикл (изониазид, фтивазид) и амино-гр в гидразиновом фрагменте (изониазид) обуславливают основные св-ва, кислотные св-ва – амидная гр (изониазид) и фенол. гидроксил
(фтивазид)
Изониазид и фтивазид являются амфолитами: пиридин.цикл (изониазид, фтивазид) и амино-гр в гидразиновом фрагменте (изониазид) обуславливают основные св-ва, кислотные св-ва – амидная гр (изониазид) и фенол. гидроксил
(фтивазид)
Слайд 13Реакции подлинности:
1. Реакции на пиридиновый цикл
Образование глутаконового альдегида
Пирролиз
С лимонной кислотой и
уксусным ангидридом
2. На третичный ат.N – с общеалкалоидными реактивами;
Изониазид + (NH4)2MoO4+H2SO4 → бурый ↓
Фтивазид + H2SO4 (к) → желтое окрашивание
2. На третичный ат.N – с общеалкалоидными реактивами;
Изониазид + (NH4)2MoO4+H2SO4 → бурый ↓
Фтивазид + H2SO4 (к) → желтое окрашивание
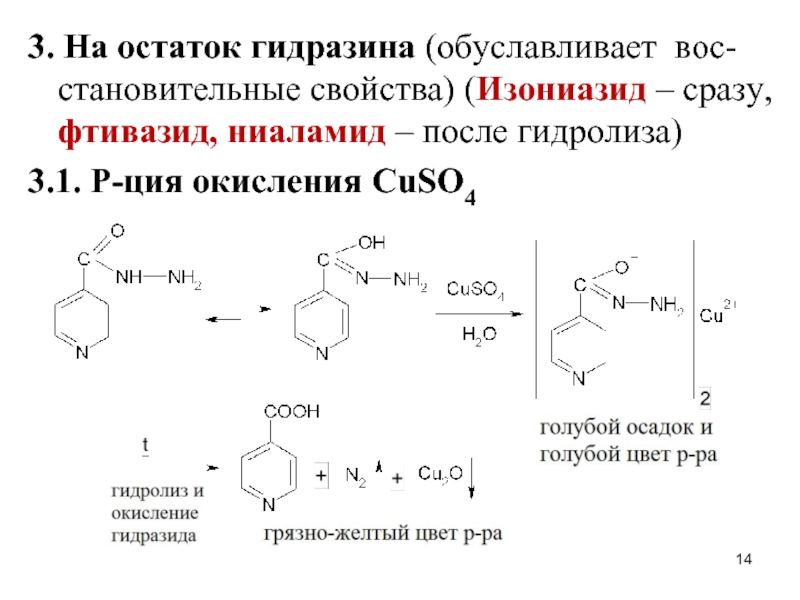
Слайд 143. На остаток гидразина (обуславливает вос-становительные свойства) (Изониазид – сразу, фтивазид,
ниаламид – после гидролиза)
3.1. Р-ция окисления CuSO4
3.1. Р-ция окисления CuSO4
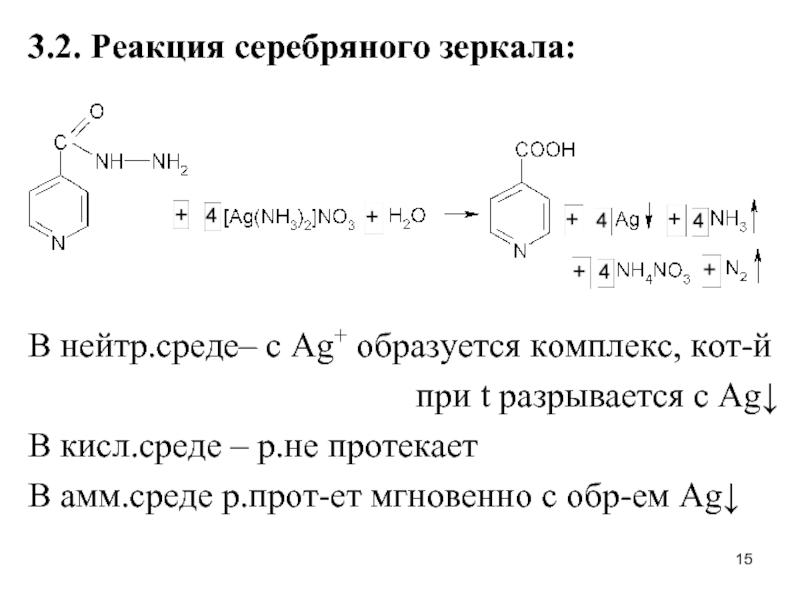
Слайд 153.2. Реакция серебряного зеркала:
В нейтр.среде– с Ag+ образуется комплекс, кот-й
при
t разрывается с Ag↓
В кисл.среде – р.не протекает
В амм.среде р.прот-ет мгновенно с обр-ем Ag↓
В кисл.среде – р.не протекает
В амм.среде р.прот-ет мгновенно с обр-ем Ag↓
Слайд 17Частные р-ции
Изониазид
1. С нитропруссидом натрия в щелоч. среде:
+Na2[Fe(CN)5NO] + NaOH →
оранж.окр-е + HCl → вишневое окр-е
2. Образование хиноидного катиона после щелочного гидролиза (на гидразин)
2. Образование хиноидного катиона после щелочного гидролиза (на гидразин)
Слайд 213. Образование хиноидного катиона после гидролиза (на гидразин)
4. На фенольный гидроксил
с FeCl3 – фиол.окр.
Этионамид, протионамид
1. При нагревнии с HCl образуется H2S
H2S + (CH3COO)2Pb → PbS↓ + 2CH3COOH
Фильтр-я бумага, пропитанная (CH3COO)2Pb , окрашивается в черный цвет
Этионамид, протионамид
1. При нагревнии с HCl образуется H2S
H2S + (CH3COO)2Pb → PbS↓ + 2CH3COOH
Фильтр-я бумага, пропитанная (CH3COO)2Pb , окрашивается в черный цвет
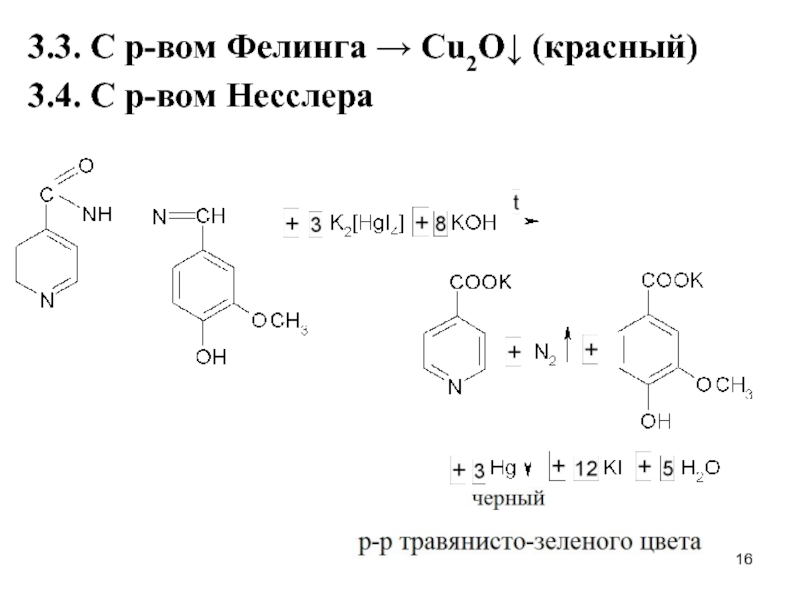
Слайд 222. При нагревании с NaOH сначала выделяется
аммиак, затем Na2S, который
с нитропруссидом натрия дает красно-фиолетовое окрашивание:
Na2[Fe(CN)5NO] + Na2S → Na4[Fe(CN)5NOS]
Na2[Fe(CN)5NO] + Na2S → Na4[Fe(CN)5NOS]
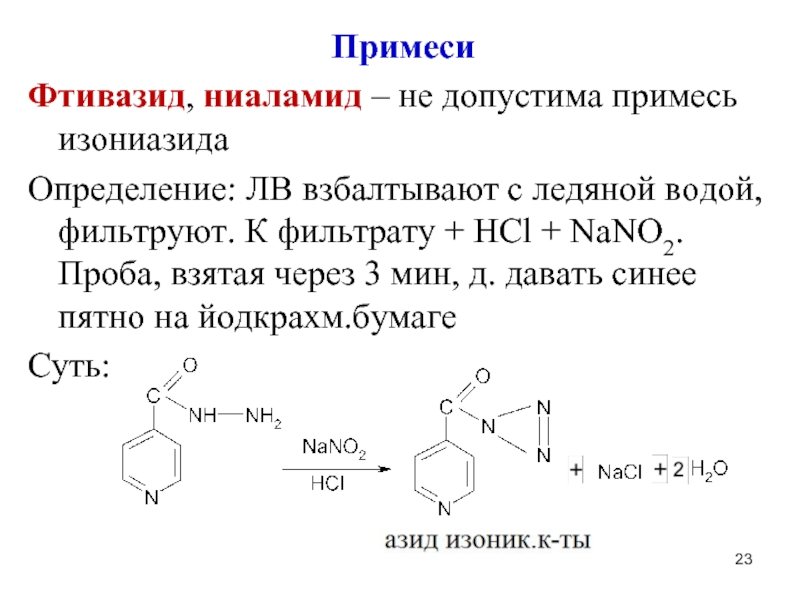
Слайд 23Примеси
Фтивазид, ниаламид – не допустима примесь изониазида
Определение: ЛВ взбалтывают с ледяной
водой, фильтруют. К фильтрату + НCl + NaNO2. Проба, взятая через 3 мин, д. давать синее пятно на йодкрахм.бумаге
Суть:
Суть:
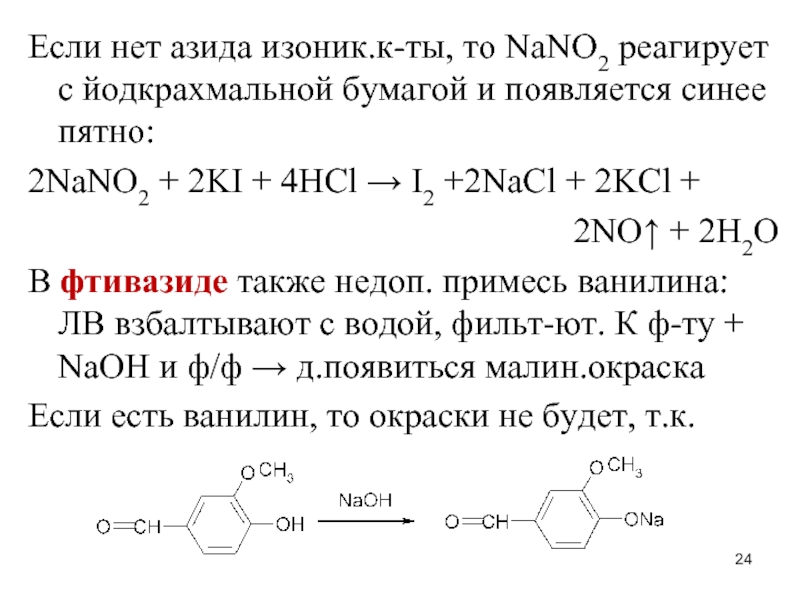
Слайд 24Если нет азида изоник.к-ты, то NaNO2 реагирует с йодкрахмальной бумагой и
появляется синее пятно:
2NaNO2 + 2KI + 4HCl → I2 +2NaCl + 2KCl +
2NO↑ + 2H2O
В фтивазиде также недоп. примесь ванилина: ЛВ взбалтывают с водой, фильт-ют. К ф-ту + NaOH и ф/ф → д.появиться малин.окраска
Если есть ванилин, то окраски не будет, т.к.
2NaNO2 + 2KI + 4HCl → I2 +2NaCl + 2KCl +
2NO↑ + 2H2O
В фтивазиде также недоп. примесь ванилина: ЛВ взбалтывают с водой, фильт-ют. К ф-ту + NaOH и ф/ф → д.появиться малин.окраска
Если есть ванилин, то окраски не будет, т.к.
Слайд 25
Изониазид – примесь гидразина (доп), ТСХ
Этионамид, протионамид – посторонние примеси (доп),
ТСХ
Слайд 26Количественное определение
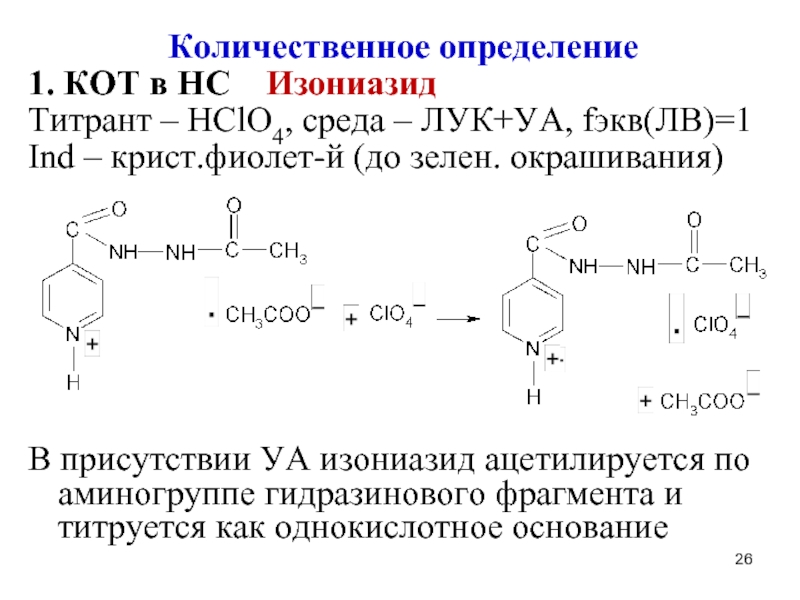
1. КОТ в НС Изониазид
Титрант – HClO4, среда –
ЛУК+УА, fэкв(ЛВ)=1
Ind – крист.фиолет-й (до зелен. окрашивания)
В присутствии УА изониазид ацетилируется по аминогруппе гидразинового фрагмента и титруется как однокислотное основание
Ind – крист.фиолет-й (до зелен. окрашивания)
В присутствии УА изониазид ацетилируется по аминогруппе гидразинового фрагмента и титруется как однокислотное основание
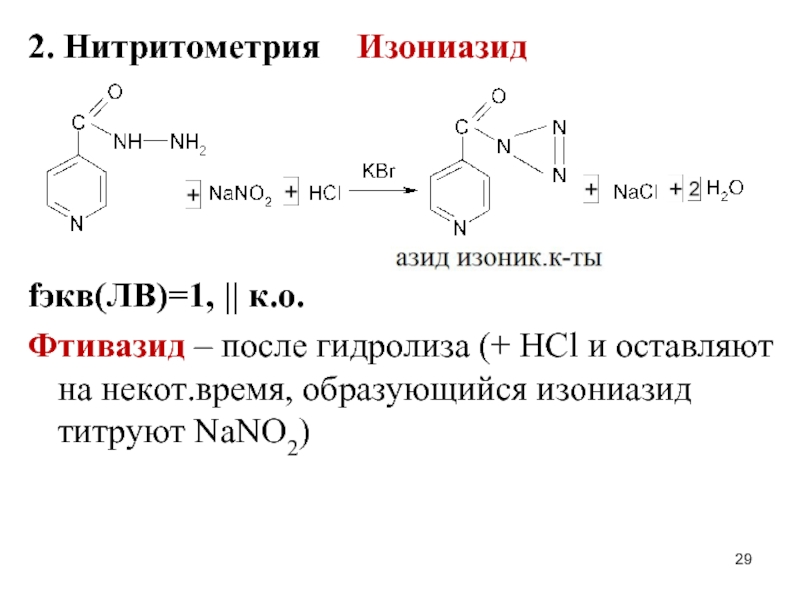
Слайд 292. Нитритометрия Изониазид
fэкв(ЛВ)=1, || к.о.
Фтивазид – после гидролиза (+ HCl
и оставляют на некот.время, образующийся изониазид титруют NaNO2)
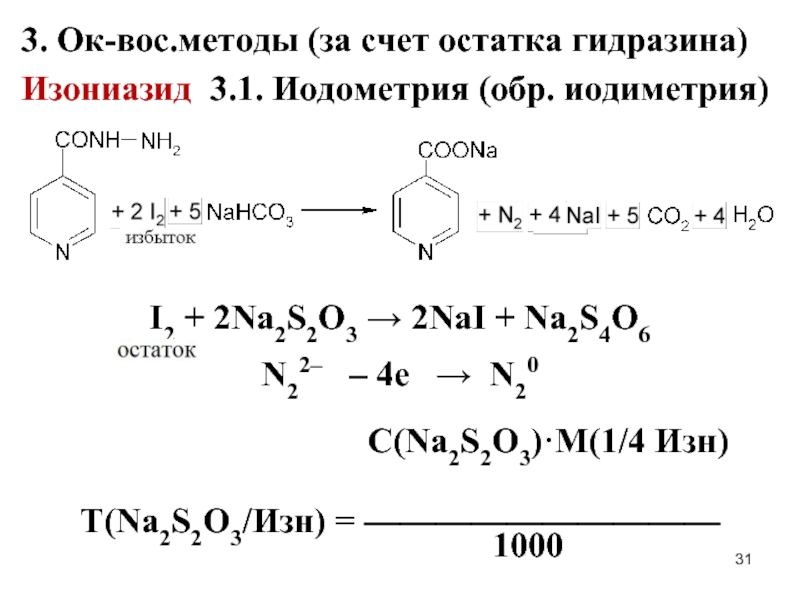
Слайд 313. Ок-вос.методы (за счет остатка гидразина)
Изониазид 3.1. Иодометрия (обр. иодиметрия)
I2 +
2Na2S2O3 → 2NaI + Na2S4O6
N22– – 4е → N20
С(Na2S2O3)·M(1/4 Изн)
Т(Na2S2O3/Изн) = ——————————
1000
N22– – 4е → N20
С(Na2S2O3)·M(1/4 Изн)
Т(Na2S2O3/Изн) = ——————————
1000
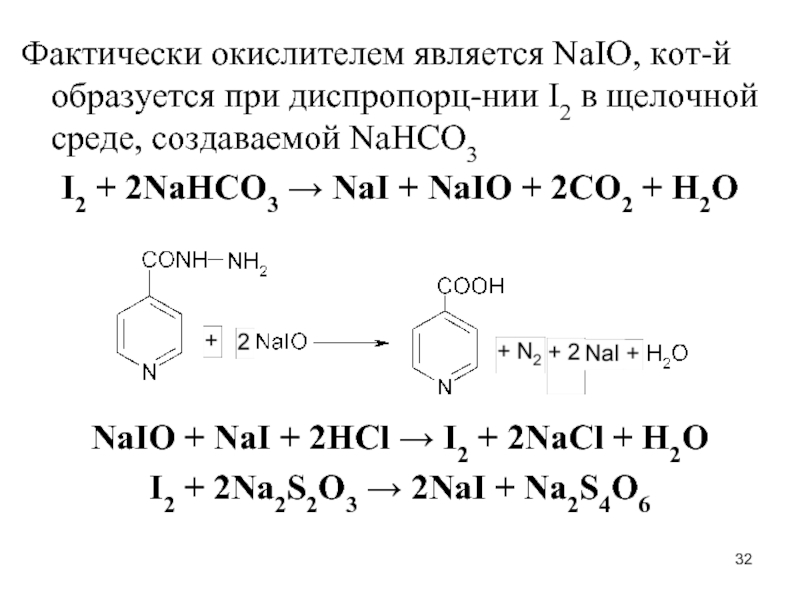
Слайд 32Фактически окислителем является NaIO, кот-й образуется при диспропорц-нии I2 в щелочной
среде, создаваемой NaHCO3
I2 + 2NaHCO3 → NaI + NaIO + 2CO2 + H2O
NaIO + NaI + 2HCl → I2 + 2NaCl + H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
I2 + 2NaHCO3 → NaI + NaIO + 2CO2 + H2O
NaIO + NaI + 2HCl → I2 + 2NaCl + H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Слайд 333.2. Обратная броматометрия
KBrO3 + 5KBr + 3H2SO4 → Br2 + 3K2SO4
+ 3H2O
Br2 +2KI → I2 + 2KBr
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
N22– – 4е → N20 ⇒ fэкв(ЛВ)=1/4, || к.о.
Br2 +2KI → I2 + 2KBr
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
N22– – 4е → N20 ⇒ fэкв(ЛВ)=1/4, || к.о.
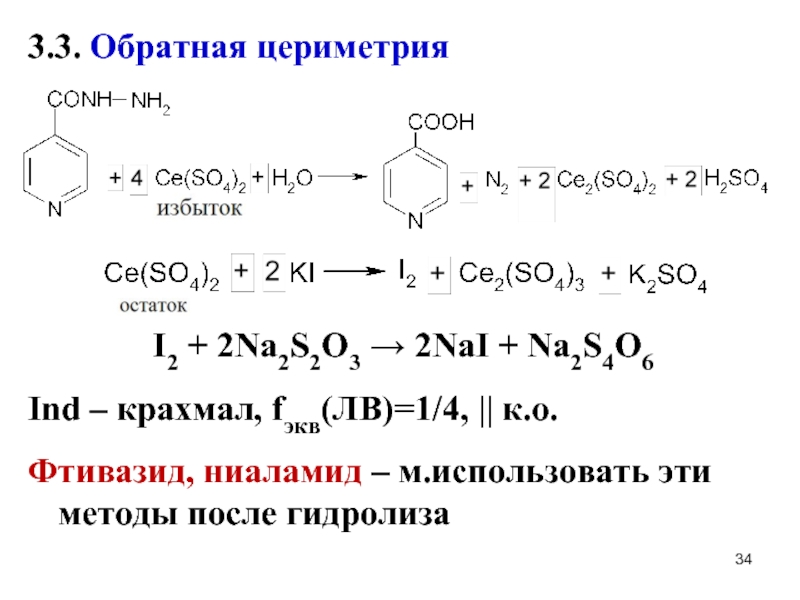
Слайд 343.3. Обратная цериметрия
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Ind – крахмал,
fэкв(ЛВ)=1/4, || к.о.
Фтивазид, ниаламид – м.использовать эти методы после гидролиза
Фтивазид, ниаламид – м.использовать эти методы после гидролиза
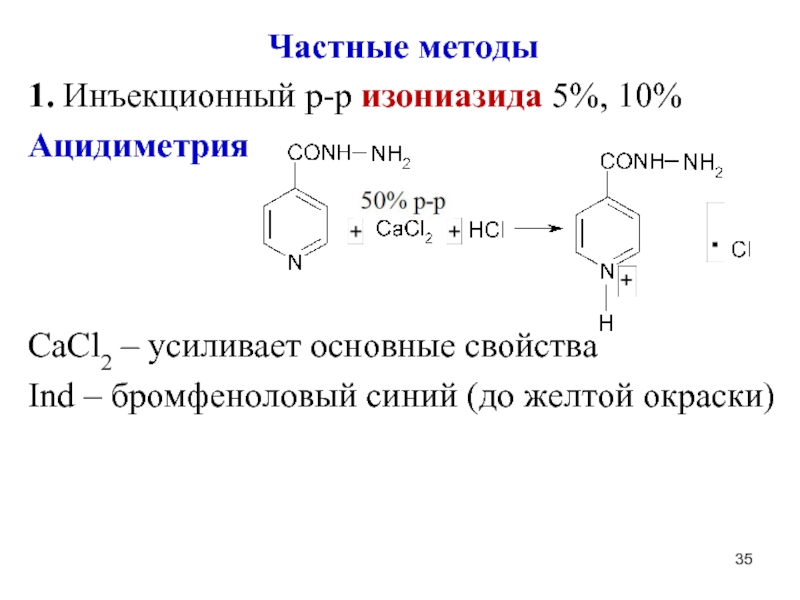
Слайд 35Частные методы
1. Инъекционный р-р изониазида 5%, 10%
Ацидиметрия
CaCl2 – усиливает основные свойства
Ind
– бромфеноловый синий (до желтой окраски)
Слайд 362. Фтивазид – иодатометрия (после гидролиза)
Сначала проводят кислотный гидролиз при кипячении
(образуется гидразин), р-р охл-ют и титруют гидразин иодатом калия:
5NH2−NH2 + 4KIO3 +4HCl → 5N2 + 2I2 +4KCl +
12H2O
Незадолго до конца титрования в р-р + хлф, в котором I2 р-ется лучше, чем в воде, хлф слой окрашивается в фиолетовый цвет и далее титруют KIO3 до обесцвечивания хлф слоя
2I2 + KIO3 + 6HCl → 5ICl + KCl + 3H2O
5NH2−NH2 + 4KIO3 +4HCl → 5N2 + 2I2 +4KCl +
12H2O
Незадолго до конца титрования в р-р + хлф, в котором I2 р-ется лучше, чем в воде, хлф слой окрашивается в фиолетовый цвет и далее титруют KIO3 до обесцвечивания хлф слоя
2I2 + KIO3 + 6HCl → 5ICl + KCl + 3H2O
Слайд 37
Суммарная реакция:
NH2−NH2 + KIO3 +2HCl → N2 + ICl + KCl
+
3H2O
I+5 + 4e → I+1 ⇒ fэкв(ЛВ)=1/4, || к.о.
4. Физ-хим. методы (СПФ, ВЭЖХ)
3H2O
I+5 + 4e → I+1 ⇒ fэкв(ЛВ)=1/4, || к.о.
4. Физ-хим. методы (СПФ, ВЭЖХ)
Слайд 38Хранение
Сп. Б, в ХУТ, прохл, защищ. от света, сухом месте
Применение
Изониазид,
фтивазид, этионамид, протионамид
– п/туберкулезные средства, внутрь по по 0,3 г (изон) и 0,5 г (фтив) 2-3 р/день
Этионамид, протионамид менее активны, чем изониазид и стрептомицин, но действуют на устойчивые к ним микобактерии
Ниаламид – в психиатрической практике при депрессивных состояниях (тб по 0,025 г)
– п/туберкулезные средства, внутрь по по 0,3 г (изон) и 0,5 г (фтив) 2-3 р/день
Этионамид, протионамид менее активны, чем изониазид и стрептомицин, но действуют на устойчивые к ним микобактерии
Ниаламид – в психиатрической практике при депрессивных состояниях (тб по 0,025 г)






![Частные р-цииИзониазид1. С нитропруссидом натрия в щелоч. среде:+Na2[Fe(CN)5NO] + NaOH → оранж.окр-е + HCl →](/img/tmb/1/9723/faae0d3a5fc441bf510adaaf20238824-800x.jpg)