- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Галогенпроизводные углеводородов презентация
Содержание
- 1. Галогенпроизводные углеводородов
- 2. Хлорирование и бромирование метана. Методы синтеза
- 3. Замещение гидроксильной группы спиртов на галоген Иодирование.
- 4. Реакция карбонилсодержащих соединений с галогенидами фосфора Физические
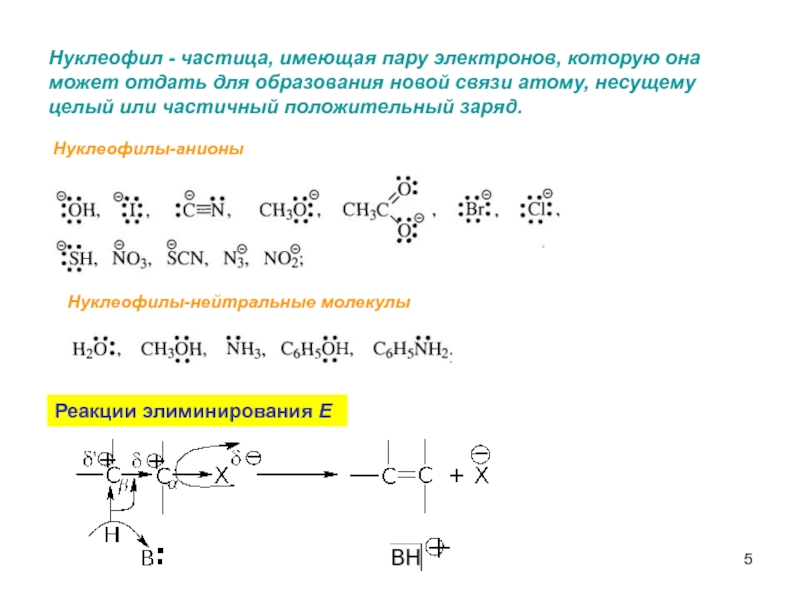
- 5. Нуклеофил - частица, имеющая пару электронов, которую
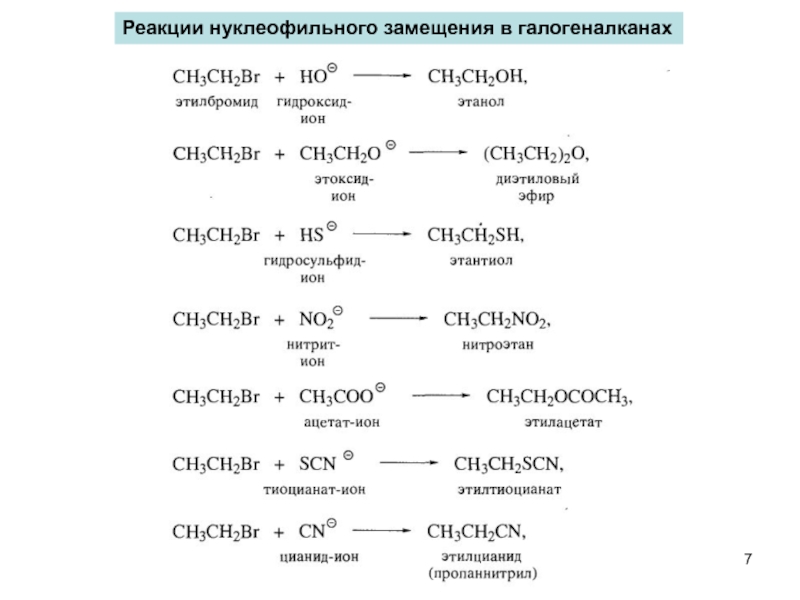
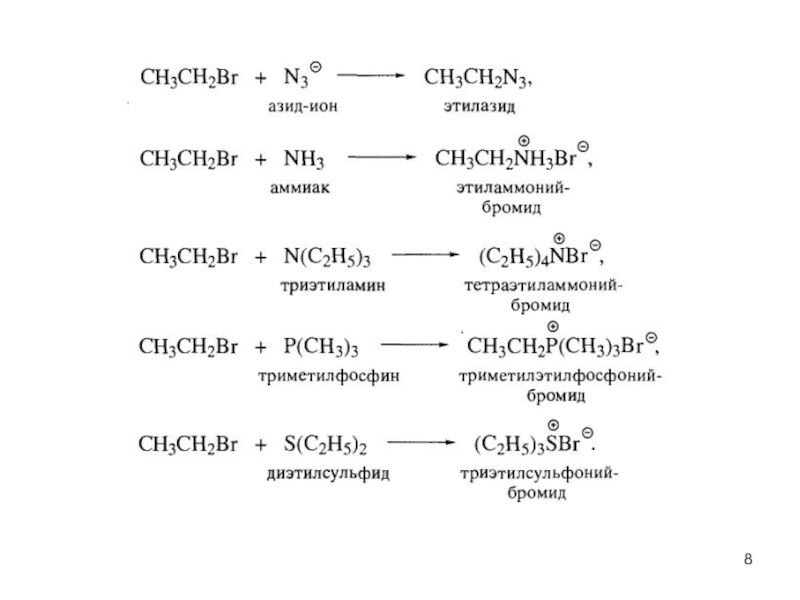
- 6. Нуклеофильное замещение R-Hal + Nu → R-Nu + Hal-
- 7. Реакции нуклеофильного замещения в галогеналканах
- 9. Бимолекулярное нуклеофильное замещение (SN2) Скорость реакции.
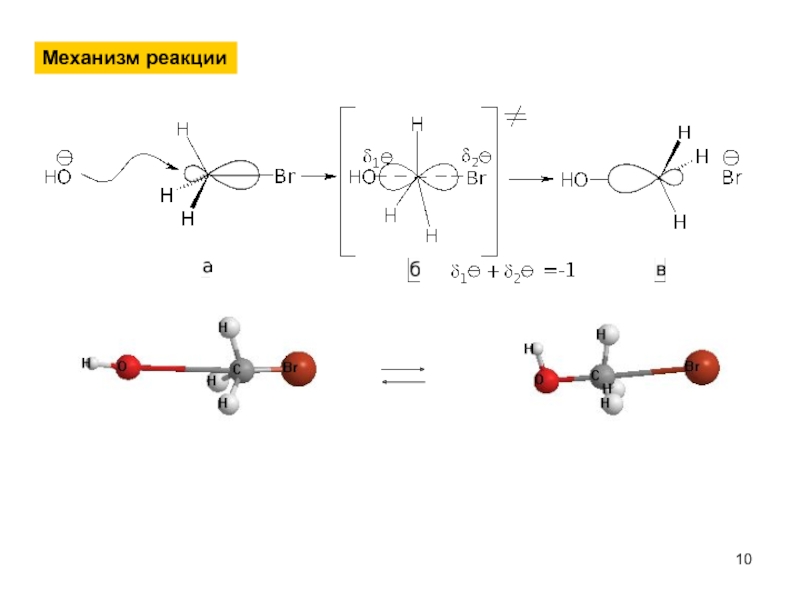
- 10. Механизм реакции
- 11. Диаграмма изменения потенциальной энергии в реакции
- 12. Нуклеофил – нейтральная молекула
- 13. Нуклеофил - анион Влияние полярности растворителя на
- 14. Влияние растворителя на скорость реакции SN2
- 15. Апротонные биполярные растворители: растворители с высокой
- 16. В апротонных растворителях (ДМФА, ДМСО) реакционная способность
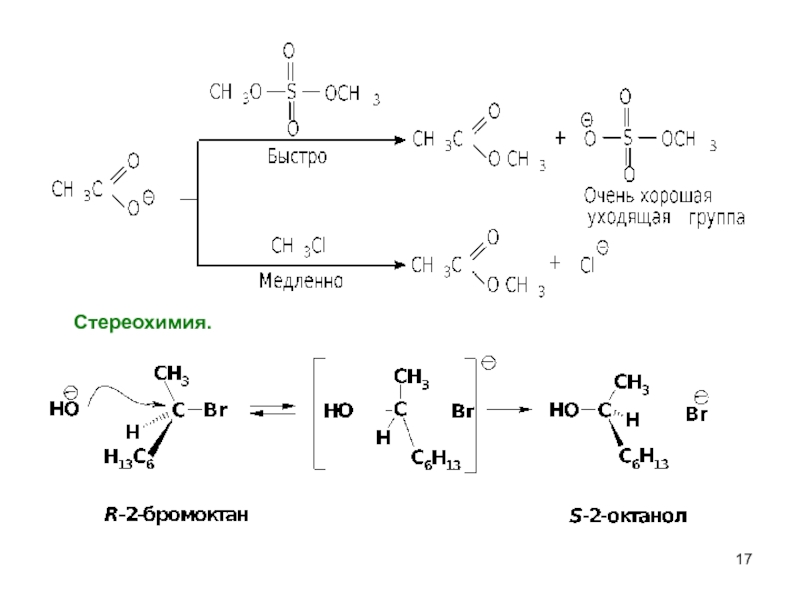
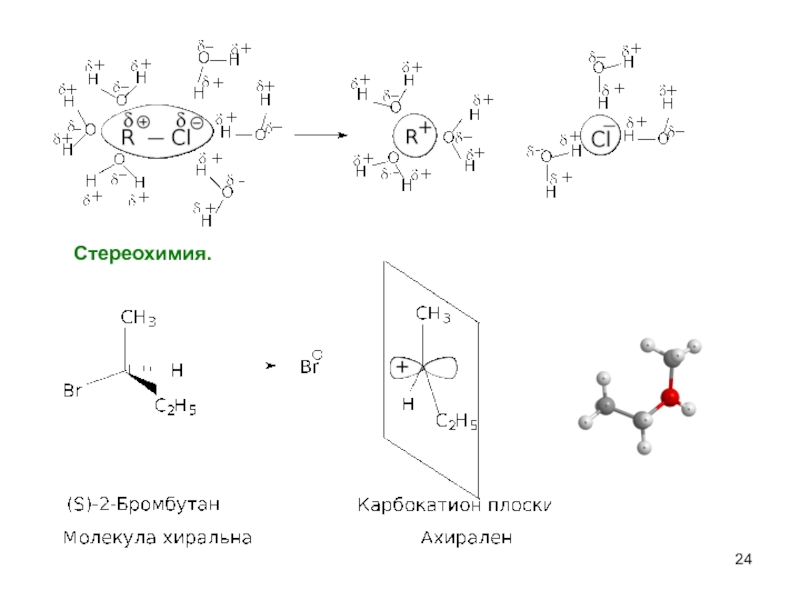
- 17. Cтереохимия.
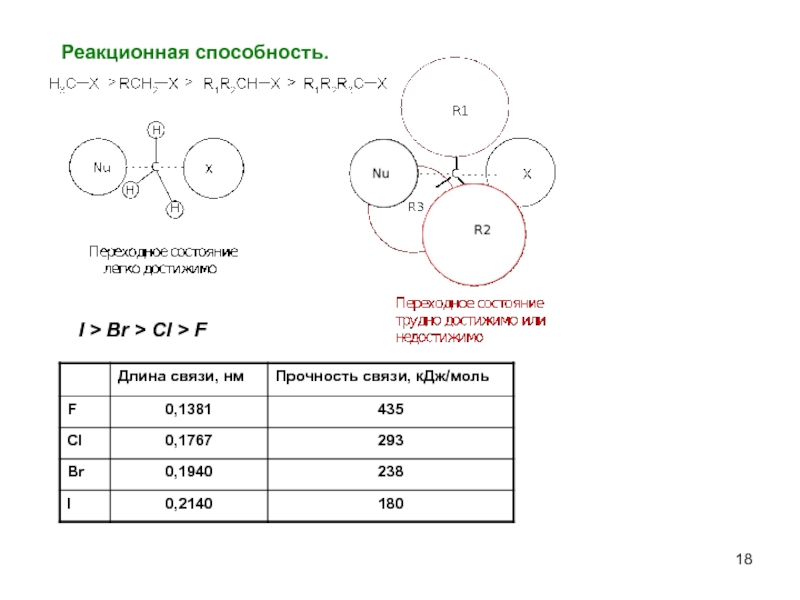
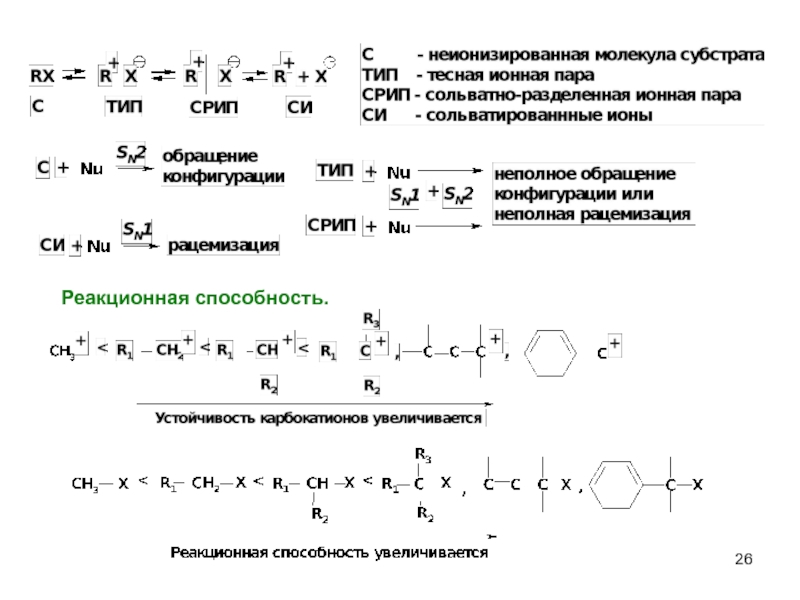
- 18. Реакционная способность. I > Br > Cl > F
- 20. Мономолекулярное нуклеофильное замещение (SN1) Механизм реакции Медленная стадия: образование карбокатиона. Электрофильный катализ.
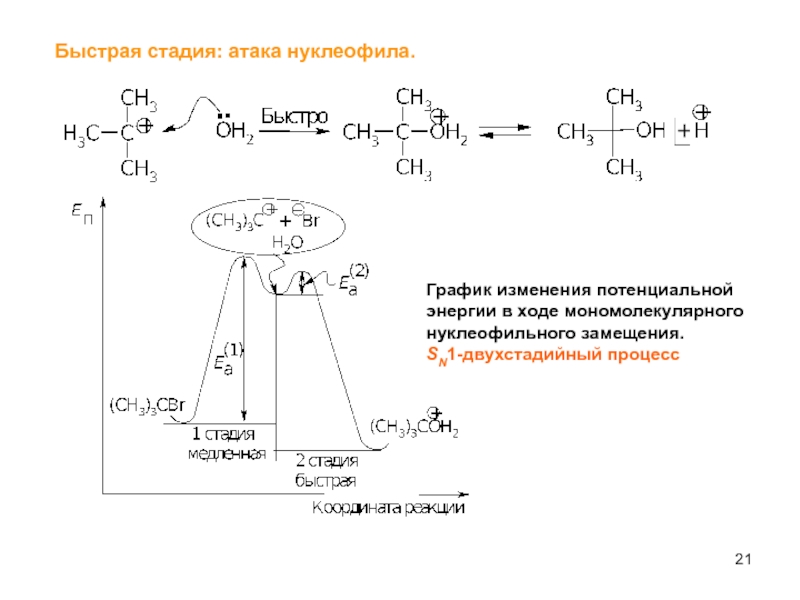
- 21. Быстрая стадия: атака нуклеофила. График изменения потенциальной
- 22. Перегруппировка – признак механизма SN1. Механизм
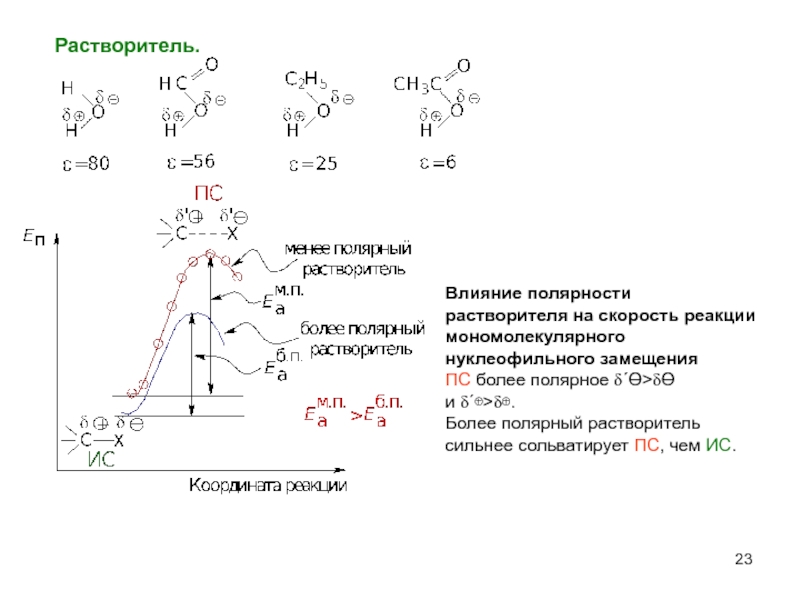
- 23. Растворитель. Влияние полярности растворителя на скорость
- 24. Стереохимия.
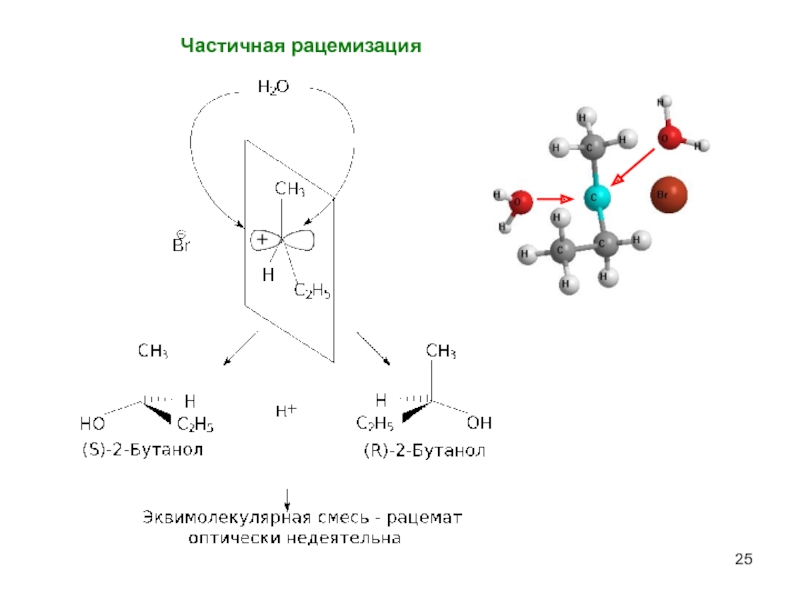
- 25. Частичная рацемизация
- 26. Реакционная способность.
- 27. Нуклеофильность и основность Нуклеофильность Кинетически контролируемая реакция
- 28. Сравнение реакций SN1 и SN2 Влияние условий реакции на соотношение двух механизмов.
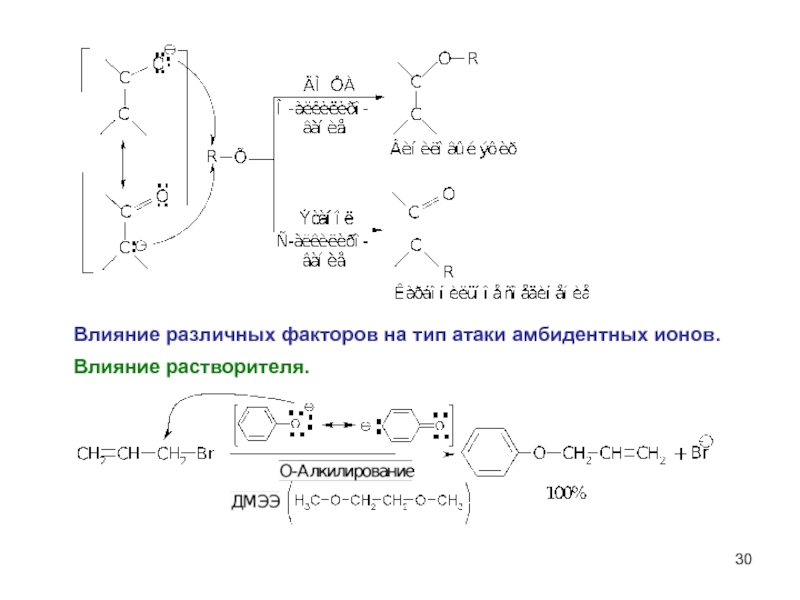
- 29. Амбидентные ионы На атомах с большей
- 30. Влияние растворителя. Влияние различных факторов на тип атаки амбидентных ионов.
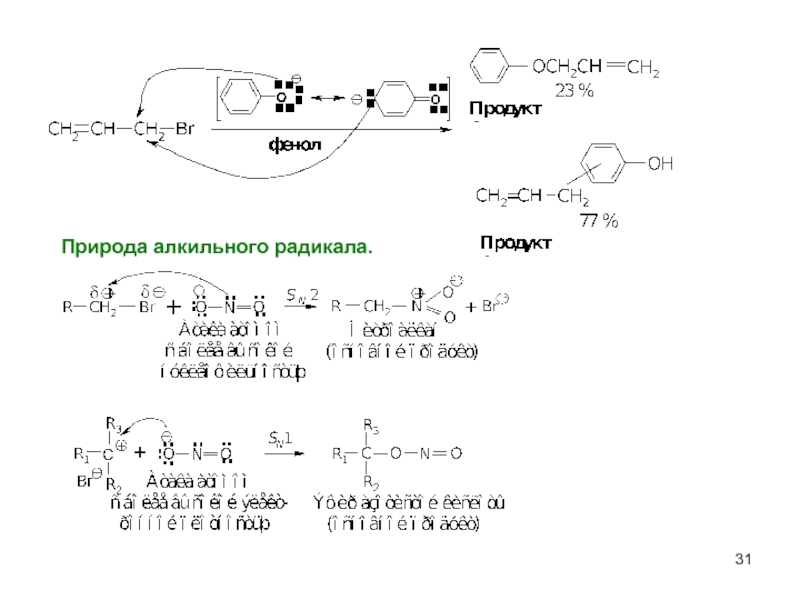
- 31. Природа алкильного радикала.
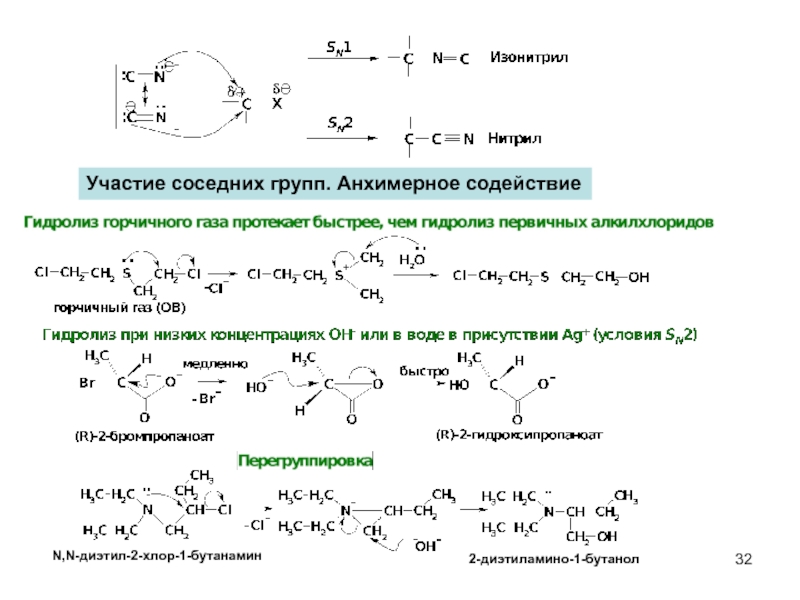
- 32. Участие соседних групп. Анхимерное содействие N,N-диэтил-2-хлор-1-бутанамин 2-диэтиламино-1-бутанол
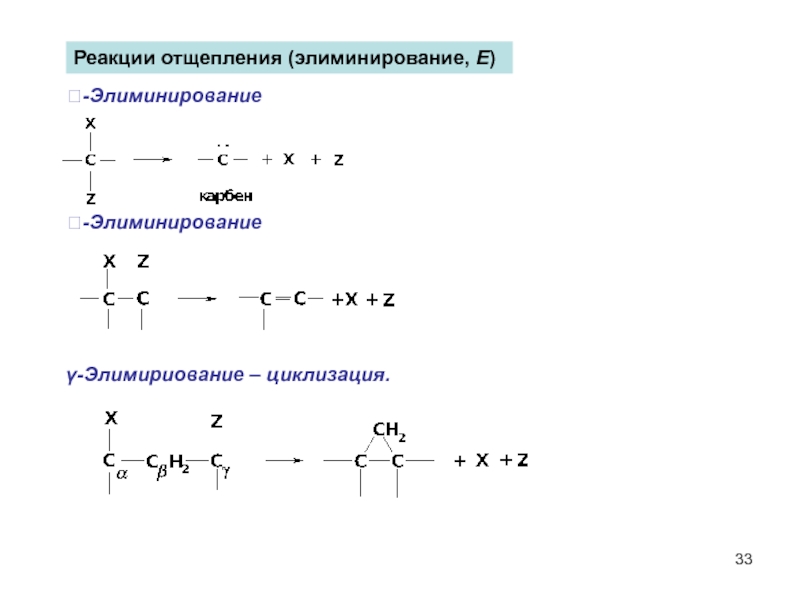
- 33. Реакции отщепления (элиминирование, Е) -Элиминирование -Элиминирование γ-Элимириование – циклизация.
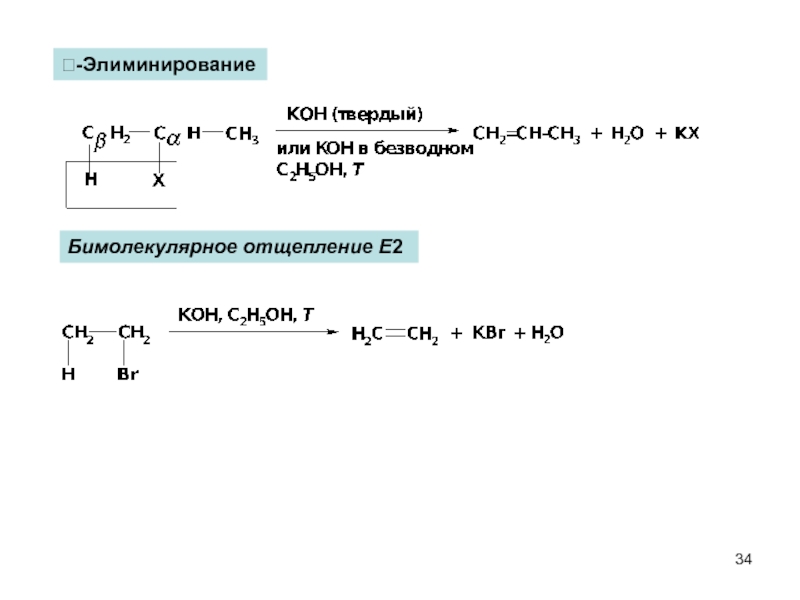
- 34. -Элиминирование Бимолекулярное отщепление Е2
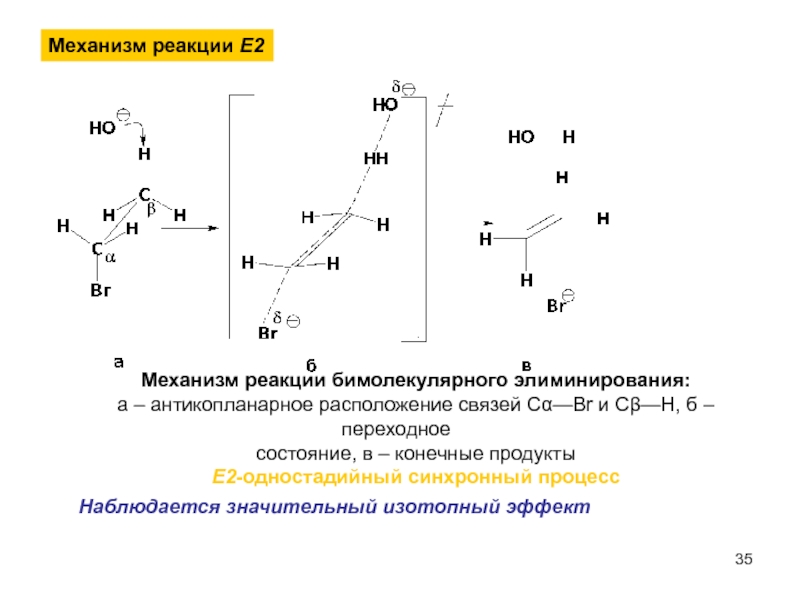
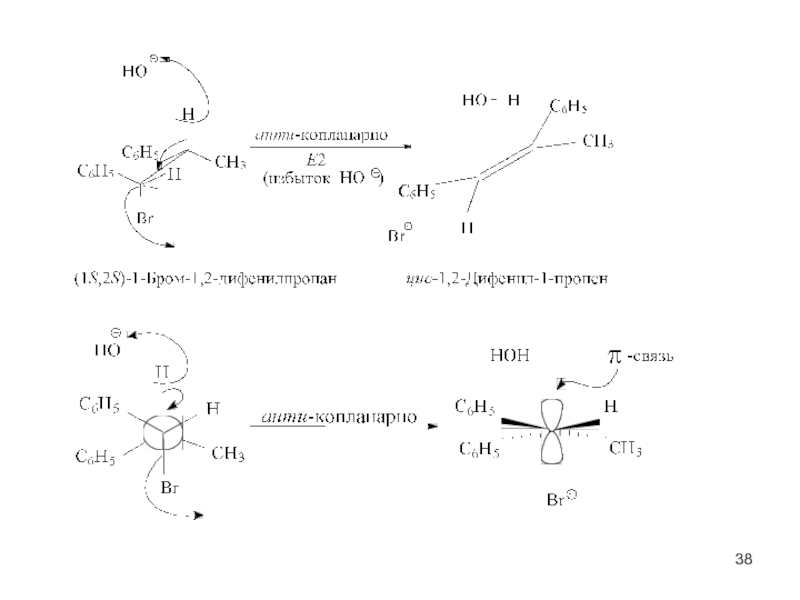
- 35. Механизм реакции Е2 Механизм реакции бимолекулярного элиминирования:
- 36. Антикопланарное расположение связей Сα—Br и Сβ—H. Атака гидроксид-аниона Переходное состояние
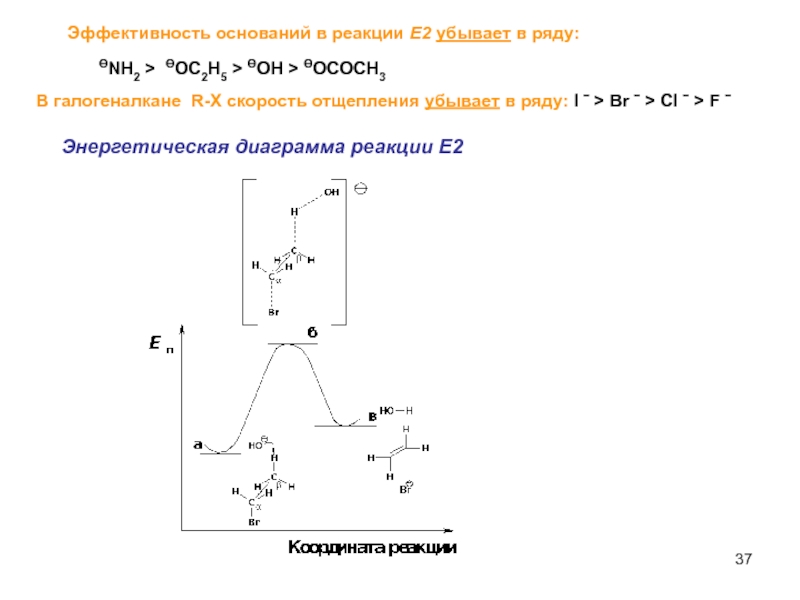
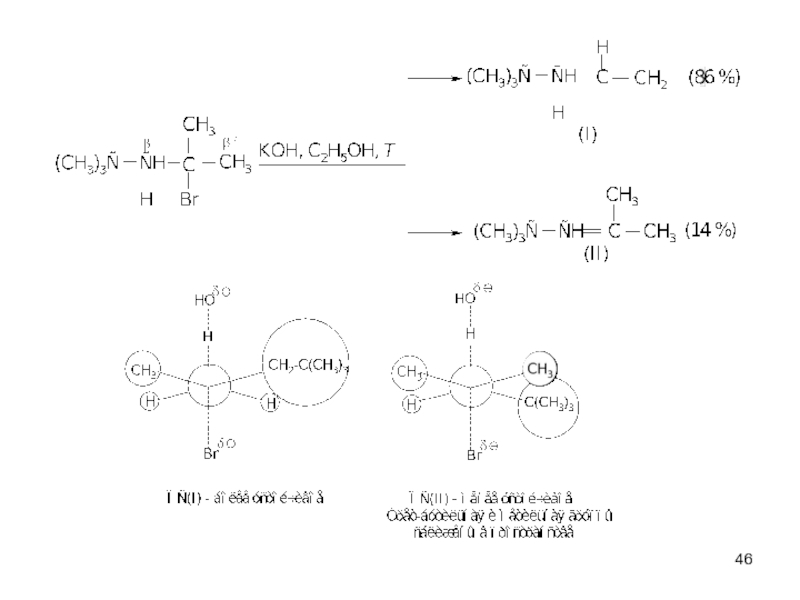
- 37. Эффективность оснований в реакции Е2 убывает в
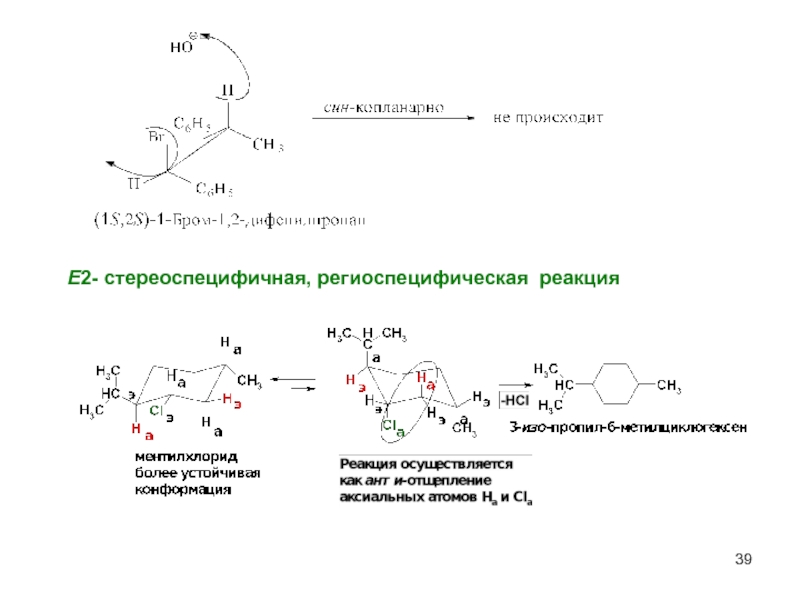
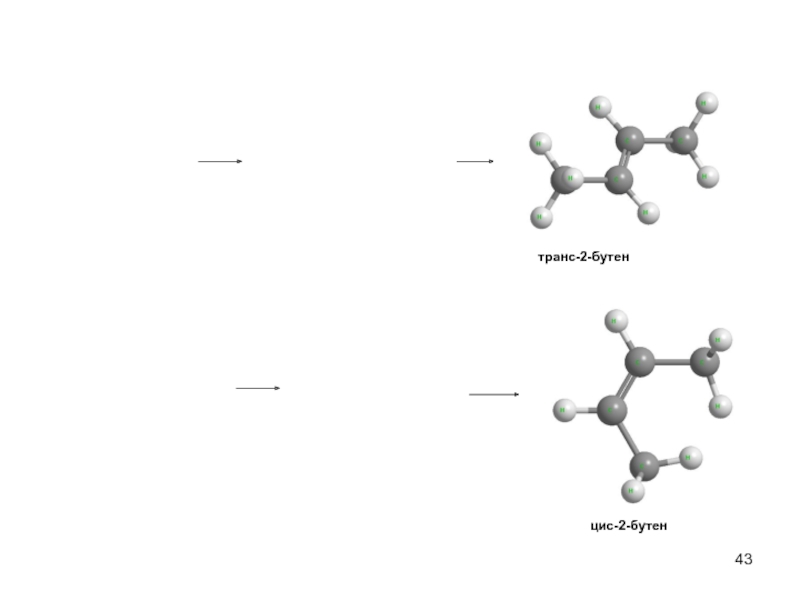
- 39. Е2- стереоспецифичная, региоспецифическая реакция
- 40. Скорость реакции V(E2) = k΄ [R-Br]
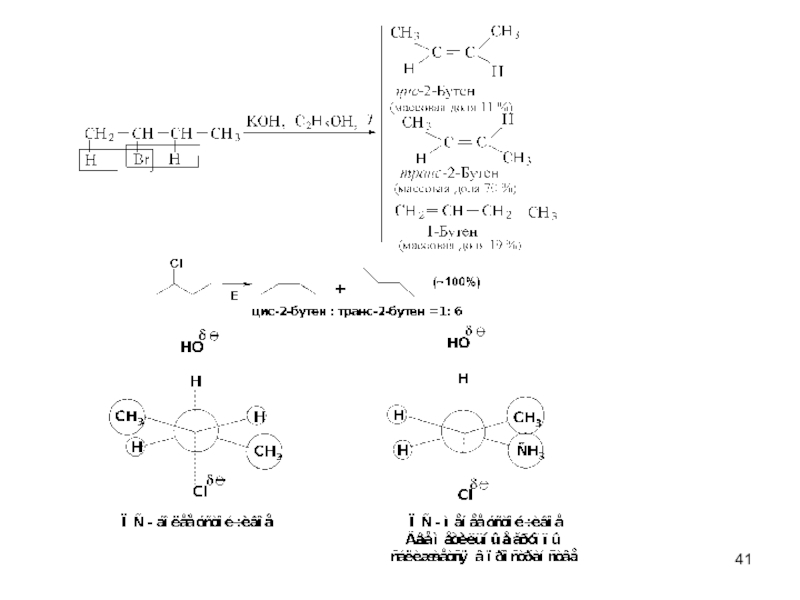
- 43. транс-2-бутен цис-2-бутен
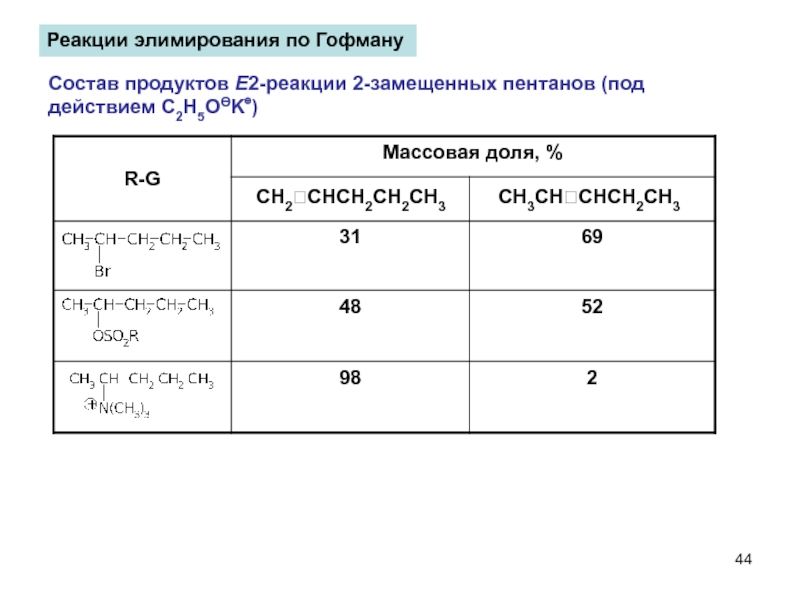
- 44. Реакции элимирования по Гофману
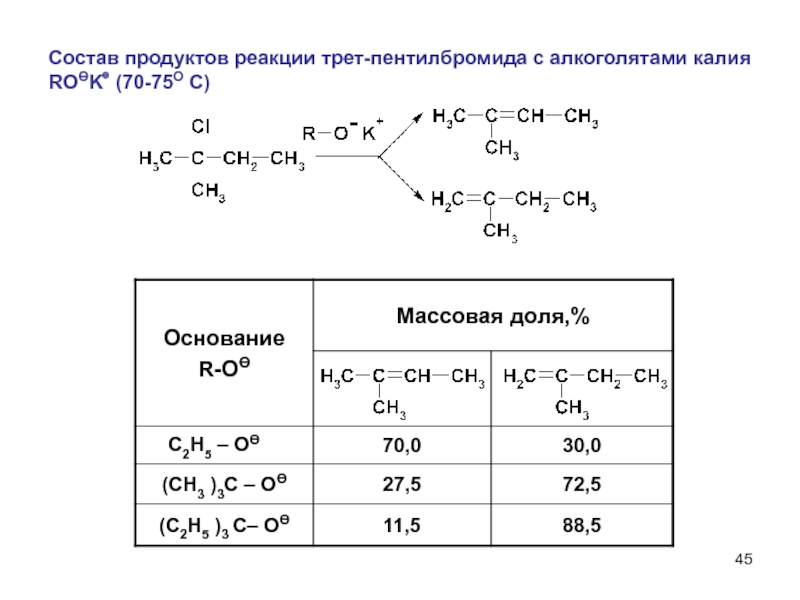
- 45. Состав продуктов реакции трет-пентилбромида с алкоголятами калия ROӨK⊕ (70-75О С) C2H5 – OӨ
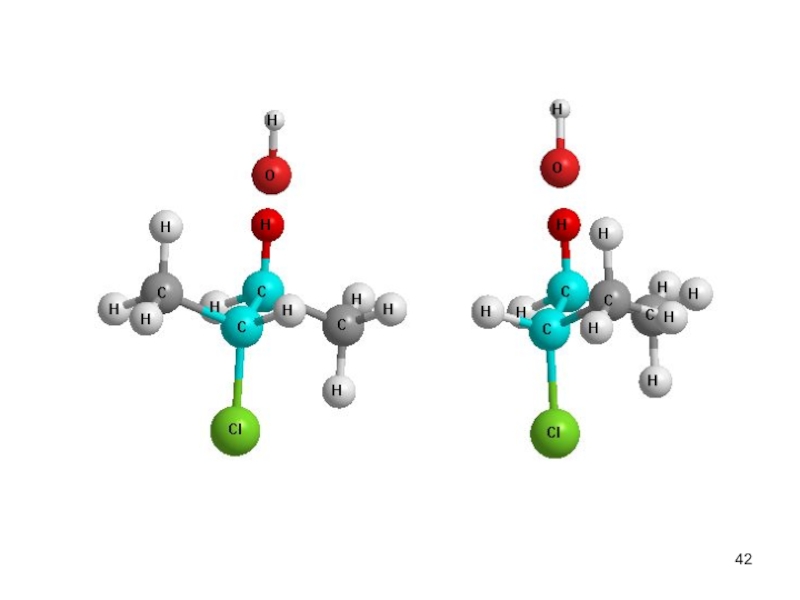
- 47. Реакционная способность Мономолекулярное отщепление Е1
- 48. Уравнение скорости реакции. v(E1) = k[R-Br]
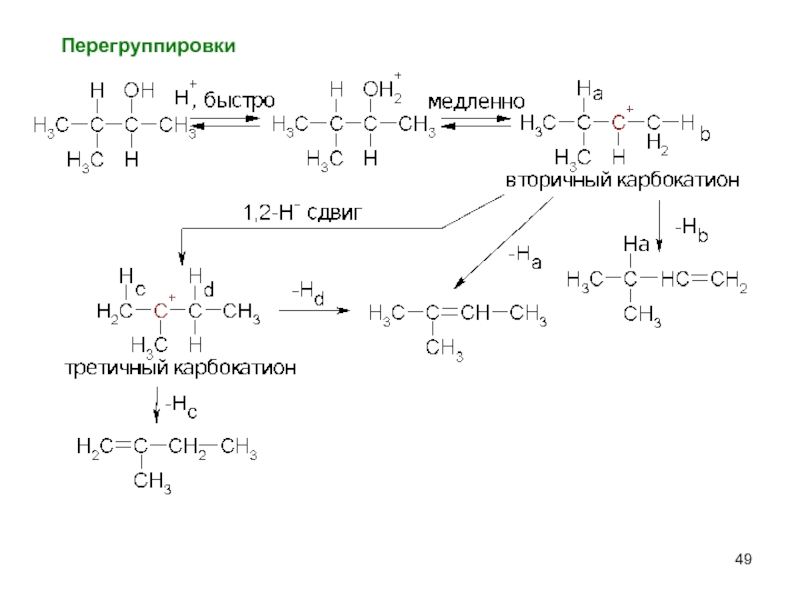
- 49. Перегруппировки
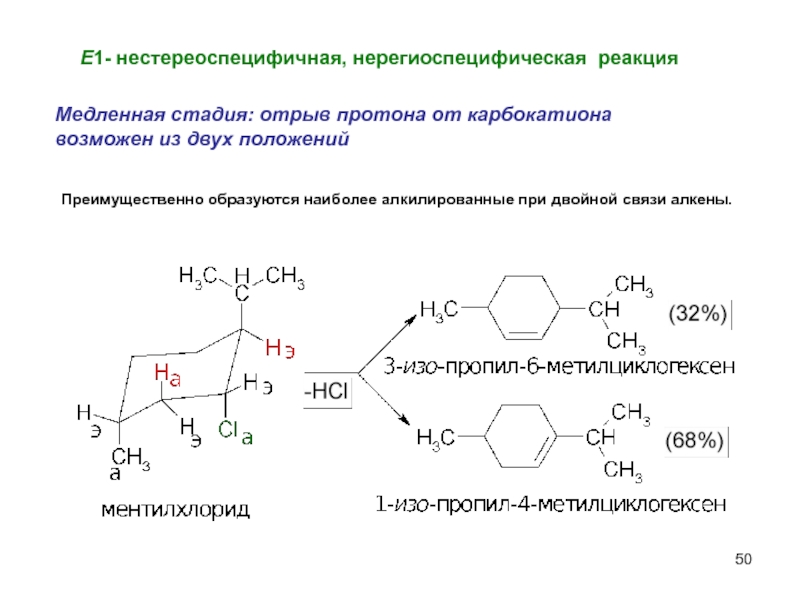
- 50. Е1- нестереоспецифичная, нерегиоспецифическая реакция Медленная стадия: отрыв
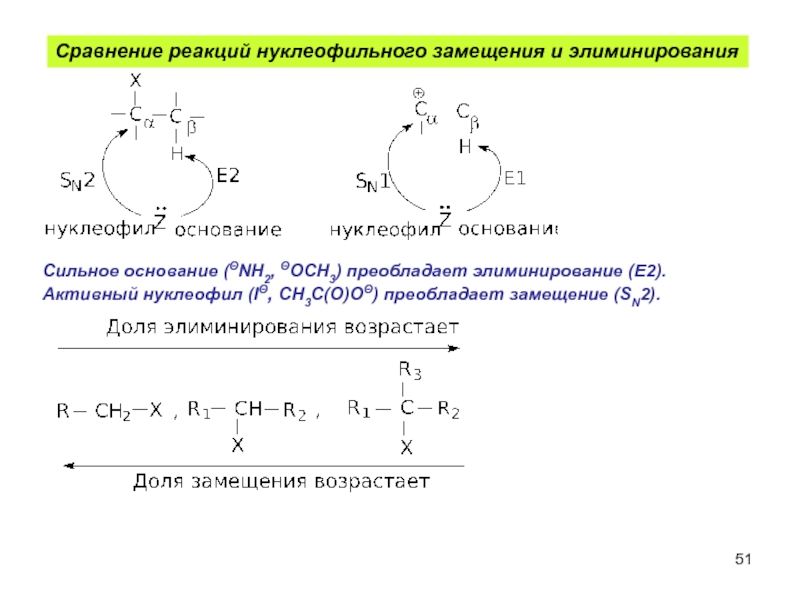
- 51. Сравнение реакций нуклеофильного замещения и элиминирования Сильное
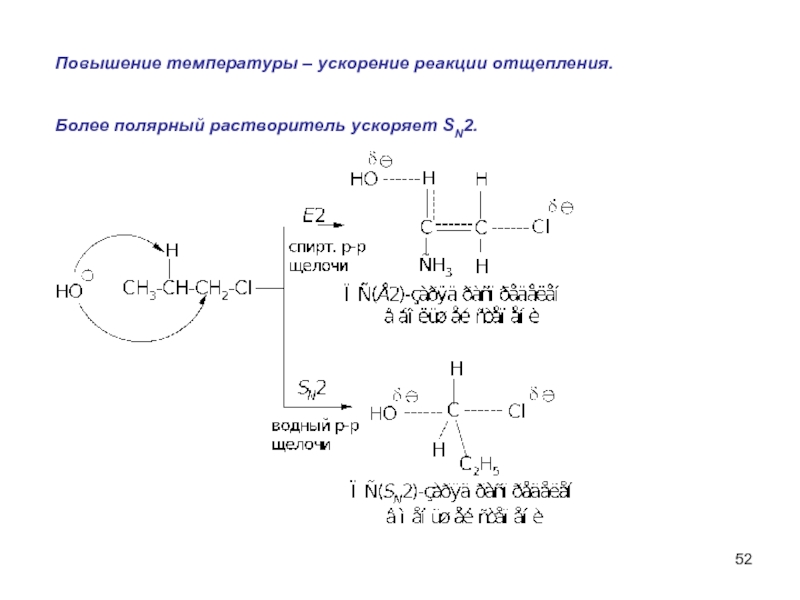
- 52. Повышение температуры – ускорение реакции отщепления. Более полярный растворитель ускоряет SN2.
- 53. Замещение при Сβ ускоряет реакцию элиминирования, т.к. образуется более Устойчивый (более алкилированный) алкен.
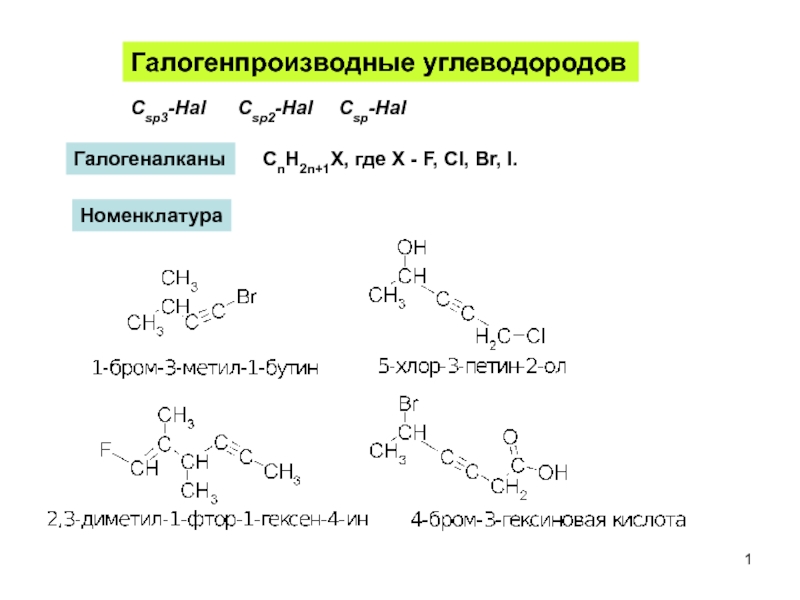
Слайд 1Галогенпроизводные углеводородов
Сsp3-Hal
Сsp2-Hal
Сsp-Hal
СnH2n+1Х, где X - F, Cl, Br, I.
Галогеналканы
Номенклатура
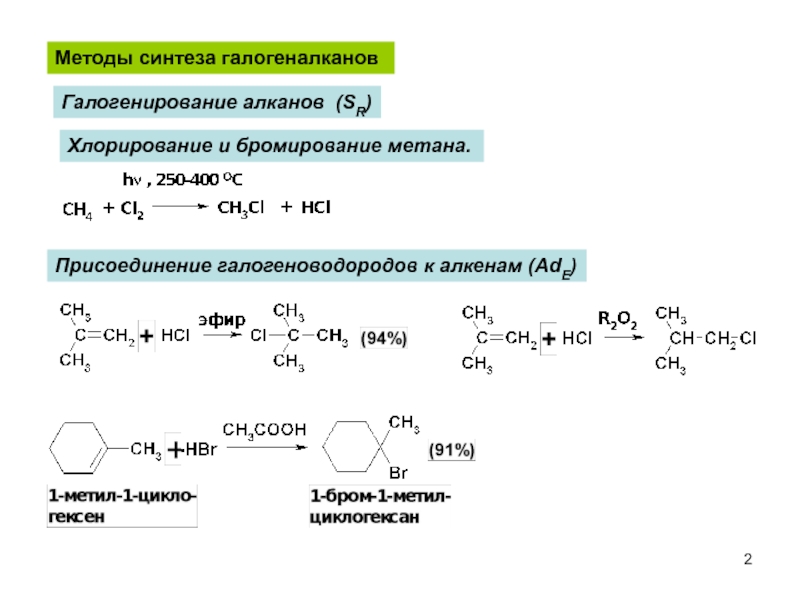
Слайд 2Хлорирование и бромирование метана.
Методы синтеза галогеналканов
Галогенирование алканов (SR)
Присоединение галогеноводородов
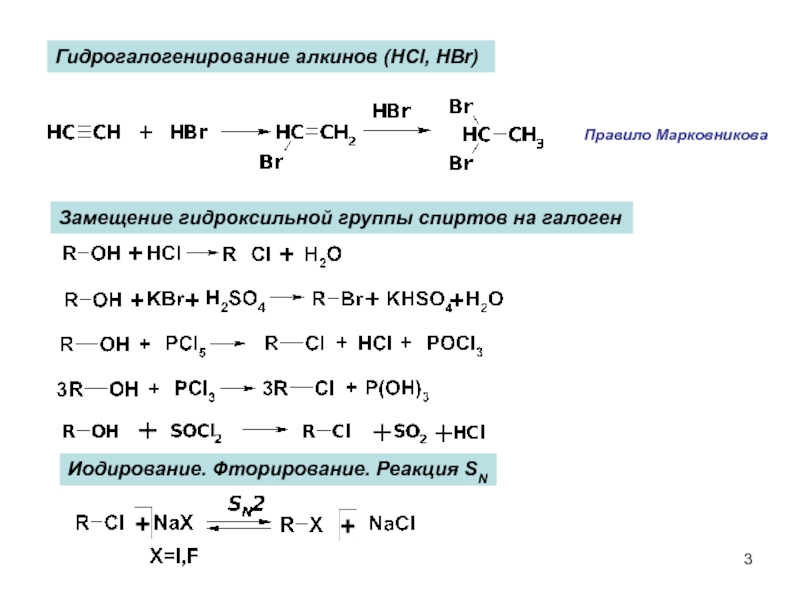
Слайд 3Замещение гидроксильной группы спиртов на галоген
Иодирование. Фторирование. Реакция SN
Гидрогалогенирование алкинов (HCl,
Правило Марковникова
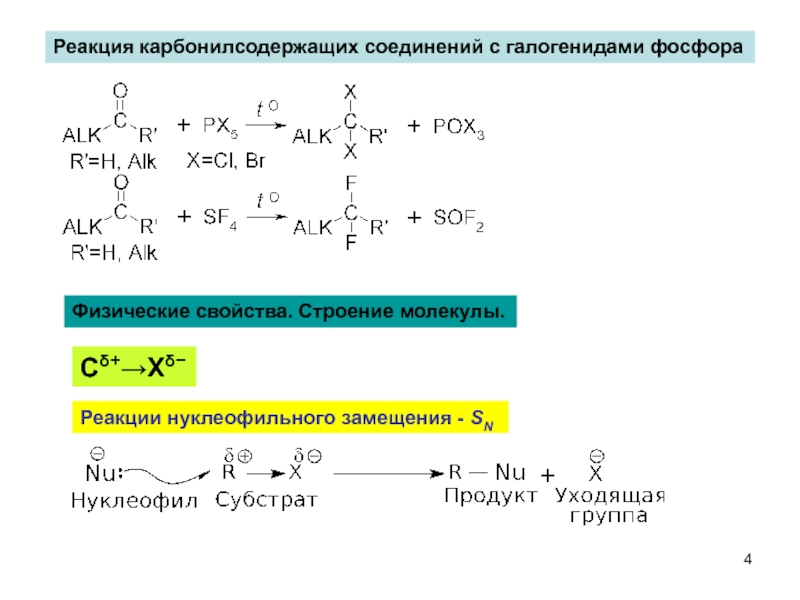
Слайд 4Реакция карбонилсодержащих соединений с галогенидами фосфора
Физические свойства. Строение молекулы.
Сδ+→Хδ−
Реакции нуклеофильного
Слайд 5Нуклеофил - частица, имеющая пару электронов, которую она
может отдать для
целый или частичный положительный заряд.
Реакции элиминирования Е
Нуклеофилы-анионы
Нуклеофилы-нейтральные молекулы
Слайд 9Бимолекулярное нуклеофильное замещение (SN2)
Скорость реакции.
v = k [R-Hal]·[Nu]
Концентрация
Растворитель.
а) достаточно хорошая растворимость реагентов,
б) лучшая сольватация переходного состояния по сравнению с
исходными соединениями,
в) предотвращение побочных реакций.
Термин «бимолекулярное замещение» означает, что в стадии,
определяющей скорость реакции, участвуют две частицы.
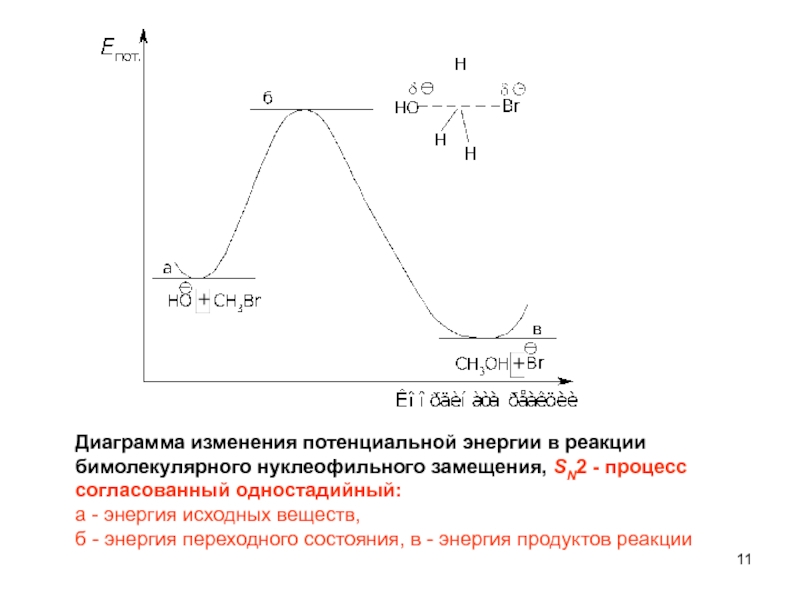
Слайд 11Диаграмма изменения потенциальной энергии в реакции
бимолекулярного нуклеофильного замещения, SN2 -
согласованный одностадийный:
а - энергия исходных веществ,
б - энергия переходного состояния, в - энергия продуктов реакции
Слайд 12
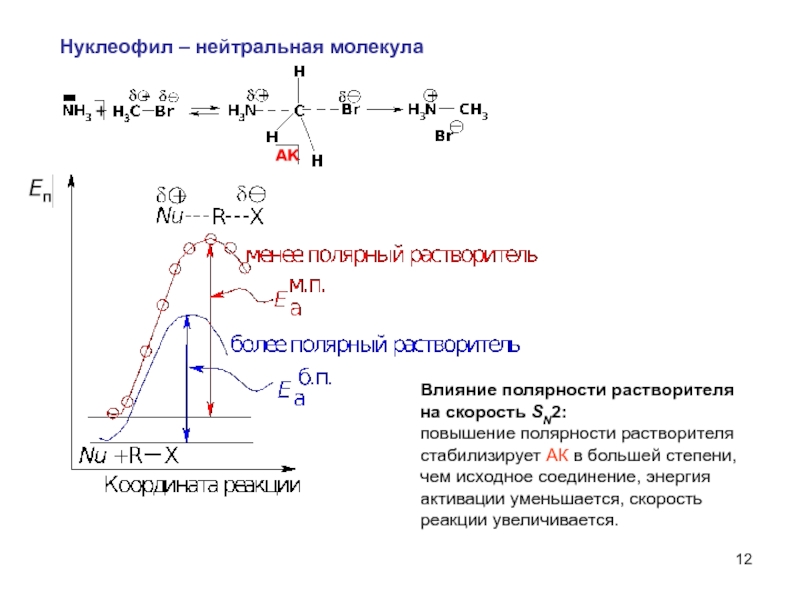
Нуклеофил – нейтральная молекула
Влияние полярности растворителя
на скорость SN2:
повышение полярности растворителя
чем исходное соединение, энергия
активации уменьшается, скорость
реакции увеличивается.
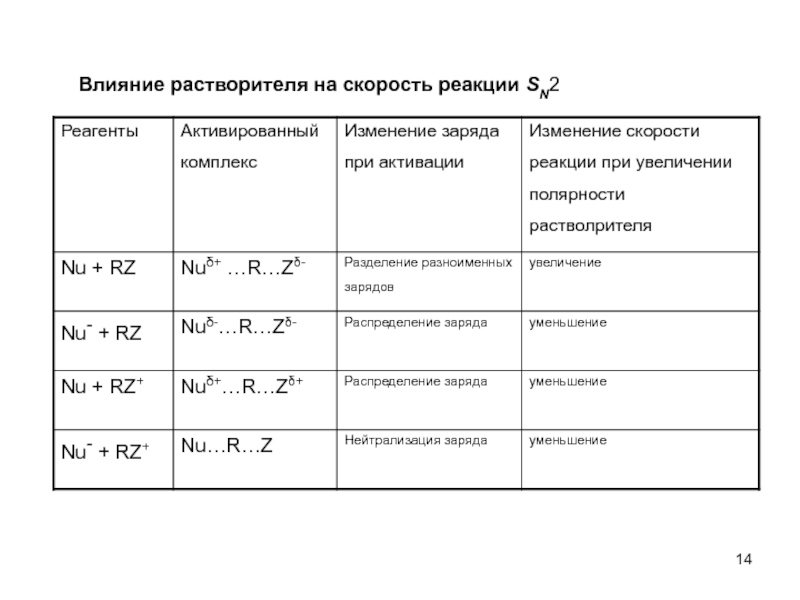
Слайд 13Нуклеофил - анион
Влияние полярности растворителя на скорость SN2:
повышение полярности растворителя стабилизирует
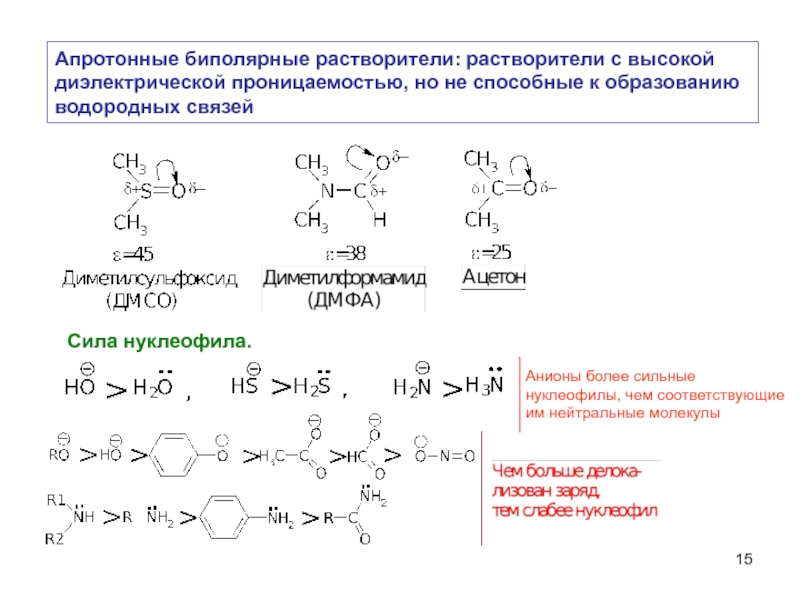
Слайд 15Апротонные биполярные растворители: растворители с высокой
диэлектрической проницаемостью, но не способные
водородных связей
Сила нуклеофила.
Анионы более сильные
нуклеофилы, чем соответствующие
им нейтральные молекулы
Слайд 16В апротонных растворителях (ДМФА, ДМСО) реакционная способность нуклеофилов
с атомами, находящимися
чем больше электроотрицательность атакующего атома, тем более реакционноспособен нуклеофил.
Однако в протонных растворителях этот ряд инвертируется: нуклеофильность аниона
тем выше, чем больше размер иона.
Уходящие группы (нуклеофуги).
Сильные основания являются обычно «плохими» уходящими группами, слабые основания –
«хорошими» уходящими группами.
Наилучшими уходящими группами являются анионы - сопряженные основания сильных кислот, так как они являются очень слабыми основаниями (отрицательный заряд распределен).
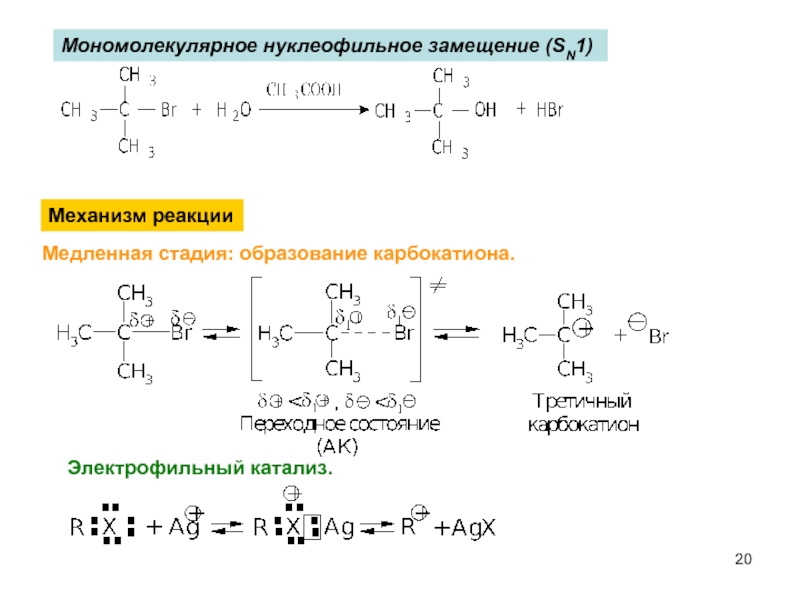
Слайд 20Мономолекулярное нуклеофильное замещение (SN1)
Механизм реакции
Медленная стадия: образование карбокатиона.
Электрофильный катализ.
Слайд 21Быстрая стадия: атака нуклеофила.
График изменения потенциальной энергии в ходе мономолекулярного нуклеофильного
SN1-двухстадийный процесс
Слайд 22Перегруппировка – признак механизма SN1.
Механизм перегруппировки.
Скорость реакции.
v= k[R-Hal]
Концентрация
Слайд 23Растворитель.
Влияние полярности растворителя на скорость реакции мономолекулярного нуклеофильного замещения
ПC более
и δ΄⊕>δ⊕.
Более полярный растворитель
сильнее сольватирует ПС, чем ИС.
Слайд 27Нуклеофильность и основность
Нуклеофильность
Кинетически контролируемая реакция
электронной пары донора с электрофильным
атомом
ковалентной связи C-Nu
Основность
Равновесная (термодинамически контролируемая)
реакция электронной пары донора с протоном,
с образованием новой связи H-X
Слайд 29Амбидентные ионы
На атомах с большей
электроотрицательностью сосредоточена
большая электронная плотность.
Атомы
электроотрицательностью обладают
большей нуклеофильной силой,
т.е. способностью предоставлять
свою пару электронов для образования
новой ковалентной связи.
В соответствии с правилом Корнблюма
амбидентные ионы в реакциях
SN2-типа атакуют атомом с
наибольшей нуклеофильностью,
а в реакциях SN1 – атомом с
наибольшей электронной плотностью.
Амбидентные нуклеофилы имееют не менее двух атомов, которые могут отдавать пару электронов субстрату для образования ковалентной связи.
Слайд 32Участие соседних групп. Анхимерное содействие
N,N-диэтил-2-хлор-1-бутанамин
2-диэтиламино-1-бутанол
Слайд 33Реакции отщепления (элиминирование, Е)
-Элиминирование
-Элиминирование
γ-Элимириование – циклизация.
Слайд 35Механизм реакции Е2
Механизм реакции бимолекулярного элиминирования:
а – антикопланарное расположение связей Сα—Br
состояние, в – конечные продукты
Е2-одностадийный синхронный процесс
Наблюдается значительный изотопный эффект
Слайд 37Эффективность оснований в реакции Е2 убывает в ряду:
ӨNH2 > ӨOC2H5 >
В галогеналкане R-X cкорость отщепления убывает в ряду: I ˉ > Br ˉ > Cl ˉ > F ˉ
Энергетическая диаграмма реакции Е2
Слайд 40Скорость реакции
V(E2) = k΄ [R-Br] [OНӨ]
V (SN2)= k[R-Br] [OНӨ]
Правило
Основным продуктом реакции отщепления от галогеналканов с
двумя не эквивалентными Сβ -атомами является наиболее
устойчивый (наиболее алкилированный) алкен.
Слайд 44Реакции элимирования по Гофману
Состав продуктов Е2-реакции 2-замещенных пентанов (под действием C2H5OӨK⊕)
CH2CHCH2CH2CH3
CH3CHCHCH2CH3
Слайд 47Реакционная способность
Мономолекулярное отщепление Е1
Механизм.
Этот ряд объясняется возрастающим числом
алкильных групп при двойной связи в
образующемся алкене.
Слайд 50Е1- нестереоспецифичная, нерегиоспецифическая реакция
Медленная стадия: отрыв протона от карбокатиона
возможен из
Преимущественно образуются наиболее алкилированные при двойной связи алкены.
Слайд 51Сравнение реакций нуклеофильного замещения и элиминирования
Сильное основание (ΘNH2, ΘOCH3) преобладает элиминирование
Активный нуклеофил (IΘ, CH3C(O)OΘ) преобладает замещение (SN2).

![Бимолекулярное нуклеофильное замещение (SN2) Скорость реакции. v = k [R-Hal]·[Nu] Концентрация нуклеофильного реагента, сила нуклеофилаРастворитель.](/img/tmb/2/197844/9c26f62574e939aec3c591fb4b720562-800x.jpg)


![Перегруппировка – признак механизма SN1. Механизм перегруппировки.Скорость реакции. v= k[R-Hal] Концентрация нуклеофильного реагента.](/img/tmb/2/197844/e7d520faee728b6e26e79d3a37f8373a-800x.jpg)




![Скорость реакции V(E2) = k΄ [R-Br] [OНӨ] V (SN2)= k[R-Br] [OНӨ]Правило Зайцева Основным продуктом реакции](/img/tmb/2/197844/e1a18c95d52109b4bf83e9f8e246fec0-800x.jpg)

![Уравнение скорости реакции. v(E1) = k[R-Br]Реакционная способность I > Br > Cl > F](/img/tmb/2/197844/3dd97d34d968e3533d6d4a481e126ef5-800x.jpg)