- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фосфор, его физические и химические свойства презентация
Содержание
- 1. Фосфор, его физические и химические свойства
- 2. Строение атома Химические свойства Круговорот
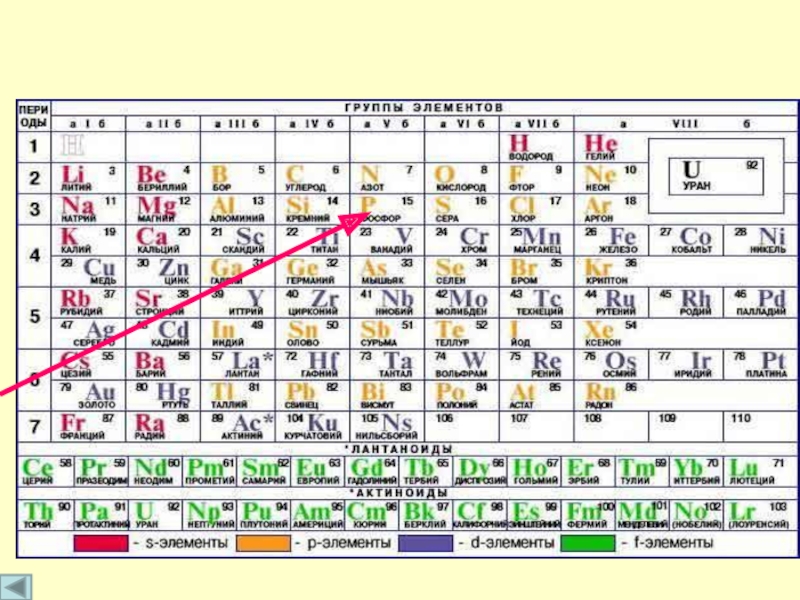
- 3. Положение фосфора в ПСХЭ
- 4. В 1669 Хеннинг Бранд при нагревании смеси
- 5. Р заряд ядра= +15 31P
- 6. Устойчивая степень окисления в соединениях +V. Шкала степеней окисления фосфора:
- 7. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ В уравнениях реакций аллотропные
- 8. Молекулы P4 имеют форму
- 9. Существует несколько форм красного
- 10. Черный фосфор имеет слоистую атомную
- 11. Фосфор в организме человека 1500
- 12. Из апатитов и фосфоритов в электрической печи:
- 13. Химические свойства фосфора Р0 Р-3 Р+5
- 14. При взаимодействии со щелочами образуется фосфин PH3:
- 16. Применение фосфора Фосфор Производство
- 17. Фосфин РН3. Бинарное соединение, степень окисления
- 18. Уравнения важнейших реакций:
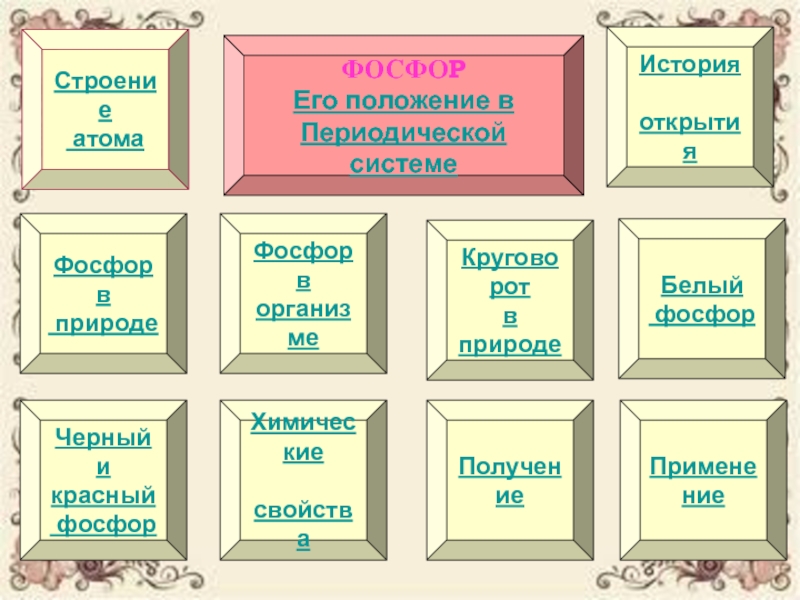
Слайд 2Строение
атома
Химические
свойства
Круговорот
в природе
Получение
Фосфор в
природе
Фосфор в
организме
Белый
фосфор
История
открытия
Черный
и
фосфор
Применение
ФОСФОР
Его положение в
Периодической системе
Слайд 4В 1669 Хеннинг Бранд при нагревании смеси белого песка и выпаренной
Phosphorus- Светоносный.
Лавуазье определил фосфор, как новый химический элемент!
История открытия
Слайд 5Р заряд ядра= +15 31P
Электронная конфигурация:
Р
Р*
(стационарное)
(возбужденное)
1s2 2s2 2p6 3s1
1s2 2s2 2р6 3s2 3p3
Строение атома
Слайд 7
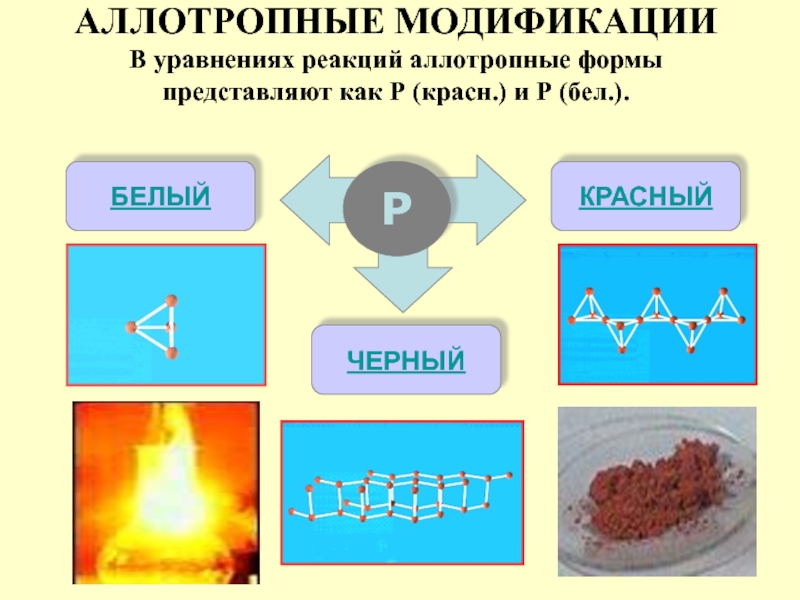
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
В уравнениях реакций аллотропные формы представляют как Р (красн.) и
Р
БЕЛЫЙ
КРАСНЫЙ
ЧЕРНЫЙ
Слайд 8
Молекулы P4 имеют форму тетраэдра. Это легкоплавкое t(пл)=44,1оС, t(кип)=275оС,
Применяется в производстве Н3РO4 и красного фосфора, как реагент в органических синтезах, раскислитель сплавов, зажигательное средство. Горящий фосфор следует гасить песком (но не водой!). Чрезвычайно ядовит.
БЕЛЫЙ ФОСФОР P4
Слайд 9
Существует несколько форм красного фосфора Их структуры окончательно не
Применяется как реагент (более безопасный, чем белый фосфор) в неорганическом синтезе, наполнитель ламп накаливания, компонент намазки коробка при изготовлении спичек.
КРАСНЫЙ ФОСФОР
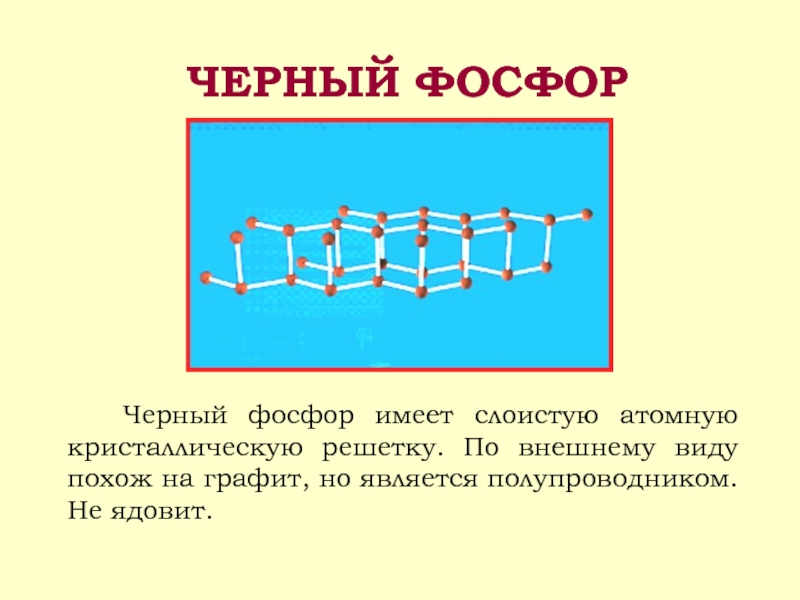
Слайд 10 Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему
ЧЕРНЫЙ ФОСФОР
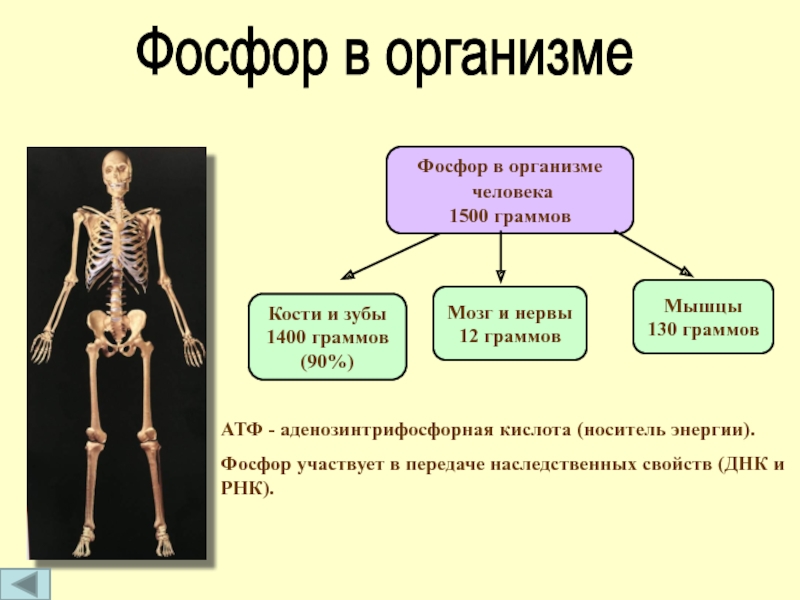
Слайд 11Фосфор в организме
человека
1500 граммов
Кости и зубы
1400 граммов
(90%)
Мышцы
130 граммов
Мозг и
12 граммов
АТФ - аденозинтрифосфорная кислота (носитель энергии).
Фосфор участвует в передаче наследственных свойств (ДНК и РНК).
Фосфор в организме
Слайд 12Из апатитов и фосфоритов в электрической печи: Са3(РО4)2+5С+3SiO2 3CaSiO3+2P+5CO
P+5 +5e
C0 -2e C+2 5
назад
Получение фосфора
Слайд 13Химические свойства фосфора
Р0
Р-3
Р+5
окислитель
восстановитель
I. Фосфор – окислитель:
При реакции с активными металлами:
Фосфиды разлагаются водой:
С Сa3P2 + 6H2O = O = 3O = 3Ca(OH)2 + + 2 + 2PH3↑ фосфин
С водородом фосфор не взаимодействует.
II. Фосфор – восстановитель:
1. При реакции с другими неметаллами:
4 4P + 5O2 = 2P2O5 + Q – белый фосфор горит под водой
Красный фосфор сгорает менее энергично
2P + 5Cl2 = 2PCl5 + Q
2. В реакции со сложными веществами –окислителями:
3 3P + 5HNO3(конц) + 2+ 2H2O = 3H3PO4 + 5NO
6P + 5KClO3 = 3P2O5 + 5KCl
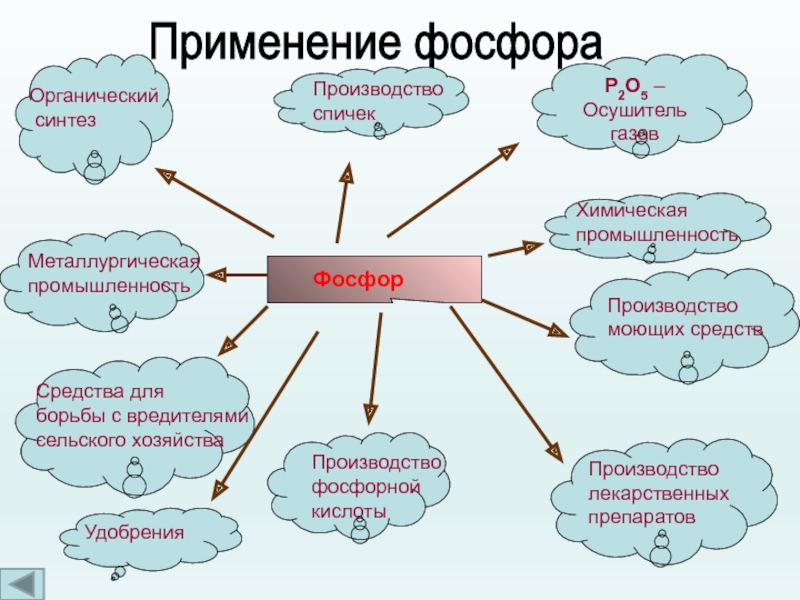
Слайд 16Применение фосфора
Фосфор
Производство
спичек
Р2О5 –
Осушитель газов
Органический
синтез
Химическая
промышленность
Металлургическая
промышленность
Средства для
борьбы с вредителями
сельского хозяйства
Удобрения
Производство
моющих средств
Производство
фосфорной
кислоты
Производство
лекарственных
препаратов