- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Феноли (бензенол) презентация
Содержание
- 1. Феноли (бензенол)
- 2. Фенол (бензенол)
- 3. ОДНОАТОМНІ ФЕНОЛИ СПОСОБИ ОДЕРЖАННЯ
- 4. 2. З ізопропілбензену (кумолу) - Р.Ю.Удріс,
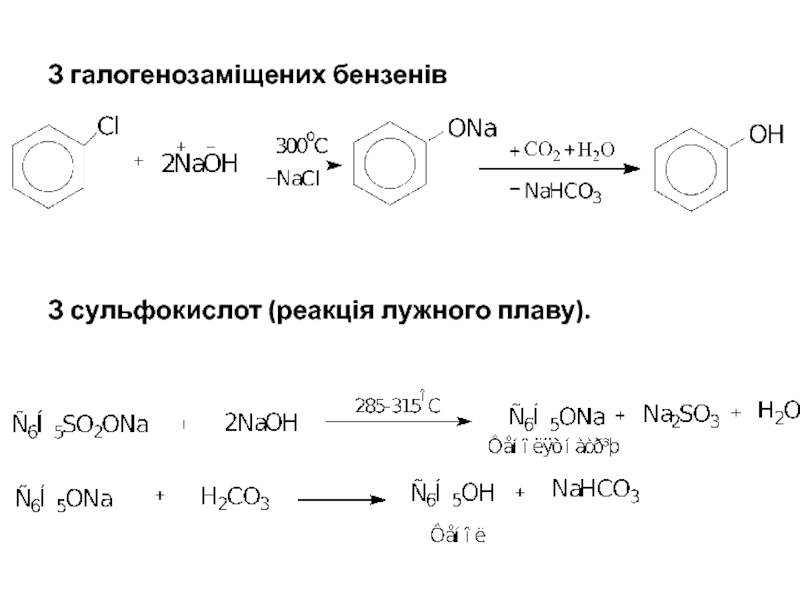
- 5. З галогенозаміщених бензенів З сульфокислот (реакція лужного плаву).
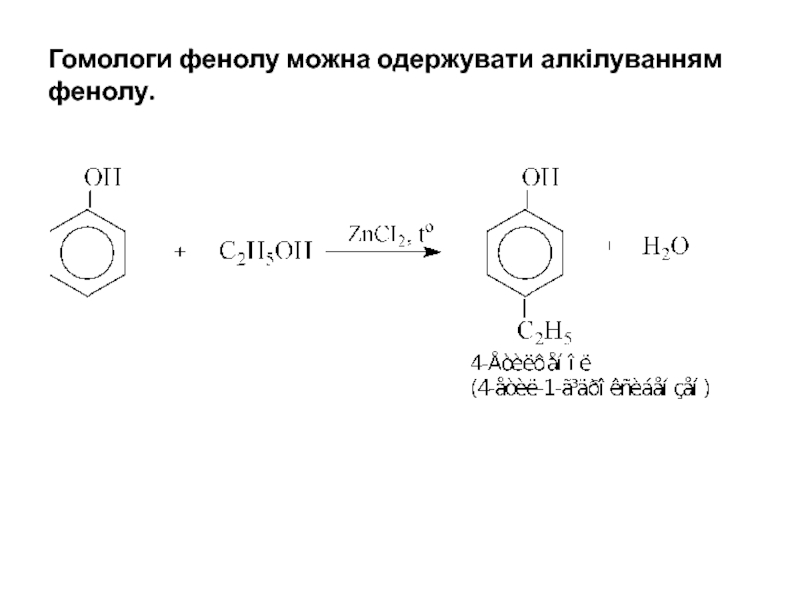
- 6. Гомологи фенолу можна одержувати алкілуванням фенолу.
- 7. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Одноатомні феноли
- 8. У фенолят-йоні негативний заряд
- 9. При взаємодії з лугами феноли утворюють відповідні
- 10. 2. Реакції електрофільного заміщення за участю бензенового
- 11. 2.2. Нітрування Утворення пікринової кислоти відбувається за
- 12. 2.3. Сульфування При сульфуванні співвідношення о- і
- 13. 3. Реакції за участю гідроксильної групи Гідроксильна
- 14. 3.2. Ацилювання Карбонові кислоти ацилюють фенол
- 15. 3.3. Одержання фенілових етерів поліетиленгліколю Феноли взаємодіють
- 16. 4. Реакції нуклеофільного заміщення Нуклеофільне заміщення груп-ОН
- 17. 5. Реакції поліконденсації з альдегідами (отримання феноло-формаль-дегідних
- 18. Новолачні смоли відносяться до термопластів, вони топляться
- 19. 6. Каталітичне гідрування Каталітичним гідруванням фенолу одержують
- 20. ДВОАТОМНІ ФЕНОЛИ
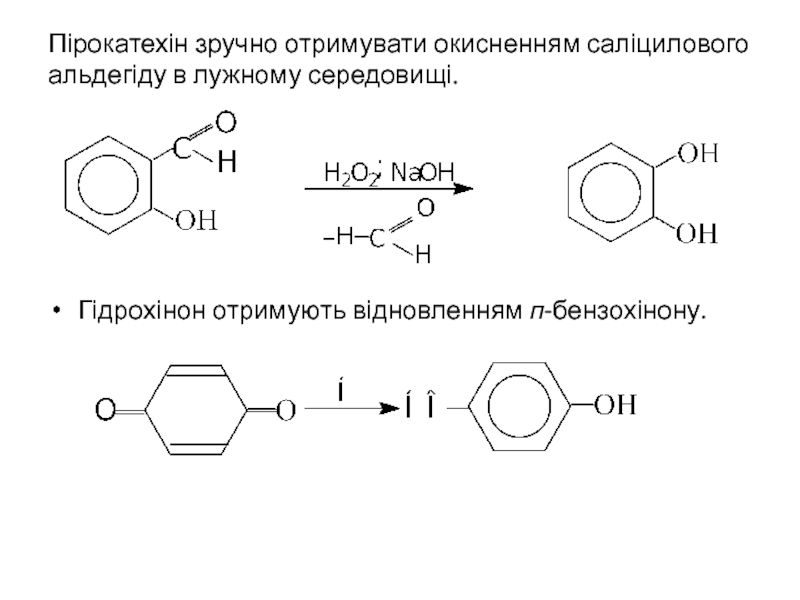
- 21. Пірокатехін зручно отримувати окисненням саліцилового альдегіду в
- 22. Резорцин одержують методом лужного плаву м-бензендисульфокислоти:
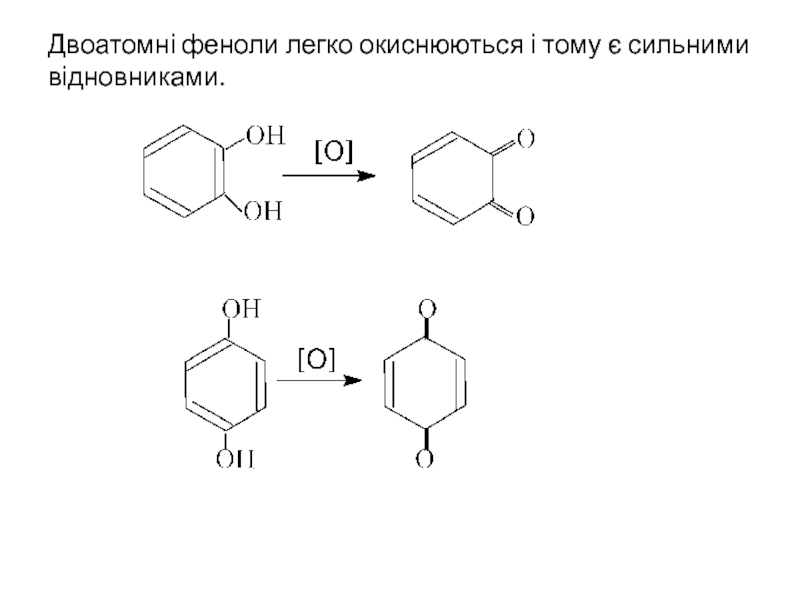
- 23. Двоатомні феноли легко окиснюються і тому є сильними відновниками.
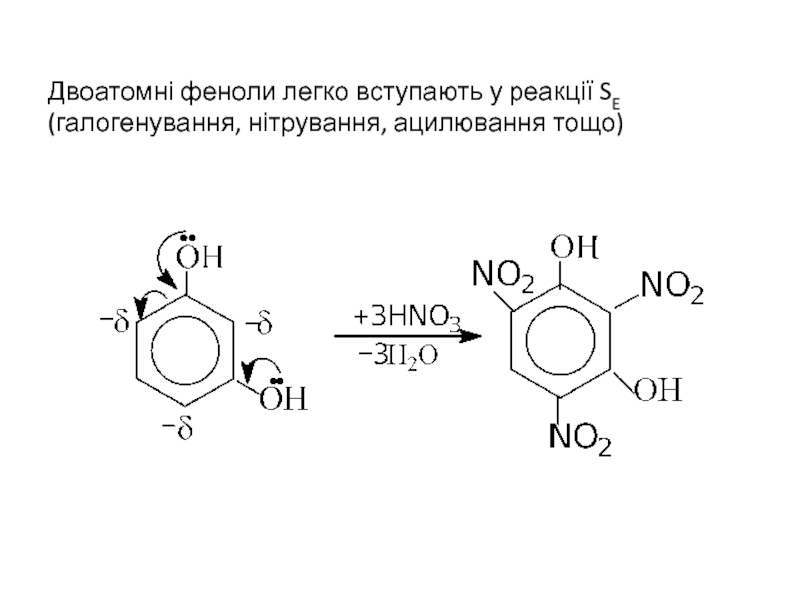
- 24. Двоатомні феноли легко вступають у реакції SE (галогенування, нітрування, ацилювання тощо)
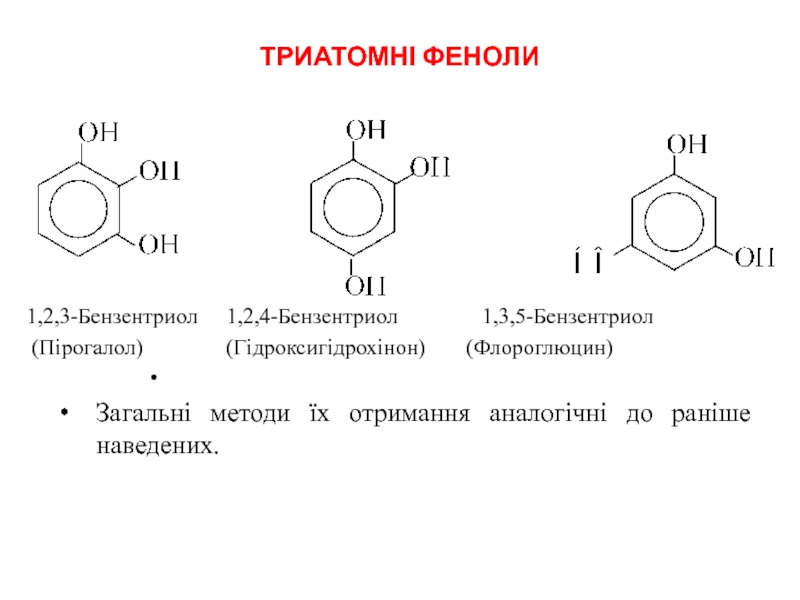
- 25. ТРИАТОМНІ ФЕНОЛИ 1,2,3-Бензентриол
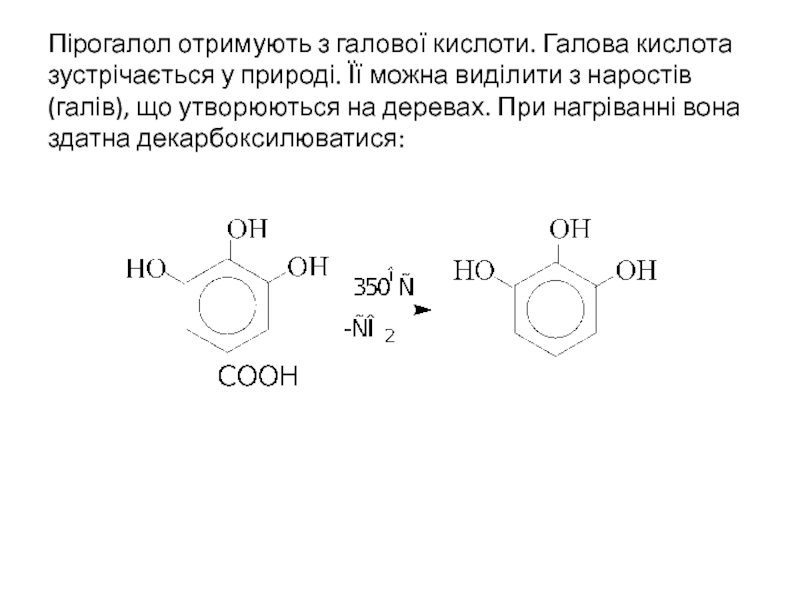
- 26. Пірогалол отримують з галової кислоти. Галова кислота
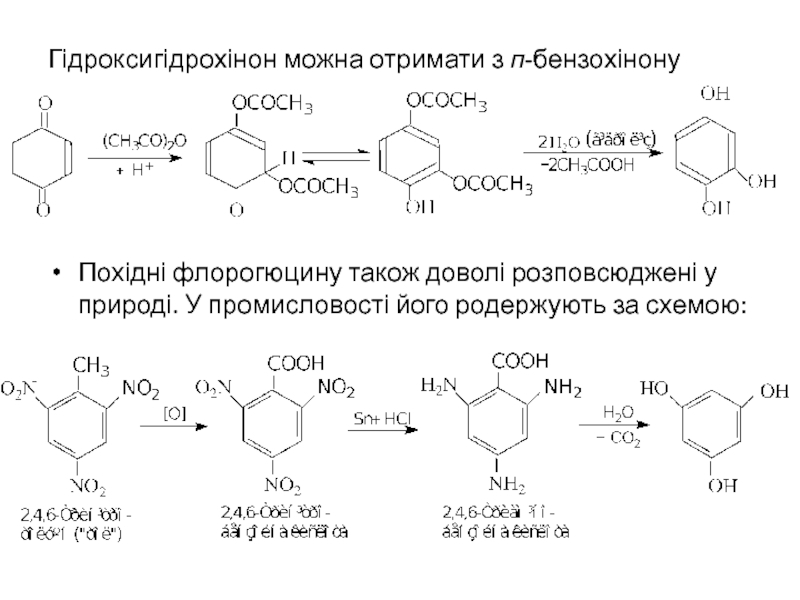
- 27. Гідроксигідрохінон можна отримати з п-бензохінону
- 28. Флороглюцин здатний до таутомерії за схемою:
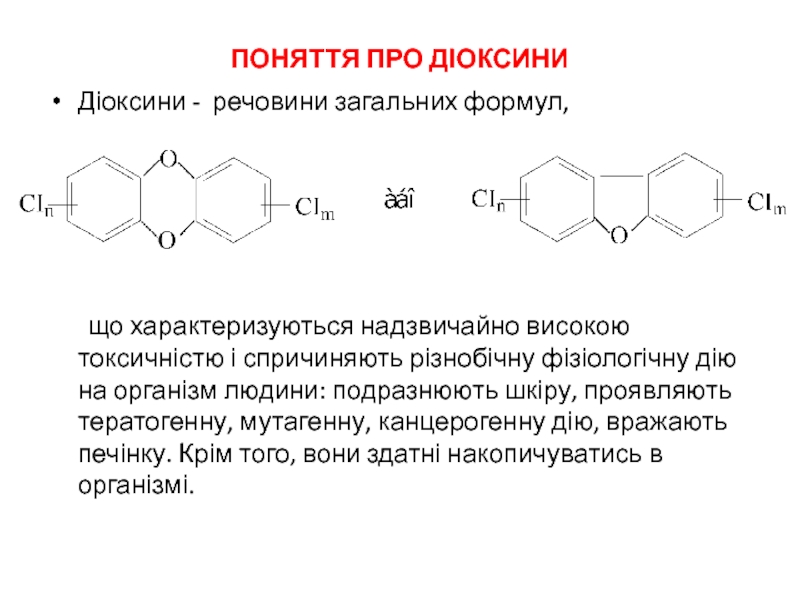
- 29. ПОНЯТТЯ ПРО ДІОКСИНИ Діоксини - речовини
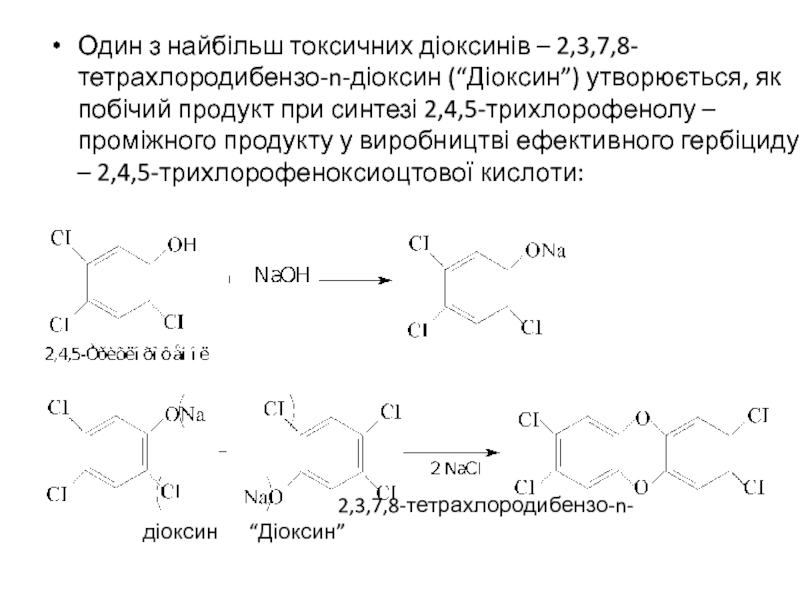
- 30. Один з найбільш токсичних діоксинів –
- 31. Джерелами забруднення навколишнього середовища діоксинами являються
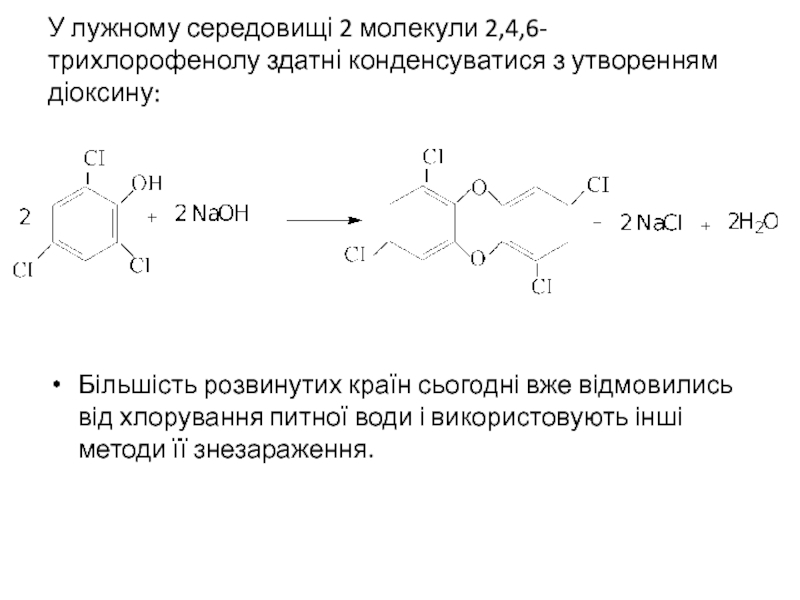
- 32. У лужному середовищі 2 молекули 2,4,6-трихлорофенолу здатні
Слайд 1ФЕНОЛИ
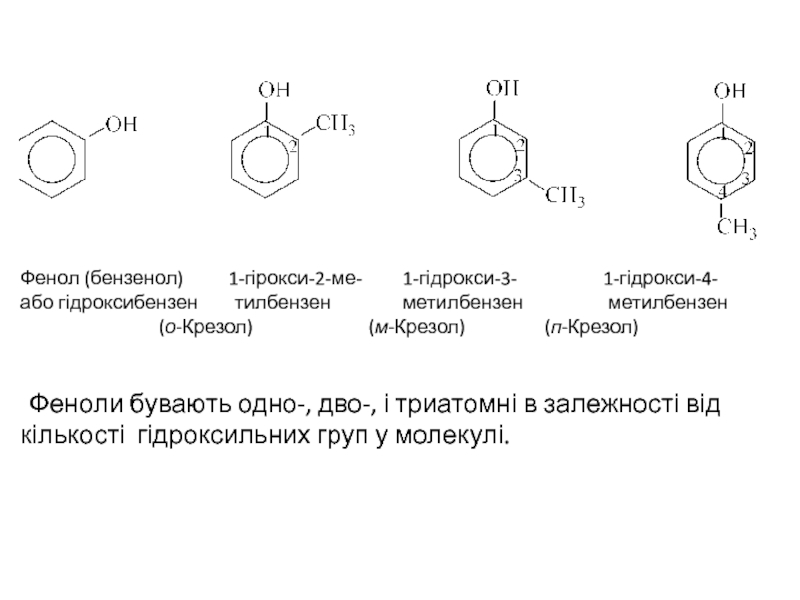
Феноли (ареноли або гідроксиарени) - сполуки, що містять в молекулі одну
Назви фенолів утворюються з назв відповідних аренів додаванням закінчення -ол. Нумерацію атомів вуглецю в ядрі починають з вуглецевого атома, при якому знаходиться ОН-група. Багато фенолів зберегли тривіальні назви. Інколи наявність гідроксильної групи позначають префіксом гідрокси.
Слайд 2 Фенол (бензенол) 1-гірокси-2-ме- 1-гідрокси-3-
Слайд 3ОДНОАТОМНІ ФЕНОЛИ
СПОСОБИ ОДЕРЖАННЯ
1. Виділення з продуктів коксування кам'яного вугілля.
При коксуванні кам'яного
Фракція “середній олій” з температурою кипіння 170-230оС містить, головним чином фенол, а фракція “важкий олій” (230-270оС ) – крезоли та ксиленоли.
Слайд 4
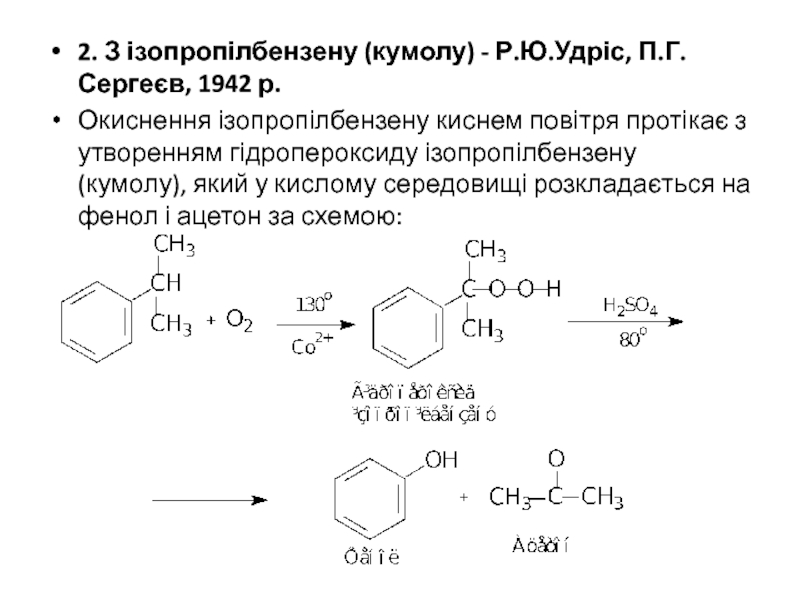
2. З ізопропілбензену (кумолу) - Р.Ю.Удріс, П.Г.Сергеєв, 1942 р.
Окиснення ізопропілбензену киснем
Слайд 7ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Одноатомні феноли - кристалічні речовини. Вони помірно розчинні
1. Кислотність фенолів
Спряження неподіленої пари електронів атома кисню з π-електронною сис-темою бензенового ядра (p-π-спряження) зсуває електронну густину атома кисню до бензенового ядра, що веде до поляризації зв'язку О-Н і сприяє протонізації водню гідро ксильної групи.
Це приводить до появи у фенолі кислотних властивостей. У водному розчині феноли здатні дисоціювати з утворенням протону і фенолят-йону.
Слайд 8
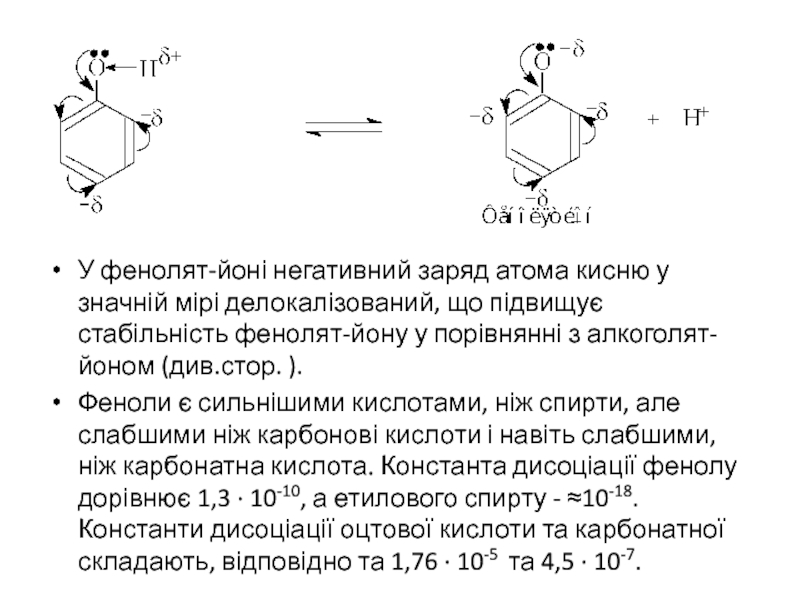
У фенолят-йоні негативний заряд атома кисню у значній мірі делокалізований, що
Феноли є сильнішими кислотами, ніж спирти, але слабшими ніж карбонові кислоти і навіть слабшими, ніж карбонатна кислота. Константа дисоціації фенолу дорівнює 1,3 · 10-10, а етилового спирту - ≈10-18. Константи дисоціації оцтової кислоти та карбонатної складають, відповідно та 1,76 · 10-5 та 4,5 · 10-7.
Слайд 9При взаємодії з лугами феноли утворюють відповідні феноляти
Але будь-яка кислота,
Разом з тим, їх кислотність залежить від природи замісника в ядрі. Електроно-акцепторні замісники (ІІ-го роду) збільшують, а електронодонорні зменшують кислот-ність фенолу. Наприклад, 2,4,6-тринітрофенол (пікринова кислота) за своєю силою наближається до мінеральних кислот (Кд = 4,2 10-1).
Слайд 102. Реакції електрофільного заміщення за участю бензенового ядра
За рахунок прояву сильного
2.1. Галогенування
2,4,6-Трибромофенол
Ця реакція протікає при кімнатній температурі і не вимагає каталізатора.
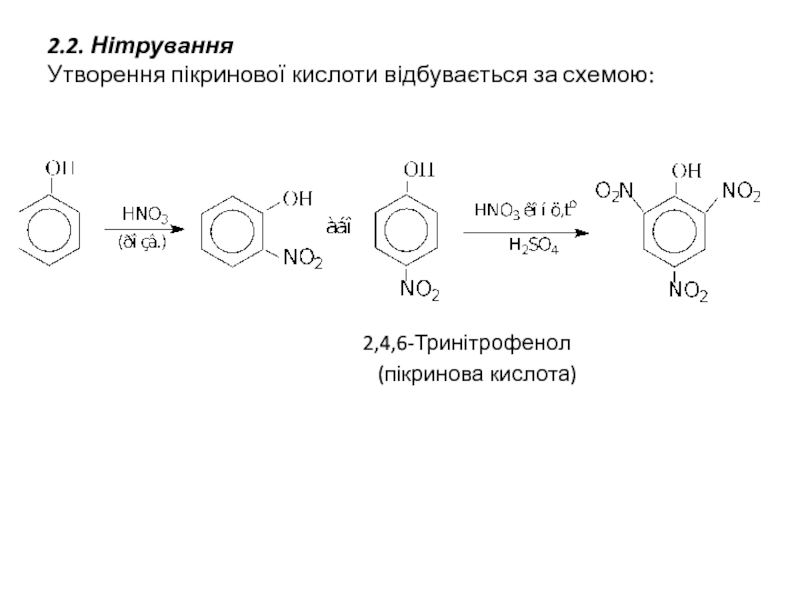
Слайд 112.2. Нітрування
Утворення пікринової кислоти відбувається за схемою:
2,4,6-Тринітрофенол
(пікринова кислота)
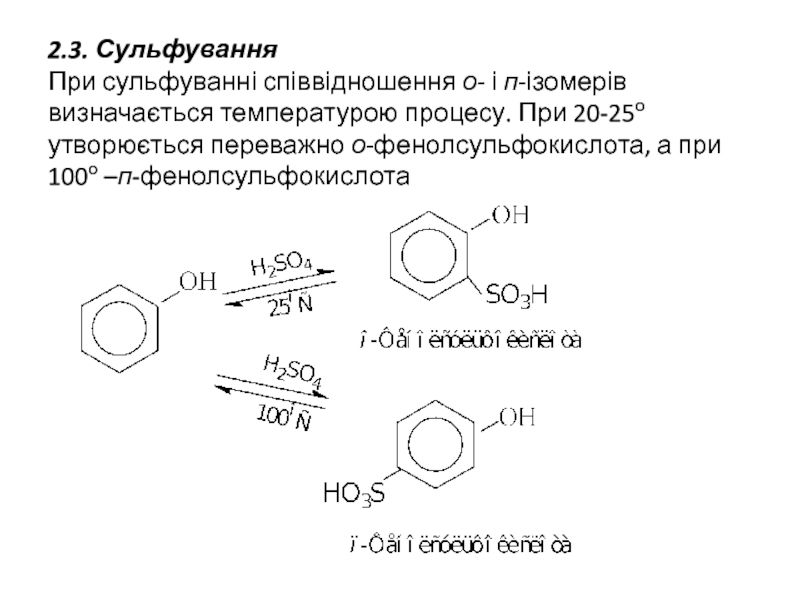
Слайд 122.3. Сульфування При сульфуванні співвідношення о- і п-ізомерів визначається температурою процесу. При
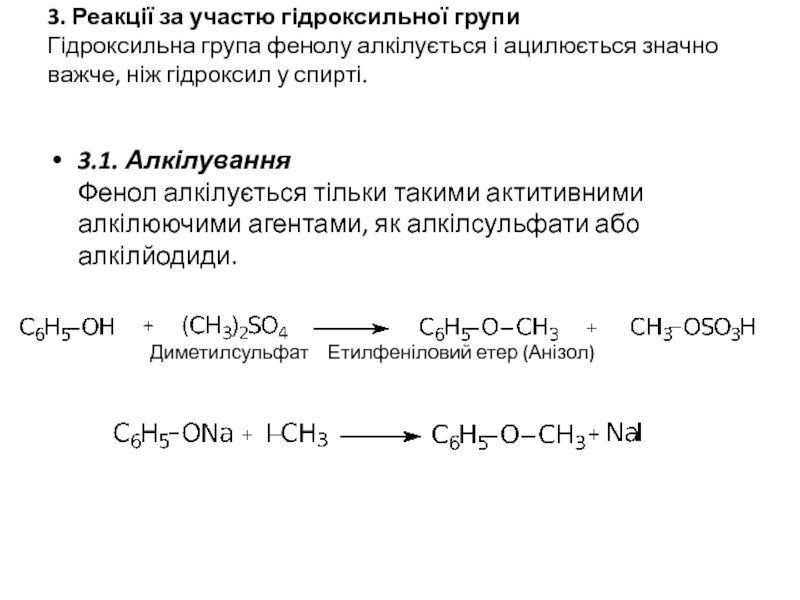
Слайд 133. Реакції за участю гідроксильної групи Гідроксильна група фенолу алкілується і ацилюється
3.1. Алкілування
Фенол алкілується тільки такими актитивними алкілюючими агентами, як алкілсульфати або алкілйодиди.
Диметилсульфат Етилфеніловий етер (Анізол)
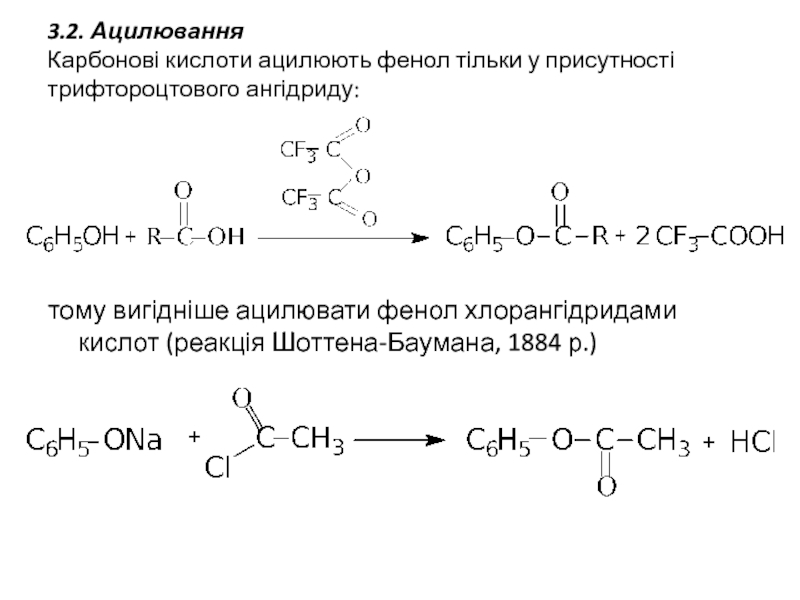
Слайд 143.2. Ацилювання
Карбонові кислоти ацилюють фенол тільки у присутності трифтороцтового ангідриду:
тому
Слайд 153.3. Одержання фенілових етерів поліетиленгліколю
Феноли взаємодіють з етиленоксидом за схемою:
При
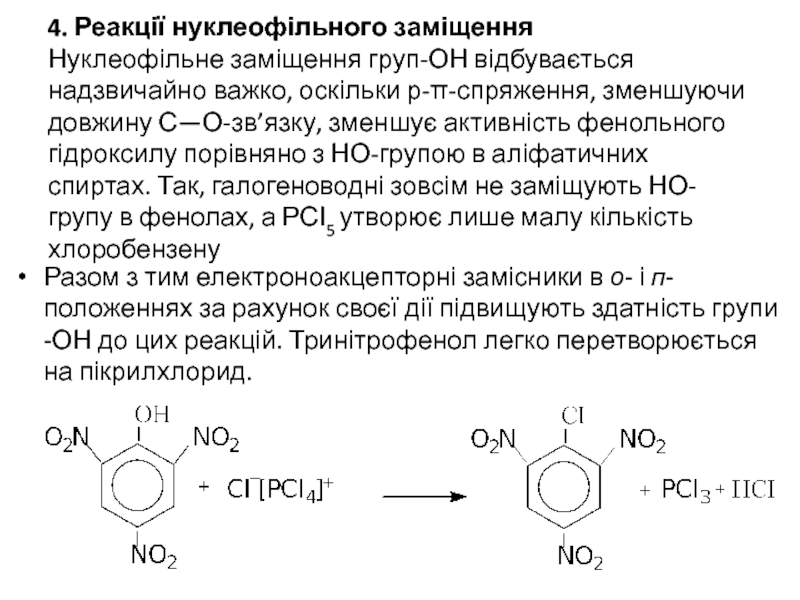
Слайд 164. Реакції нуклеофільного заміщення Нуклеофільне заміщення груп-ОН відбувається надзвичайно важко, оскільки р-π-спряження,
Разом з тим електроноакцепторні замісники в о- і п-положеннях за рахунок своєї дії підвищують здатність групи -ОН до цих реакцій. Тринітрофенол легко перетворюється на пікрилхлорид.
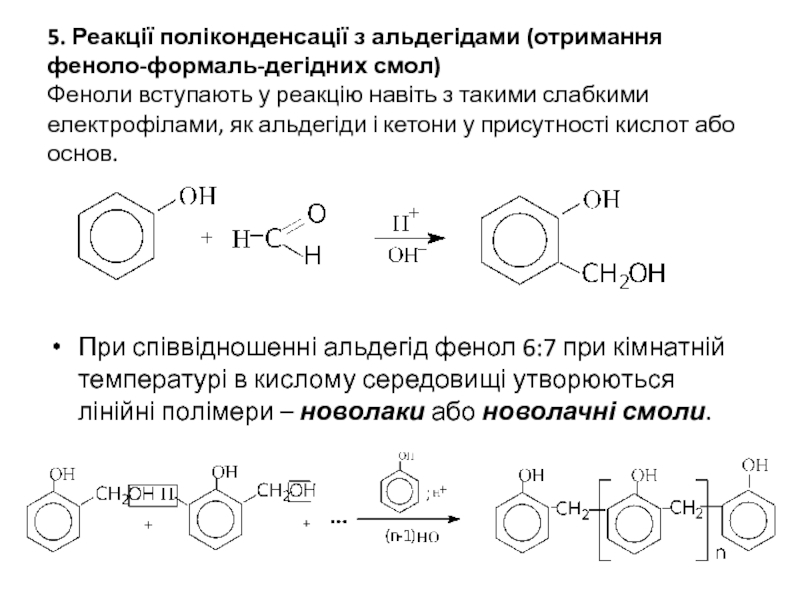
Слайд 175. Реакції поліконденсації з альдегідами (отримання феноло-формаль-дегідних смол) Феноли вступають у реакцію
При співвідношенні альдегід фенол 6:7 при кімнатній температурі в кислому середовищі утворюються лінійні полімери – новолаки або новолачні смоли.
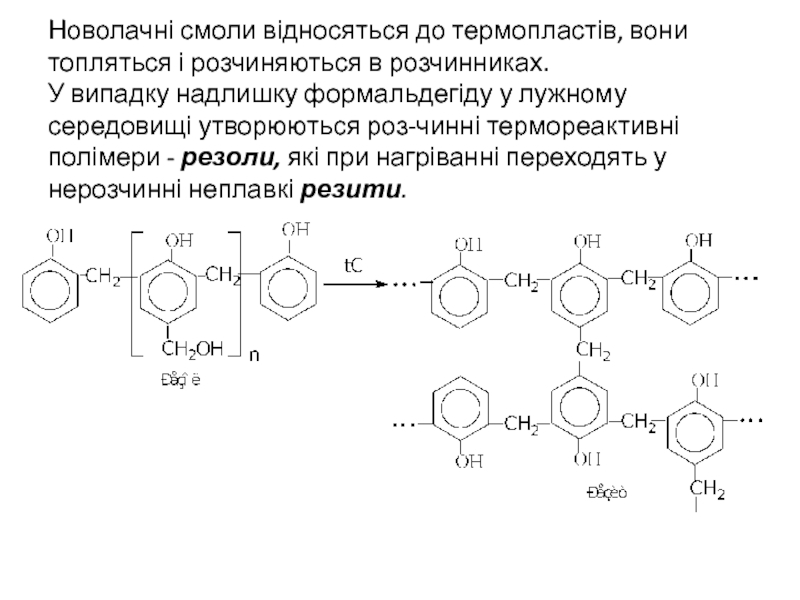
Слайд 18Новолачні смоли відносяться до термопластів, вони топляться і розчиняються в розчинниках. У
Слайд 196. Каталітичне гідрування Каталітичним гідруванням фенолу одержують циклогексанол. Він використо-вується для виробництва
7. Одержання “Діану” або “Біфенолу-А”
Ацетон 2,2-Ди(4-гідроксидифеніл)пропан
("Бісфенол А" або"Діан")
Слайд 20ДВОАТОМНІ ФЕНОЛИ
1,2-Дигідроксибензен 1,3-Дигідроксибензен 1,4-Дигідроксибензен
1,2-Бензендіол 1,3-Бензендіол
(Пірокатехін) (Резорцин) (Гідрохінон)
Їх отримують такими ж методами, як і одноатомні феноли, але існують і спеціальні методи одержання.
Слайд 21Пірокатехін зручно отримувати окисненням саліцилового альдегіду в лужному середовищі.
Гідрохінон отримують відновленням
Слайд 22Резорцин одержують методом лужного плаву м-бензендисульфокислоти:
За хімічними властивостями вони подібні до
Пірокатехін здатний утворювати феноляти не тільки з лужними, але й з важкими металами.
Слайд 25ТРИАТОМНІ ФЕНОЛИ
1,2,3-Бензентриол 1,2,4-Бензентриол 1,3,5-Бензентриол
(Пірогалол) (Гідроксигідрохінон) (Флороглюцин)
Загальні методи
Слайд 26Пірогалол отримують з галової кислоти. Галова кислота зустрічається у природі. Її
Слайд 27Гідроксигідрохінон можна отримати з п-бензохінону
Похідні флорогюцину також доволі розповсюджені у природі.
Слайд 28Флороглюцин здатний до таутомерії за схемою:
Підтвердженням існування флороглюцину у кетонній формі
Слайд 29ПОНЯТТЯ ПРО ДІОКСИНИ
Діоксини - речовини загальних формул,
що характеризуються надзвичайно високою токсичністю
Слайд 30
Один з найбільш токсичних діоксинів – 2,3,7,8-тетрахлородибензо-n-діоксин (“Діоксин”) утворюється, як побічий
2,3,7,8-тетрахлородибензо-n- діоксин “Діоксин”
Слайд 31
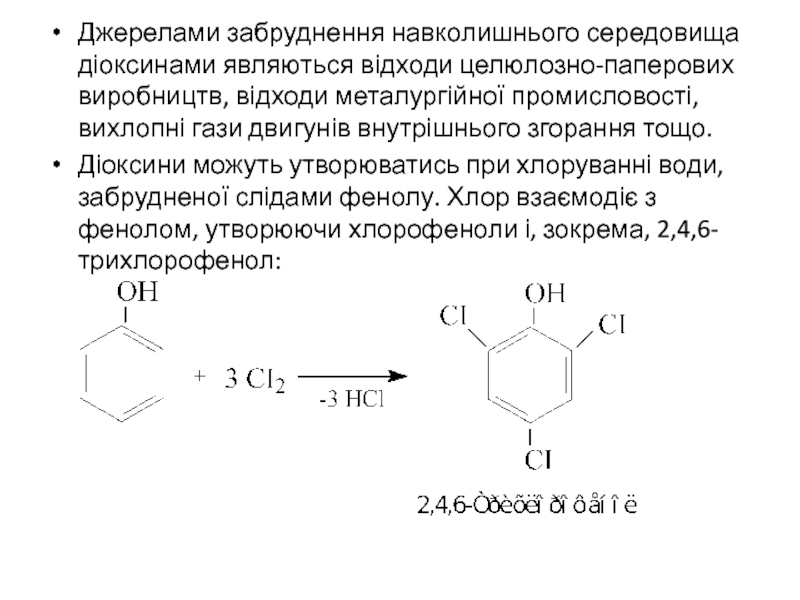
Джерелами забруднення навколишнього середовища діоксинами являються відходи целюлозно-паперових виробництв, відходи металургійної
Діоксини можуть утворюватись при хлоруванні води, забрудненої слідами фенолу. Хлор взаємодіє з фенолом, утворюючи хлорофеноли і, зокрема, 2,4,6-трихлорофенол: