- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фенол. Состав молекулы фенола презентация
Содержание
- 1. Фенол. Состав молекулы фенола
- 2. Состав молекулы фенола: С6Н5ОН Фенол рассматривают как
- 3. Физические свойства фенола Фенол – твёрдое вещество
- 4. Влияние бензольного кольца
- 5. Кислотные свойства фенола 1. Взаимодействие
- 6. Влияние гидроксогруппы на бензольное кольцо
- 7. Сходство химических свойств фенола с аренами (бромирование)
- 8. Сходство химических свойств фенола с аренами (нитрование)
- 9. Применение фенола
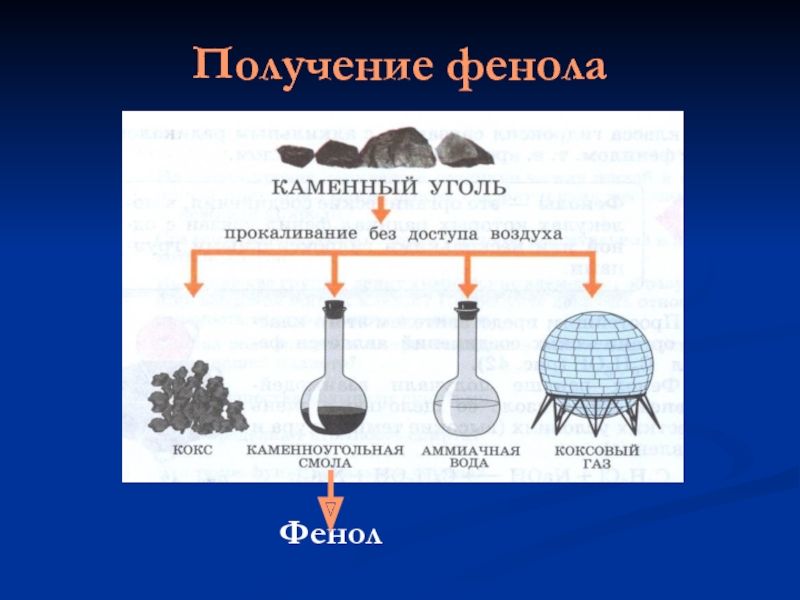
- 10. Получение фенола
- 11. Выводы Фенол сочетает в себе свойства спиртов
Слайд 2Состав молекулы фенола: С6Н5ОН
Фенол рассматривают как производное бензола, в котором один
атом водорода замещён на группу –ОН.
Структурная формула фенола:
СН
СН С–О–Н
СН СН
СН
Структурная формула фенола:
СН
СН С–О–Н
СН СН
СН
Слайд 3Физические свойства фенола
Фенол – твёрдое вещество (с характерным запахом).
Высокие температуры кипения
и плавления фенола объясняются наличием межмолекулярных водородных связей, которые прочнее, чем между молекулами предельных одноатомных спиртов.
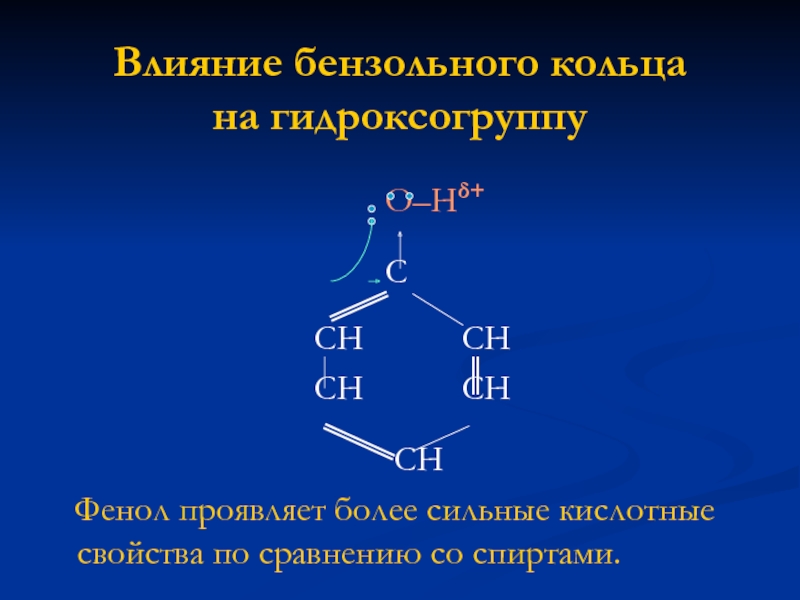
Слайд 4Влияние бензольного кольца на
гидроксогруппу
О–Нδ+
С
СН СН
СН СН
СН
Фенол проявляет более сильные кислотные свойства по сравнению со спиртами.
Слайд 5Кислотные свойства фенола
1. Взаимодействие с активными металлами:
2С6Н5–ОН + 2Na
→ 2С6Н5–ОNa + H2
фенолят натрия
2. Взаимодействие с основаниями:
С6Н5–ОН + NaОН → С6Н5–ОNa + H2О
фенолят натрия
3. Взаимодействие с солями:
с FeCl3 → комплексное соединение
(сине-фиолетовый раствор)
фенолят натрия
2. Взаимодействие с основаниями:
С6Н5–ОН + NaОН → С6Н5–ОNa + H2О
фенолят натрия
3. Взаимодействие с солями:
с FeCl3 → комплексное соединение
(сине-фиолетовый раствор)
Слайд 6Влияние гидроксогруппы на бензольное кольцо
О–Н
С
δ-СН δ-СН
СН СН
Сδ-Н
В отличие от бензола в молекуле фенола могут заместиться сразу три атома водорода в кольце в положениях 2, 4, 6.
С
δ-СН δ-СН
СН СН
Сδ-Н
В отличие от бензола в молекуле фенола могут заместиться сразу три атома водорода в кольце в положениях 2, 4, 6.
Слайд 7Сходство химических свойств фенола с аренами (бромирование)
О–Н О–Н
С С
δ-СН δ-СН + 3Br2 → Br С С Br + 3HBr
СН СН СН СН
Сδ-Н С Br
2,4,6-трибромфенол
С С
δ-СН δ-СН + 3Br2 → Br С С Br + 3HBr
СН СН СН СН
Сδ-Н С Br
2,4,6-трибромфенол
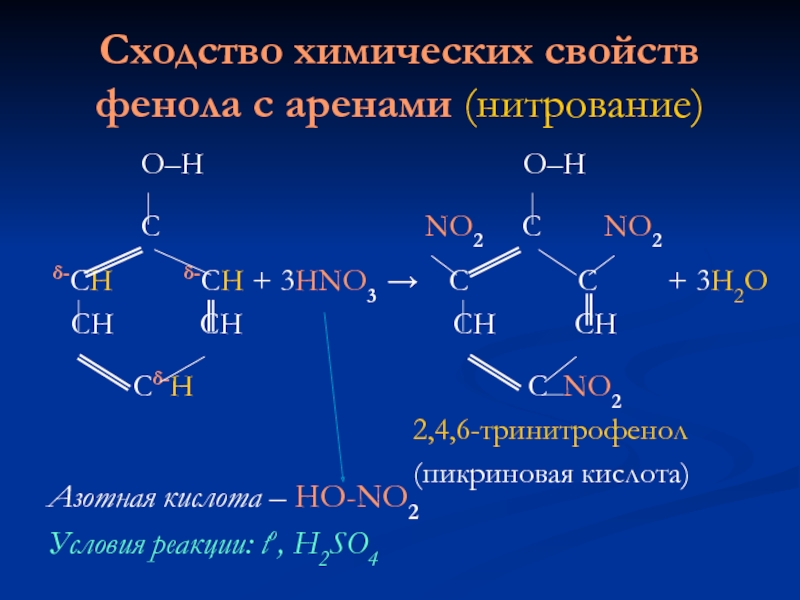
Слайд 8Сходство химических свойств фенола с аренами (нитрование)
О–Н О–Н
С NO2 С NO2
δ-СН δ-СН + 3HNO3 → С С + 3H2O
СН СН СН СН
Сδ-Н С NO2
2,4,6-тринитрофенол
(пикриновая кислота)
Азотная кислота – HO-NO2
Условия реакции: tо, H2SO4
С NO2 С NO2
δ-СН δ-СН + 3HNO3 → С С + 3H2O
СН СН СН СН
Сδ-Н С NO2
2,4,6-тринитрофенол
(пикриновая кислота)
Азотная кислота – HO-NO2
Условия реакции: tо, H2SO4
Слайд 11Выводы
Фенол сочетает в себе свойства спиртов и ароматических углеводородов.
В ряду: одноатомные
спирты → многоатомные спирты → фенол усиливаются кислотные свойства.
Качественными реакциями на фенол являются: а) взаимодействие с раствором FeCl3 с образова-нием сине-фиолетового окрашивания; б) взаимодействие фенола с бромной водой с образованием белого осадка.
Природным источником получения фенола является каменный уголь.
Качественными реакциями на фенол являются: а) взаимодействие с раствором FeCl3 с образова-нием сине-фиолетового окрашивания; б) взаимодействие фенола с бромной водой с образованием белого осадка.
Природным источником получения фенола является каменный уголь.