- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация презентация
Содержание
- 1. Электролитическая диссоциация
- 2. CH3COOH ↔ CH3COO- + H+
- 3. Сильные: α > 0.3
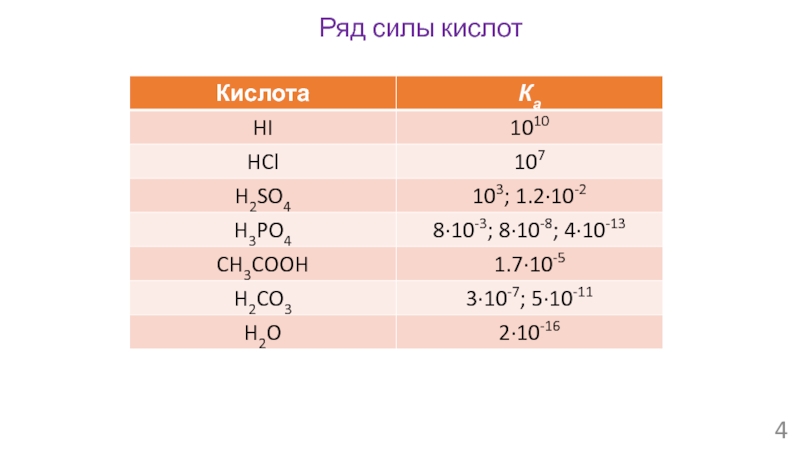
- 4. Ряд силы кислот
- 5. Кислотность воды и растворов H2O ↔ OH-
- 6. Задача Рассчитать рН 0.1М раствора масляной (одноосновной) кислоты, если её степень диссоциации равна 1.5%.
- 7. Задача Рассчитать рН 0.1М раствора масляной (одноосновной)
- 9. Электропроводность растворов Закон Ома: I = U/R
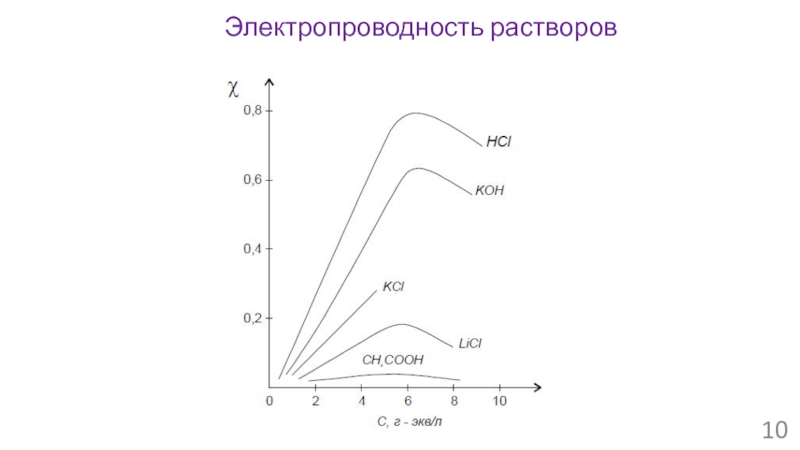
- 10. Электропроводность растворов
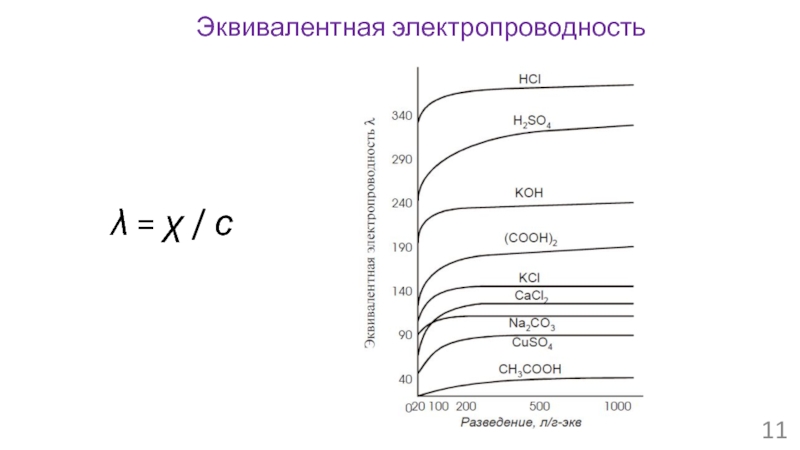
- 11. Эквивалентная электропроводность λ = χ / с
- 12. λ∞ = λ+ + λ- α = λ/ λ∞ Эквивалентная электропроводность и подвижность ионов
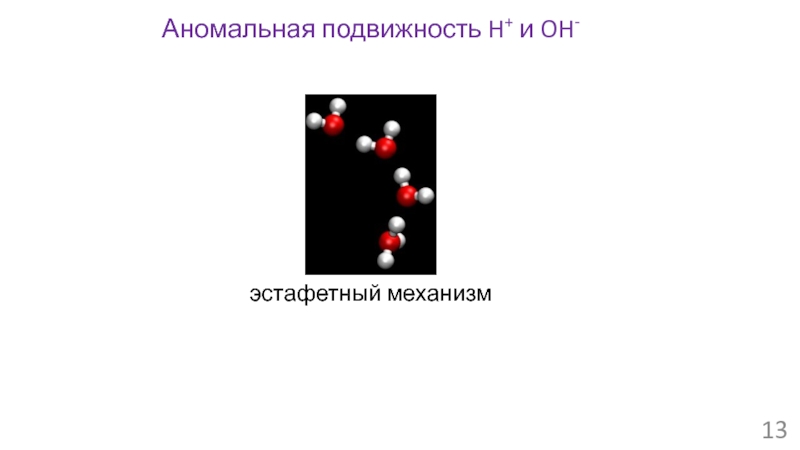
- 13. Аномальная подвижность H+ и OH- эстафетный механизм
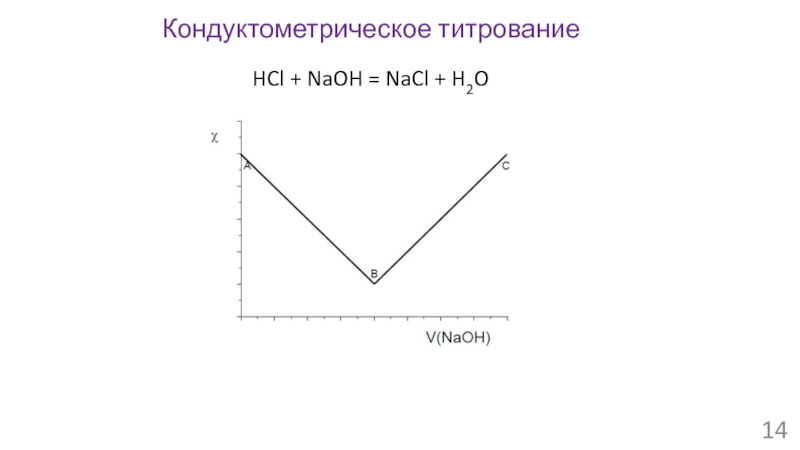
- 14. Кондуктометрическое титрование HCl + NaOH = NaCl + H2O
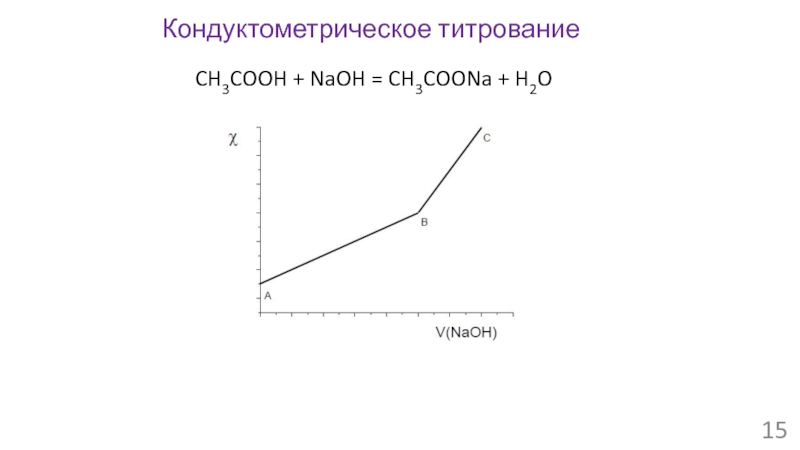
- 15. Кондуктометрическое титрование CH3COOH + NaOH = CH3COONa + H2O
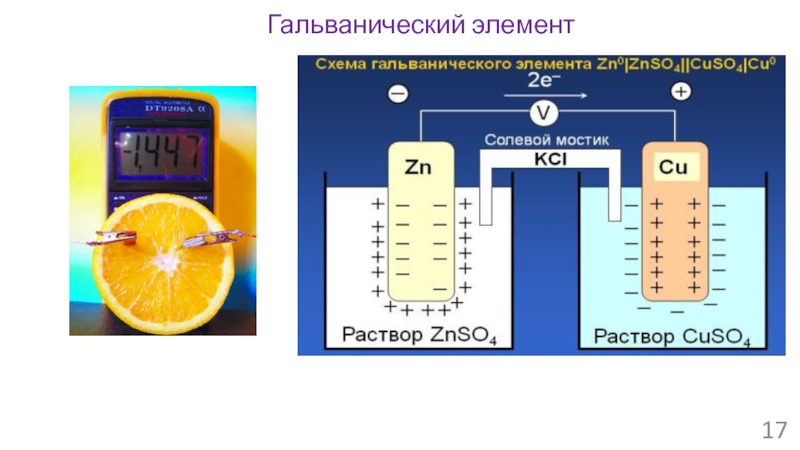
- 16. Гальванический элемент
- 17. Гальванический элемент
- 18. Гальванический элемент
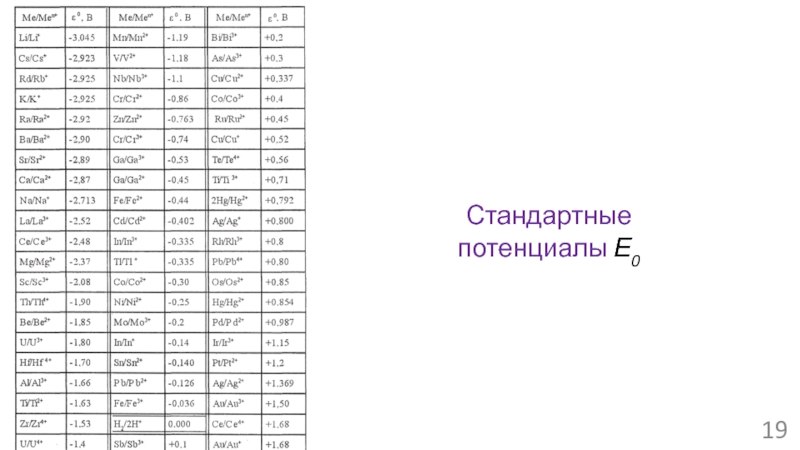
- 19. Стандартные потенциалы Е0
- 20. ЕХC = ЕAg,0 + (0.059/1)∙log(aAg+) = 0.222
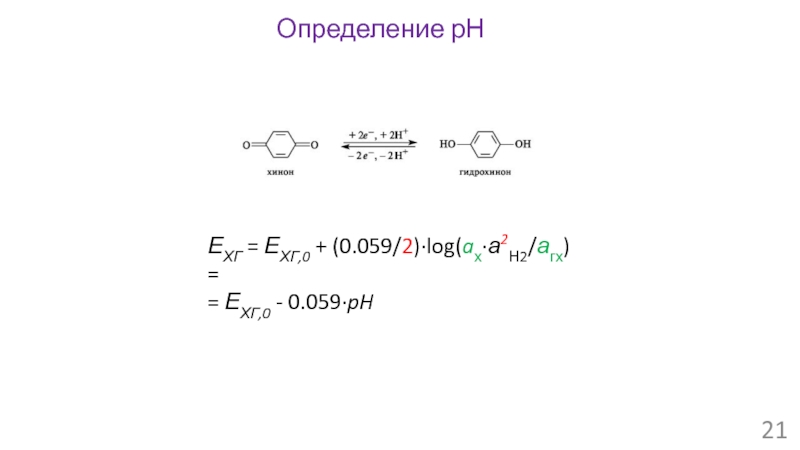
- 21. ЕХГ = ЕХГ,0 + (0.059/2)∙log(aх∙а2Н2/агх) = = ЕХГ,0 - 0.059∙pH Определение рН
- 22. Задача ЭДС гальванического элемента, состоящего из хлорсеребряного
- 23. Задача ЭДС гальванического элемента, состоящего из хлорсеребряного
Слайд 2CH3COOH ↔ CH3COO- + H+
Kдисс = [CH3COO-][H+] / [CH3COOH]
C0 =
α = [CH3COO-] / C0
Электролитическая диссоциация
Слайд 3Сильные: α > 0.3
Средние: 0.03< α < 0.3 10-4
Сила электролитов
Активность — «эффективная» концентрация
a = γ∙c
в разбавленных растворах γ ≈ 1; a ≈ c
Слайд 5Кислотность воды и растворов
H2O ↔ OH- + H+
Kдисс = [OH-]∙[H+] /
Ионное произведение воды:
Kw = [OH-]∙[H+] = 10-14 (при 25°С)
pH = -log a(H+) ≈ -log [H+]
Нейтральная вода:
[H+]=[OH-]=10-7
pH = 7
Слайд 6Задача
Рассчитать рН 0.1М раствора масляной (одноосновной) кислоты, если её степень диссоциации
Слайд 7Задача
Рассчитать рН 0.1М раствора масляной (одноосновной) кислоты, если её степень диссоциации
НА ↔ H+ + A-
α = [A-] / C0
[A-] = α∙C0 = 0.015∙0.1 = 0.0015
[H+] = [A-] = 0.0015
pH ≈ -log [H+] = -log (0.0015) = 2.82
Слайд 9Электропроводность растворов
Закон Ома: I = U/R
Сопротивление проводника:
R = ρ∙L/S
Проводимость
1/R = 1/ρ
Удельная электропроводность:
χ = 1/ρ [Cм/м]
Слайд 20ЕХC = ЕAg,0 + (0.059/1)∙log(aAg+) = 0.222 В
Хлорсеребряный электрод
Ag | AgCl
AgCl = Ag+ + Cl-
ПРAgCl = aAg+ ∙ aCl-
aAg+ = ПРAgCl = 1.78∙10-10
Слайд 22Задача
ЭДС гальванического элемента, состоящего из хлорсеребряного и хингидронного электродов, равна 0.32
ЕХГ,0 = 0.69 В
Слайд 23Задача
ЭДС гальванического элемента, состоящего из хлорсеребряного и хингидронного электродов, равна 0.32
ЕХГ = ЕХГ,0 - 0.059∙pH = 0.69 - 0.059∙pH
ЕХГ,0 = 0.69 В
ЕХC = 0.22 В
U = EХГ – EХC = 0.69 - 0.059∙pH - 0.22 = 0.47 - 0.059∙pH = 0.32
pH = 2.5

![CH3COOH ↔ CH3COO- + H+Kдисс = [CH3COO-][H+] / [CH3COOH]C0 = [CH3COO-] + [CH3COOH]α = [CH3COO-]](/img/tmb/5/401988/3bf72517d05a9e916520546a78a26f85-800x.jpg)

![Кислотность воды и растворовH2O ↔ OH- + H+Kдисс = [OH-]∙[H+] / [H2O]Ионное произведение воды:Kw =](/img/tmb/5/401988/1328eafe82112da330d2743a84b101ac-800x.jpg)