- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода презентация
Содержание
- 1. Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
- 2. Классификация органических реакций По характеру перестройки связей
- 3. Радикалы Трифенилметил — стабильный свободный радикал и первый радикал, описанный
- 4. Электрофилы Электрофильные реагенты (Е, Е+) – это
- 5. Нуклеофилы Нуклеофильные реагенты (:Nu, Nu-) – это
- 6. Карбокатион и карбанион Карбанион sp3-гибридизация 8 электронов
- 7. Карбокатионы Факторы, увеличивающие стабильность карбокатионов: Электронодонорные заместители, Сопряжение, Стерические эффекты
- 8. Карбокатионы
- 9. Карбанионы sp3-гибридизация
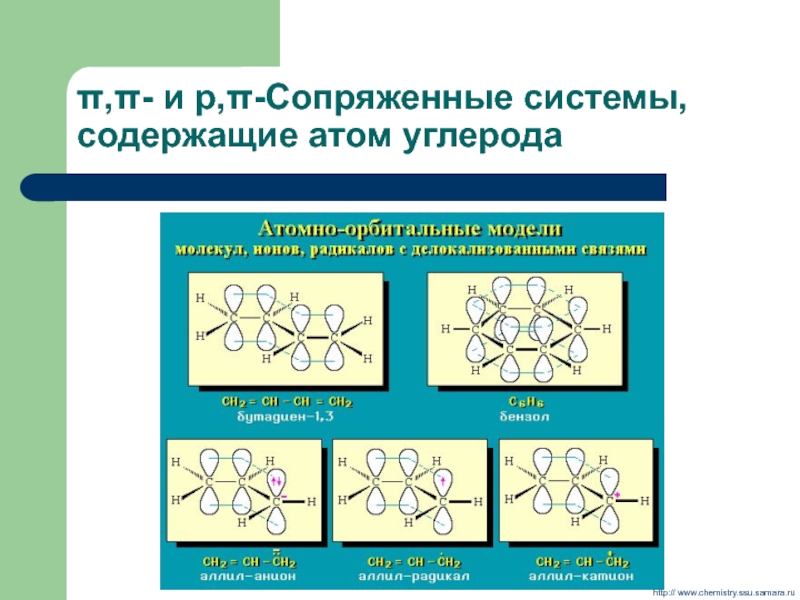
- 10. π,π- и р,π-Сопряженные системы, содержащие атом углерода http:// www.chemistry.ssu.samara.ru
- 11. Карбанионы Карбанионные центры могут находится в
- 12. Карбанионы. Факторы стабилизации 1. Пространственный
- 13. Классификация органических реакций по типу частиц, участвующих
- 14. Реакции замещения Реакции замещения (S) – один
- 15. Механизмы SN-реакций Мономолекулярный механизм SN1 Бимолекулярный механизм SN2
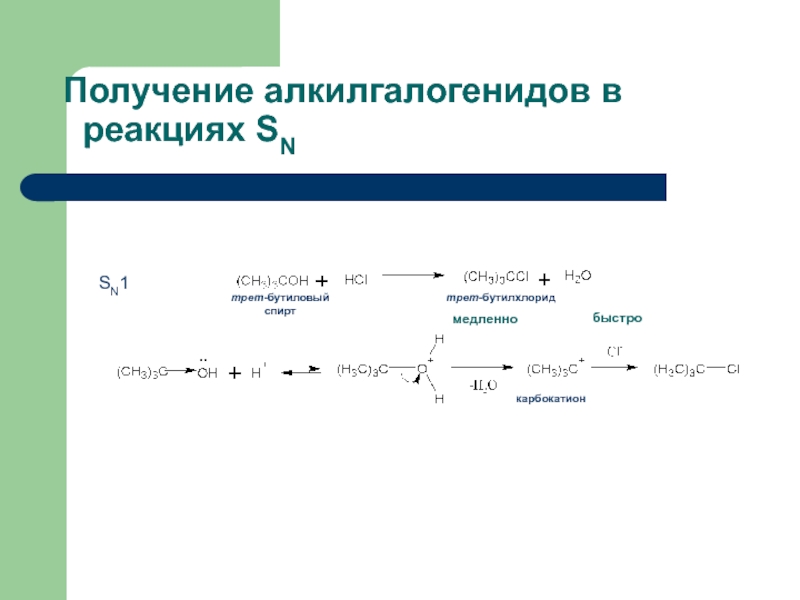
- 16. Мономолекулярный механизм SN1 Двухстадийный процесс
- 17. Изменение энергии системы вдоль координаты реакции при
- 18. Эффект общего иона R+ - карбокатион
- 19. Бимолекулярный механизм SN2
- 20. Изменение энергии системы вдоль координаты реакции при
- 21. Вальденовское обращение Если
- 22. Факторы, влияющие на скорость реакции SN Строение
- 23. Влияние строения субстрата на скорость реакции SN1 3) Эффект сопряжения
- 24. -I-эффект (СН3)3CХ < (СН3)2CHХ
- 25. Влияние стерического фактора на скорость реакции SN2
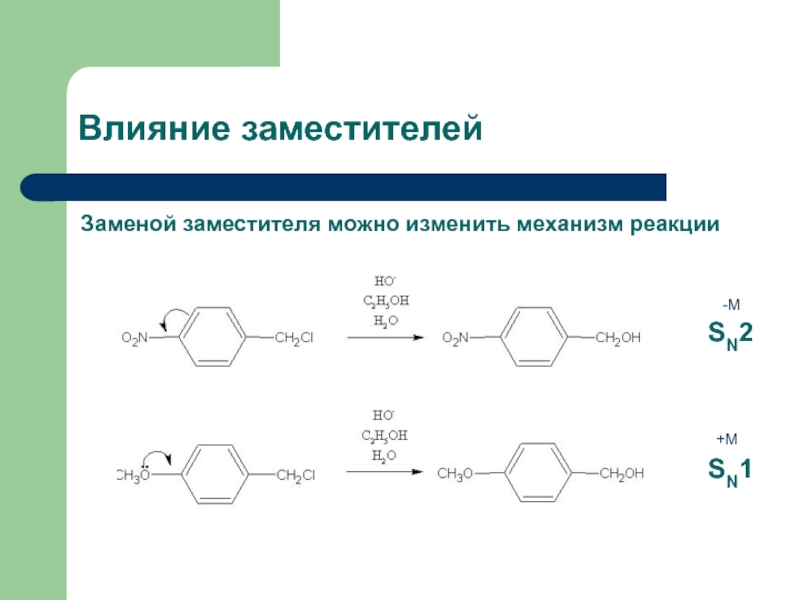
- 26. Влияние заместителей Заменой заместителя можно изменить механизм реакции SN2 SN1 -M +M
- 27. Влияние природы нуклеофила на скорость реакции SN1
- 28. Влияние природы нуклеофила на скорость реакции SN2
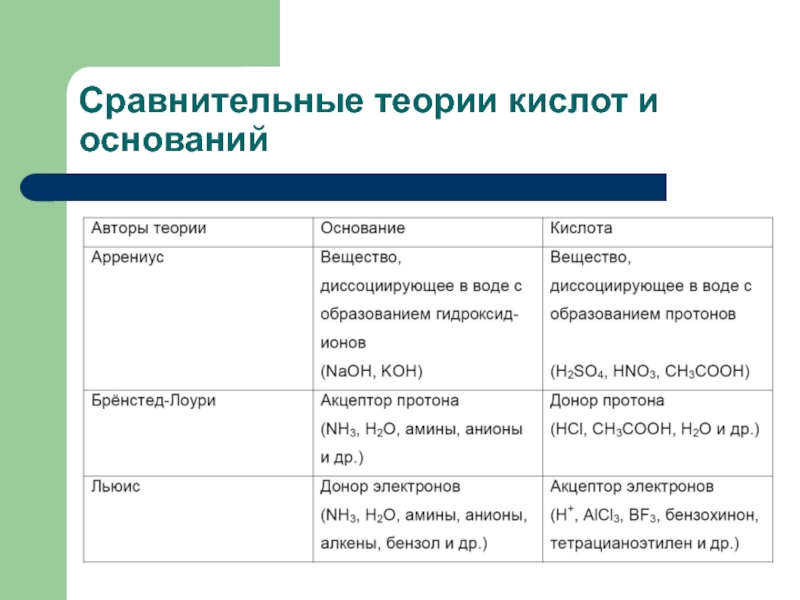
- 29. Сравнительные теории кислот и оснований
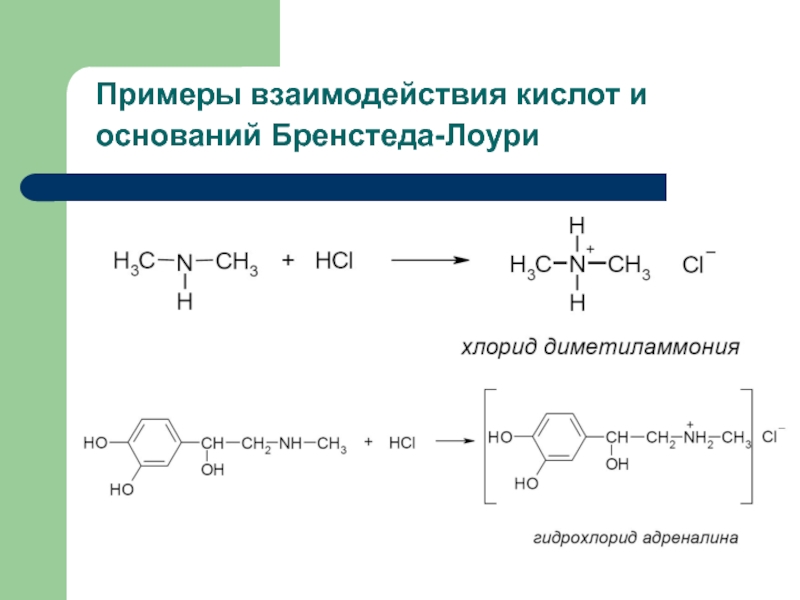
- 30. Примеры взаимодействия кислот и оснований Бренстеда-Лоури
- 31. Нуклеофильность и основность Сильный нуклеофил не обязательно сильное основание Сильное основание не обязательно сильный нуклеофил
- 32. Нуклеофильность и основность Нуклеофил = основание, но
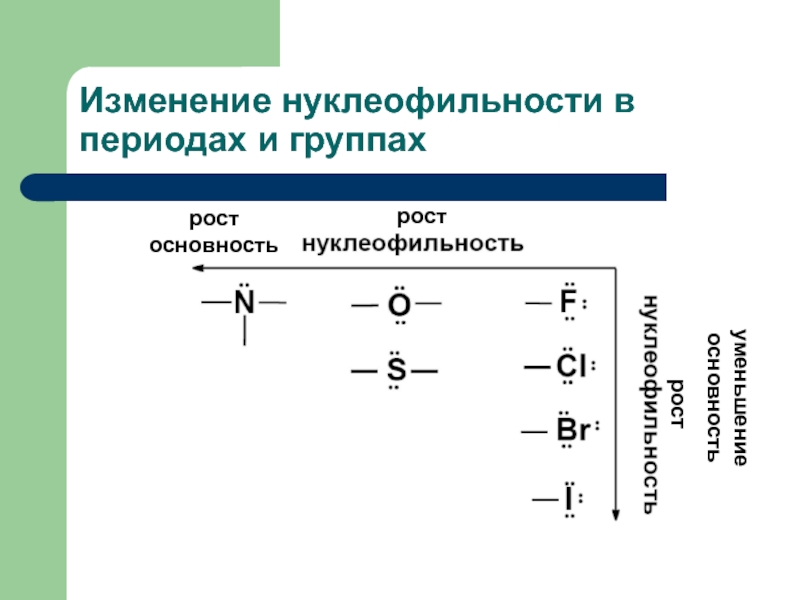
- 33. Изменение нуклеофильности в периодах и группах рост рост рост основность уменьшение основность
- 34. Факторы, влияющие на основность Чем больше электроотрицательность
- 35. Влияние природы растворителя на нуклеофильность I_ >
- 36. Изменение нуклеофильности Депротонированная форма является более сильным
- 37. Увеличение нуклеофильности повышает вероятность протекания реакции по механизму SN2 Резюме
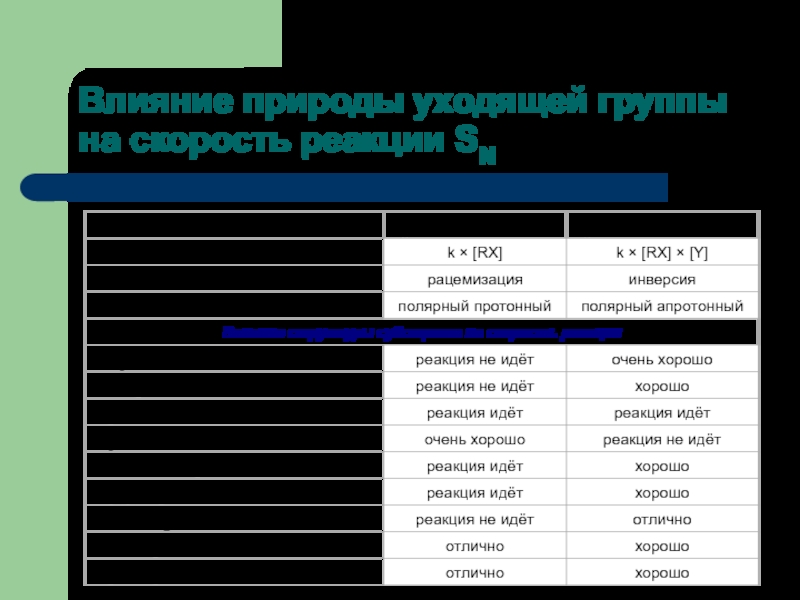
- 38. Влияние природы уходящей группы на скорость реакции
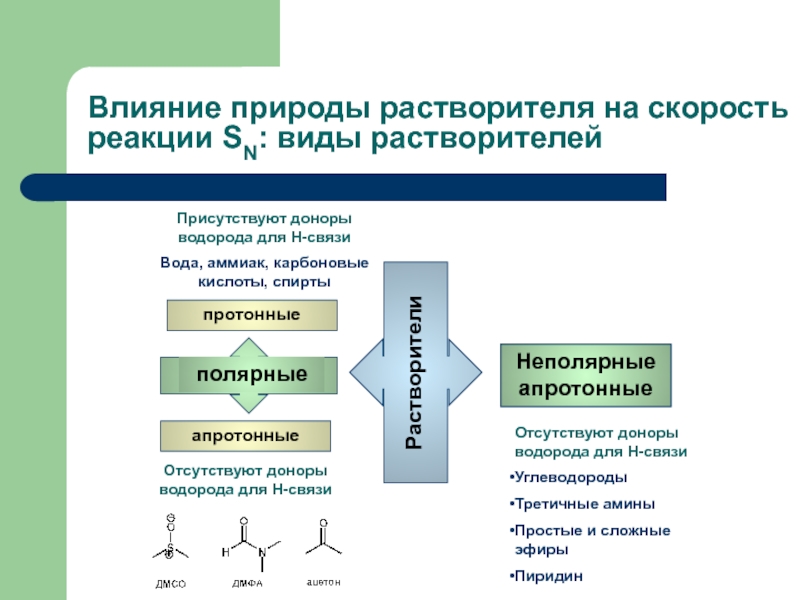
- 39. Влияние природы растворителя на скорость реакции SN: виды растворителей
- 40. Влияние природы растворителя на скорость реакции SN1
- 41. Влияние природы уходящей группы на скорость реакции SN
- 42. Влияние природы растворителя на скорость реакции SN2
- 43. Основные органические реакции, относящиеся к типу SN
- 44. Получение алкилгалогенидов в реакциях SN медленно быстро .. карбокатион трет-бутиловый спирт трет-бутилхлорид SN1
- 45. Примеры реакций Гидролиз алкилгалогенидов
- 46. Примеры реакций Алкоголиз алкилгалогенидов
- 47. Примеры реакций Аммонолиз алкилгалогенидов Реакция алкилгалогенидов с цианидами
- 48. Примеры реакций Взаимодействие алкилгалогенидов с солями кислот
- 49. Благодарю за внимание!
Слайд 2Классификация органических реакций
По характеру перестройки связей
- гетеролитические (ионные)
Разрыв связей в молекулах
- гомолитические
Разрыв связей в молекулах происходит с разъединением осуществляющей ковалентную связь электронной пары
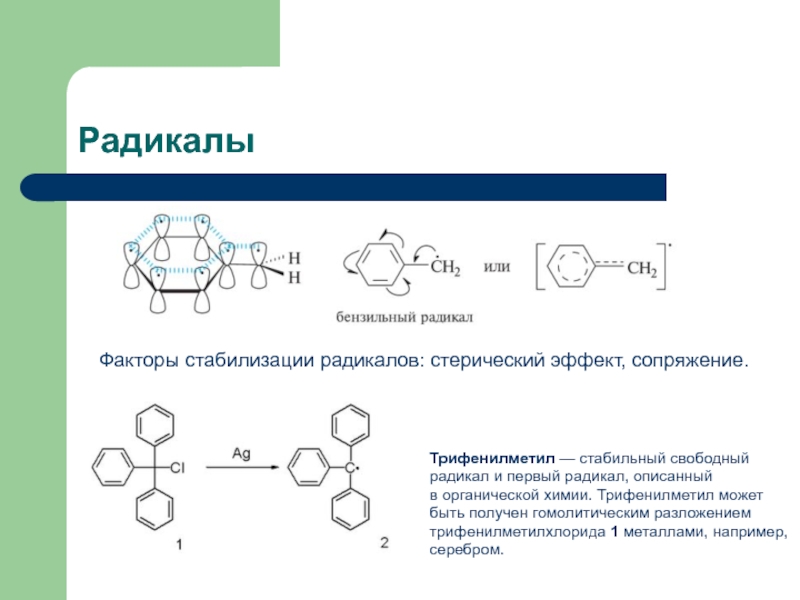
Слайд 3Радикалы
Трифенилметил — стабильный свободный радикал и первый радикал, описанный в органической химии. Трифенилметил может быть
Факторы стабилизации радикалов: стерический эффект, сопряжение.
Слайд 4Электрофилы
Электрофильные реагенты (Е, Е+) – это частицы, образующие новые ковалентные связи
- положительно заряженные ионы
H+ Hal+ NO2+ NO+
- нейтральные молекулы, имеющие электронодефицитный центр
Слайд 5Нуклеофилы
Нуклеофильные реагенты (:Nu, Nu-) – это частицы, образующие новые ковалентные связи
- отрицательно заряженные ионы
- нейтральные молекулы, имеющие неподеленную пару электронов
- доноры π-электронов
>С=С<
π-связь
Ароматическое кольцо
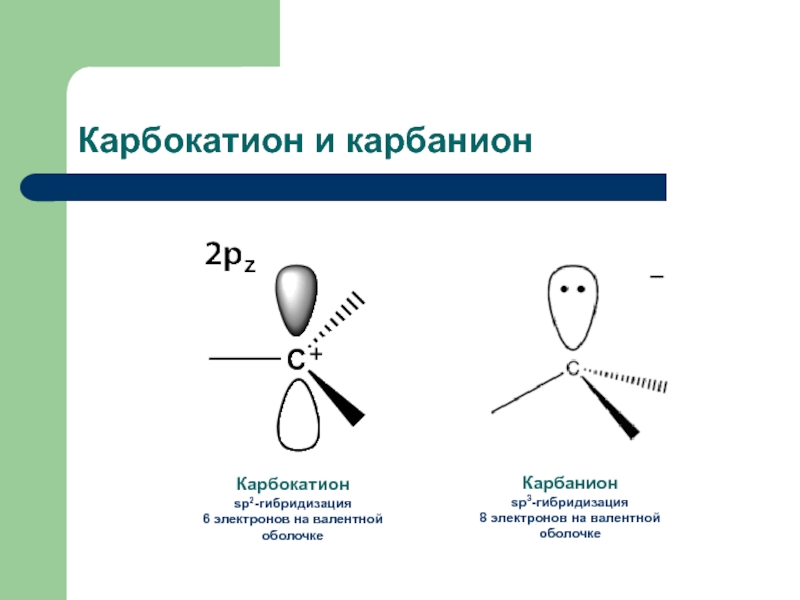
Слайд 6Карбокатион и карбанион
Карбанион
sp3-гибридизация
8 электронов на валентной оболочке
Карбокатион
sp2-гибридизация
6 электронов на валентной оболочке
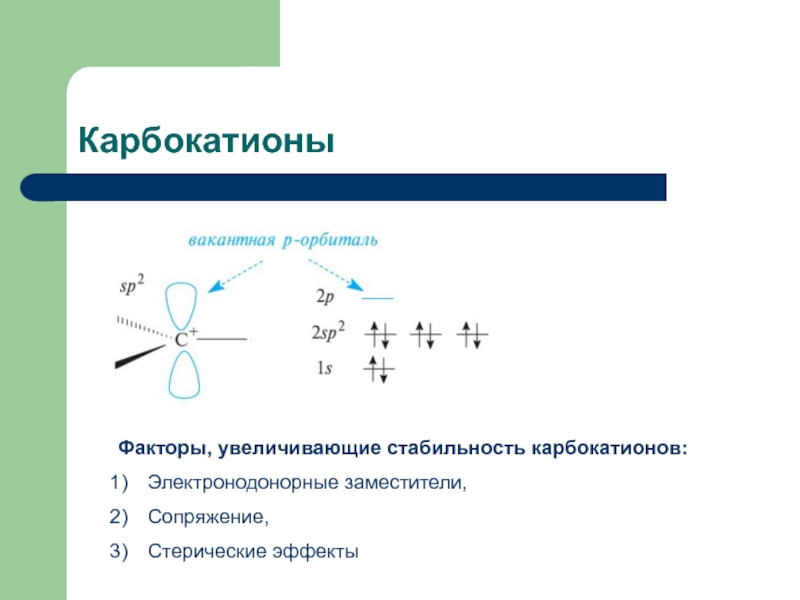
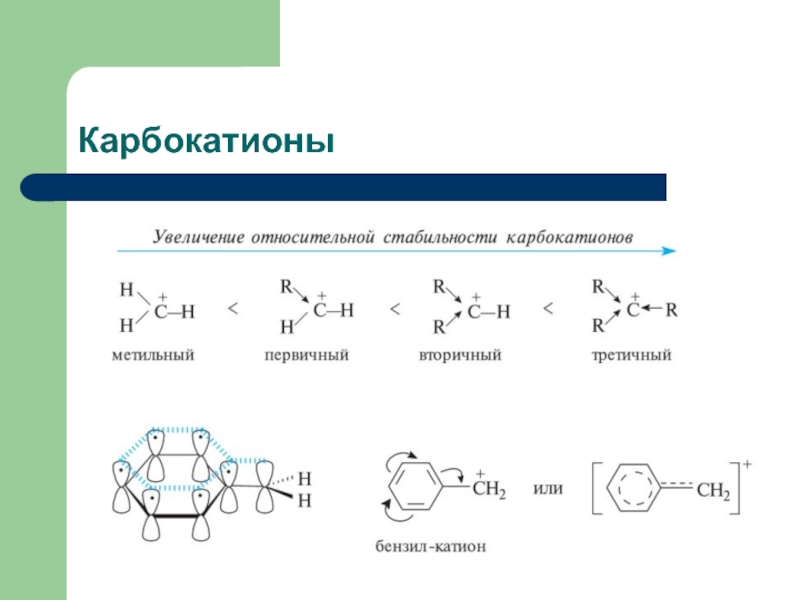
Слайд 7Карбокатионы
Факторы, увеличивающие стабильность карбокатионов:
Электронодонорные заместители,
Сопряжение,
Стерические эффекты
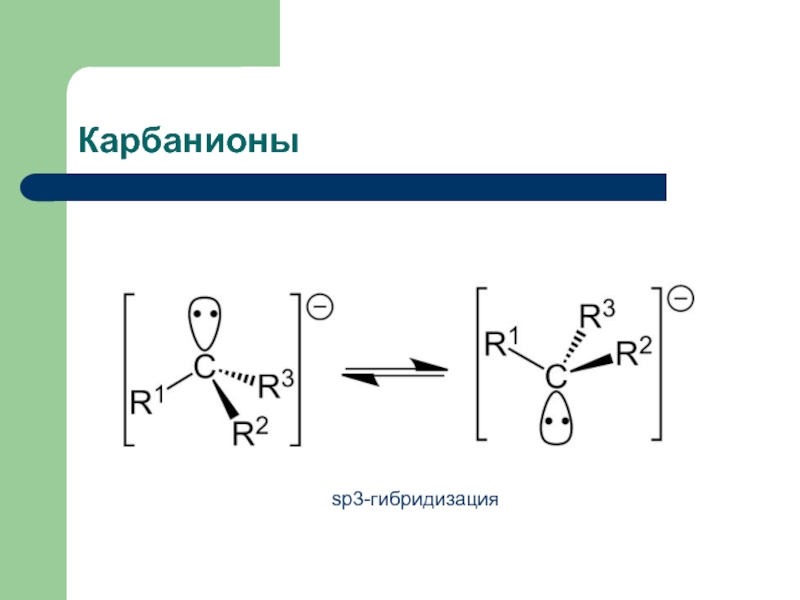
Слайд 11Карбанионы
Карбанионные центры могут находится в состоянии sp3-гибридизации, sp2-гибридизации (в сопряженных системах,
p-π-сопряжение, sp2-гибридизация атома углерода.
Слайд 12
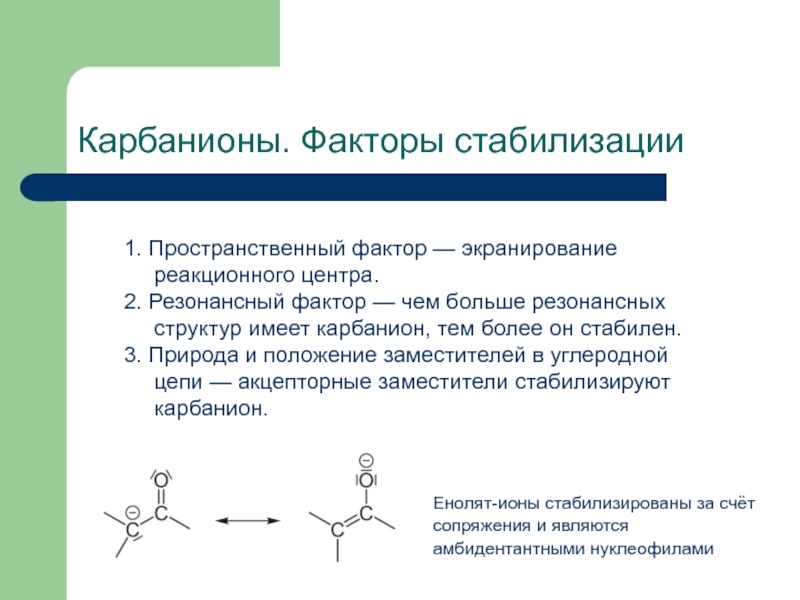
Карбанионы. Факторы стабилизации
1. Пространственный фактор — экранирование реакционного центра.
2. Резонансный фактор — чем
3. Природа и положение заместителей в углеродной цепи — акцепторные заместители стабилизируют карбанион.
Енолят-ионы стабилизированы за счёт сопряжения и являются амбидентантными нуклеофилами
Слайд 13Классификация органических реакций по типу частиц, участвующих в реакции
Радикальные реакции протекают
Электрофильные реакции протекают с участием электрофилов. (например, электрофильное замещение SE, электрофильное присоединение AE).
Нуклеофильные реакции протекают с участием нуклеофилов (например, нуклеофильное замещение SE, нуклеофильное присоединение AE)
“Без механизма”. Реакции, протекающие без образования и участия радикалов или ионов. Например, реакция Дильса-Альдера:
Слайд 14Реакции замещения
Реакции замещения (S) – один или несколько атомов или групп
A-Х + Y A-Y + X
Реакции нуклеофильного замещения (SN)
C-Х + Y C-Y + X
нуклеофуг
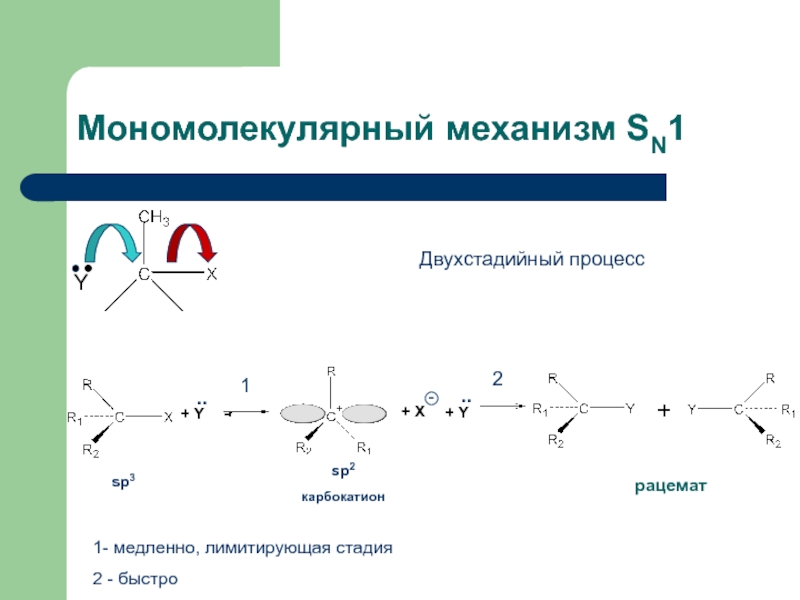
Слайд 16Мономолекулярный механизм SN1
Двухстадийный процесс
1
2
1- медленно, лимитирующая стадия
2 - быстро
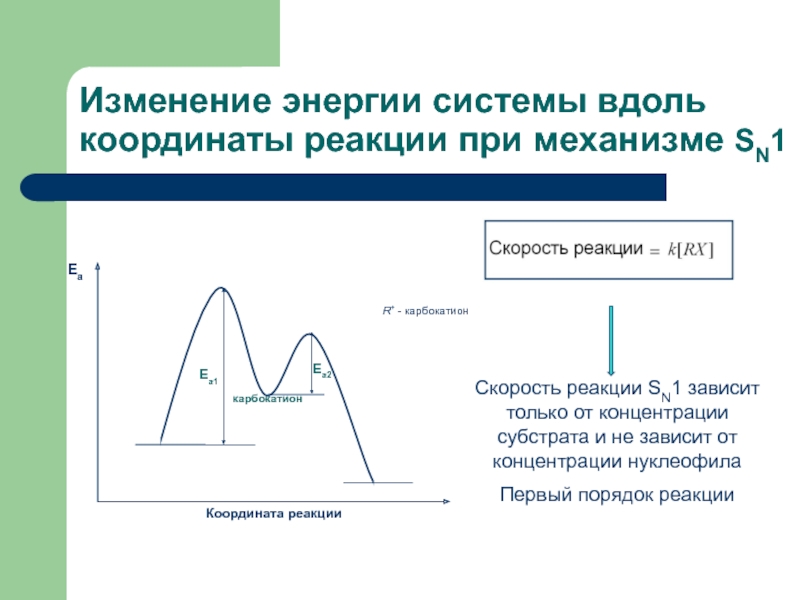
Слайд 17Изменение энергии системы вдоль координаты реакции при механизме SN1
Скорость реакции SN1
Первый порядок реакции
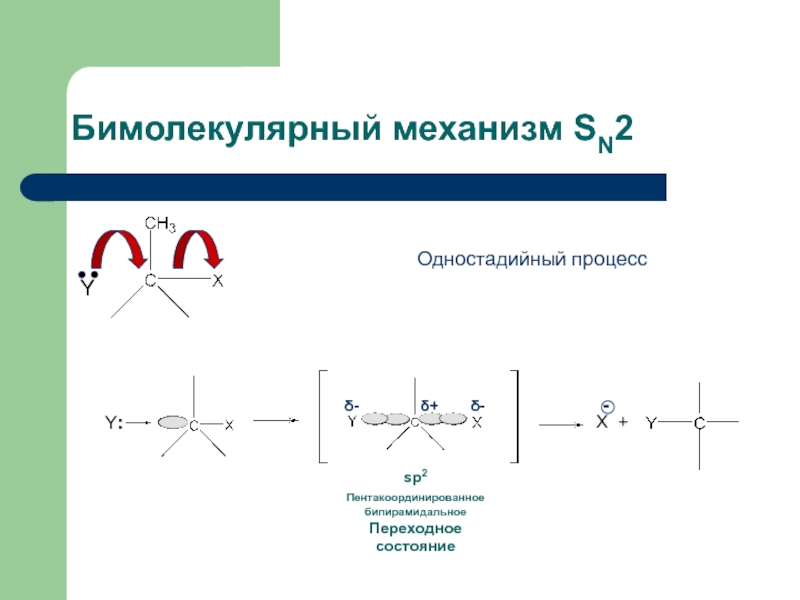
Слайд 19Бимолекулярный механизм SN2
Одностадийный процесс
sp2
Пентакоординированное бипирамидальное
Переходное состояние
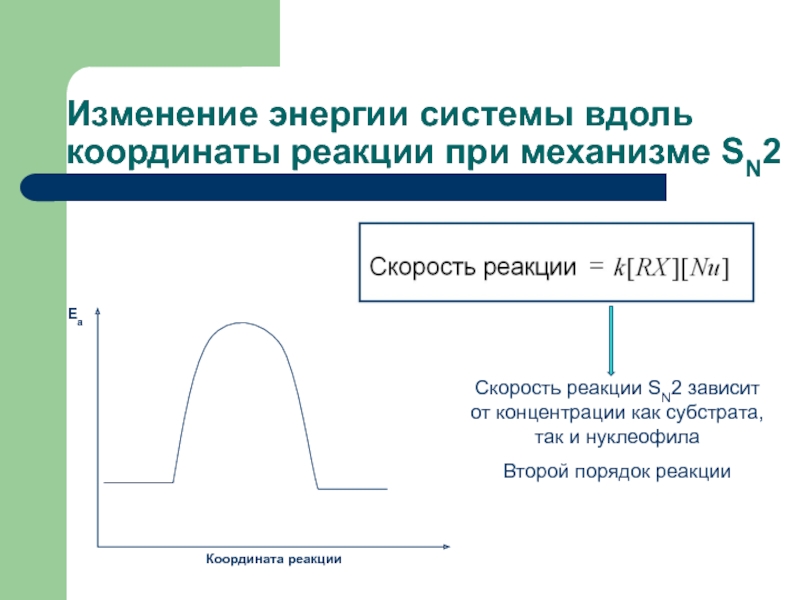
Слайд 20Изменение энергии системы вдоль координаты реакции при механизме SN2
Скорость реакции SN2
Второй порядок реакции
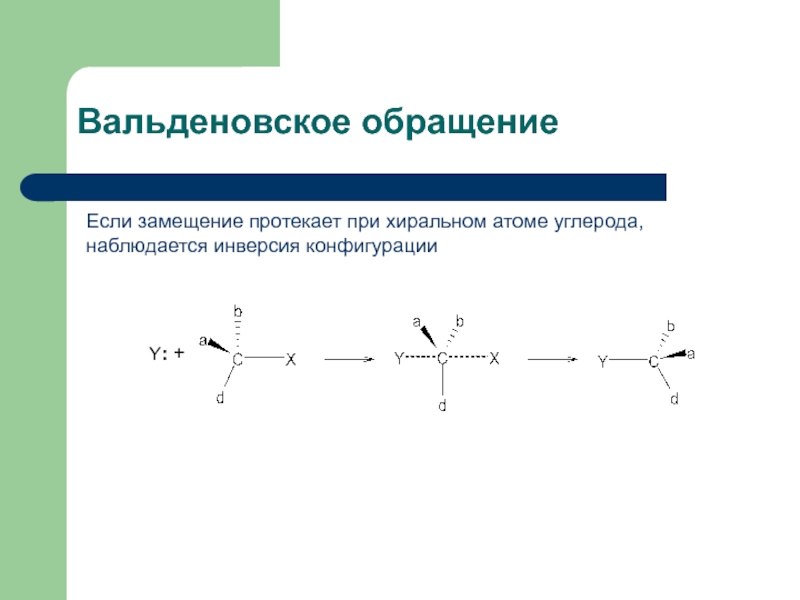
Слайд 21Вальденовское обращение
Если замещение протекает при хиральном атоме углерода, наблюдается инверсия конфигурации
Слайд 22Факторы, влияющие на скорость реакции SN
Строение субстрата
Природа нуклеофила
Природа уходящей группы
Природа растворителя
Пространственные
Катализаторы
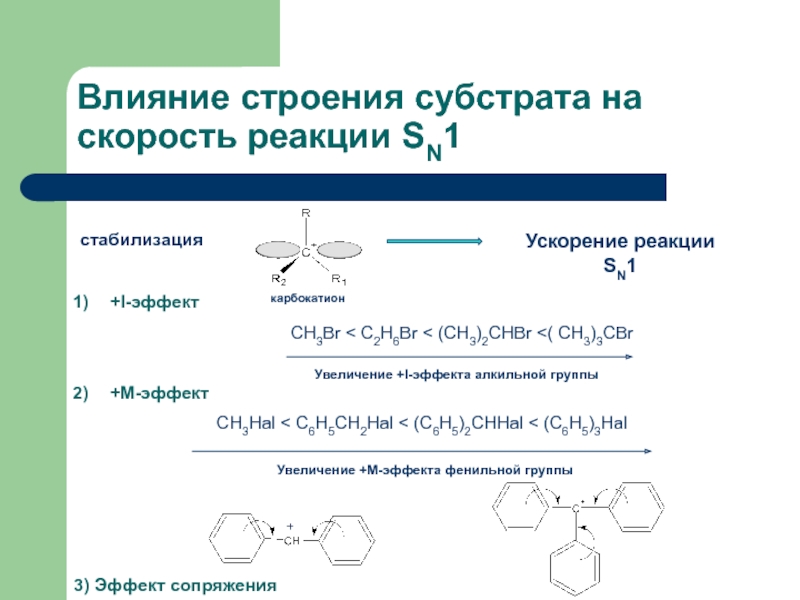
Слайд 24
-I-эффект
(СН3)3CХ < (СН3)2CHХ < С2Н5Х < СН3Х
-М-эффект
Пространственное строение субстрата (стерический
Эффект сопряжения
Влияние строения субстрата на скорость реакции SN2
Ускорение реакции SN2
Повышение скорости реакции SN2
Электроноакцепторные группы
Слайд 25Влияние стерического фактора на скорость реакции SN2
Алкилирование аминов алкилгалогенидами (реакция Меншуткина):
2)
СН3СН2Х > СН3СН2СН2Х > (СН3)2СНСН2Х > (СН3)3ССН2Х
Четвертичное аммониевое основание
Понижение скорости реакции SN2
Х - галоген
Слайд 27Влияние природы нуклеофила на скорость реакции SN1
Скорость реакции SN1 не зависит
Слайд 28Влияние природы нуклеофила на скорость реакции SN2
Повышение концентрации нуклеофила приводит к
Влияние природы нуклеофила (основания Льюиса)
- основность: способность нуклеофила связываться с протоном, т.е. сродство к протону (влияние на кислотно-основное равновесие)
- нуклеофильность: способность нуклеофила связываться с углеродом (или другими атомами), т.е. сродство к углероду (или другим атомам) (влияние на скорость SN2)
Основания Льюиса – доноры пары электронов
Слайд 31Нуклеофильность и основность
Сильный нуклеофил не обязательно сильное основание
Сильное основание не обязательно
Слайд 32Нуклеофильность и основность
Нуклеофил = основание, но основность и нуклеофильность могут не
HO_ > СN_ > HS_ > F_ > Cl_ > Br_ > I_
HS_ > СN_ > I_ > HO_ > Br_ > Cl_ > F_
Уменьшение основности
В протонном растворителе:
Слайд 34Факторы, влияющие на основность
Чем больше электроотрицательность атома основного центра, тем сильнее
Зависимость действует для оснований, имеющих оснόвные центры представленные атомами одного периода таблицы Менделеева.
Электроотрицательность: N < O < F
основность: NH3 > H2O > HF
то есть аммониевые основания сильнее, чем оксониевые. Амины являются более сильными основаниями, чем спирты.
2) Электронодонорные заместители увеличивают оснόвность, электроноакцепторные уменьшают.
Слайд 35Влияние природы растворителя на нуклеофильность
I_ > Br_ > Cl_ > F_
Причина: увеличение эффективности сольватации, приводящей к делокализации заряда
Сила нуклеофила в протонном растворителе
(вода, аммиак, карбоновые кислоты, спирты)
Сила нуклеофила в апротонном растворителе (углеводороды)
F_ > Cl_ > Br_ > I_
Причина: отсутствие сольватации аниона приводит к увеличению плотности заряда на анионе
Слайд 36Изменение нуклеофильности
Депротонированная форма является более сильным нуклеофилом, чем протонированная:
Н2О более слабый
ROH более слабый нуклеофил, чем RO_
NH3 более слабый нуклеофил, чем NH2_
Сила нуклеофила увеличивается с его поляризуемостью (с увеличением размера атома-нуклеофильного центра):
RO_ более слабый нуклеофил, чем RS_
Слайд 38Влияние природы уходящей группы на скорость реакции SN
C-Х + Y C-Y +
основание
Уходящая группа отщепляется тем легче, чем она лучше поляризуема и лучше сольватируется, то есть, чем более слабым основанием она является
Слайд 40Влияние природы растворителя на скорость реакции SN1
Сольватация карбокатиона молекулами воды:
Полярные протонные
Слайд 42Влияние природы растворителя на скорость реакции SN2
R-X + Y_ → [Y…R…X]
RBr + HO_ → ROH + Br_
R-X + Y: → [Y…R…X] → RY+ + X_
R-Br + N(CH3)3 → RN(CH3)3 + Br_
RX+ + Y_ → [Y…R…X] → RY + X:
RN(CH3)3 + I_ → RN(CH3)2 + CH3I
RX+ + Y: → [Y…R…X] → RX1 + Y+1
RS(CH3)2 + N(CH3)3 → RSCH3 + (CH3)4N+
Распределение заряда в большем пространстве
Уменьшение полярности и сольватации, снижение скорости реакции
Частичная нейтрализация
Уменьшение полярности и сольватации, снижение скорости реакции
Переходное состояние более полярно и сольватировано
Слабое замедление
Сильное замедление
Сильное ускорение
Замена растворителя на более полярный
Частичная нейтрализация
Слабое замедление
δ_
δ+
δ+
δ+
δ_
δ_
δ_
δ_
+
+
+
Слайд 43Основные органические реакции, относящиеся к типу SN
Получение алкилгалогенидов
Получение и расщепление простых
Щелочное омыление
Синтез простых эфиров по Вильямсону
Синтез эфиров карбоновых кислот
Синтез меркаптанов
Алкилирование аммиака и аминов
Синтез нитрилов по Кольбе
Синтез нитроалканов
Реакция Финкельштейна






















![Влияние природы растворителя на скорость реакции SN2R-X + Y_ → [Y…R…X] → RY + X_ RBr](/img/tmb/5/402362/94dbe3d8b66ca52036bee92387c47312-800x.jpg)