- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитическая диссоциация презентация
Содержание
- 1. Электролитическая диссоциация
- 2. Теория электролитической диссоциации была создана шведским ученым
- 3. Электролиты – вещества, растворы или расплавы которых
- 4. Молекулы воды представляют собой диполи, так как
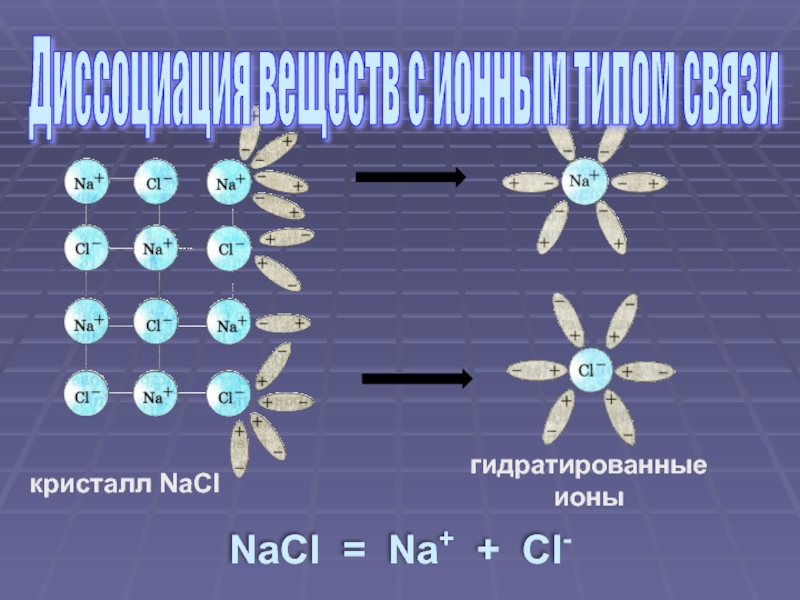
- 5. кристалл NaCl гидратированные ионы NaCl =
- 6. Ориентация молекул – диполей воды около
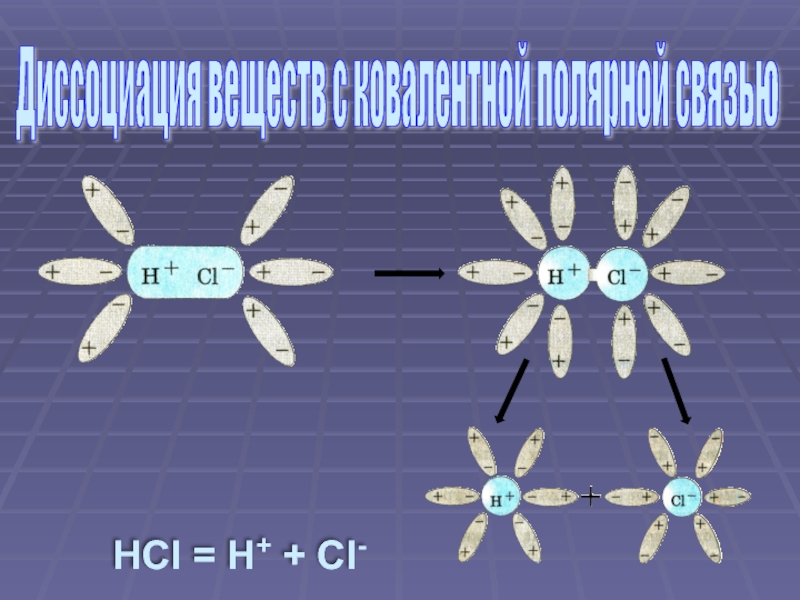
- 7. HCl = H+ + Cl- Диссоциация веществ с ковалентной полярной связью
- 8. Ориентация молекул воды вокруг полюсов молекулы электролита
- 9. < 2 % слабые > 30
- 10. Основные положения теории электролитической диссоциации При
- 11. HSO3− H+ + SO32− Кислоты
- 12. Основания – электролиты, которые при диссоциации образуют
- 13. Средние соли – сильные электролиты, которые при
- 14. Вещества, растворы которых проводят электрический ток. Процесс
- 15. 1. Электролиты 2. Электролитическая диссоциация
- 16. http://www.catalogmineralov.ru – сайт содержит каталог минералов, большую
Слайд 2Теория электролитической диссоциации была создана шведским ученым С. Аррениусом в 1883
Механизм электролитической диссоциации был подробно изучен русским ученым И. А. Каблуковым
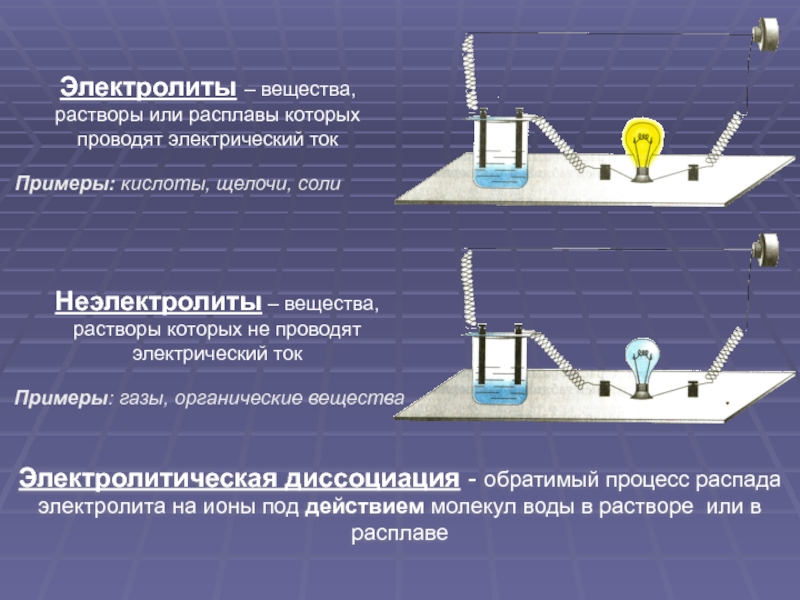
Слайд 3Электролиты – вещества, растворы или расплавы которых проводят электрический ток
Неэлектролиты –
Электролитическая диссоциация - обратимый процесс распада электролита на ионы под действием молекул воды в растворе или в расплаве
Примеры: газы, органические вещества
Примеры: кислоты, щелочи, соли
Слайд 4Молекулы воды представляют собой диполи, так как атомы водорода расположены под
строение молекулы воды
Слайд 6 Ориентация молекул – диполей воды около ионов кристалла
Взаимодействие молекул
Распад кристалла электролита на гидратированные ионы (диссоциация)
Механизм электролитической диссоциации веществ с ионным типом связи
Слайд 8Ориентация молекул воды вокруг полюсов молекулы электролита
Взаимодействие молекул воды с противоположно
Превращение ковалентной полярной связи в ионную (ионизация молекул электролита)
Распад молекул электролита на гидратированные ионы (диссоциация)
Механизм электролитической диссоциации веществ с ковалентной полярной связью
Это нужно запомнить!
Слайд 9< 2 %
слабые
> 30 %
сильные
2 − 30 %
средней
силы
Степень электролитической
диссоциации зависит
Соли, щелочи, кислоты H2SO4, HNO3, HCl, HBr, HI
H3PO4, HF
H2O, NH4OH, Me(OH)n , H2CO3, H2SiO3, H2S, CH3COOH
Степень электролитической диссоциации – отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц
природы электролита и растворителя
температуры
концентрации
Слайд 10Основные положения теории электролитической диссоциации
При растворении в воде электролиты диссоциируют
Причиной диссоциации электролита в водном растворе является его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нем
Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока – катоду, их называют катионами; а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду, их называют анионами
Электролитическая диссоциация – процесс обратимый для слабых электролитов
Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации
Слайд 11HSO3− H+ + SO32−
Кислоты – электролиты, которые при диссоциации
HNO3 H+ + NO3−
H2SO4 2H+ + SO42−
Общие характерные свойства кислот обусловлены присутствием катионов водорода
Слабые многоосновные кислоты диссоциируют ступенчато:
H2SO3 H+ + HSO3−
HCl H+ + Cl-
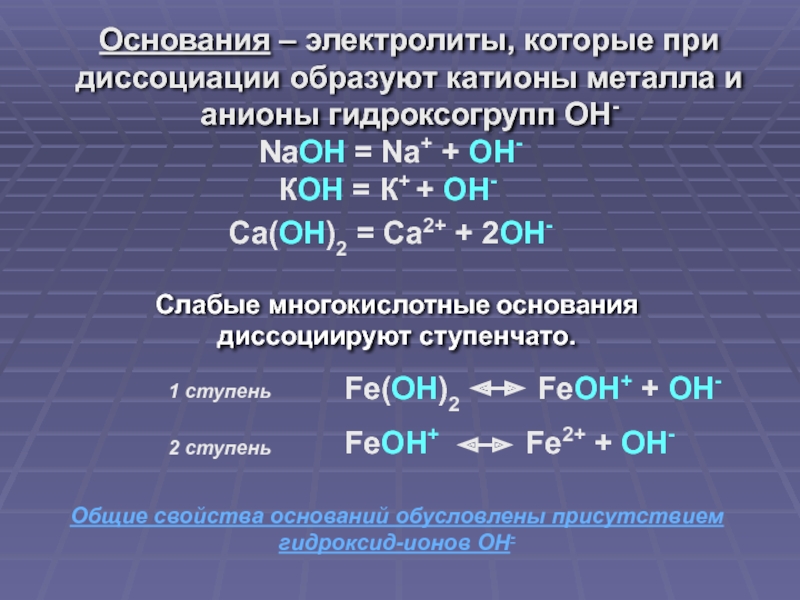
Слайд 12Основания – электролиты, которые при диссоциации образуют катионы металла и анионы
NaOH = Na+ + OH-
КОН = К+ + ОН-
Са(ОН)2 = Са2+ + 2ОН-
Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН-
Слабые многокислотные основания диссоциируют ступенчато.
Fe(OH)2 FeOH+ + OH-
1 ступень
2 ступень
FeOH+ Fe2+ + OH-
Слайд 13Средние соли – сильные электролиты, которые при диссоциации образуют катионы металла
К3РО4 3К+ + РО43-
NH4Cl NH4+ + Cl−
Кислые соли – электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток
NaHCO3 Na+ + HCO3−
Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН−
(FeOH)2SO4 2FeOH+ + SO42−
α1 >> α2
α1 >> α2
HCO3− H+ + CO32−
FeOH+ Fe2+ + OH−
Слайд 14Вещества, растворы которых проводят электрический ток.
Процесс распада электролита на ионы.
Положительно заряженные
Отрицательно заряженные ионы
Электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка.
Электролиты, которые при диссоциации образуют катионы металла и анионы гидроксогрупп ОН−.
Электролиты, которые при диссоциации образуют катионы металла и анионы кислотных остатков.
Количественная характеристика электролитической диссоциации
Молекулы, имеющие два электрических заряда, равных по величине, но противоположных по знаку, и расположенных на некотором расстоянии друг от друга
Автор теории электролитической диссоциации.
Проверьте свои знания
Запишите понятия, соответствующие этим определениям
Слайд 151. Электролиты
2. Электролитическая диссоциация
3. Катионы
4. Анионы
5. Кислоты
6. Основания
7. Соли
8. Степень электролитической диссоциации
9. Диполи
10. С. Аррениус
Ответы
Слайд 16http://www.catalogmineralov.ru – сайт содержит каталог минералов, большую коллекцию фотографий и описание
http://www.elementy.ru – сайт « Элементы большой науки», содержит каталоги и статьи научно-популярных журналов «Химия и жизнь», « Наука и жизнь», «Природа» и др.
http://www.ovitanah.com - сайт посвящен витаминам и микроэлементам, содержит интересную информацию.
http://www.alhimik.ru – сайт «Алхимик» содержит самую разнообразную информацию по химии.
Если интересно…