- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
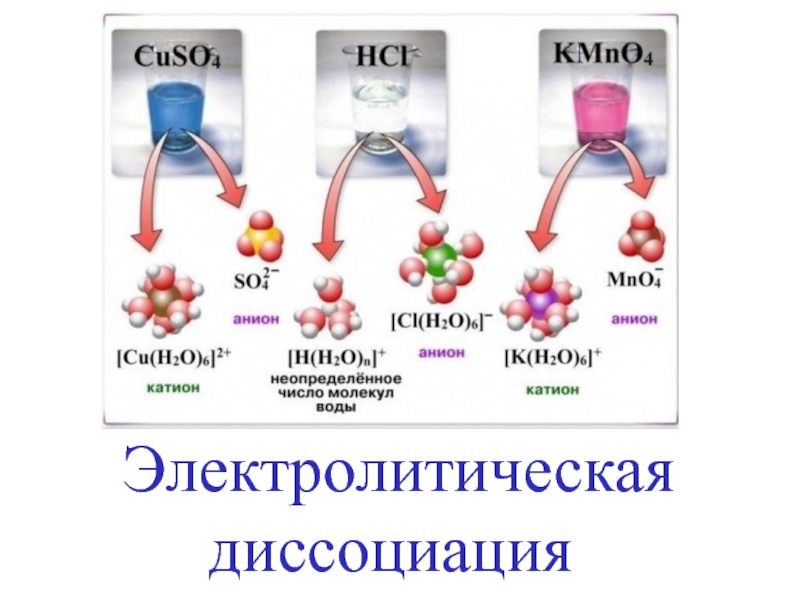
Электролитическая диссоциация презентация
Содержание
- 1. Электролитическая диссоциация
- 2. Девиз урока «Смысл нельзя дать, его нужно найти» Виктор Франкл
- 3. Кто был этот ученый? Он родился в
- 4. История возникновения теории электролитической диссоциации связана с
- 5. вещества, растворы и
- 6. Термины «электролит» в переводе с греческого разлагаемый
- 7. Аррениус занимался изучением электропроводности сильно разбавленных водных
- 8. Причины электролитической диссоциации Сторонники физической теории растворов
- 9. Причины электролитической диссоциации И.А. Каблуков и
- 10. Причины распада вещества на ионы в расплавах
- 11. Причины диссоциации веществ в воде Вода
- 12. Механизм диссоциации веществ с ионной связью Ориентация
- 13. В раствор переходят гидратированные ионы, свойства которых отличаются от свойств негидратированных
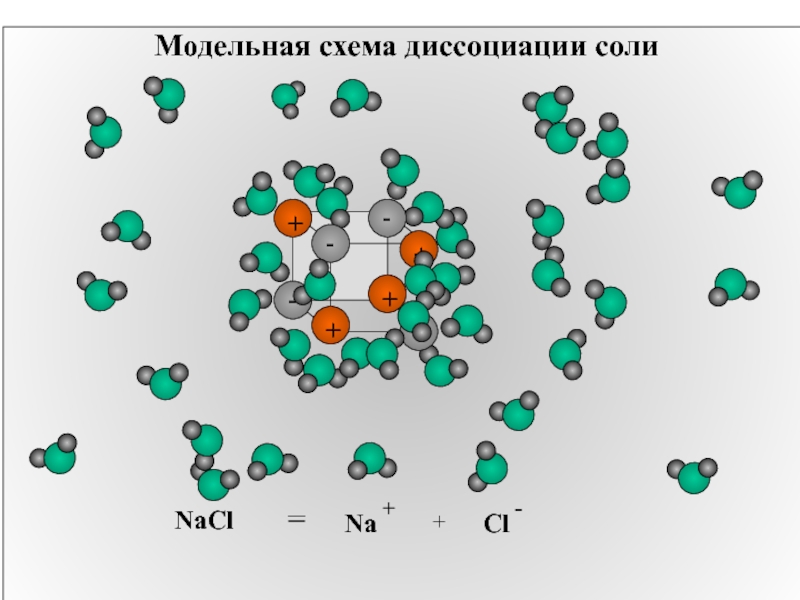
- 14. Модельная схема диссоциации соли NaCl = + Na +
- 15. Механизм диссоциации веществ с ковалентной полярной связью
- 16. Ионная или сильнополярная ковалентная связь Кислоты Основания
- 20. Количественная характеристика электролитической диссоциации α = n/N
- 21. практически полностью диссоцируют
- 22. Основные положения ТЭД Электролитическая диссоциация для слабых
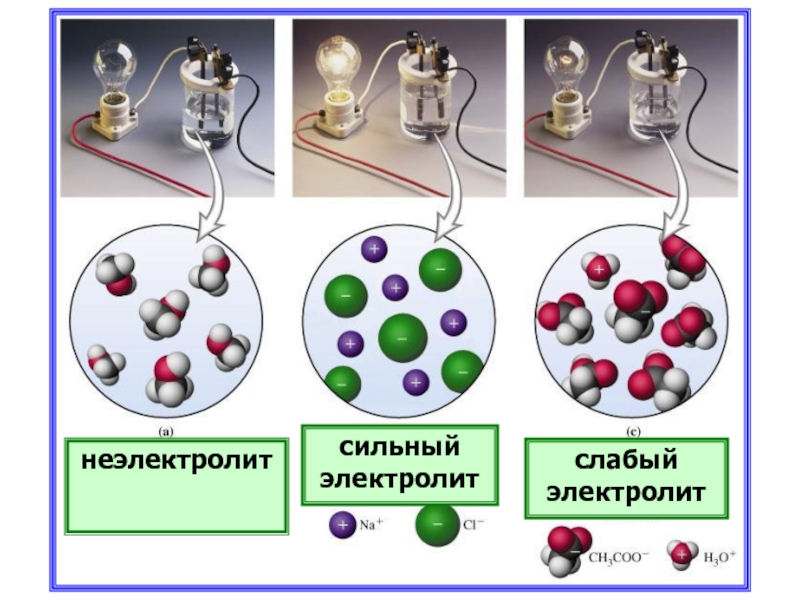
- 23. неэлектролит сильный электролит слабый электролит
- 27. Значение теории электролитической диссоциации ТЭД позволила объяснить
- 28. Значение теории электролитической диссоциации Обосновала механизм многих
- 29. Выводы ТЭД была предложена в 1887 году
- 30. Выводы Степень диссоциации зависит от природы электролита
Слайд 3Кто был этот ученый?
Он родился в 1859 году в старинном шведском
Слайд 4История возникновения теории электролитической диссоциации связана с именем шведского физико-химика Аррениуса.
Сванте Август Аррениус (1859-1927)
Слайд 5
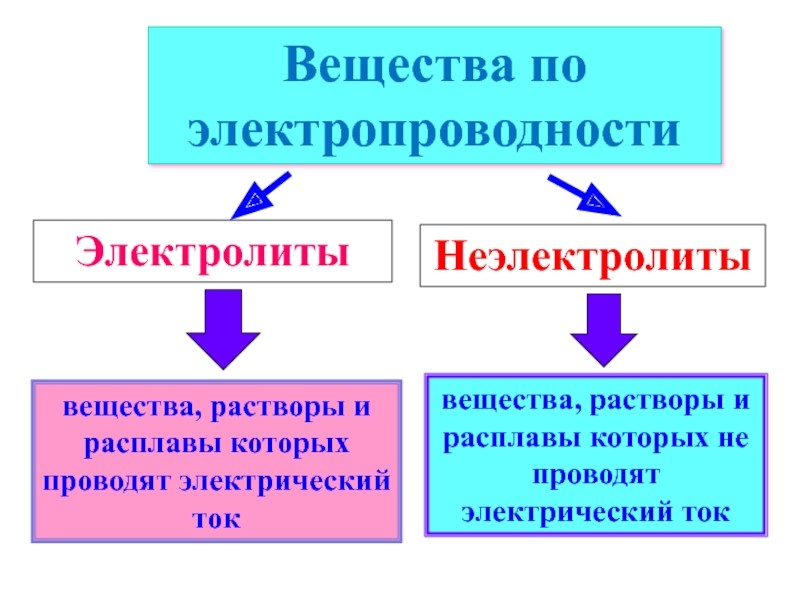
вещества, растворы и расплавы которых проводят электрический ток
Вещества по электропроводности
Электролиты
Неэлектролиты
вещества,
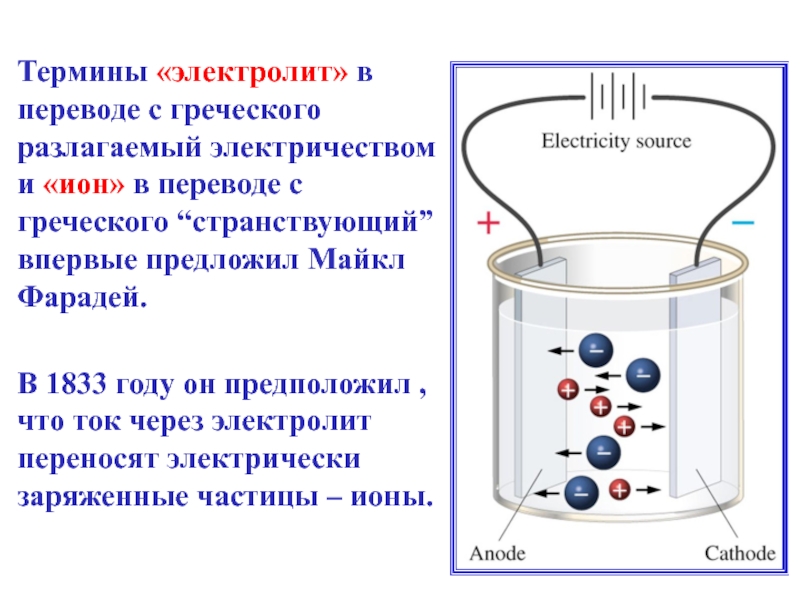
Слайд 6Термины «электролит» в переводе с греческого разлагаемый электричеством и «ион» в
В 1833 году он предположил , что ток через электролит переносят электрически заряженные частицы – ионы.
Слайд 7Аррениус занимался изучением электропроводности сильно разбавленных водных растворов. В мае 1883
Вывод: молекулы электролита диссоциируют на ионы без воздействия тока, причем степень диссоциации растет с разбавлением.
В 1887 году появилась статья Аррениуса «О диссоциации растворенных в воде веществ». Он превратил чисто качественную гипотезу в количественную теорию, которая могла быть проверена экспериментально.
Слайд 8Причины электролитической диссоциации
Сторонники физической теории растворов (Вант-Гофф, Аррениус и Освальд) считали,
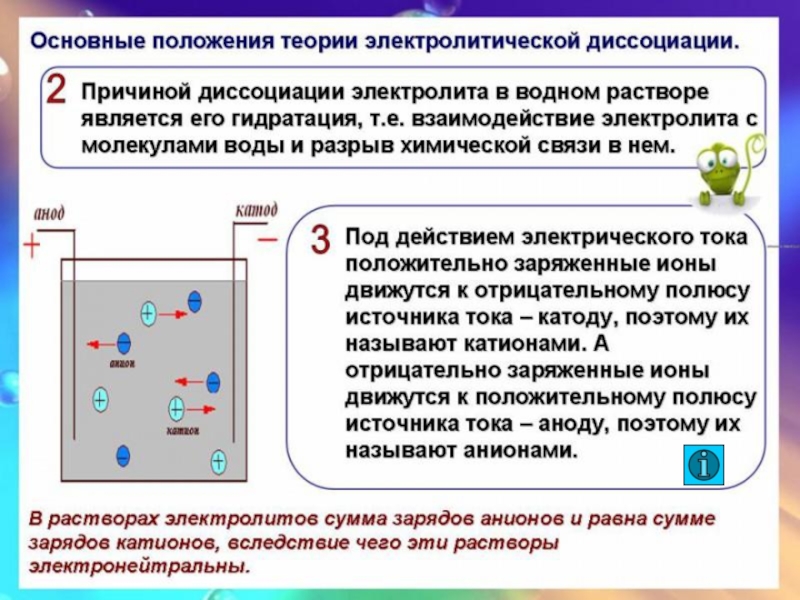
Д.И. Менделеев и его сторонники доказывали, что растворение – результат химического взаимодействия растворенного вещества с молекулами воды.
В результате химического взаимодействия с водой образуются соединения – гидраты.
Слайд 9Причины электролитической диссоциации
И.А. Каблуков и В.А. Кистяковский применили химическую теорию Д.И.
Они показали, что растворение — физико-химический процесс, включающий в себя как образование ионов (теория электролитической диссоциации), так и гидратацию веществ (гидратная теория) молекулами воды.
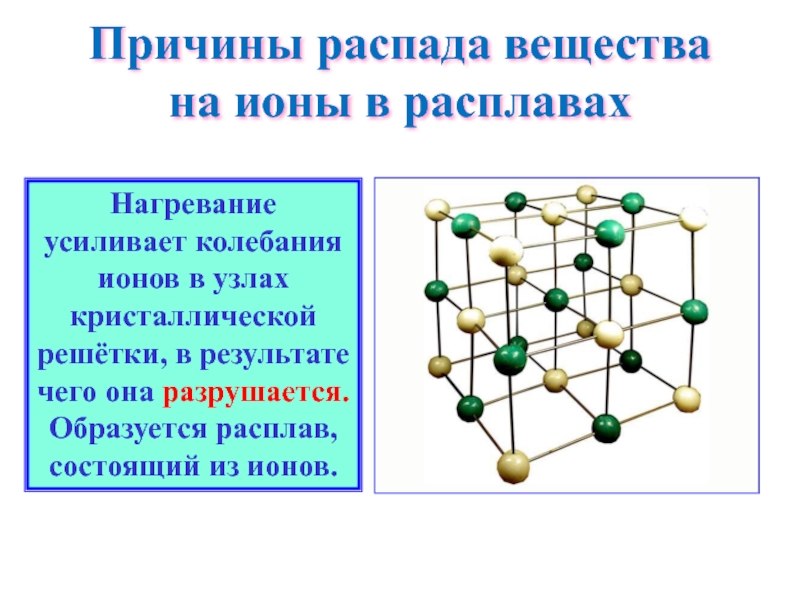
Слайд 10Причины распада вещества на ионы в расплавах
Нагревание усиливает колебания ионов
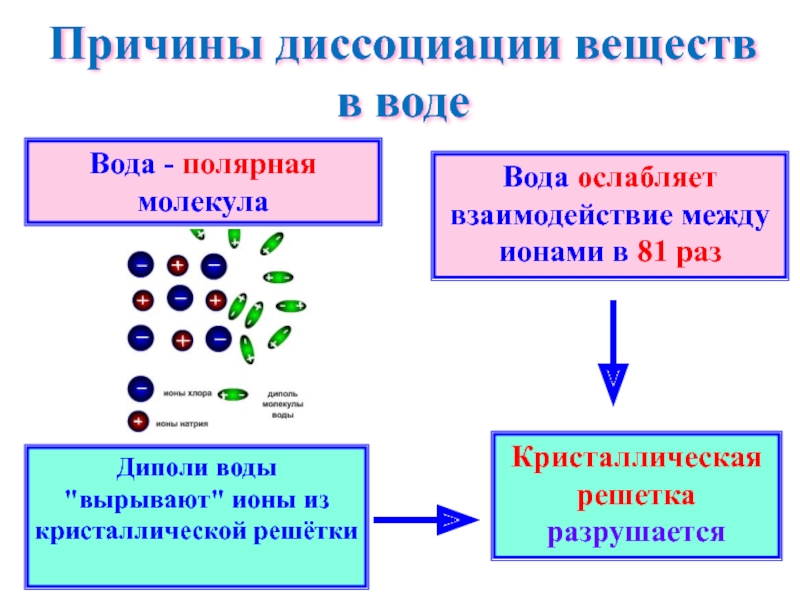
Слайд 11Причины диссоциации веществ в воде
Вода - полярная молекула
Вода ослабляет
Диполи воды "вырывают" ионы из кристаллической решётки
Кристаллическая решетка разрушается
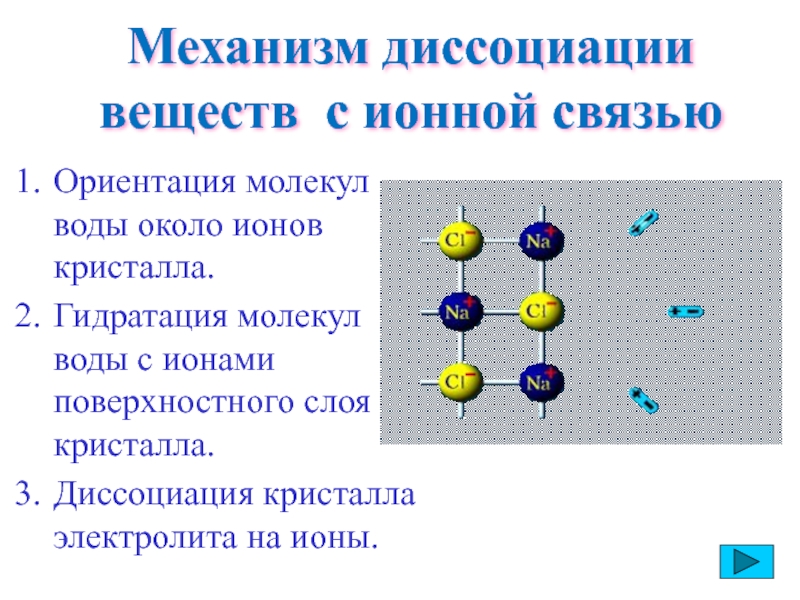
Слайд 12Механизм диссоциации веществ с ионной связью
Ориентация молекул воды около ионов кристалла.
Гидратация
Диссоциация кристалла электролита на ионы.
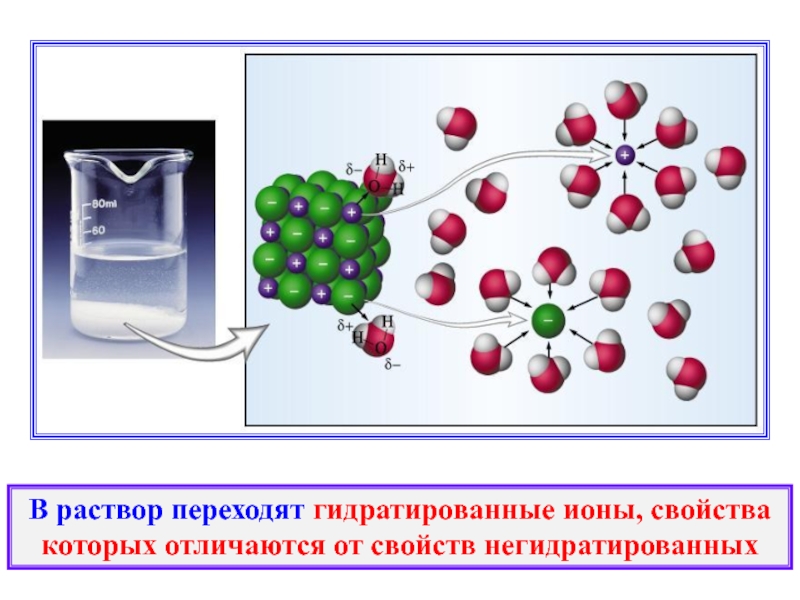
Слайд 13В раствор переходят гидратированные ионы, свойства которых отличаются от свойств негидратированных
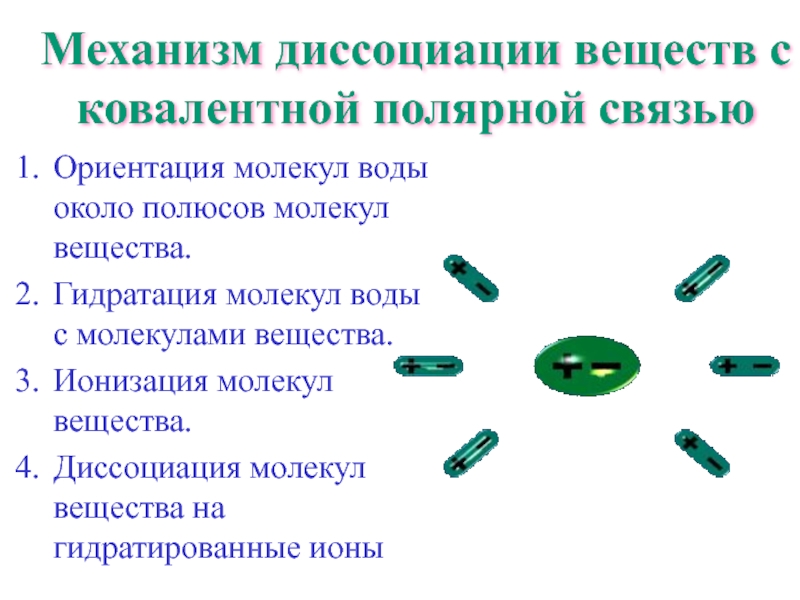
Слайд 15Механизм диссоциации веществ с ковалентной полярной связью
Ориентация молекул воды около полюсов
Гидратация молекул воды с молекулами вещества.
Ионизация молекул вещества.
Диссоциация молекул вещества на гидратированные ионы
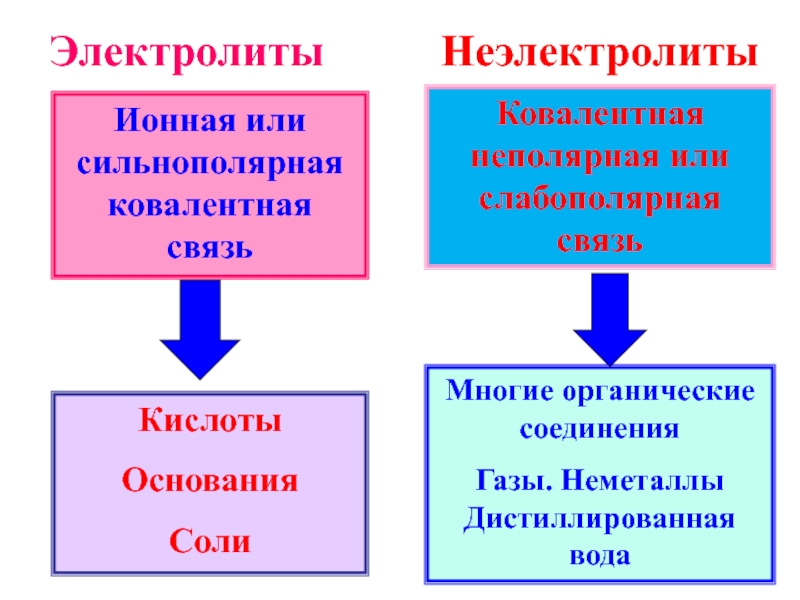
Слайд 16Ионная или сильнополярная ковалентная связь
Кислоты
Основания
Соли
Ковалентная неполярная или слабополярная связь
Многие органические соединения
Газы.
Электролиты
Неэлектролиты
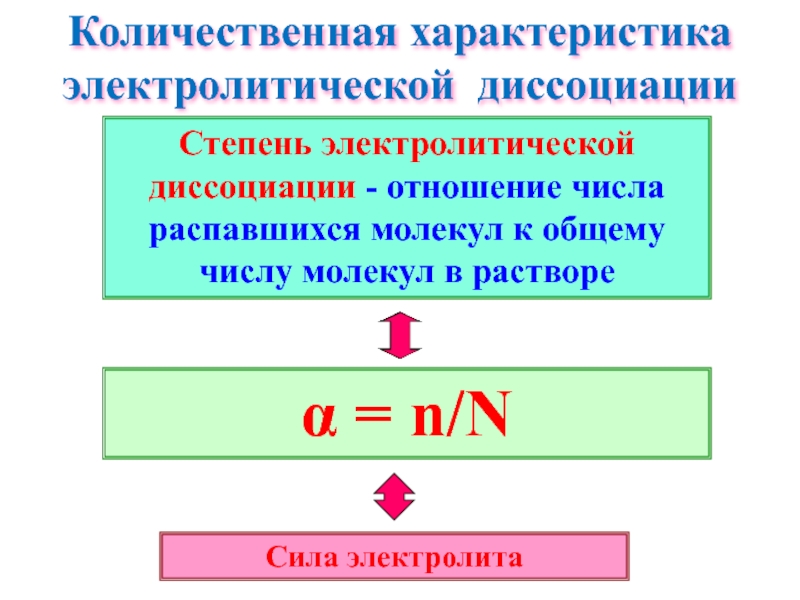
Слайд 20Количественная характеристика электролитической диссоциации
α = n/N
Сила электролита
Степень электролитической диссоциации - отношение
Слайд 21
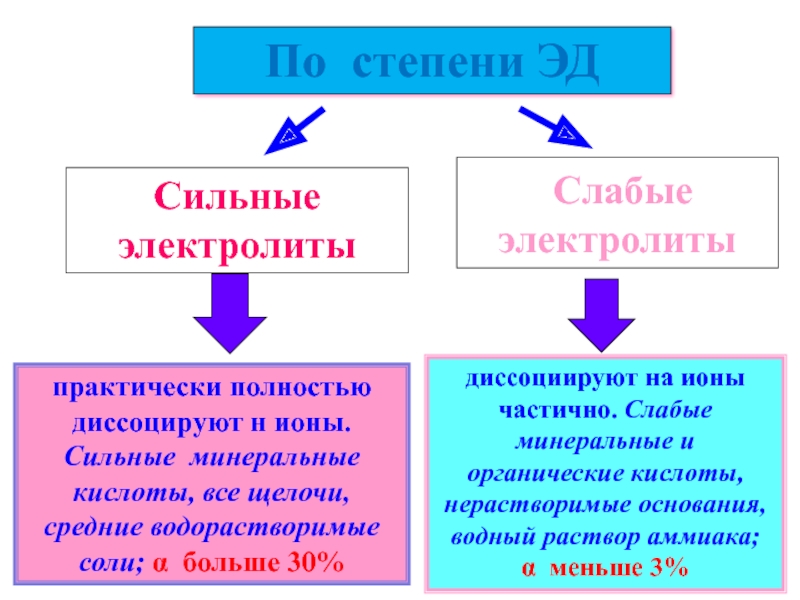
практически полностью диссоцируют н ионы. Сильные минеральные кислоты, все щелочи, средние
По степени ЭД
Сильные электролиты
Слабые электролиты
диссоциируют на ионы частично. Слабые минеральные и органические кислоты, нерастворимые основания, водный раствор аммиака; α меньше 3%
Слайд 22Основные положения ТЭД
Электролитическая диссоциация для слабых электролитов – процесс обратимый. Обратный
Не все электролиты в одинаковой мере диссоциируют на ионы.
Химические свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Слайд 27Значение теории электролитической диссоциации
ТЭД позволила объяснить свойства водных растворов электролитов и
Вместе с законом действующих масс она позволила объяснить все известные практические способы, условия и механизм аналитических реакций (качественный анализ).
Слайд 28Значение теории электролитической диссоциации
Обосновала механизм многих органических реакций и помогла физиологам
Оказала сильное влияние на развитие химического языка и в целом сыграла фундаментальную роль в современном естествознании.
Слайд 29Выводы
ТЭД была предложена в 1887 году шведским ученым Сванте Августом Аррениусом.
Современная теория водных растворов электролитов кроме ТЭД Аррениуса включает представления о
гидратации ионов (И.А. Каблуков, В.А. Кистяковский)
и теорию сильных электролитов (П. Й. Дебай, Э.А.
Хюккель).
Легче всего диссоциируют вещества с ионной связью.
Слайд 30Выводы
Степень диссоциации зависит от природы электролита и его концентрации. По степени
По характеру образующихся ионов различают три типа электролитов: кислоты, основания и соли.
С помощью ТЭД дают определения и описывают свойства кислот, оснований и солей.