- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Синтез высокомолекулярных соединений. Полимеризация презентация
Содержание
- 1. Синтез высокомолекулярных соединений. Полимеризация
- 2. Новые возможности радикальной полимеризации в контролируемом синтезе
- 3. Возможности контролируемой радикальной полимеризации Контроль скорости
- 4. Псевдоживая (контролируемая) радикальная полимеризация Reversible-deactivation radical polymerization
- 5. 1. Обратимое ингибирование Способы "оживления" макромолекул Стабильные
- 6. Кобальт порфирины Спиновые ловушки метилнитрозопропан фенилтретбутилнитрон фенилазатрифенилметан
- 7. 2. Обратимый перенос атома Способы "оживления" макромолекул
- 8. псевдоживая полимеризация с обратимой передачей цепи (ОПЦ)
- 9. 3. Обратимая передача цепи Способы "оживления" макромолекул
- 10. Где в России исследуют закономерности псевдоживых процессов?
- 11. ИНИЦИИРОВАНИЕ Инициирование – превращение небольшой доли молекул
- 12. ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИ
- 13. В зависимости от природы активного центра и
- 14. МОНОМЕРЫ
- 15. ТЕПЛОВЫЕ ЭФФЕКТЫ ПОЛИМЕРИЗАЦИИ И ЭНЕРГИЯ СВЯЗЕЙ тепловой
- 16. ТЕРМОДИНАМИКА ПОЛИМЕРИЗАЦИИ При ΔG
- 17. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ Q: при
- 18. При полимеризации мономеров, двойная связь которых образована
- 19. ЭТИЛЕН Q = 94.3 кДж/моль ФАКТОРЫ, ВЛИЯЮЩИЕ
- 20. ЭНТРОПИЯ ПОЛИМЕРИЗАЦИИ Энтропия характеризует меру упорядоченности системы.
- 21. ВЕРХНЯЯ ПРЕДЕЛЬНАЯ ТЕМПЕРАТУРА ПОЛИМЕРИЗАЦИИ В большинстве случаев
- 22. НИЖНЯЯ ПРЕДЕЛЬНАЯ ТЕМПЕРАТУРА ПОЛИМЕРИЗАЦИИ Если при полимеризации
- 23. ПОЛИМЕРИЗАЦИОННО – ДЕПОЛИМЕРИЗАЦИОННОЕ РАВНОВЕСИЕ между концентрациями мономера,
- 24. Способность мономера к полимеризации наряду с термодинамическими факторами определяется и кинетическими факторами
- 25. РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯ Основные стадии полимеризации: Инициирование Рост
- 26. ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИ
- 27. ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИ
- 28. 1. Термический распад инициаторов азоинициаторы: перекиси:
- 29. МЕХАНИЗМ И КИНЕТИКА ПОЛИМЕРИЗАЦИИ Допущения, принимаемые для
- 30. Рост цепи Реакционная способность мономера и
- 31. ПРАВИЛО АНТИБАТНОСТИ: чем более активен мономер, тем
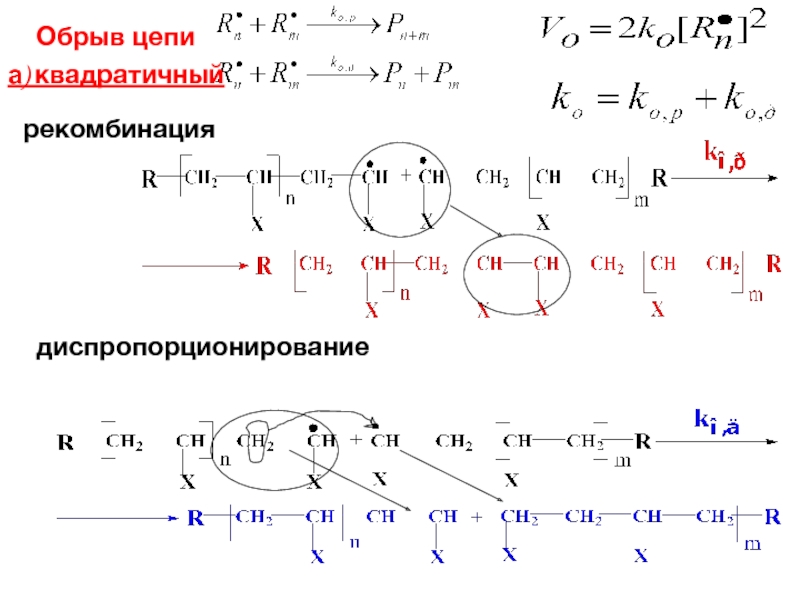
- 32. Обрыв цепи рекомбинация а) квадратичный диспропорционирование
- 33. б) обрыв на молекуле ингибитора
- 34. Передача цепи играет роль в регулировании
- 35. Передача цепи играет роль в регулировании
- 36. КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ Поскольку мономер расходуется
- 37. Доля обрыва цепей диспропорционированием Доля обрыва цепей рекомбинацией 1-α
- 38. Степень полимеризации уменьшается с ростом температуры при Т
- 40. Инициирование: I2→ 2I∙
- 41. Полимеризация при термическом
- 42. ПОЛИМЕРИЗАЦИЯ НА ГЛУБОКИХ КОНВЕРСИЯХ Стадии реакции обрыва:
- 43. Ионная полимеризация
- 44. ИНИЦИИРОВАНИЕ Анионная полимеризация Инициируют металлалкилы, алкоксиды
- 45. Анионная полимеризация Мономеры ( -C=C-)
- 46. АНИОННАЯ ПОЛИМЕРИЗАЦИЯ Основные стадии полимеризации: Инициирование Рост
- 47. Рост цепи Rn-B+ + M →
- 48. Реакции обрыва в анионной полимеризации 1. перенос
- 49. Полимеризация ненасыщенных углеводородов (стирол, диены) отсутствие реакций
- 50. Катионная полимеризация C=C Полимеризуются только
- 51. КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ Основные стадии полимеризации: Инициирование Рост
- 52. ИНИЦИИРОВАНИЕ Катионная полимеризация 1.протонодонорные кислоты
- 53. Присоединение первичных активных частиц к мономеру K+
- 54. Обрыв цепи При катионной полимеризации реакции обрыва
- 55. Передача на мономер играет важнейшую роль в катионной полимеризации
- 56. Передача на растворитель и примеси Передача на
- 57. СОПОЛИМЕРИЗАЦИЯ – совместная полимеризация 2-х или более
- 58. сополимеризация Градиентные: состав макромолекулы изменяется непрерывно вдоль
- 59. Различают : Мгновенную неоднородность, которая
- 60. Композиционная неоднородность макромолекул сополимеров Эксплуатационные свойства бинарных
- 61. Реакция роста цепи ~M1* + M1 →
- 62. k12[M1*][M2]= k21[M2*][M1] Допущения для вывода уравнения состава
- 63. Диаграмма составов сополимеров Если r1>1 и r21, r2
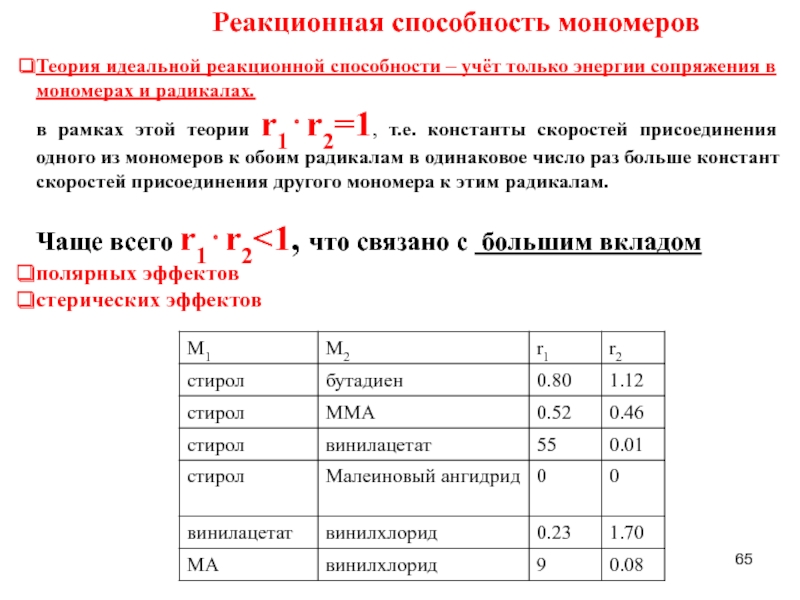
- 64. Радикальная сополимеризация Значения r1 ,
- 65. Реакционная способность мономеров Теория идеальной реакционной способности
- 66. Схема Q-e Полуэмпирическая схема, предложенная Алфреем и
- 67. Анионная сополимеризация Мономеры (М2) с
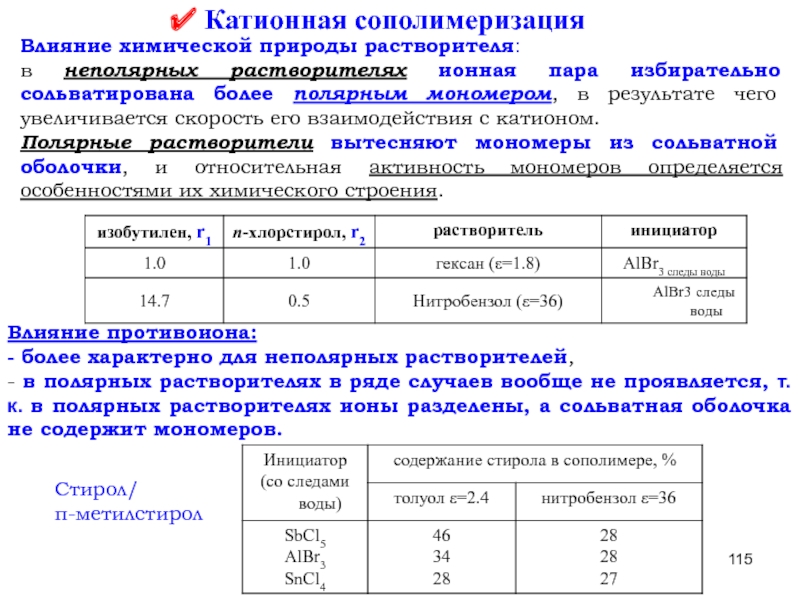
- 68. Катионная сополимеризация Влияние химической природы растворителя:
- 69. Влияние природы противоиона: - более характерно для
- 70. поликонденсация
- 71. Сравнительные характеристики реакций полимеризации и поликонденсации полимеризация
- 72. Поликонденсация – процесс образования макромолекул в результате
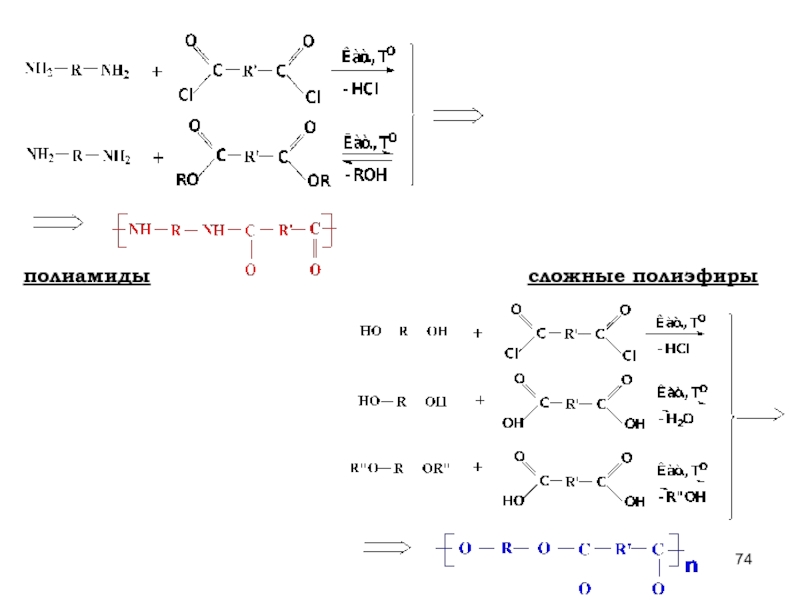
- 73. СОПОЛИКОНДЕНСАЦИЮ (2 и более мономеров) простые полиэфиры полиамиды
- 74. полиамиды сложные полиэфиры
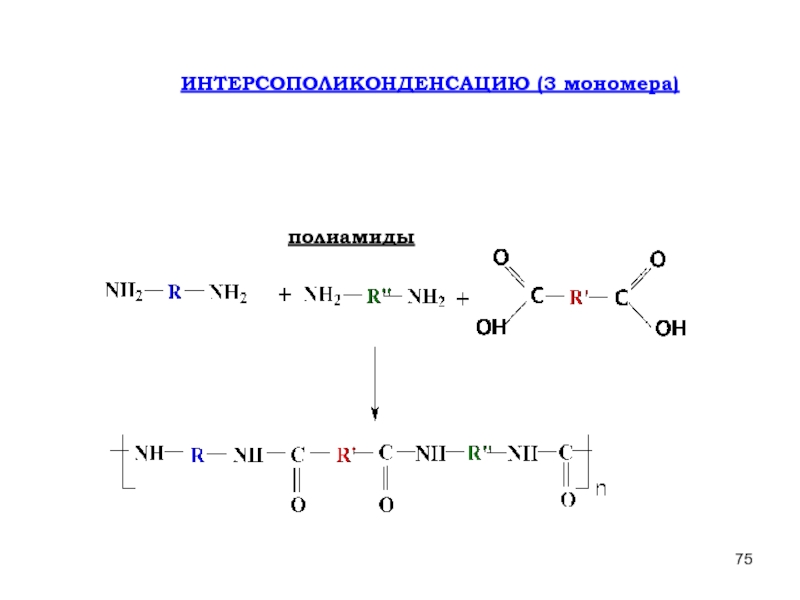
- 75. ИНТЕРСОПОЛИКОНДЕНСАЦИЮ (3 мономера) полиамиды
- 76. По топологии образующихся макромолекул поликонденсацию подразделяют на:
- 77. По значению константы поликонденсационного равновесия K поликонденсацию
- 78. Значения констант равновесия (К) для некоторых случаев поликонденсации Необратимая поликонденсация Обратимая поликонденсация
- 79. Побочные химические реакции , в результате которых
- 80. Кинетика поликонденсации Для поликонденсации характерно исчезновение
- 81. Кинетика поликонденсации Мономеры взяты в эквимолярных количествах
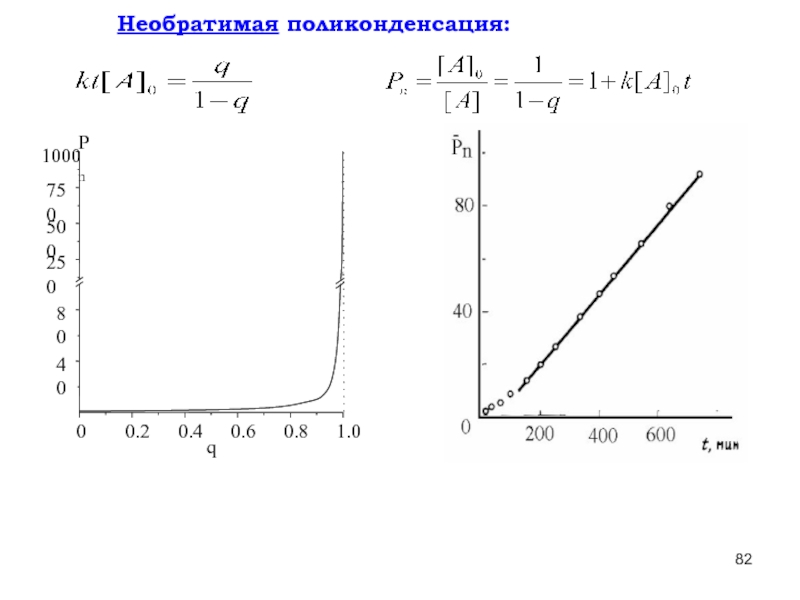
- 82. Необратимая поликонденсация:
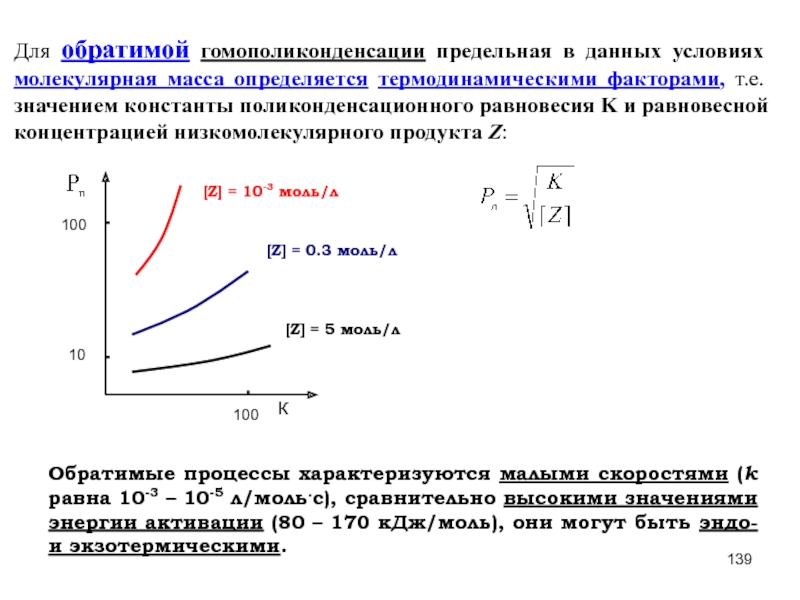
- 83. Для обратимой гомополиконденсации предельная в данных условиях
- 84. Факторы, влияющие на молекулярную массу поликонденсационных полимеров
- 86. ПОЛИПРИСОЕДИНЕНИЕ Реакции проходят без выделения низкомолекулярного продукта !!! Полимочевины Полиуретаны
- 87. Сравнительные характеристики реакций полимеризации и поликонденсации полимеризация
- 88. Конец синтеза ФФФХИ-2015 (химики) дальше задачи
- 89. Как можно достичь одновременного снижения скорости реакции
- 90. КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ Поскольку мономер расходуется
- 91. ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИ
- 92. Какой инициатор надо использовать, чтобы получить
- 93. С какими мономерами (приведите 2 примера)
- 94. 3. Какая из инициирующих систем позволяет получить
- 95. 1. Для каких значений n достигается максимальная
- 96. Конец синтеза
- 98. Для каких значений n достигается максимальная
- 99. 5. Какие надо использовать мономеры, чтобы получить:
- 100. Как изменится длина материальной цепи, если при
- 101. Задачи по синтезу Каков тепловой эффект (Q
- 102. 1. Для каких значений n достигается максимальная
- 106. конец
- 107. СОПОЛИМЕРИЗАЦИЯ – совместная полимеризация 2-х или более
- 108. Эксплуатационные свойства бинарных сополимеров зависят от:
- 109. Реакция роста цепи ~M1* + M1 →
- 110. k12[M1*][M2]= k21[M2*][M1] Допущения для вывода уравнения состава
- 111. Диаграмма состава сополимера Если r1>1 и r21, r2
- 112. Радикальная сополимеризация Значения r1 ,
- 113. Реакционная способность мономеров Теория идеальной реакционной способности
- 114. Схема Q-e Полуэмпирическая схема, предложенная Алфреем и
- 115. Катионная сополимеризация Влияние химической природы растворителя:
- 116. Анионная сополимеризация Мономеры с сильными
- 117. КИНЕТИКА ПОЛИМЕРИЗАЦИИ И МОЛЕКУЛЯРНЫЕ МАССЫ
- 118. Изменение природы активного центра, может сопровождаться снижением
- 119. Влияние растворителя и противоиона
- 120. Анионная полимеризация Стереоспецифическая полимеризация диенов под действием
- 121. Конфигурационную структуру макромолекул можно контролировать, регулируя условия
- 122. Механизм полимеризации на катализаторах Циглера-Натта Биметаллический механизм
- 123. КИНЕТИКА ПОЛИМЕРИЗАЦИИ И МОЛЕКУЛЯРНЫЕ МАССЫ
- 124. Поликонденсация – процесс образования макромолекул в результате
- 125. СОПОЛИКОНДЕНСАЦИЮ (2 и более мономеров) простые полиэфиры полиамиды
- 126. полиамиды сложные полиэфиры
- 127. ИНТЕРСОПОЛИКОНДЕНСАЦИЮ (3 мономера) полиамиды
- 128. По топологии образующихся макромолекул поликонденсацию подразделяют на:
- 129. По значению константы поликонденсационного равновесия K поликонденсацию
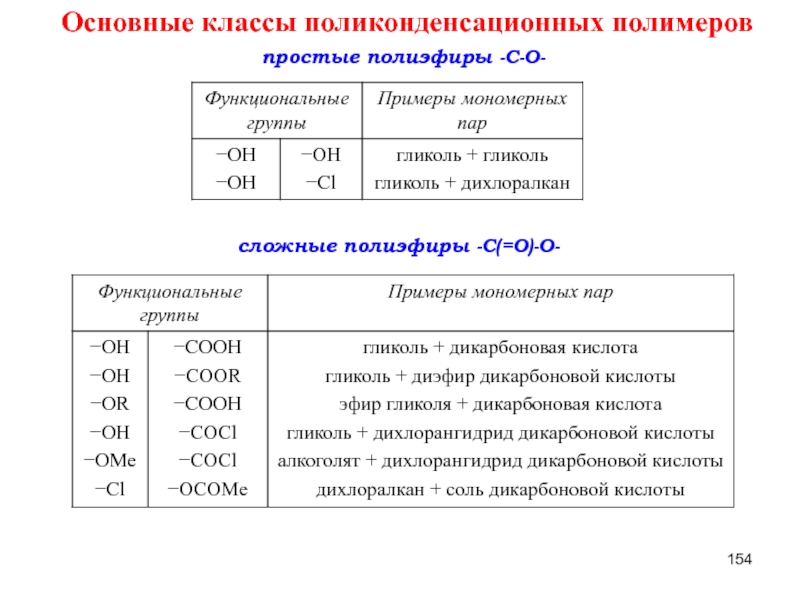
- 130. Основные классы поликонденсационных полимеров простые полиэфиры -C-O- сложные полиэфиры -C(=O)-O-
- 131. полиуретаны –NH-C(=O)-O- полиамиды –NH-C(=O)- полимочевины –NH-C(=O)-NH-
- 132. Некоторые конденсационные полимеры полиэтиленадипинат полиэтилентерефталат
- 133. Ароматические полиимиды: Полиэфиримиды: Термостойкие
- 134. Значения констант равновесия (К) для некоторых случаев поликонденсации Необратимая поликонденсация Обратимая поликонденсация
- 135. Побочные химические реакции , в результате которых
- 136. Кинетика поликонденсации Для поликонденсации характерно исчезновение
- 137. Кинетика поликонденсации Мономеры взяты в эквимолярных количествах.
- 138. Необратимая поликонденсация:
- 139. Для обратимой гомополиконденсации предельная в данных условиях
- 140. Факторы, влияющие на молекулярную массу поликонденсационных полимеров
- 142. Некоторые конденсационные полимеры полиэтиленадипинат полиэтилентерефталат
- 143. Ароматические полиимиды: Полиэфиримиды: Термостойкие
- 144. ПОЛИПРИСОЕДИНЕНИЕ Реакции проходят без выделения низкомолекулярного продукта !!! Полимочевины Полиуретаны
- 145. Конец синтеза
- 146. полиуретаны –NH-C(=O)-O- полиамиды –NH-C(=O)- полимочевины –NH-C(=O)-NH-
- 152. Рост цепи M + Rn+X-
- 153. Рост цепи на свободных ионах характеризуется значением
- 154. Основные классы поликонденсационных полимеров простые полиэфиры -C-O- сложные полиэфиры -C(=O)-O-
- 155. Полимеризация ненасыщенных мономеров с полярными заместителями (акриловые
- 156. В средах умеренной полярности ионогенные инициаторы
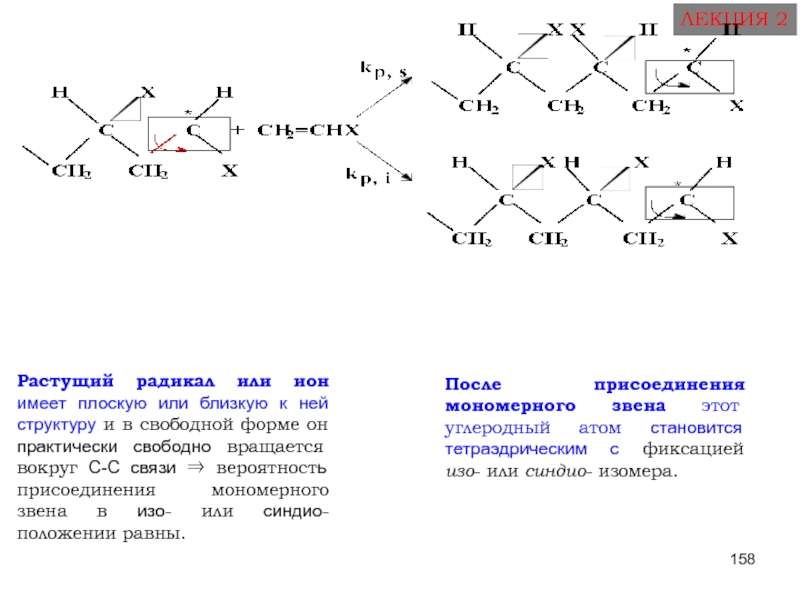
- 157. СТЕРЕОСПЕЦИФИЧЕСКАЯ ПОЛИМЕРИЗАЦИЯ ЛЕКЦИЯ 2 полимеризация, в
- 158. ЛЕКЦИЯ 2 Растущий радикал или ион
- 159. Катионная полимеризация Ионная полимеризация Ионная полимеризация
- 160. Координационно-ионная полимеризация В большинстве каталитических систем
- 161. Сравнительные характеристики реакций полимеризации и поликонденсации полимеризация
Слайд 1СИНТЕЗ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ
мономеры
макромолекула
ПОЛИМЕРИЗАЦИЯ
Полимеризация – процесс получения высокомолекулярных соединений, при котором макромолекула
Это цепная реакция, в которой развитие кинетической цепи сопровождается ростом материальной цепи макромолекулы.
Слайд 2Новые возможности радикальной полимеризации в контролируемом синтезе макромолекул
Классическая радикальная полимеризация
инициирование I
R1 . + M → P .
рост P . + nM → Pn+1 .
обрыв Pp . + Pn. → P
передача P . + SH → PH +S .
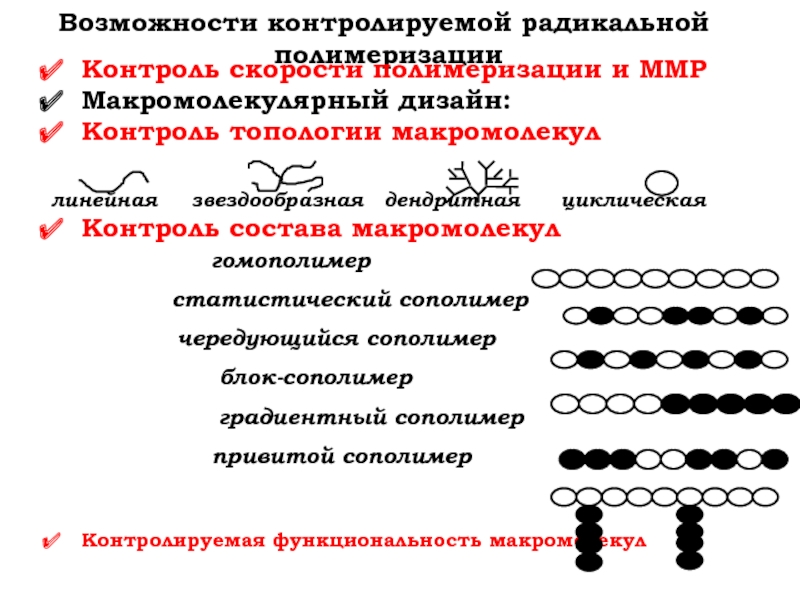
Слайд 3Возможности контролируемой радикальной
полимеризации
Контроль скорости полимеризации и ММР
Макромолекулярный дизайн:
Контроль топологии макромолекул
линейная звездообразная дендритная циклическая
Контроль состава макромолекул
гомополимер
статистический сополимер
чередующийся сополимер
блок-сополимер
градиентный сополимер
привитой сополимер
Контролируемая функциональность макромолекул
Слайд 4Псевдоживая (контролируемая) радикальная полимеризация Reversible-deactivation radical polymerization
"Оживление" цепей и их участие
Идея: замена необратимого квадратичного обрыва на обратимый регулируемый
Мономер тот же или другие, полимеризующиеся по радикальному механизму
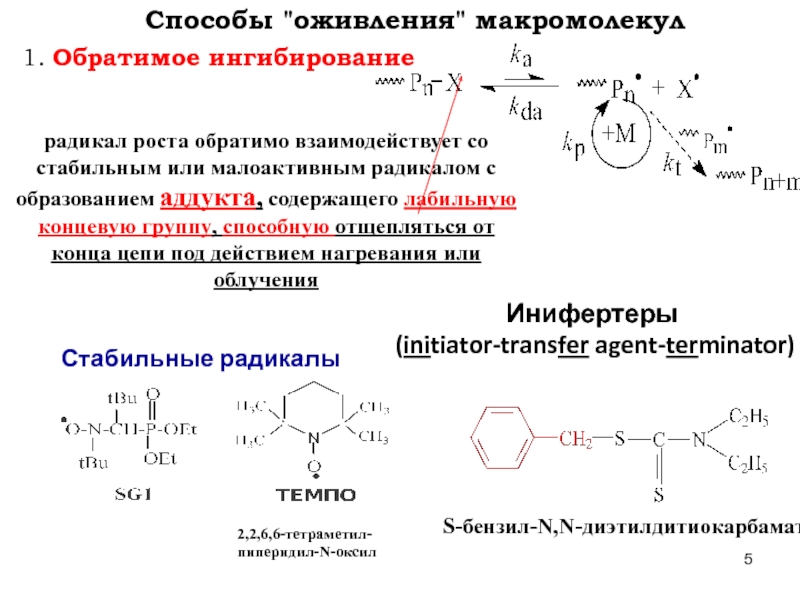
Слайд 51. Обратимое ингибирование
Способы "оживления" макромолекул
Стабильные радикалы
радикал роста обратимо взаимодействует со стабильным
2,2,6,6-тетраметил-
пиперидил-N-оксил
Инифертеры
(initiator-transfer agent-terminator)
S-бензил-N,N-диэтилдитиокарбамат
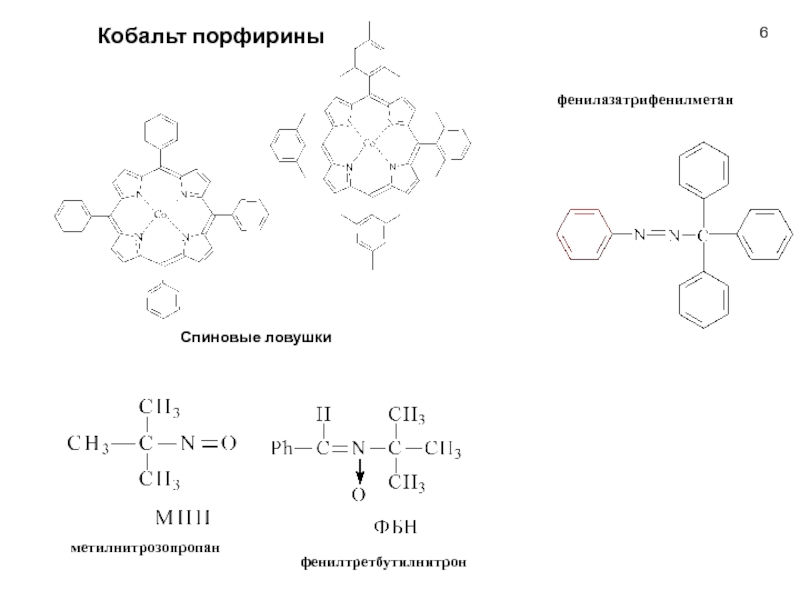
Слайд 6Кобальт порфирины
Спиновые ловушки
метилнитрозопропан
фенилтретбутилнитрон
фенилазатрифенилметан
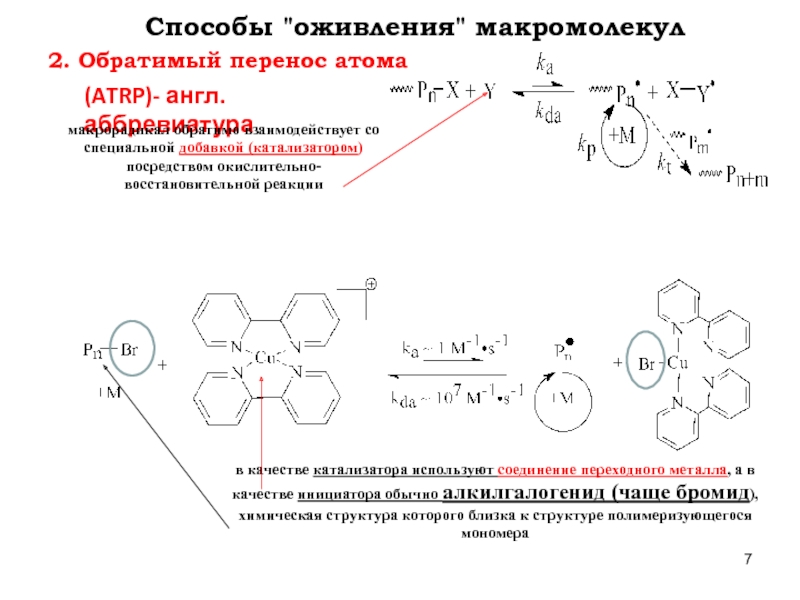
Слайд 72. Обратимый перенос атома
Способы "оживления" макромолекул
(ATRP)- англ.аббревиатура
макрорадикал обратимо взаимодействует со специальной
в качестве катализатора используют соединение переходного металла, а в качестве инициатора обычно алкилгалогенид (чаще бромид), химическая структура которого близка к структуре полимеризующегося мономера
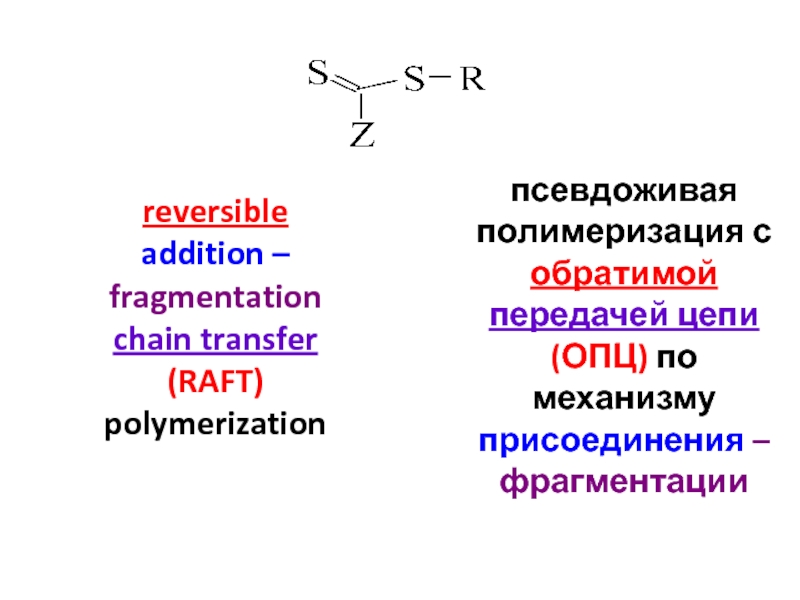
Слайд 8псевдоживая полимеризация с обратимой передачей цепи (ОПЦ) по механизму присоединения –
reversible addition – fragmentation chain transfer
(RAFT)
polymerization
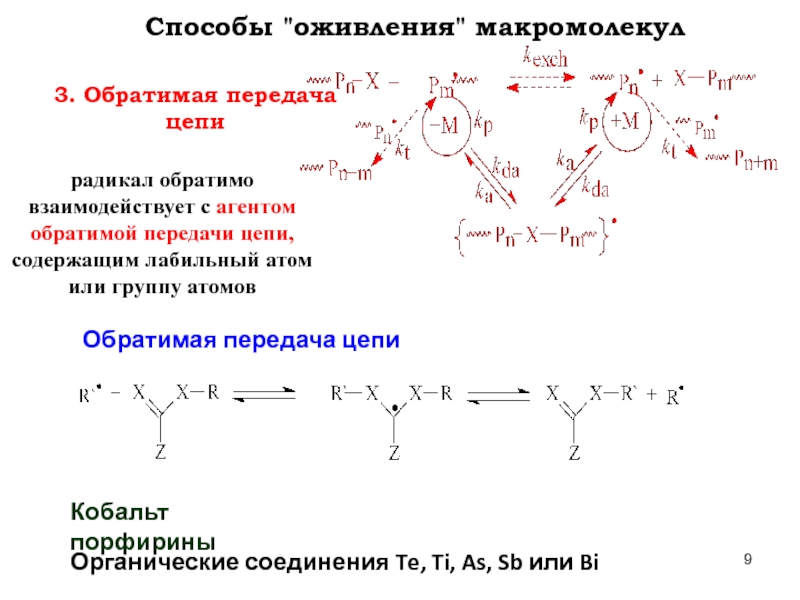
Слайд 93. Обратимая передача цепи
Способы "оживления" макромолекул
радикал обратимо взаимодействует с агентом обратимой
Обратимая передача цепи
Кобальт порфирины
Органические соединения Te, Ti, As, Sb или Bi
Слайд 11ИНИЦИИРОВАНИЕ
Инициирование – превращение небольшой доли молекул мономера в активные центры под
Радикальная полимеризация
1. Термический распад инициаторов
азоинициаторы: перекиси:
азо-бис-изобутиронитрил перекись бензоила
2. Фотохимическое инициирование
чистый мономер M+hν → M*
фотолитическая диссоциация инициаторов I+hν → I*
фотосенсибилизаторы (бензофенон) Z+hν → Z*
Z*+C → Z+C*
C* → R∙+R'∙
3. Инициирование окислительно-восстановительными системами
H2O2 + Fe2+→ HO- +HO∙ +Fe3+ реактив Фентона
ROOR + Fe2+→ RO- + RO∙ (Cr2+, V2+, Ti3+, Co2+)
RCH2OH + Ce4+ → RC∙HOH + H+ + Ce3+
-O3S-O-O-SO3- + S2O32- → SO42- +SO4∙ +S2O3∙
C6H5NR2 + C6H5CO(O)-OC(O)C6H5 → C6H5N+∙R2 + C6H5C(O)O∙ + C6H5C(O)O-
Слайд 12ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИ
Кинетическая цепь ν – число молекул
Материальная цепь (среднечисловая степень полимеризации) Pn – число элементарных актов присоединения мономеров на один акт гибели радикала Rn∙ при обрыве и передаче цепи
Слайд 13В зависимости от природы активного центра и от механизма акта роста
РАДИКАЛЬНУЮ - активный центр - свободный радикал – частица с неспаренным электроном. (радикал роста, макрорадикал)
КАТИОННУЮ - концевой атом растущей цепи имеет полный положительный заряд
АНИОННУЮ - концевой атом растущей цепи имеет полный отрицательный заряд
КООРДИНАЦИОННО-ИОННУЮ - если противоион, входящий в состав активного центра, принимает участие в акте роста, образуя с присоединяющейся молекулой мономера координационный комплекс или циклическое переходное состояние
Слайд 14МОНОМЕРЫ
Виниловые мономеры CH2=CH-X
Винилиденовые мономеры CH2=C(X)-Y
X, Y - алкил, галоген, COOH, COOR, OCOR, CN, CONH2, C6H5, арил, −CH=CH2
- образуются высокомолекулярные продукты, если использованы:
- образуются олигомерные продукты, если использованы:
Аллиловые мономеры CH2=CH-CH2-X
Виниловые эфиры CH2=CH-OR
- не полимеризуются, если использованы :
Виниленовые мономеры CHX=CHX (за исключением X = F)
Соединения с кратной связью С = гетероатом
Слайд 15ТЕПЛОВЫЕ ЭФФЕКТЫ ПОЛИМЕРИЗАЦИИ И ЭНЕРГИЯ СВЯЗЕЙ
тепловой эффект химической реакции (ΔQ =
Полимеризация по двойной С=С связи
(исчезает 1 двойная связь и образуются 2 одинарных связей)
Тепловой эффект реакции при постоянном давлении:
Q = 2Dод – Dдв (D – энергия диссоциации связи)
Полимеризация по кратным связям
а) С = С
б) С = гетероатом (О)
( мало используют)
Полимеризация с раскрытием цикла
Слайд 16ТЕРМОДИНАМИКА ПОЛИМЕРИЗАЦИИ
При ΔG
Термодинамическая возможность образования макромолекул при постоянном давлении описывается уравнением изменения изобарно-изотермического потенциала реакционной системы G:
ΔG = ΔH - TΔS
ΔH – изменение энтальпии системы (ΔH = − ΔQ),
Т – абсолютная температура
ΔS – изменение энтропии системы
Слайд 17ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ Q:
при полимеризации виниловых мономеров:
1. Объемные боковые
2. Уменьшение электронной плотности на двойной связи способствует снижению энергии двойной связи в мономере и, как следствие, ⇒ Q увеличивается
3. Увеличение энергии двойной связи вследствие сопряжения в мономере ⇒ Q уменьшается
При полимеризации с раскрытием цикла природа связей не изменяется и Q определяется напряженностью цикла (разность внутренних энергий цикла и линейной структуры), которая зависит от его размеров.
Полимеризация с раскрытием цикла
Слайд 18При полимеризации мономеров, двойная связь которых образована атомом углерода и гетероатомом,
Полимеризация по двойной связи С=гетероатом
ЭТИЛЕН Q = 94.3 кДж/моль
CH2O Q = 69.9 кДж/моль
CH3CHO Q = 46.1 кДж/моль объемный заместитель
CF3CHO Q = 64.5 кДж/моль взаимодействие электронов заместителя и двойной связи
CCl3CHO Q = 68.7 кДж/моль
Слайд 19ЭТИЛЕН Q = 94.3 кДж/моль
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ Q:
1. Объемные боковые
Бутен-1 Q = 85.9 кДж/моль
Метилакрилат Q = 78.8 кДж/моль
Изобутилен Q = 54.5 кДж/моль
2. Взаимодействие электронов заместителя и двойной связи:
при уменьшении плотности электронов на двойной связи энергия двойной связи в мономере уменьшается ⇒ Q увеличивается
Винилхлорид Q = 130 кДж/моль
Винилиденфторид Q = 147 кДж/моль
Тетрафторэтилен Q = 172 кДж/моль
НО!!!
Винилиденхлорид Q = 101 кДж/моль (см. п.1)
3. Увеличение энергии диссоциации двойной связи вследствие сопряжения в мономере ⇒ Q уменьшается
Стирол Q = 75.8 кДж/моль
α-Метилстирол Q = 33.5 кДж/моль (см. п.1)
4. Сопряжение двойных связей в полимере ⇒ Q увеличивается
Ацетилен Q = 75.8 кДж/моль
Слайд 20ЭНТРОПИЯ ПОЛИМЕРИЗАЦИИ
Энтропия характеризует меру упорядоченности системы.
ΔS = ΔSпост. + ΔSвращ. +
Уменьшение энтропии при полимеризации происходит главным образом вследствие:
- потери поступательных степеней свободы и вращательного движения молекул как целого,
- появления степени свободы внутренних вращений звеньев макромолекулы.
ΔS слабо зависит от химической природы виниловых и винилиденовых мономеров
При полимеризации гетероциклов свобода внутренних вращений при раскрытии цикла может увеличиться настолько, что перекроет эффект уменьшения свободы поступательного движения ⇒ ΔS может возрасти
ε-Капролактам ΔS = 4.6 Дж/моль⋅К
Стирол ΔS = - 196 Дж/моль⋅К
Слайд 21ВЕРХНЯЯ ПРЕДЕЛЬНАЯ ТЕМПЕРАТУРА ПОЛИМЕРИЗАЦИИ
В большинстве случаев при полимеризации ΔH < 0
с повышением температуры (Т) ΔG увеличивается
При определенной температуре, называемой верхней предельной температурой полимеризации (Тпр)
Тпр ⇒ ΔGТ = ΔHТ − ТпрΔSТ = 0 ⇒ Тпр = ΔHТ/ΔSТ
1. T<Тпр образование высокомолекулярного вещества термодинамически возможно.
2. T > Тпр более выгодна деполимеризация
3. Т=Тпр устанавливается полимеризационно– деполимеризационное равновесие.
α-Метилстирол Тпр = 67оС Q = 33.5 кДж/моль
Формальдегид (г) Тпр = 119оС Q = 69.9 кДж/моль
Метилметакрилат Тпр = 197оС Q = 58.2 кДж/моль
Тетрафторэтилен Тпр = 1097оС Q = 172 кДж/моль
Слайд 22НИЖНЯЯ ПРЕДЕЛЬНАЯ ТЕМПЕРАТУРА ПОЛИМЕРИЗАЦИИ
Если при полимеризации ΔH > 0 и ΔS
При температуре, называемой нижней предельной температурой полимеризации
Тпр ⇒ ΔGТ = ΔHТ − ТпрΔSТ = 0 ⇒ Тпр = ΔHТ/ΔSТ
1. T < Тпр более выгодна деполимеризация
2. T > Тпр идет полимеризация.
3. Т=Тпр устанавливается полимеризационно–деполимеризационное равновесие.
Сера, Селен
Слайд 23ПОЛИМЕРИЗАЦИОННО – ДЕПОЛИМЕРИЗАЦИОННОЕ РАВНОВЕСИЕ
между концентрациями мономера, макрорадикала Rn и
макрорадикала Rn+1
при
Допущения:
1) Степень полимеризации Pn>>1
2) Активность Rn* не зависит от Pn
Слайд 24Способность мономера к полимеризации наряду с термодинамическими факторами определяется и
кинетическими
Слайд 25РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯ
Основные стадии полимеризации:
Инициирование
Рост цепи необходимы для кинетической характеристики
Обрыв цепи
Передача цепи
Инициирование
а) генерирование радикалов R. из инициатора I
б) взаимодействие радикала R. с мономером
Часть радикалов R. может расходоваться на побочные реакции, для учета этого вводят параметр эффективности инициирования f, равный отношению числа радикалов, участвовавших в реакции (б) к числу радикалов, образовавшихся по реакции (а).
Скорость инициирования Vи = kи 2f [I]
Слайд 26ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИ
Кинетическая цепь ν – число молекул
Материальная цепь (среднечисловая степень полимеризации) Pn – число элементарных актов присоединения мономеров на один акт гибели радикала Rn∙ при обрыве и передаче цепи
Слайд 27ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИ
Кинетическая цепь ν – число молекул
Материальная цепь (среднечисловая степень полимеризации) Pn – число элементарных актов присоединения мономеров на один акт гибели радикала Rn∙ при обрыве и передаче цепи
Слайд 281. Термический распад инициаторов
азоинициаторы: перекиси:
азо-бис-изобутиронитрил перекись бензоила
2. Фотохимическое инициирование
3. Инициирование окислительно-восстановительными
H2O2 + Fe2+→ HO- +HO∙ +Fe3+ реактив Фентона
C6H5NR2 + C6H5CO(O)-OC(O)C6H5 → C6H5N+∙R2 + C6H5C(O)O∙ + C6H5C(O)O-
Слайд 29МЕХАНИЗМ И КИНЕТИКА ПОЛИМЕРИЗАЦИИ
Допущения, принимаемые для вывода кинетических уравнений полимеризации
Малые конверсии
Pn >>1 (действительно идёт реакция полимеризации)
3. Активность растущих макромолекул не зависит от их степени полимеризации (принцип Флори)
4. Если время жизни активных частиц мало по сравнению со временем полимеризации ⇒ используют принцип квазистационарности – скорость инициирования равна скорости обрыва цепи
Слайд 30Рост цепи
Реакционная способность мономера и макрорадикала определяется
Сопряжением кратной сязи
Полярностью заместителя
Объёмом заместителя (стерический фактор)
Сопряжение с заместителем снижает активность макрорадикала в большей степени, чем повышает активность мономера.
АКТИВНЫЕ МОНОМЕРЫ: с большой энергией сопряжения (мономеры, у которых двойная связь сопряжена с ненасыщенной группой заместителя).
НЕАКТИВНЫЕ МОНОМЕРЫ: сопряжение отсутствует или его энергия мала.
Слайд 31ПРАВИЛО АНТИБАТНОСТИ: чем более активен мономер, тем менее активен образовавшийся из
Реакционная способность радикалов (и соответственно kp) уменьшается в ряду:
X = -OAlk > -OCOCH3 > -Alk > -COOCH3 > -CN > -CH=CH2 > -C6H5
16
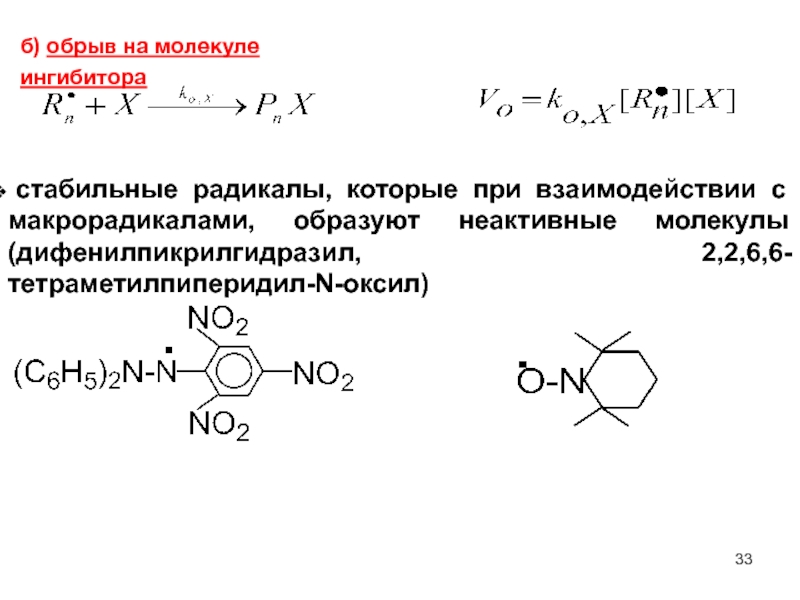
Слайд 33б) обрыв на молекуле ингибитора
стабильные радикалы, которые при взаимодействии
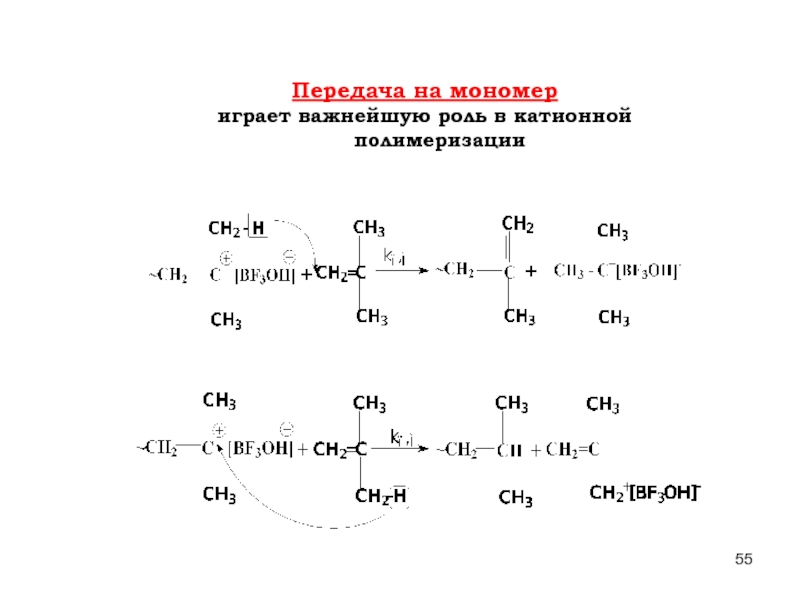
Слайд 34Передача цепи играет роль в регулировании длины материальной цепи (степени
На растворитель (S)
На мономер (М)
Слайд 35Передача цепи играет роль в регулировании длины материальной цепи (степени
На другую макромолекулу
Слайд 36
КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ
Поскольку мономер расходуется в основном на стадии роста, то
Скорость полимеризации пропорциональна [I]0.5 и [M]
Скорость полимеризации увеличивается с ростом температуры при Т<<Тпр
Условие квазистационарности
Слайд 38
Степень полимеризации уменьшается с ростом температуры при Т
Слайд 40Инициирование: I2→ 2I∙
Вырожденная (деградационная) передача цепи на мономер, который превращается в
Скорость квадратичного обрыва радикалов в этих условиях много меньше скорости передачи цепи на мономер, поэтому условие квазистационарности записывается:
Vин=Vп kин[I]=kпм[R∙][M]
Должна быть, НО!!!
Полимеризация аллиловых мономеров.
Неактивный аллильный радикал
Мономер не участвует в полимеризации
Слайд 41
Полимеризация при термическом инициировании:
Vин=Vo kин[M]2=ko[R∙]2
Полимеризация в присутствии ингибитора
Vин=Vo
27
Слайд 42ПОЛИМЕРИЗАЦИЯ НА ГЛУБОКИХ КОНВЕРСИЯХ
Стадии реакции обрыва:
Диффузия центров масс индивидуальных макрорадикалов
Сегментальная диффузия
Химическая реакция макрорадикалов с образованием макромолекулы
Слайд 44ИНИЦИИРОВАНИЕ
Анионная полимеризация
Инициируют металлалкилы, алкоксиды и амиды металлов, щелочи и другие
При использовании щелочных металлов или систем на основе щелочного металла с полициклическими углеводородами (дифенил, нафталин, антрацен) инициирование происходит по механизму переноса электрона. В результате образуются анион-радикалы мономера, которые рекомбинируют с образованием дианиона.
Слайд 45 Анионная полимеризация
Мономеры ( -C=C-)
Олефины с ярко выраженными электроноакцепторными
CH2=C(X)-Н (X - NO2, COOR, CN, C6H5, арил, −CH=CH2
C=О
Среди ненасыщенных кислородсодержащих мономеров высокую активность проявляют альдегиды
Циклические мономеры
циклические простые эфиры: под действием основных катализаторов полимеризуются лишь напряженные окиси 3 – 5-членные
циклические сложные эфиры (лактоны) и амиды (лактамы)
Слайд 46АНИОННАЯ ПОЛИМЕРИЗАЦИЯ
Основные стадии полимеризации:
Инициирование
Рост цепи
Обрыв цепи
Передача цепи
Инициирование − присоединение к мономеру
а) части молекулы инициатора (A –B+) + M → AM- + B+ (алкилы, алкоксиды щелочных металлов)
Б) свободного аниона A- + M → AM- (NaNH2 в NH3 (жидк.))
в) перенос на молекулу мономера электрона с инициирующего анион-радикала A. + M → AM. (щелочные металлы с полициклическими ароматическими углеводородами )
Г)металла Ме + M → Ме+ + M. (щелочные металлы в эфирных растворителях)
часто отсутствуют, но характерны для полярных сред и полярных мономеров
Аналогично катионной полимеризации в анионной полимеризации могут участвовать несколько типов активных центров, находящихся в равновесии друг с другом.
Слайд 47Рост цепи
Rn-B+ + M → Rn+1-B+
Rn- (B)+
Rn-
( B)
+
B +
R
Присоединение мономера
Молекулы растворителя
Какие ионные пары более активные?
Влияние сольватирующей способности растворителя
Слайд 48Реакции обрыва в анионной полимеризации
1. перенос гидрид-иона с конца растущей цепи
2. перенос гидрид-иона с конца растущей цепи на мономер (винилхлорид, винилиденхлорид, хлоропрен – перенос хлорид иона)
3. отрыв протона растущей цепью от растворителя (полимеризация стирола или бутадиена в толуоле или жидком аммиаке)
На мономер
Реакции обрыва в анионной полимеризации реализуются с очень большим трудом, они энергетически не выгодны
живые цепи
Слайд 49Полимеризация ненасыщенных углеводородов (стирол, диены)
отсутствие реакций кинетического обрыва цепи при незначительной
Кинетика такого процесса определяется соотношением констант скоростей инициирования kи и роста цепи kp.
При kи >> kp Vp = kp[M][I]0
Все цепи зарождаются практически одновременно. Образующиеся полимеры характеризуются узким ММР (Mw/Mn~1).
Pn=nq[M]0/[I]0,
q – конверсия, n – число растущих концов в макромолекуле (n=1 или 2).
При kи << kp процесс протекает нестационарно и образующиеся полимеры характеризуютя широким ММР.
Слайд 50 Катионная полимеризация
C=C
Полимеризуются только олефины с ярко выраженными электронодонорными свойствами
Электронная плотность на кратных связях в большей мере влияет на активность мономеров, чем пространственные факторы.
C=О
Среди ненасыщенных кислородсодержащих мономеров высокую активность проявляют альдегиды: формальдегид
Циклические мономеры
Активность мономеров повышается с увеличением напряженности цикла: циклоалканы , циклические простые эфиры, циклические сложные эфиры (лактоны) и амиды (лактамы)
Слайд 51КАТИОННАЯ ПОЛИМЕРИЗАЦИЯ
Основные стадии полимеризации:
Инициирование
Рост цепи
Обрыв цепи
Передача цепи
Инициирование – 1) образование первичных
а) катионы, реагирующие свободно или в составе ионной пары
б) цвиттер-ионы (кислота Льюиса BF3 и мономер, содержащий гетероатом, например, триоксан)
в) ион-радикалы (под действием излучения)
г) координационные комплексы, не имеющие ярко выраженного ионного характера
и 2) их присоединение к мономеру
в ряде случаев могут отсутствовать
Активность этих частиц различна.
В зависимости от условий возможно одновременное образование первичных частиц разного типа или их переход друг в друга.
Слайд 52ИНИЦИИРОВАНИЕ
Катионная полимеризация
1.протонодонорные кислоты H2SO4, H3PO4,
2. Инициирование комплексом катализатор–сокатализатор – реагенты Фриделя-Крафтса BF3, AlCl3, SnCl4 и др. в присутствии доноров протонов (вода, галогенводородные кислоты, спирты) или галогеналкилов.
Инициатор-соинициатор !!!
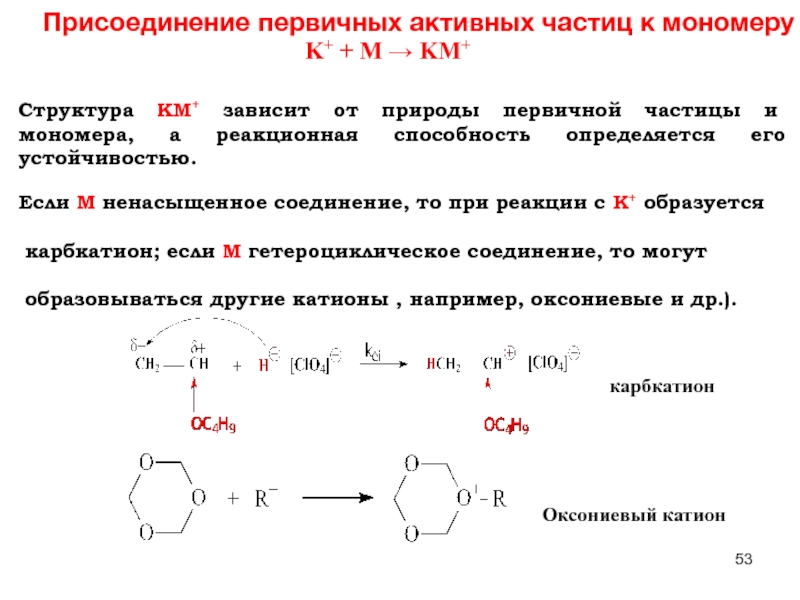
Слайд 53Присоединение первичных активных частиц к мономеру
K+ + M → KM+
Структура KM+
Если M ненасыщенное соединение, то при реакции с K+ образуется
карбкатион; если M гетероциклическое соединение, то могут
образовываться другие катионы , например, оксониевые и др.).
карбкатион
Оксониевый катион
Слайд 54Обрыв цепи При катионной полимеризации реакции обрыва и передачи цепи можно
Нейтрализация заряда на конце цепи (истинный кинетический обрыв).
Слайд 56Передача на растворитель и примеси
Передача на макромолекулы
с разрывом основной цепи
Без гетероатома – полимеризация пропилена
Слайд 57СОПОЛИМЕРИЗАЦИЯ – совместная полимеризация 2-х или более мономеров (классификация).
~M1M1M2M1M2M2M1M1M1M2M1M1M2 ~
Статистические сополимеры:
Чередующиеся (для 2-х мономерных звеньев): в макромолекуле сополимера мономерные звенья чередуются
~ M1M2M1M2M1M2M1M2M1M2M1M2~
Периодические: упорядоченная последовательность из более, чем двух мономерных звеньев
~ M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3~
Распределение звеньев в макромолекулах сополимеров
Слайд 58сополимеризация
Градиентные: состав макромолекулы изменяется непрерывно вдоль цепи
~ M1M1М2M1M1М1M1M2М1M1M2М2M1M1М2M2M2М2~
Блок-сополимеры: линейные макромолекулы с
~M1M1M1M1M1M1M1M1M1M1M1M1M2M2M2M2M2M2M2M2~
Привитые сополимеры: разветвленные макромолекулы, у которых основная цепь состоит из звеньев одного мономера, а к ней ковалентно присоединены одна или более боковых макромолекул, построенных из звеньев другого мономера
~M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1~
M2M2M2M2M2M2M2M2M2M2M2M2M2M2~
Слайд 59Различают :
Мгновенную неоднородность, которая возникает в результате статистического характера
Конверсионную неоднородность, обусловленную изменением состава мономерной смеси в ходе сополимеризации (кроме азеотропной сополимеризации).
При азеотропной сополимеризации составы сополимера и мономерной смеси не меняются по ходу реакции и остаются равными исходному составу мономерной смеси, что приводит к получению продуктов, композиционная неоднородность которых минимальна и связана только с ее мгновенной составляющей.
Композиционная неоднородность
макромолекул сополимеров
Слайд 60Композиционная неоднородность макромолекул сополимеров
Эксплуатационные свойства бинарных сополимеров зависят от:
среднего состава
композиционной неоднородности
распределения мономерных звеньев в макромолекулах.
Состав отдельной макромолекулы может отличаться от среднего состава всего образца, что приводит к композиционной неоднородности сополимера.
Слайд 61Реакция роста цепи
~M1* + M1 → ~M1M1* k11
~M1* + M2
~M2* + M2 → ~M2M2* k22
~M2* + M1 → ~M2M1* k21
Кинетика реакции роста цепи определяет состав сополимеров и весь комплекс их химических и физико-механических свойств
Концевая модель (Майо и Льюис, Алфрей и Голдфингер)
учитывает влияние концевого звена на реакционную способность активного центра по отношению к молекулам мономеров.
Слайд 62k12[M1*][M2]= k21[M2*][M1]
Допущения для вывода уравнения состава сополимера
Pn >>1 (действительно реакция
Реакционная способность M1* и M2* не зависит от Pn
Условие квазистационарности: Vp,12=Vp,21
малые конверсии
k11, k22 – константы скорости присоединения радикала к своему мономеру
k12, k21 – константы скорости присоединения радикала к чужому мономеру
Уравнение описывает состав «мгновенного» сополимера, образующегося на начальных конверсиях, когда изменением концентраций мономеров можно пренебречь.
r1 и r2 – константы сополимеризации
Слайд 63Диаграмма составов сополимеров
Если r1>1 и r2
Если r1=r2=1, то состав сополимера всегда равен составу исходной смеси.
Если r1<1 и r2<1, то при малых содержаниях M1 в исходной смеси мономеров сополимер обогащен звеньями М1, а при больших — звеньями M2 (тенденция к чередованию в сополимере звеньев М1 и М2, которая тем больше, чем ближе к нулю значения r1 и r2).
Если r1>1 и r2>1, то наблюдается тенденция к раздельной полимеризации мономеров в смеси.
Если кривая состава пересекает диагональ диаграммы составов; в точке пересечения, называемой азеотропной, состав сополимера равен составу сомономерной смеси.
r1>1, r2<1
r1<1, r2>1
r1=1, r2=1
r1<1, r2<1
r1 >1, r2>1
r 1= k11 / k12 r2 = k22 / k21
Слайд 64 Радикальная сополимеризация
Значения r1 , r2 и состав сополимера обычно
Исключение составляют
явления, связанные c донорно-акцепторными взаимодействиями реагентов. Если один из мономеров оказывается сильным донором, а другой – сильным акцептором, образуются чередующиеся сополимеры. Дополнительно еще сказываются и стерические затруднения
Стирол – малеиновый ангидрид r1=0 r2=0
сополимеризация ионогенных мономеров в зависимости от pH
Акриловая кислота – акриламид pH =2 r1=0.9 r2=0.25,
pH =9 r1=0.3 r2=0.95
Слайд 65Реакционная способность мономеров
Теория идеальной реакционной способности – учёт только энергии сопряжения
в рамках этой теории r1⋅r2=1, т.е. константы скоростей присоединения одного из мономеров к обоим радикалам в одинаковое число раз больше констант скоростей присоединения другого мономера к этим радикалам.
Чаще всего r1⋅r2<1, что связано с большим вкладом
полярных эффектов
стерических эффектов
Слайд 66Схема Q-e
Полуэмпирическая схема, предложенная Алфреем и Прайсом, используется для количественной характеристики
Рi и Qj – параметры, соответствующие энергиям сопряжения в радикале и мономере.
еi и еj учитывает поляризацию мономеров (электронодонорный (e<0) или электроноакцепторный (e>0) характер заместителей при двойной связи мономера )
Величины Q и e вычисляют из опытных значений r1 и r2.
Для стирола принято Q = 1 и е = −0,8.
Слайд 67 Анионная сополимеризация
Мономеры (М2) с сильными электроноакцепторными группами практически не
Природа растворителя и инициатора существенно влияют на значения констант сополимеризации.
Если анионная сополимеризация, как и гомополимеризация, протекает в отсутствие реакций обрыва и передачи цепи, то изменение состава мономерной смеси в ходе сополимеризации приводит к изменению состава вдоль цепи макромолекулы, т.е. к образованию градиентного сополимера, а не к образованию макромолекул разного состава.
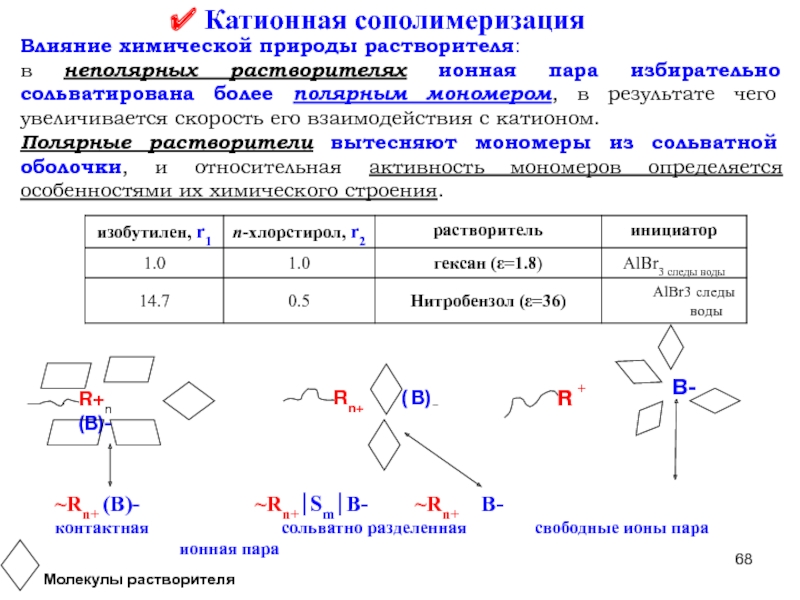
Слайд 68 Катионная сополимеризация
Влияние химической природы растворителя:
в неполярных растворителях ионная пара избирательно
Полярные растворители вытесняют мономеры из сольватной оболочки, и относительная активность мономеров определяется особенностями их химического строения.
~Rn+ (B)- ~Rn+⏐Sm⏐B- ~Rn+ B-
контактная сольватно разделенная свободные ионы пара ионная пара
R+n (B)-
Rn+
( B)
_
+
B-
R
Молекулы растворителя
Слайд 69Влияние природы противоиона:
- более характерно для неполярных растворителей,
- в полярных растворителях
Стирол/
п-метилстирол
Слайд 71Сравнительные характеристики реакций полимеризации и поликонденсации полимеризация
1. цепная реакция присоединения активных центров (радикалов, анионов , катионов) к кратным связям мономеров.
2.не выделяется низкомолекулярное вещество.
3. молекулярная масса образующегося полимера практически не зависит от конверсии.
4. практически нет промежуточных олигомеров.
1.Ступенчатая реакция между функциональными группами многофункциональных мономеров.
2.выделяется низкомолекулярное вещество, которое необходимо удалять из реакционной среды.
3.молекулярная масса полимера зависит от конверсии, от константы равновесия, от Са\Св, от конц. низкомолекулярного вещества.
4. промежуточные олигомеры стабильны и способны к дальнейшим реакциям.
Слайд 72Поликонденсация – процесс образования макромолекул в результате ступенчатого химического взаимодействия функциональных
ПОЛИКОНДЕНСАЦИЯ
ГОМОПОЛИКОНДЕНСАЦИЮ (1 мономер)
полиамиды
По типу участвующих в реакции мономеров мономеров поликонденсацию подразделяют на:
простые полиэфиры
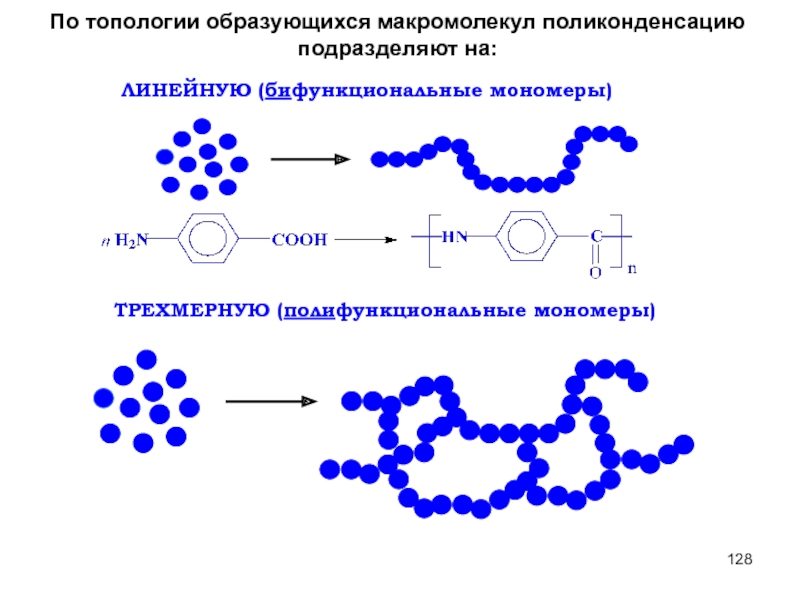
Слайд 76По топологии образующихся макромолекул поликонденсацию подразделяют на:
ЛИНЕЙНУЮ (бифункциональные мономеры)
ТРЕХМЕРНУЮ (полифункциональные
Слайд 77По значению константы поликонденсационного равновесия K поликонденсацию подразделяют на:
K = k1/k-1
неравновесную (необратимую)
K ≈ 10÷100
Степень завершенности реакции и степень полимеризации лимитируются равновесными концентрациями реагентов и продуктов реакции
К ≥103
Степень завершенности реакции и степень полимеризации лимитируются не термодинамическими, а кинетическими факторами
Слайд 78Значения констант равновесия (К) для некоторых случаев поликонденсации
Необратимая поликонденсация
Обратимая поликонденсация
Слайд 79Побочные химические реакции , в результате которых функциональные группы утрачивают способность
1. Взаимодействие функциональных групп мономеров с монофункциональным соединением, присутствующим в виде примеси или специально введенной добавки – обрыв цепи.
2. Химическое превращение функциональных групп вследствие протекания побочных реакций:
HOOC–R-COOH → HR-COOH + CO2
ClOC-R-COCl + 2H2O → HOOC-R-COOH + 2HCl
3. Циклизацияа) внутримолекулярная (реагируют функциональные группы одной молекулы, 5–7 и 20–40 членные циклы)
б) межмолекулярная (реагируют функциональные группы разных молекул)
4. Деструкционные процессы – реакции, приводящие к разрыву основной цепи макромолекул
Слайд 80Кинетика поликонденсации
Для поликонденсации характерно исчезновение мономера уже на ранних стадиях
Дальнейший рост цепи происходит при практически полном отсутствии мономера в системе (при полимеризации на ВСЕХ стадиях наряду с макромолекулами, активными макрорадикалами (анионами и катионами) присутствует мономер).
При количественном анализе кинетики поликонденсации используют принцип Флори: активность реагирующих групп не зависит от длины цепи макромолекулы.
Реакционная способность функциональных групп бифункционального мономера не зависит от того, прореагировала ли его другая функциональная группа.
Вязкость системы практически не влияет на скорость реакции, т.к. такие реакции проводят при повышенных температурах.
Слайд 81Кинетика поликонденсации
Мономеры взяты в эквимолярных количествах
.
Уравнение изменения концентрации
функциональных групп:
k –
После интегрирования , введения начальной концентрации функциональных групп [A]0 и глубины превращения q (доли прореагировавших к данному моменту времени функциональных групп):
Для необратимой поликонденсации и начальных стадий обратимой поликонденсации, когда обратной реакцией можно пренебречь:
Для необратимой поликонденсации характерны высокие скорости (k до 105 л/моль.с), низкие значения энергии активации (8 – 40 кДж/моль); как правило, эти процессы сильно экзотермичны.
Слайд 83Для обратимой гомополиконденсации предельная в данных условиях молекулярная масса определяется термодинамическими
Обратимые процессы характеризуются малыми скоростями (k равна 10-3 – 10-5 л/моль.с), сравнительно высокими значениями энергии активации (80 – 170 кДж/моль), они могут быть эндо- и экзотермическими.
Слайд 84Факторы, влияющие на молекулярную массу поликонденсационных полимеров
Глубина проведения процесса q (необратимая
Эквимольность реагирующих между собой исходных соединений (молярное соотношение мономеров)
Нарушения:
Если в реакцию вводят неэквимольные количества исходных веществ. Тогда
при q=1
Если в реакционной смеси присутствуют монофункциональные соединения C, взаимодействующие с исходными веществами, то
Если функциональные группы мономеров претерпевают химические изменения, превращаясь в группы, нереакционноспособные в условиях поликонденсации (циклизация, деструкционные процессы)
Наличие низкомолекулярных продуктов реакции ( олигомеров)
Слайд 85
конверсия мономера:
⇒
2. Если [CA]≠[CB], то вводится
Доля n-мера в поликонденсационных полимерах определяется
следующим образом:
Числовая доля
Весовая доля
Слайд 86ПОЛИПРИСОЕДИНЕНИЕ
Реакции проходят без выделения низкомолекулярного продукта !!!
Полимочевины
Полиуретаны
Слайд 87Сравнительные характеристики реакций полимеризации и поликонденсации полимеризация
1. цепная реакция присоединения активных центров (радикалов, анионов , катионов) к кратным связям мономеров.
2.не выделяется низкомолекулярное вещество.
3. молекулярная масса образующегося полимера практически не зависит от конверсии.
4. практически нет промежуточных олигомеров.
1.Ступенчатая реакция между функциональными группами многофункциональных мономеров.
2.выделяется низкомолекулярное вещество, которое необходимо удалять из реакционной среды.
3.молекулярная масса полимера зависит от конверсии, от константы равновесия, от Са\Св, от конц. низкомолекулярного вещества.
4. промежуточные олигомеры стабильны и способны к дальнейшим реакциям.
Слайд 89Как можно достичь одновременного снижения скорости реакции радикальной полимеризации винилового мономера
Слайд 90
КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИ
Поскольку мономер расходуется в основном на стадии роста, то
Скорость полимеризации пропорциональна [I]0.5 и [M]
Скорость полимеризации увеличивается с ростом температуры при Т<<Тпр
Условие квазистационарности
Слайд 91ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИ
Кинетическая цепь ν – число молекул
Материальная цепь (среднечисловая степень полимеризации) Pn – число элементарных актов присоединения мономеров на один акт гибели радикала Rn∙ при обрыве и передаче цепи
Слайд 92
Какой инициатор надо использовать, чтобы получить сополимер стирола с винилбутиловым эфиром
Какой инициатор надо использовать, чтобы получить сополимер стирола с винилбутиловым эфиром состава 20:80? Схема реакции.
Слайд 93
С какими мономерами (приведите 2 примера) при сополимеризации ММА (Б) в
Напишите схемы реакции и прокомментируйте.
Слайд 943. Какая из инициирующих систем позволяет получить высоко-
молекулярный полистирол с узким
распределением ( ММР ~ 1.1 )
а) пероксид бензоила
б) бутиллитий
в) минеральные неорганические кислоты
г) кислоты Льюиса
----------------------------------------------------------------------------------------
4. Оцените величины констант сополимеризации ra и rb,
если при сополимеризации мономеров a и b получен сополимер структуры aaaaaaaaabbaaaaaaaaaa
а) обе константы равны 1
б) обе константы по величине стремятся к нулю
в) r a 0 rb больше 1
г ) ra больше 1 rb 0
Слайд 951. Для каких значений n достигается максимальная вероятность образования циклических молекул
синтеза сложных полиэфиров по реакции
гомо-поликонденсации. А – (СН2)n - Б А= ? Б = ?
Слайд 98 Для каких значений n достигается максимальная вероятность образования циклических молекул
n = 5 6 1 2 (выберите правильный ответ и прокомментируйте)
Слайд 995. Какие надо использовать мономеры, чтобы получить:
Простые полиэфиры
Сложные полиэфиры
Полиамиды
Полиуретаны
Полимочевины
Напишите схемы реакций
Слайд 100Как изменится длина материальной цепи, если при радикальной полимеризации на малых
(не изменится) Докажите.
Слайд 101Задачи по синтезу
Каков тепловой эффект (Q = ?) реакции полимеризации ММА
Изменение энтропии -30 кал\моль.град
Степень конверсии q = 90%
1. q= (Mo – M равн.) \ Mo………….. M равн.= 0.1 мол\л
2. Ho – T Sо = RT ln M равн.
3. Ho + 273 * 30 = 2*273* ln 0.1 ……….. Ho = -Q ( Q = - Ho)
Слайд 1021. Для каких значений n достигается максимальная вероят-
ность образования циклических молекул
синтеза сложных полиэфиров по реакции
гомо-поликонденсации. А – (СН2)n - Б А= ? Б = ?
-------------------------------------------------------------------------------------
Какой из перечисленных факторов не влияет на молекуляр-
ную массу продукта радикальной полимеризации, полученного
на начальных конверсиях реакции.
а) концентрация передатчика кинетической цепи цепи
б) степень превращения
в) способность мономера к самопередаче
г) концентрация инициатора
--------------------------------------------------------------------------------------
Слайд 107СОПОЛИМЕРИЗАЦИЯ – совместная полимеризация 2-х или более мономеров (классификация).
Статистические: в макромолекуле
~M1M1M2M1M2M2M1M1M1M2M1M1M2 ~
Чередующиеся (для 2-х мономерных звеньев): в макромолекуле сополимера мономерные звенья чередуются
~ M1M2M1M2M1M2M1M2M1M2M1M2~
Периодические: упорядоченная последовательность из более, чем двух мономерных звеньев
~ M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3~
Градиентные: состав макромолекулы изменяется непрерывно вдоль цепи
~ M1M1М2M1M1М1M1M2М1M1M2М2M1M1М2M2M2М2~
Блок-сополимеры: линейные макромолекулы с длинными (полимерными) блоками одинаковых звеньев, разделенными длинными (полимерными) блоками других звеньев
~M1M1M1M1M1M1M1M1M1M1M1M1M2M2M2M2M2M2M2M2~
Привитые сополимеры: разветвленные макромолекулы, у которых основная цепь состоит из звеньев одного мономера, а к ней ковалентно присоединены одна или более боковых макромолекул, построенных из звеньев другого мономера
~M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1~
M2M2M2M2M2M2M2M2M2M2M2M2M2M2~
Слайд 108Эксплуатационные свойства бинарных сополимеров зависят от:
среднего состава сополимера,
композиционной
распределения мономерных звеньев в макромолекулах.
Состав отдельной макромолекулы может отличаться от среднего состава всего образца, что приводит к композиционной неоднородности сополимера.
Различают :
Мгновенную неоднородность, которая возникает в результате статистического характера реакций обрыва цепи.
Конверсионную неоднородность, обусловленную изменением состава мономерной смеси в ходе сополимеризации (кроме азеотропной сополимеризации).
При азеотропной сополимеризации составы сополимера и мономерной смеси не меняются по ходу реакции и остаются равными исходному составу мономерной смеси, что приводит к получению продуктов, композиционная неоднородность которых минимальна и связана только с ее мгновенной составляющей.
Композиционная неоднородность и распределение звеньев
Слайд 109Реакция роста цепи
~M1* + M1 → ~M1M1* k11
~M1* + M2
~M2* + M2 → ~M2M2* k22
~M2* + M1 → ~M2M1* k21
Кинетика реакции роста цепи определяет состав сополимеров и весь комплекс их химических и физико-механических свойств
Концевая модель (Майо и Льюис, Алфрей и Голдфингер)
учитывает влияние концевого звена на реакционную способность активного центра по отношению к молекулам мономеров.
Слайд 110k12[M1*][M2]= k21[M2*][M1]
Допущения для вывода уравнения состава сополимера
Pn >>1 (действительно реакция
Реакционная способность M1* и M2* не зависит от Pn
Условие квазистационарности: Vp,12=Vp,21
малые конверсии
k11, k22 – константы скорости присоединения радикалом своего мономера
k12, k21 – константы скорости присоединения радикалом чужого мономера
r1 и r2 – константы сополимеризации
Уравнение описывает состав «мгновенного» сополимера, а также состав сополимера, образующегося на начальных конверсиях, когда изменением концентраций мономеров можно пренебречь.
Слайд 111Диаграмма состава сополимера
Если r1>1 и r2
Если r1=r2=1, то состав сополимера всегда равен составу исходной смеси.
Если r1<1 и r2<1, то при малых содержаниях M1 в исходной смеси мономеров сополимер обогащен звеньями М1, а при больших — звеньями M2 (тенденция к чередованию в сополимере звеньев М1 и М2, которая тем больше, чем ближе к нулю значения r1 и r2).
Если r1>1 и r2>1, то наблюдается тенденция к раздельной полимеризации мономеров в смеси.
Если кривая состава пересекает диагональ диаграммы составов; в точке пересечения, называемой азеотропной, состав сополимера равен составу сомономерной смеси.
r1>1, r2<1
r1<1, r2>1
r1=1, r2=1
r1<1, r2<1
r1 >1, r2>1
r 1= k11 / k12 r2 = k22 / k21
Слайд 112 Радикальная сополимеризация
Значения r1 , r2 и состав сополимера обычно
Исключение составляют
явления, связанные c донорно-акцепторными взаимодействиями реагентов. Если один из мономеров оказывается сильным донором, а другой – сильным акцептором, образуются чередующиеся сополимеры. Дополнительно еще сказываются и стерические затруднения
Стирол – малеиновый ангидрид r1=0 r2=0
сополимеризация ионогенных мономеров в зависимости от pH
Акриловая кислота – акриламид pH =2 r1=0.9 r2=0.25,
pH =9 r1=0.3 r2=0.95
Слайд 113Реакционная способность мономеров
Теория идеальной реакционной способности – учёт только энергии сопряжения
в рамках этой теории r1⋅r2=1, т.е. константы скоростей присоединения одного из мономеров к обоим радикалам в одинаковое число раз больше констант скоростей присоединения другого мономера к этим радикалам.
Чаще всего r1⋅r2<1, что связано с большим вкладом
полярных эффектов
стерических эффектов
Слайд 114Схема Q-e
Полуэмпирическая схема, предложенная Алфреем и Прайсом, используется для количественной характеристики
Рi и Qj – параметры, соответствующие энергиям сопряжения в радикале и мономере.
еi и еj учитывает поляризацию мономеров (электронодонорный (e<0) или электроноакцепторный (e>0) характер заместителей при двойной связи мономера )
Величины Q и e вычисляют из опытных значений r1 и r2.
Для стирола принято Q = 1 и е = −0,8.
Слайд 115 Катионная сополимеризация
Влияние химической природы растворителя:
в неполярных растворителях ионная пара избирательно
Полярные растворители вытесняют мономеры из сольватной оболочки, и относительная активность мономеров определяется особенностями их химического строения.
Влияние противоиона:
- более характерно для неполярных растворителей,
- в полярных растворителях в ряде случаев вообще не проявляется, т.к. в полярных растворителях ионы разделены, а сольватная оболочка не содержит мономеров.
Стирол/
п-метилстирол
Слайд 116 Анионная сополимеризация
Мономеры с сильными электроноакцепторными группами не сополимеризуются с
Природа растворителя и инициатора существенно влияют на значения констант сополимеризации.
Если анионная сополимеризация, как и гомополимеризация, протекает в отсутствие реакций обрыва и передачи цепи, то изменение состава мономерной смеси в ходе сополимеризации приводит к изменению состава вдоль цепи макромолекулы, т.е. к образованию градиентного сополимера, а не к образованию макромолекул разного состава.
Слайд 117КИНЕТИКА ПОЛИМЕРИЗАЦИИ И МОЛЕКУЛЯРНЫЕ МАССЫ
Рассмотрим случай, когда ограничение цепей происходит за
мономолекулярного обрыва цепи : Rn+[BF3OH]- → Pn + Н+[BF3OH]-
и передачи цепи на мономер: Rn+[BF3OH]- + М→ Pn+1 + Н+[BF3OH]-
инициирование: Vи=kи[H+(BF3OH)-][M]
рост цепи: Vр=kp[Rn+(BF3OH)-][M]
обрыв цепи: Vo=ko[Pn+(BF3OH)-]
передача цепи: Vп,М=kп,М[Pn+(BF3OH)-][М]
Условие квазистационарности: Vи=Vo
ER=Eи + Ep − Eo
ER= + Ep − Eo − Eи < 0
Слайд 118Изменение природы активного центра, может сопровождаться снижением его реакционной способности (изомеризация
Слайд 119
Влияние растворителя и противоиона
стирол - изопрен
1) Увеличение полярности растворителя приводит
2) Li+ − сильно комплексообразующий противоион. Изопрен в неполярных растворителях образует комплексы с ионом Li+ ⇒ сополимер обогащен изопреном (неактивным мономером).
Na+ − обладает меньшей комплексообразующей активностью ⇒ сополимер обогащен стиролом (активным мономером).
Слайд 120Анионная полимеризация
Стереоспецифическая полимеризация диенов под действием Li и его соединений возможна
В полярных растворителях предварительная координация присоединяющегося мономера оказывается очень затруднённой и стереоспецифический эффект пропадает.
При сильной координации вращение вокруг связи С2 – С3 невозможно ⇒ цис-1,4
При слабой координации ⇒ транс- и 3,4
При очень слабой координации ⇒ 3,4-присоединение
Полимеризация изопрена
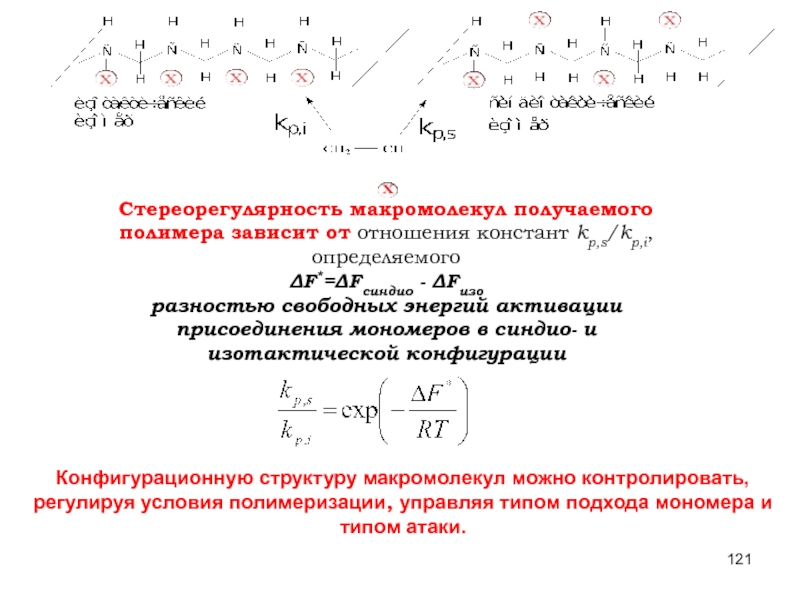
Слайд 121Конфигурационную структуру макромолекул можно контролировать, регулируя условия полимеризации, управляя типом подхода
Стереорегулярность макромолекул получаемого полимера зависит от отношения констант kp,s/kp,i, определяемого
ΔF*=ΔFсиндио - ΔFизо
разностью свободных энергий активации присоединения мономеров в синдио- и изотактической конфигурации
Слайд 122Механизм полимеризации на катализаторах Циглера-Натта
Биметаллический механизм Натта для α-олефинов
Каждый акт присоединения
Слайд 123КИНЕТИКА ПОЛИМЕРИЗАЦИИ И МОЛЕКУЛЯРНЫЕ МАССЫ
Для полимеризации, инициированной амидами металлов
инициирование: Vи=kи[M](Kp[KNH2])1/2
рост цепи: Vр=kp[Rn-][M]
обрыв цепи: Vo=ko[Rn-]
передача
Для полимеризации на "живых" цепях
Условие квазистационарности: Vи=Vo
KNH2 ⇔ K+ + NH2-
Слайд 124Поликонденсация – процесс образования макромолекул в результате ступенчатого химического взаимодействия функциональных
ПОЛИКОНДЕНСАЦИЯ
ГОМОПОЛИКОНДЕНСАЦИЮ (1 мономер)
полиамиды
По типу участвующих в реакции мономеров мономеров поликонденсацию подразделяют на:
простые полиэфиры
Слайд 128По топологии образующихся макромолекул поликонденсацию подразделяют на:
ЛИНЕЙНУЮ (бифункциональные мономеры)
ТРЕХМЕРНУЮ (полифункциональные
Слайд 129По значению константы поликонденсационного равновесия K поликонденсацию подразделяют на:
K = k1/k-1
неравновесную (необратимую)
K ≈ 10÷100
Степень завершенности реакции и степень полимеризации лимитируются равновесными концентрациями реагентов и продуктов реакции
К ≥103
Степень завершенности реакции и степень полимеризации лимитируются не термодинамическими, а кинетическими факторами
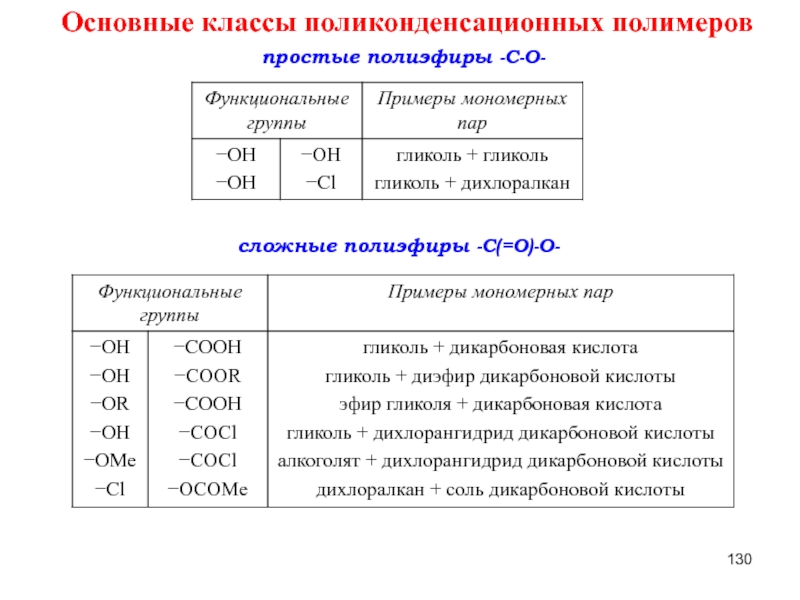
Слайд 130Основные классы поликонденсационных полимеров
простые полиэфиры -C-O-
сложные полиэфиры -C(=O)-O-
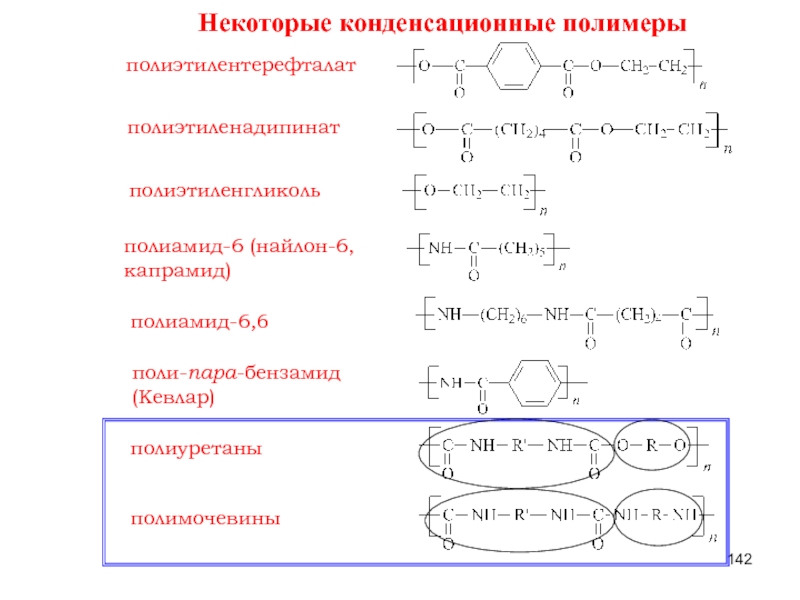
Слайд 132Некоторые конденсационные полимеры
полиэтиленадипинат
полиэтилентерефталат
полиэтиленгликоль
полиамид-6 (найлон-6,
капрамид)
полиамид-6,6
поли-пара-бензамид
(Кевлар)
полиуретаны
полимочевины
Слайд 134Значения констант равновесия (К) для некоторых случаев поликонденсации
Необратимая поликонденсация
Обратимая поликонденсация
Слайд 135Побочные химические реакции , в результате которых функциональные группы утрачивают способность
1. Взаимодействие функциональных групп мономеров с монофункциональным соединением, присутствующим в виде примеси или специально введенной добавки – обрыв цепи.
2. Химическое превращение функциональных групп вследствие протекания побочных реакций:
HOOC–R-COOH → HR-COOH + CO2
ClOC-R-COCl + 2H2O → HOOC-R-COOH + 2HCl
3. Циклизация
а) внутримолекулярная (реагируют функциональные группы одной молекулы, 5–7 и 20–40 членные циклы)
б) межмолекулярная (реагируют функциональные группы разных молекул)
4. Деструкционные процессы – реакции, приводящие к разрыву основной цепи макромолекул
Слайд 136Кинетика поликонденсации
Для поликонденсации характерно исчезновение мономера уже на ранних стадиях
Дальнейший рост цепи происходит при практически полном отсутствии мономера в системе (при полимеризации на ВСЕХ стадиях наряду с макромолекулами присутствует мономер).
При количественном анализе кинетики поликонденсации используют принцип Флори: активность реагирующих групп не зависит от длины цепи макромолекулы.
Реакционная способность функциональных групп бифункционального мономера не зависит от того, прореагировала ли его другая функциональная группа.
Вязкость системы практически не влияет на скорость реакции.
Слайд 137Кинетика поликонденсации
Мономеры взяты в эквимолярных количествах.
Уравнение изменения концентрации функциональных групп:
k –
После интегрирования и введения начальной концентрации функциональных групп [A]0 и глубины превращения q (доли прореагировавших к данному моменту времени функциональных групп):
Для необратимой поликонденсации и начальных стадий обратимой поликонденсации, когда обратной реакцией можно пренебречь:
Для большинства случаев необратимой поликонденсации характерны высокие скорости (k до 105 л/моль.с), низкие значения энергии активации (8 – 40 кДж/моль); как правило, эти процессы сильно экзотермичны.
Слайд 139Для обратимой гомополиконденсации предельная в данных условиях молекулярная масса определяется термодинамическими
Обратимые процессы характеризуются малыми скоростями (k равна 10-3 – 10-5 л/моль.с), сравнительно высокими значениями энергии активации (80 – 170 кДж/моль), они могут быть эндо- и экзотермическими.
Слайд 140Факторы, влияющие на молекулярную массу поликонденсационных полимеров
Глубина проведения процесса q (необратимая
Эквимольность реагирующих между собой исходных соединений (молярное соотношение мономеров)
Нарушения:
Если в реакцию вводят неэквимольные количества исходных веществ. Тогда
при q=1
Если в реакционной смеси присутствуют монофункциональные соединения C, взаимодействующие с исходными веществами, то
Если функциональные группы мономеров претерпевают химические изменения, превращаясь в группы, нереакционноспособные в условиях поликонденсации (циклизация, деструкционные процессы)
Наличие низкомолекулярного продукта реакции.
Слайд 141
конверсия мономера:
⇒
2. Если [CA]≠[CB], то вводится
Доля n-мера в поликонденсационных полимерах определяется
следующим образом:
Числовая доля
Весовая доля
Слайд 142Некоторые конденсационные полимеры
полиэтиленадипинат
полиэтилентерефталат
полиэтиленгликоль
полиамид-6 (найлон-6,
капрамид)
полиамид-6,6
поли-пара-бензамид
(Кевлар)
полиуретаны
полимочевины
Слайд 144ПОЛИПРИСОЕДИНЕНИЕ
Реакции проходят без выделения низкомолекулярного продукта !!!
Полимочевины
Полиуретаны
Слайд 152Рост цепи
M + Rn+X- → Rn+1+X-
Активность катионов характеризует их
Ряд активности карбкатионов:
CH3+ > … > (CH3)3C+ >… > (C6H5)3C+
Чем больше электронная плотность у реакционного центра, тем меньше заряд на валентноненасыщенном атоме углерода катиона и тем меньше его реакционная способность. Стабильность карбкатионов, содержащих фенильные заместители в α-положении к активному центру, связана с эффектом сопряжения.
Слайд 153Рост цепи на свободных ионах характеризуется значением энергии активации, близким к
Рост цепи на ионных парах происходит в подавляющем большинстве систем. kp зависит от условий процесса, природы среды и катализатора.
В полимеризующейся в присутствии растворителя S системе могут существовать в равновесии следующие типы активных центров:
Реакционная способность (константа скорости реакции роста kp):
свободные ионы 105 – 106 л/моль.с
сольватно разделенная ионная пара ~103 л/моль.с
контактная ионная пара 1 – 102 л/моль.с
Слайд 154Основные классы поликонденсационных полимеров
простые полиэфиры -C-O-
сложные полиэфиры -C(=O)-O-
Слайд 155Полимеризация ненасыщенных мономеров с полярными заместителями (акриловые и метакриловые мономеры, винилхлорид,
Характеризуется процессами дезактивации инициатора и растущих цепей, которые зависят от природы функциональной группы и инициатора, температуры.
У полярных мономеров с высокой склонностью к анионной полимеризации
Еа,роста < Еа,поб.р-ций
понижение температуры позволяет подавить (для метилметакрилата) или исключить (для нитроэтилена) реакции дезактивации.
Слайд 156 В средах умеренной полярности ионогенные инициаторы до взаимодействия с мономером
HClO4 → H+ + ClO4-
В случае металлгалогенидов MeXn образование первичных катионов идет по более сложному механизму:
образование комплекса катализатор–сокатализатор MeXn⋅RX (RX, H2O, ROH, HX, RCOX, (RCO)2O)
реакция между компонентами комплекса с образованием промежуточного соединения с ярко выраженным ионным характером:
MeXn⋅RX → R+ + [MeXn+1]−
В средах малой полярности ситуация усложняется:
образование тримолекулярного комплекса катализатор–сокатализатор–мономер MeXn⋅RX⋅M
реакция между компонентами комплекса:
MeXn⋅RX⋅M → RM+ + [MeXn+1]−
Образование первичных активных частиц
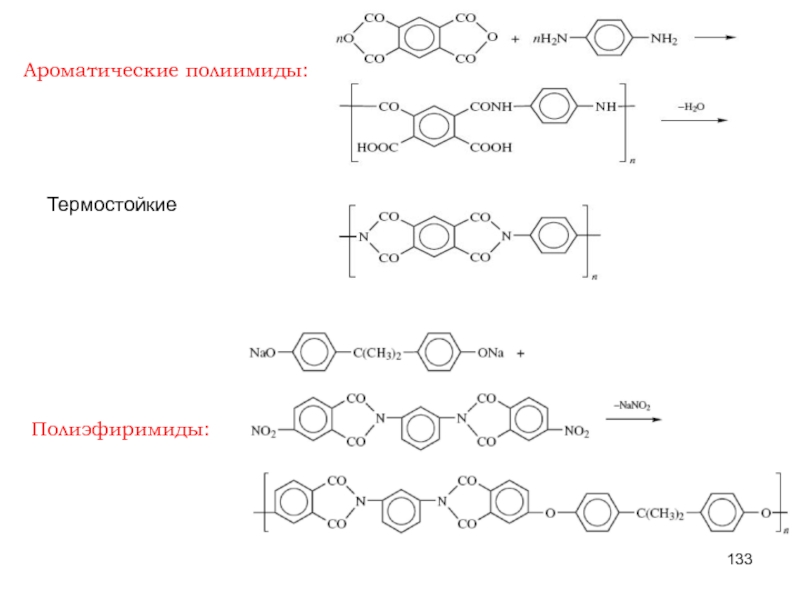
Слайд 157СТЕРЕОСПЕЦИФИЧЕСКАЯ ПОЛИМЕРИЗАЦИЯ
ЛЕКЦИЯ 2
полимеризация, в ходе которой из ряда возможных конфигураций при
Принцип стереорегулирования - контроль каждого элементарного акта роста цепи: активный центр должен иметь фиксированную структуру, чтобы присоединяющееся к нему мономерное звено было ориентировано и подходило строго определённым образом.
Слайд 158
ЛЕКЦИЯ 2
Растущий радикал или ион имеет плоскую или близкую к ней
После присоединения мономерного звена этот углеродный атом становится тетраэдрическим с фиксацией изо- или синдио- изомера.
Слайд 159Катионная полимеризация
Ионная полимеризация
Ионная полимеризация более стереоспецифична, что связано с участием
Если активным центром на конце растущей цепи является ионная пара, то противоион может влиять на фиксацию той или иной конфигурации концевого звена растущей цепи.
Влияние противоиона сводится к чисто стерическим эффектам.
При полимеризации винилизобутилового эфира на катализаторе BF3.H2O (противоион [BF3.OН]-) при −70оС образуется атактический полимер, при полимеризации в тех же условиях на катализаторе BF3.(C2H5)2O (противоион [BF3.OC2H5]-) образуется изотактический полимер. Здесь увеличение объема противоиона значительно усиливает стереоконтроль в реакции роста цепи.
Слайд 160Координационно-ионная полимеризация
В большинстве каталитических систем присоединению мономера к растущей цепи
Координация в комплексе обеспечивает устойчивую определённую ориентацию молекул мономера и способствует отбору именно этой конфигурации мономеров, присоединяющихся к активному центру.
Такой механизм образования макромолекул называют координационно-ионным.
Катализаторы Циглера-Натта – системы, образующиеся при взаимодействии органических соединений металлов I–III групп ((C2H5)3Al, (C2H5)2AlCl, C6H5MgBr, C4H9Li) с солями переходных металлов IV – VIII групп (TiCl4, TiCl3, VCl4, MoCl4, Ti(OC4H9)4).
Тип растущего центра зависит от состава катализатора и мономера:
C4H9Li+CrCl3+ акрилаты, метакрилаты ⇒ анионно-координационный механизм
TiCl4 + C2H5AlCl2 + виниловые эфиры ⇒ катионно-координационный механизм
Слайд 161Сравнительные характеристики реакций полимеризации и поликонденсации полимеризация
1. цепная реакция присоединения активных центров (радикалов, анионов , катионов) к кратным связям мономеров.
2.не выделяется низкомолекулярное вещество.
3. молекулярная масса образующегося полимера практически не зависит от конверсии.
4. практически нет промежуточных олигомеров.
1.Ступенчатая реакция между функциональными группами многофункциональных мономеров.
2.выделяется низкомолекулярное вещество, которое необходимо удалять из реакционной среды.
3.молекулярная масса полимера зависит от конверсии, от константы равновесия, от Са\Св, от конц. низкомолекулярного вещества.
4. промежуточные олигомеры стабильны и способны к дальнейшим реакциям.































![Полимеризация при термическом инициировании:Vин=Vo kин[M]2=ko[R∙]2 Полимеризация в присутствии ингибитораVин=Vo kин[I]=ko[R∙][Z] 27](/img/tmb/4/346191/e2ff99e87b9cb739539f8b5af9c01870-800x.jpg)


















![k12[M1*][M2]= k21[M2*][M1]Допущения для вывода уравнения состава сополимера Pn >>1 (действительно реакция полимеризации) Реакционная способность M1*](/img/tmb/4/346191/8370d8d03212692a63695d807d757275-800x.jpg)

















![конверсия мономера: ⇒ 2. Если [CA]≠[CB], то вводится стехиометрический разбаланс: Доля n-мера в поликонденсационных](/img/tmb/4/346191/b09d1f06ed70f72c9c443acee1e276f9-800x.jpg)
























![k12[M1*][M2]= k21[M2*][M1]Допущения для вывода уравнения состава сополимера Pn >>1 (действительно реакция полимеризации) Реакционная способность M1*](/img/tmb/4/346191/8de3fa01165513a122219885632ea8ec-800x.jpg)










1/2рост цепи: Vр=kp[Rn-][M]обрыв цепи: Vo=ko[Rn-]передача цепи: Vп=kп[Rn-][NH3] Для полимеризации](/img/tmb/4/346191/0a12fc215fc374b0ed2b0e238a6e7e89-800x.jpg)













![конверсия мономера: ⇒ 2. Если [CA]≠[CB], то вводится стехиометрический разбаланс: Доля n-мера в поликонденсационных](/img/tmb/4/346191/94e9fcd3350243593cbeb1212e6b2535-800x.jpg)