- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Буферные системы презентация
Содержание
- 1. Буферные системы
- 2. Значение постоянства рН в организме Изменение активной
- 3. Буферные системы Растворы, обладающие свойством достаточно стойко
- 4. Классификация буферных систем Буферные системы кислотного типа
- 5. Анионы многоосновных кислот (анионы кислой и средней
- 6. Вывод формулы рН буферных систем В растворе
- 7. Cкислоты [H+] = КД ---------------- моль/л
- 8. Анализ уравнения Гендерсона-Гассельбаха рН буферной системы зависит
- 9. Механизм действия буферных систем CH3COOH + CH3COONa
- 10. Эффективность буферных систем При добавлении больших количеств
- 11. Буферная емкость (В) Количество молей эквивалентов сильной
- 12. Буферная емкость зависит от: Абсолютной концентрации компонентов
- 13. Пример Имеем два ацетатных буфера, концентрация компонентов
- 14. Рабочий участок буферной системы Значение рН, при
- 15. Буферные системы организма Гидрокарбонатная Белковая Гемоглобиновая-оксигемоглобиновая Фосфатная Аминокислотная
- 16. Буферные системы плазмы крови Гидрокарбонатная буферная
- 17. Ее особенности в организме Действие тесно связано
- 18. Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера:
- 19. Механизм действия HCO3-/H2CO3 В случае накопления кислот
- 20. Механизмы регуляции дыхания стабилизируют буферное соотношение в
- 21. Белковая буферная система Составляет в плазме 7%
- 22. Белок-основание R – CH – COO- +
- 23. Фосфатная буферная система Na2HPO4 + NaH2PO4 Концентрация
- 24. Буферные системы эритроцитов Гемоглобиновый-оксигемоглобиновый буфер Составляет 35%
- 25. Связь с дыханием HHb + O2
- 26. Кооперативность действия буферных систем крови Фосфатная буферная
- 27. Кислотно-основное равновесие Соотношение кислотных и основных свойств крови
- 28. Показатели кислотно-основного состояния крови рН крови
- 29. Резервная щелочность крови Способность крови связывать CO2
- 30. Нарушения К-О равновесия Уменьшение емкости буферных систем
- 31. Виды нарушений К-О равновесия Компенсированный ацидоз Некомпенсированный ацидоз Компенсированный алкалоз Некомпенсированный алкалоз
- 32. Коррекция нарушений К-О равновесия Натрия гидрокарбонат (4,5%
Слайд 1Буферные системы
Общие понятия
Классификация буферных систем
Механизм действия буферных систем
Буферные системы крови
Слайд 2Значение постоянства рН в организме
Изменение активной реакции среды крови приводит к
серьезным нарушениям жизнедеятельности организма
Слайд 3Буферные системы
Растворы, обладающие свойством достаточно стойко сохранять постоянное значение активной реакции
среды как при добавлении кислоты и щелочей, так и при разведении
С точки зрения протонной теории буферными системами являются сопряженные кислотно-основные пары
С точки зрения протонной теории буферными системами являются сопряженные кислотно-основные пары
Слайд 4Классификация буферных систем
Буферные системы кислотного типа (слабая кислота и соль этой
кислоты и слабого основания)
CH3COO-/CH3COOH – ацетатный буфер
Буферные системы основного типа (слабое основание и соль этого основания и сильной кислоты)
NH4+/ NH4OH – аммиачный буфер
CH3COO-/CH3COOH – ацетатный буфер
Буферные системы основного типа (слабое основание и соль этого основания и сильной кислоты)
NH4+/ NH4OH – аммиачный буфер
Слайд 5Анионы многоосновных кислот (анионы кислой и средней или двух кислых солей)
HPO42-/H2PO4-
– фосфатный буфер
Ионы и молекулы амфолитов
R – CH – COO-
| – белковый буфер
NH3+
Ионы и молекулы амфолитов
R – CH – COO-
| – белковый буфер
NH3+
Слайд 6Вывод формулы рН буферных систем
В растворе имеет место равновесие
CH3COOH ⇄ H+
+ CH3COO-
[H+][CH3COO-]
Кд = ---------------------
[CH3COOH]
[CH3COOH]
[H+] = КД-----------------
[CH3COO-]
- для уксусной кислоты
[H+][CH3COO-]
Кд = ---------------------
[CH3COOH]
[CH3COOH]
[H+] = КД-----------------
[CH3COO-]
- для уксусной кислоты
Присутствие соли влияет на диссоциацию кислоты
CH3COONa ⇄ Na+ + CH3COO- (α = 1)
CH3COOH ← H+ + CH3COO-
КД(CH3COOH) =
= 1,8⋅10-5
[CH3COOH] = Cкислоты
[CH3COO-] = Cсоли
Слайд 7 Cкислоты
[H+] = КД ---------------- моль/л
Cсоли
Cкислоты
рН =
-lg[H+] = - lgКД – lg ------------------- или
Cсоли
Cсоли
рН = рКа + lg ----------------- –
Cкислоты
– это уравнение Гендерсона-Гассельбаха
Cсоли
рН = 14 – рКв – lg ----------------
Cоснования
Cсоли
Cсоли
рН = рКа + lg ----------------- –
Cкислоты
– это уравнение Гендерсона-Гассельбаха
Cсоли
рН = 14 – рКв – lg ----------------
Cоснования
Слайд 8Анализ уравнения Гендерсона-Гассельбаха
рН буферной системы зависит от:
Константы диссоциации слабой кислоты рКа
или основания рКв
Соотношения концентраций взятых компонентов
Наиболее эффективно буферная система работает когда концентрации компонентов равны, т.е. когда рН = рК
Соотношения концентраций взятых компонентов
Наиболее эффективно буферная система работает когда концентрации компонентов равны, т.е. когда рН = рК
Слайд 9Механизм действия буферных систем
CH3COOH + CH3COONa
CH3COONa + HCI = CH3COOH +
NaCI
Кислота нейтрализуется солью
CH3COOH + NaOH = CH3COONa + H2O
В этом случае щелочь нейтрализуется слабой кислотой. Небольшое изменение в соотношении концентраций слабой кислоты ее соли незначительно изменяет рН
Кислота нейтрализуется солью
CH3COOH + NaOH = CH3COONa + H2O
В этом случае щелочь нейтрализуется слабой кислотой. Небольшое изменение в соотношении концентраций слабой кислоты ее соли незначительно изменяет рН
Слайд 10Эффективность буферных систем
При добавлении больших количеств кислот и щелочей меняется соотношение
кислота/соль и меняется рН буферной системы
Слайд 11Буферная емкость (В)
Количество молей эквивалентов сильной кислоты или основания, которое необходимо
добавить к 1 литру буферной смеси, чтобы изменить рН на единицу
ν ν
В = ------------------ = -----------
(рН2 – рН1)⋅VЛ ΔрН⋅ VЛ
Буферная емкость рассчитывается и по кислоте (Ва) и по основанию (Вв). Эти величины обычно не одинаковы.
ν ν
В = ------------------ = -----------
(рН2 – рН1)⋅VЛ ΔрН⋅ VЛ
Буферная емкость рассчитывается и по кислоте (Ва) и по основанию (Вв). Эти величины обычно не одинаковы.
Слайд 12Буферная емкость зависит от:
Абсолютной концентрации компонентов буферной системы
От соотношения между этими
концентрациями
Наибольшей буферной емкостью будут обладать растворы с соотношением:
[кислота]
-------------- = 1
[соль]
Наибольшей буферной емкостью будут обладать растворы с соотношением:
[кислота]
-------------- = 1
[соль]
Слайд 13Пример
Имеем два ацетатных буфера, концентрация компонентов в одном составляет 10 мг-экв,
а в другом 100 мг-экв. Соотношение компонентов кислота/соль = 1. Добавим к каждому буферу по 5 мг-экв HCI
[кислота] 10 + 5 15
------------ = --------- = ------ = 3;
[соль] 10 – 5 5
[кислота] 100 + 5 105
------------ = --------- = ------ ≈ 1;
[соль] 100 – 5 95
[кислота] 10 + 5 15
------------ = --------- = ------ = 3;
[соль] 10 – 5 5
[кислота] 100 + 5 105
------------ = --------- = ------ ≈ 1;
[соль] 100 – 5 95
Слайд 14Рабочий участок буферной системы
Значение рН, при котором сохраняются свойства буферной системы
(рН = рК ± 1)
Способность противодействовать изменению значения рН наиболее высокая в точке рН = рК и эффективна в пределах рК ± 1
Способность противодействовать изменению значения рН наиболее высокая в точке рН = рК и эффективна в пределах рК ± 1
Слайд 15Буферные системы организма
Гидрокарбонатная
Белковая
Гемоглобиновая-оксигемоглобиновая
Фосфатная
Аминокислотная
Слайд 16Буферные системы плазмы крови
Гидрокарбонатная буферная система
H2CO3 + NaHCO3
Является первой по
значимости; составляет в плазме 35% буферной емкости крови и 18% - в эритроцитах (всего 53%)
Слайд 17Ее особенности в организме
Действие тесно связано с функцией дыхания организма
Один из
компонентов буферной системы (угольная кислота) образуется в крови из CO2
CO2(г) ⇄ CO2(р) ⇄ H2CO3 ⇄ H+ + HCO3-
Концентрация CO2 в крови определяется коэффициентом растворимости при 37ºC и парциальным давлением рCO2
[H2CO3] = C⋅pCO2
CO2(г) ⇄ CO2(р) ⇄ H2CO3 ⇄ H+ + HCO3-
Концентрация CO2 в крови определяется коэффициентом растворимости при 37ºC и парциальным давлением рCO2
[H2CO3] = C⋅pCO2
Слайд 18Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера:
[HCO3-]
pH = рК(H2CO3) +
lg-------------;
[H2CO3]
[HCO3-]
рН = рК(H2CO3) + lg-------------
C⋅pCO2
В организме: [HCO3-]
---------- = 10
[H2CO3]
рН = 6,4 + lg10 = 6,4 + 1 = 7,4
[H2CO3]
[HCO3-]
рН = рК(H2CO3) + lg-------------
C⋅pCO2
В организме: [HCO3-]
---------- = 10
[H2CO3]
рН = 6,4 + lg10 = 6,4 + 1 = 7,4
Слайд 19Механизм действия
HCO3-/H2CO3
В случае накопления кислот в крови расходуется NaHCO3:
HCO3- +
H+ → H2CO3
При повышении кислотности увеличивается объем легочной вентиляции:
H2CO3 → CO2↑ + H2O
При увеличении щелочности расходуется H2CO3, уменьшается легочная вентиляция, накапливается CO2:
H2CO3 + OH- → H2O + HCO3-
При повышении кислотности увеличивается объем легочной вентиляции:
H2CO3 → CO2↑ + H2O
При увеличении щелочности расходуется H2CO3, уменьшается легочная вентиляция, накапливается CO2:
H2CO3 + OH- → H2O + HCO3-
Слайд 20Механизмы регуляции дыхания стабилизируют буферное соотношение в гидрокарбонатном буфере. Чувствительность дыхательного
центра к изменению рН очень велика.
Уменьшение рН на 0,1 Увеличивает объем легочной вентиляции в 2 раза
Таким образом, механизм действия гидрокарбонатного буфера связан с функцией дыхания
Уменьшение рН на 0,1 Увеличивает объем легочной вентиляции в 2 раза
Таким образом, механизм действия гидрокарбонатного буфера связан с функцией дыхания
Слайд 21Белковая буферная система
Составляет в плазме 7% буферной емкости крови.
R –
CH – COOH
|
NH2
Белок-соль
R – CH – COO- + H+ → R – CH – COOH
| |
NH3+ NH3+
|
NH2
Белок-соль
R – CH – COO- + H+ → R – CH – COOH
| |
NH3+ NH3+
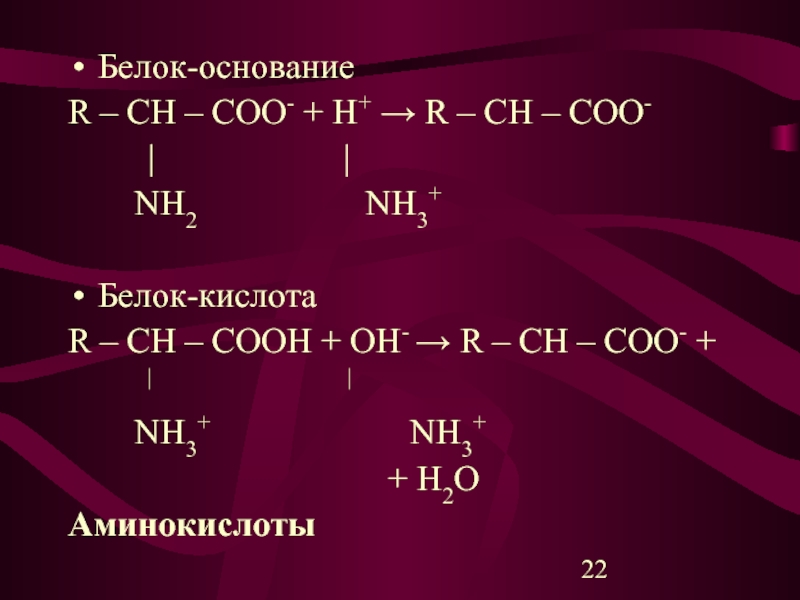
Слайд 22Белок-основание
R – CH – COO- + H+ → R – CH
– COO-
| |
NH2 NH3+
Белок-кислота
R – CH – COOH + OH- → R – CH – COO- +
| |
NH3+ NH3+
+ H2O
Аминокислоты
| |
NH2 NH3+
Белок-кислота
R – CH – COOH + OH- → R – CH – COO- +
| |
NH3+ NH3+
+ H2O
Аминокислоты
Слайд 23Фосфатная буферная система
Na2HPO4 + NaH2PO4
Концентрация ее компонентов в плазме невелика (фосфаты
выводятся с мочой). Составляет в плазме 1% буферной емкости крови и 4% - в эритроцитах. Наибольшее значение имеет в тканях, моче, пищеварительных соках. В крови буферное соотношение
Na2HPO4
----------- = 3,5
NaH2PO4
Фосфатная буферная система имеет более высокую емкость по кислоте
Na2HPO4
----------- = 3,5
NaH2PO4
Фосфатная буферная система имеет более высокую емкость по кислоте
Слайд 24Буферные системы эритроцитов
Гемоглобиновый-оксигемоглобиновый буфер
Составляет 35% буферной емкости крови
HHb ⇄ H+ +
Hb- (рК = 8,2)
HHbO2 ⇄ H+ + HbO2- (рК = 6,95)
HHb и HHbO2 – слабые кислоты, но HHbO2 – сильнее (около 65% HHbO2 находится в диссоциированном состоянии, а HHb – тоько на 10%)
При добавлении кислот:
H+ + Hb- → HHb;
При добавлении оснований:
HHbO2 + OH- → HbO2- + H2O
HHbO2 ⇄ H+ + HbO2- (рК = 6,95)
HHb и HHbO2 – слабые кислоты, но HHbO2 – сильнее (около 65% HHbO2 находится в диссоциированном состоянии, а HHb – тоько на 10%)
При добавлении кислот:
H+ + Hb- → HHb;
При добавлении оснований:
HHbO2 + OH- → HbO2- + H2O
Слайд 25Связь с дыханием
HHb + O2 → HHbO2 В легких
CO2:
Кровь → легкие
HHbO2 → HHb + O2 В тканях
CO2: Ткани → кровь
HHbO2 → HHb + O2 В тканях
CO2: Ткани → кровь
Слайд 26Кооперативность действия буферных систем крови
Фосфатная буферная система проявляет кооперативность действия с
гидрокарбонатной буферной системой. Если наступает истощение гидрокарбонатной буферной системы (в пределах 7,4), то фосфатная способна поддерживать рН в пределах 6,2-8,2.
Большой вклад в буферную емкость вносят органические фосфаты: триозофосфаты, гексозофосфаты, аденозинфосфаты, а также фосфолипиды (строительный материал клеточных мембран); сама мембрана обладает буферным действием
Большой вклад в буферную емкость вносят органические фосфаты: триозофосфаты, гексозофосфаты, аденозинфосфаты, а также фосфолипиды (строительный материал клеточных мембран); сама мембрана обладает буферным действием
Слайд 28Показатели
кислотно-основного состояния
крови
рН крови (7,4 ± 0,05)
Парциальное давление CO2
p CO2
= 40 ± 5 мм рт. ст.
алкалоз: 10 мм рт. ст.
ацидоз: 130 мм рт. ст.
Содержание гидрокарбонатов в плазме
C(H2CO3) = 24.4 ± 3 ммоль/л
Общее содержание буферных оснований в плазме крови (ВВ = 42 ± 3 ммоль/л)
Избыток или дефицит буферных оснований в крови (ВЕ) – в норме ± 3, при патологии ± 30 ммоль/л
алкалоз: 10 мм рт. ст.
ацидоз: 130 мм рт. ст.
Содержание гидрокарбонатов в плазме
C(H2CO3) = 24.4 ± 3 ммоль/л
Общее содержание буферных оснований в плазме крови (ВВ = 42 ± 3 ммоль/л)
Избыток или дефицит буферных оснований в крови (ВЕ) – в норме ± 3, при патологии ± 30 ммоль/л
Слайд 29Резервная щелочность крови
Способность крови связывать CO2
Она определяется количеством CO2, связанной
в виде гидрокарбонатов. Определяют общее количество CO2 и количество физически растворимой CO2 в исследуемой плазме. Вычитая из первой цифры вторую, получают искомую величину. Она выражается в объемных процентах CO2 (объем CO2 в мл на 100 мл плазмы). В плазме у человека резервная щелочность составляет 50-65% CO2
Слайд 30Нарушения К-О равновесия
Уменьшение емкости буферных систем крови по кислоте (ацидоз) или
по щелочи (алкалоз)
Причины:
Дыхание (состав газовой смеси, частота)
Потребление кислот и оснований
Метаболизм (диабет)
Причины:
Дыхание (состав газовой смеси, частота)
Потребление кислот и оснований
Метаболизм (диабет)
Слайд 31Виды нарушений К-О равновесия
Компенсированный ацидоз
Некомпенсированный ацидоз
Компенсированный алкалоз
Некомпенсированный алкалоз
Слайд 32Коррекция нарушений К-О равновесия
Натрия гидрокарбонат (4,5% раствор, рН = 8,1; 100-200
мл) применяют при ацидозе (сахарный диабет, инфекции, травмы), вводят в/в. В тяжелых случаях – 100 мл 8,4% раствора
Трисамин («трисбуфер») – триоксиметиламинометан. Водный раствор 3,66% (изотонический) рН = 10,2 обладает буферным действием, устраняет ацидоз; вводят в/в
Аскорбиновая кислота (5% раствор) применяют при алкалозе, вводят в/в
Трисамин («трисбуфер») – триоксиметиламинометан. Водный раствор 3,66% (изотонический) рН = 10,2 обладает буферным действием, устраняет ацидоз; вводят в/в
Аскорбиновая кислота (5% раствор) применяют при алкалозе, вводят в/в





![Вывод формулы рН буферных системВ растворе имеет место равновесиеCH3COOH ⇄ H+ + CH3COO- [H+][CH3COO-]Кд = ---------------------](/img/tmb/2/106750/a91e86b963d2f93aaa5321a433429c1c-800x.jpg)
![Cкислоты[H+] = КД ---------------- моль/л Cсоли CкислотырН = -lg[H+] = - lgКД – lg](/img/tmb/2/106750/6bd8cc47d4aa5beb8c96d74ab1549f0c-800x.jpg)










![Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера: [HCO3-]pH = рК(H2CO3) + lg-------------; [H2CO3] [HCO3-]рН](/img/tmb/2/106750/7528bdb10e834088de05c638e48fdf5c-800x.jpg)