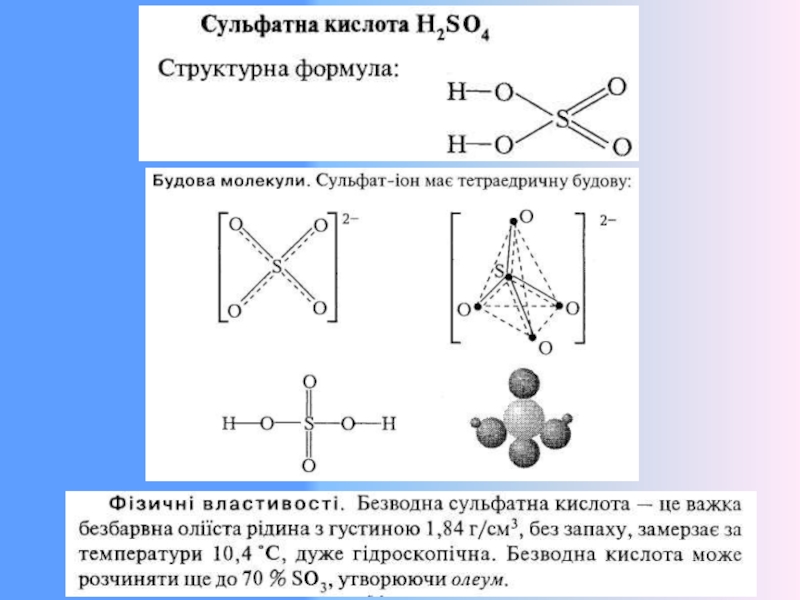
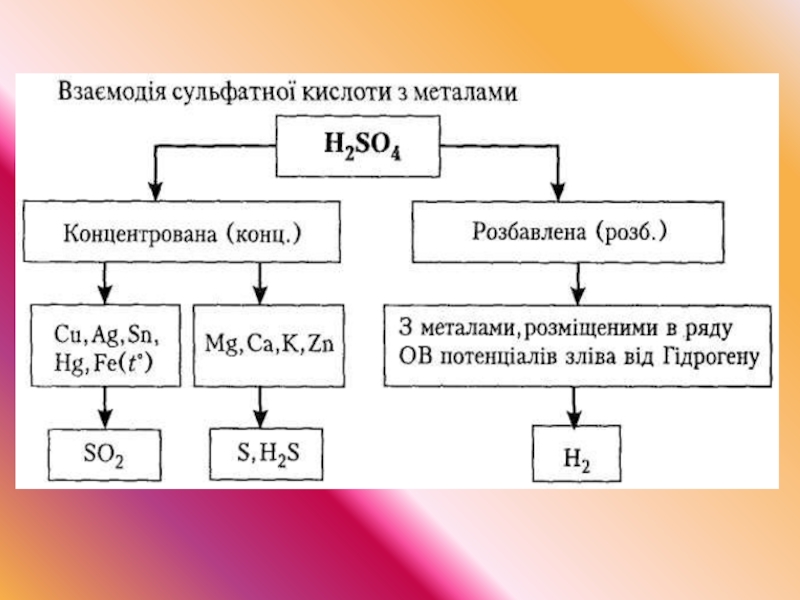
12. Солі сульфатної кислоти (сульфати). Властивості, застосування.
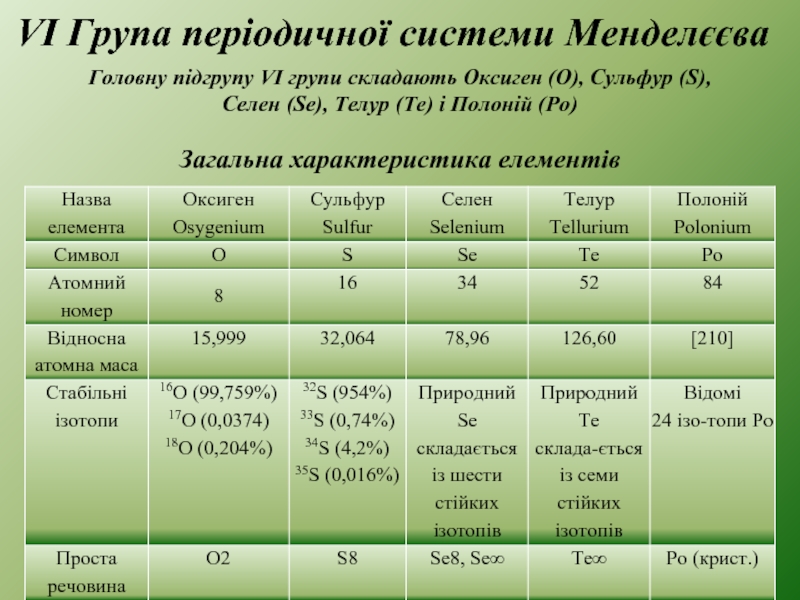
1. Загальна характеристика елементів.
2. Оксиген. Характеристика, одержання, властивості, застосування.
3. Озон. Характеристика, одержання, властивості, застосування.
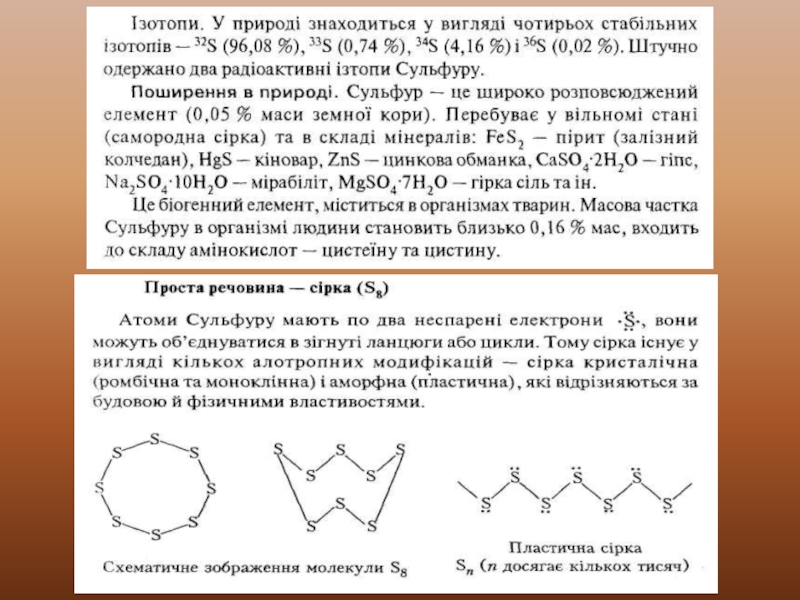
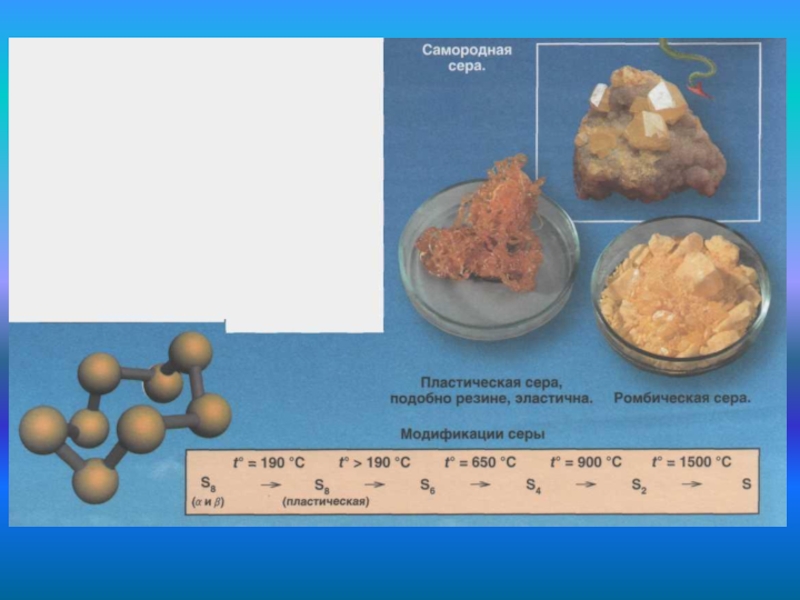
4. Сульфур. Характеристика, властивості, застосування.
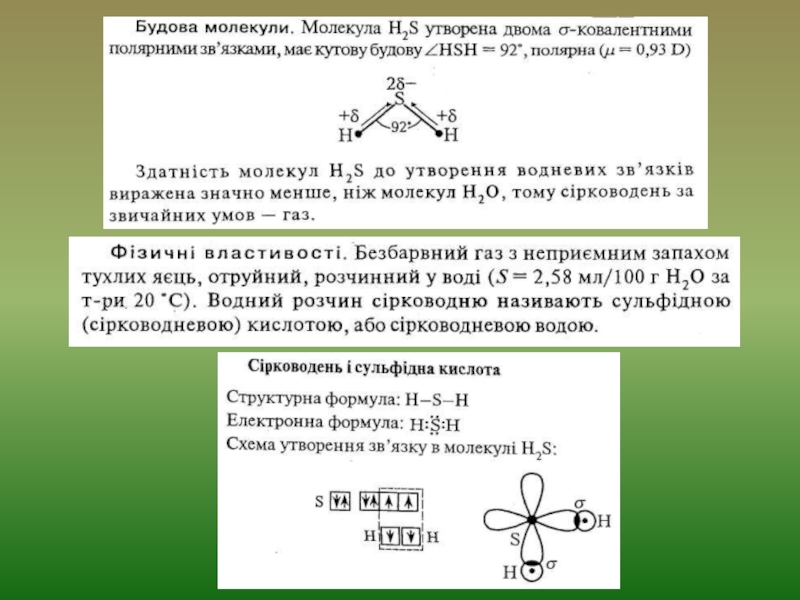
5. Сірководень і сульфідна кислота. Фізичні та хімічні властивості, одержання.
6. Солі сульфідної кислоти (сульфіди). Хімічні властивості сульфідів.
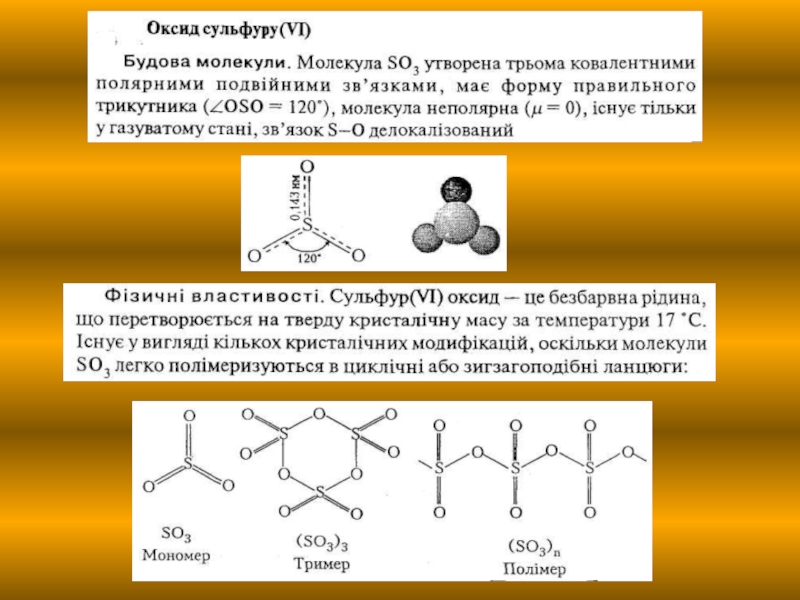
7. Оксид сульфуру (IV). Властивості, застосування.
8. Сульфітна кислота. Властивості, застосування.
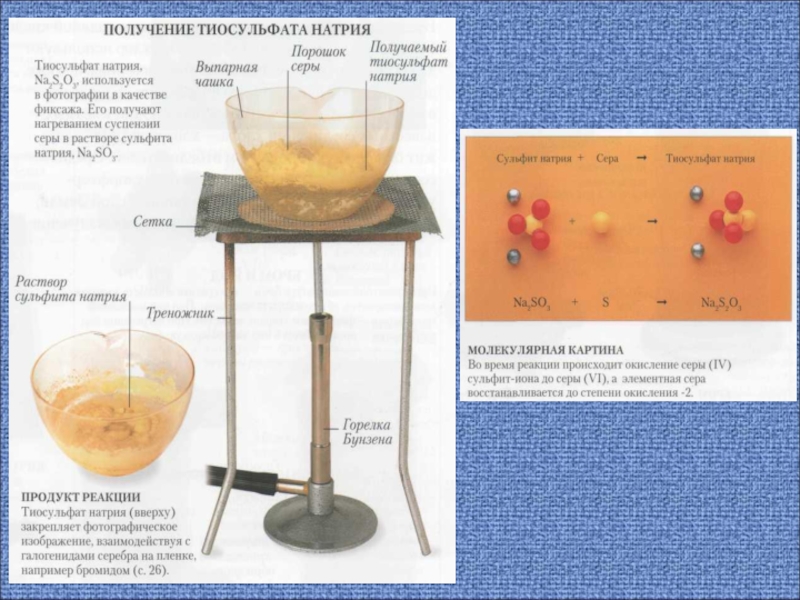
9. Солі сульфітної кислоти (сульфіти). Властивості, застосування.
ТЕМА: VI ГРУПА.
ПЕРІОДИЧНА СИСТЕМА МЕНДЕЛЄЄВА