- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотсодержащие органические соединения презентация
Содержание
- 1. Азотсодержащие органические соединения
- 2. Амины алифатического ряда
- 3. Так как в
- 4. Амины могут содержать
- 5. С аминами тесно
- 7. Номенклатура аминов
- 8. Для наименования первичных
- 9. Названия аминов могут
- 12. Химические свойства
- 14. Под влиянием
- 15. Увеличение основных свойств
- 16. Алкилы увеличивают
- 17. CH3 NH2 + HCl
- 19. Реакции аминов с азотистой кислотой
- 20. Вторичные амины при
- 21. Например:
- 22. Аминокислоты Аминокислотами
- 23. Строение, изомерия и номенкулатура
- 24. Простейшей
- 25. Химические свойства
- 26. Амфотерность аминокислот
- 27. NH2 CH2 COOH +
- 28. Кислотная и основная
- 29. CH2
- 30. Реакции аминогрупп в аминокислотах
- 31. Функциональные производные аминокислот
- 32. Отличительные свойства α, β, γ и δ-аминокислот
- 33. H2N CH C
- 34. Таким же путем
- 35. Белковые вещества.
- 36. В природе
- 37. При нагревании с
- 38. Каждый организм из
- 39. Строение белков.
- 41. Таким образом, белки,
- 42. Природа белка определяется
- 43. Большое значение имеет
- 44. Характерная особенность полипептидных
- 45. Спирали
- 46. Свойства белков.
- 47. Все
- 49. Осаждение белков из растворов.
- 51. Цветные реакции белков. Биуретовая реакция.
- 52. Таким образом, биуретовая
- 53. Ксантопротеиновая реакция.
- 54. Например,
- 56. Классификация белков.
- 57. Среди протеинов
- 58. Белковые
- 59. Ароматические амины
- 60. Номенклатура и изомерия
- 61. Простейшими
- 62. Толуидины по
- 63. а) жирно-ароматические
- 64. б) чисто ароматические
- 65. Химические свойства Реакции за счет аминогруппы
- 66. Основные
- 67. Реакции с азотистой кислотой
- 68. Третичные
- 69. Реакции за счет ароматического ядра
- 70. Действие окислителей.
- 71. Способы получения ароматических аминов
- 72. Ароматические диазосоединения и азосоединения (азокрасители)
- 73. В диазосоединениях
- 74. Диазосоединения существуют в
- 75. Под
- 76. Простейшее
- 78. Получение ароматических диазосоединений
- 81. Химические свойства диазосоединений
- 82. Реакции, протекающие с выделением азота.
- 83. Если соль
- 84. Реакции, протекающие без выделения азота.
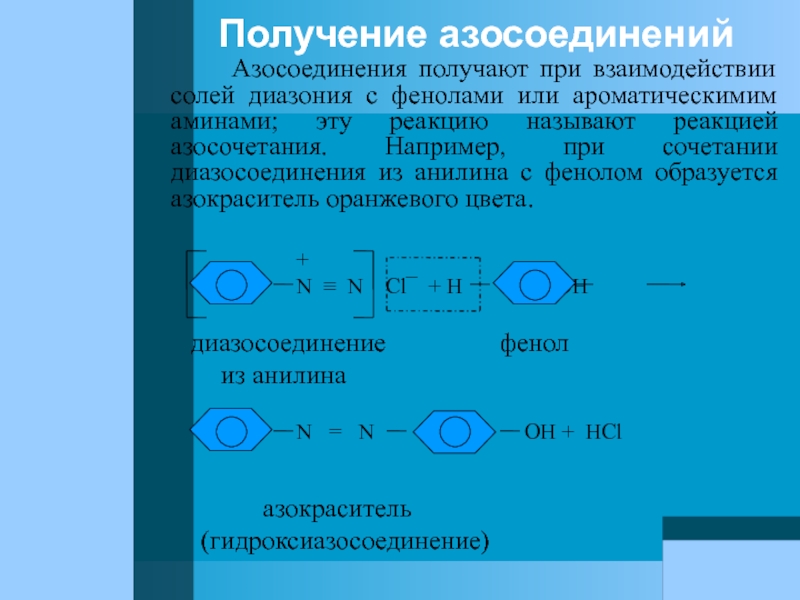
- 85. Получение азосоединений
- 87. Полная схема
- 88. 2) азосочетание
- 89. Рекомендуемая литература Пример списка литературы Коровин Николай
Слайд 1АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
К азотсодержащим органическим соединениям относят
Слайд 2Амины алифатического ряда
Амины - органические соединения, которые
R – H NH3 R – NH2
углеводород аммиак амин
Слайд 3 Так как в аммиаке радикалами могут быть
радикалом, называются первичными,
с двумя радикалами – вторичными
и с тремя радикалами – третичными
R R
| |
R – NH2 R – NH R – N – R
первичный вторичный третичный
амин амин амин
Слайд 4 Амины могут содержать одну, две и более
Следует иметь в виду, что диамины с двумя аминогруппами при одном углеродном атоме не существуют. Поэтому простейшим диамином является этилендиамин, содержащий две аминогруппы при различных углеродных атомах:
NH2 – CH2 – CH2 – NH2
этилендиамин
(1,2 - этандиамин)
Слайд 5 С аминами тесно связаны органические вещества, являющиеся
Производные гидроксида аммония, содержащие в комплексном аммониевом катионе вместо атомов водорода радикалы, называют гидроксидами замещенного аммония; соединения, содержащие ион четырехзамещенного аммония, в котором с азотом вместо всех четырех атомов водорода связаны четыре радикала, называют четвертичными аммониевыми основаниями:
Слайд 6
[NH4]+ OH-
гидроксид
аммония гидроксид четырехзамещенного
аммония
(четвертичное аммониевое
основание)
Слайд 7Номенклатура аминов
По правилам Международной номенклатуры, если
Слайд 8 Для наименования первичных аминов или диаминов с
CH3
|
CH3 – NH2 CH3 – CH – NH2
метиламин изопропиламин
CH2 – CH2 – CH2 – CH2
| |
NH2 NH2
тетраметилендиамин
Слайд 9 Названия аминов могут быть произведены и от
CH3
5 4 3 2 1
CH3 CH CH2 CH CH3
NH2
4-метил-2-пентанамин
Слайд 10
Названия вторичных и
CH2 CH3
СH3 NH CH3 CH3 CH2 N CH2 CH3
диметиламин триэтиламин
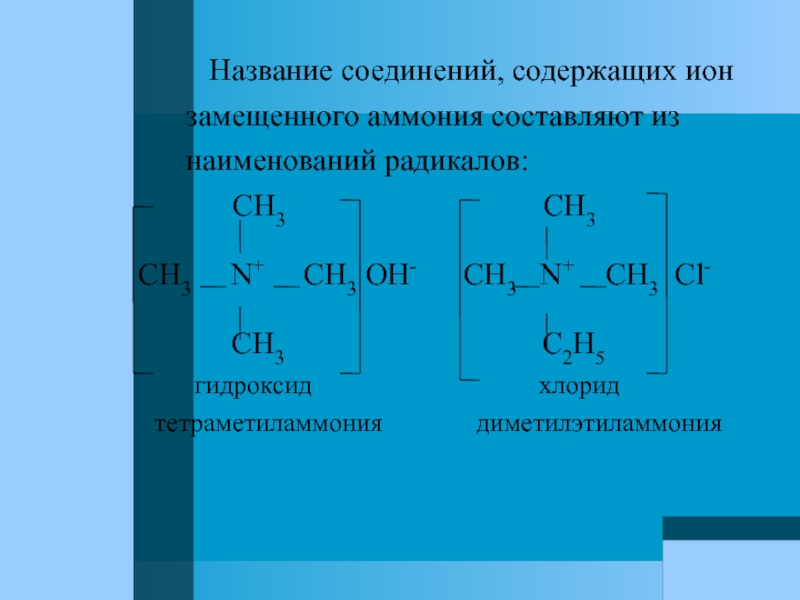
Слайд 11 Название соединений, содержащих ион
замещенного аммония составляют из
наименований радикалов:
CH3 CH3
CH3 N+ CH3 OH- CH3 N+ CH3 Cl-
CH3 C2H5
гидроксид хлорид
тетраметиламмония диметилэтиламмония
Слайд 12Химические свойства
Как производные аммиака амины
+
CH3 NH2 + HOH CH3 NH3 + OH ¯
метиламин ион метиламина
Слайд 13
Водные растворы аминов
CH3 NH3 OH .
Они имеют щелочную реакцию и окрашивают лакмус в синий цвет.
Слайд 14 Под влиянием простейших алкильных радикалов основные
Слайд 15 Увеличение основных свойств аминогруппы в аминах сравнительно
●● ●●
CH3 N H CH3 N H
H CH3
метиламин диметиламин
Слайд 16 Алкилы увеличивают общую электронную плотность атома
Как основание аммиак с кислотами дает соли аммония. Аналогично проявляются основные свойства аминов.
Например:
Слайд 17 CH3 NH2 + HCl CH3
метиламин хлорид метиламмония
CH3 NH2 + H2SO4 CH3 NH3 SO4
2
сульфат метиламмония
Слайд 18 Едкие щелочи,
основания, вытесняют амины из их
солей.
CH3 NH3 Cl + NaOH CH3 NH2 + H2O + NaCl
метиламин
Реакция ускоряется при нагревании.
Слайд 19Реакции аминов с азотистой кислотой
первичные амины выделяются газообразный азот
и вода и образуется спирт:
R N H2 + O = N OH R OH + N2 + H2O
первичный азотистая спирт
амин кислота
Например:
CH3 N H2 + O = N OH CH3OH + N2 +H2O
метиламин метанол
Слайд 20 Вторичные амины при действии на них азотистой
R R
N H + HO N = О N = N = О + H2O
R R
вторичный азотистая нитрозамин
амин кислота
Слайд 21 Например:
CH3
N H + HO N = О N N = О +H2O
CH3 CH3
диметиламин диметилнитрозамин
Третичные амины, в которых при азоте нет водорода, не реагируют с азотистой кислотой.
Слайд 22Аминокислоты
Аминокислотами называют карбоновые кислоты, в углеводородных
H2N R COOH.
Поскольку в аминокислотах находятся различные функциональные группы, они являются соединениями со смешанными функциями.
Слайд 23Строение, изомерия и номенкулатура
Изомерия аминокислот определяется положением аминогрупп
Названия аминокислот, поскольку в них главной функциональной группой является карбоксил, выводят из тривиальных или систематических названий соответствующих по углеродному скелету незамещенных кислот, добавляя к ним приставку амино-; положение аминогруппы по отношению к карбоксилу обозначают либо буквами греческого алфавита, либо цифрами. Для аминокислот общеприняты тривиальные названия.
Слайд 24 Простейшей является аминоуксусная (аминоэтановая) кислота;
CH3COOH H2N CH2 COOH
уксусная аминоуксусная
кислота кислота
(глицин, гликокол)
Слайд 25Химические свойства
Вследствие наличия в
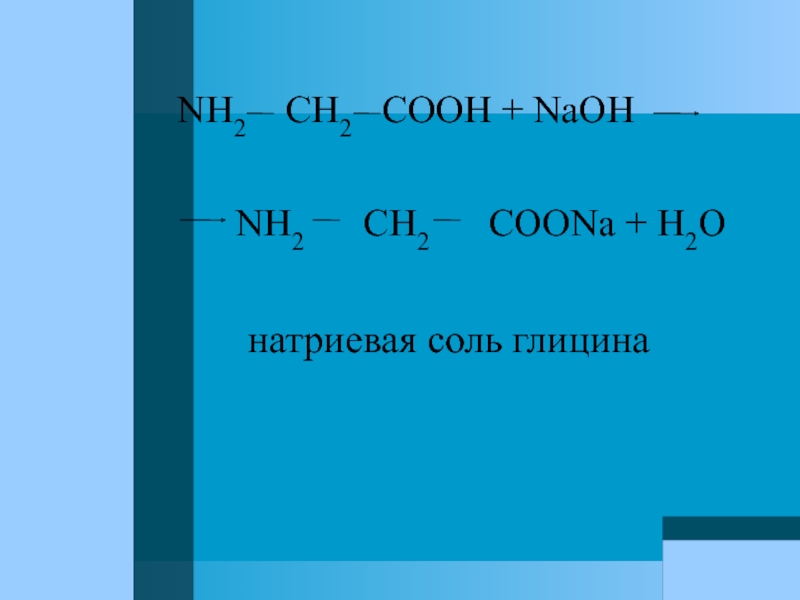
Слайд 26Амфотерность аминокислот
Аминокислоты – амфотерные соединения, образующие
NH2 CH2 COOH + HCl N+ H3 CH2COOH
Cl ¯
глицин хлороводородная соль
глицина
Слайд 28 Кислотная и основная группы внутри молекул аминокислот
Слайд 29 CH2 COOH
NH2 +NH3
глицин внутренняя соль глицина
Характерной особенностью аминокислот является способность к образованию внутрикомплексных солей с тяжелыми металлами.
Слайд 30Реакции аминогрупп в аминокислотах
Аминокислоты
СH3 CH COOH + HO N = O
NH2
α-аминопропионовая
кислота
CH3 CH COOH+ N2 + H2O
OH
α-гидроксипропионовая
кислота
Слайд 31Функциональные производные аминокислот
Подобно незамещенным карбоновым
O O O
C OH C OC2H5 C NH2
CH2 NH2 CH2 NH2 CH2 NH2
глицин сложный эфир амид
глицина глицина
Слайд 32Отличительные свойства α, β, γ и δ-аминокислот
Например:
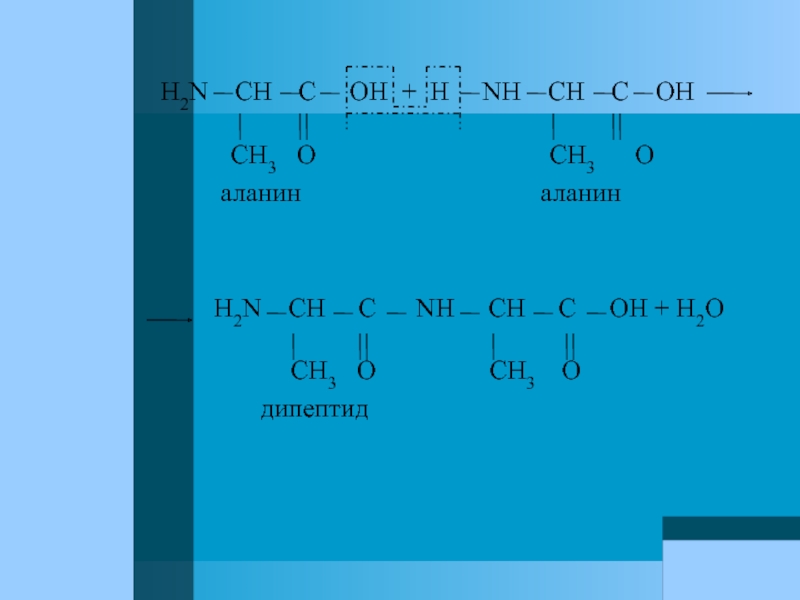
Слайд 33
H2N CH C OH + H
CH3 O CH3 O
аланин аланин
H2N CH C NH CH C OH + H2O
CH3 O CH3 O
дипептид
Слайд 34 Таким же путем из многих аминокислотных молекул
Слайд 35Белковые вещества.
Белковые вещества, или
Значение белков в природе исключительно велико, так как эти вещества играют первостепенную роль во всех явлениях жизни. Белки широко распространены в природе. Особенно много их содержат организмы животных и человека. Огромное значении белки имеют и для жизнедеятельности растительных организмов.
Слайд 36 В природе существует огромное множество различных
Элементный состав белков непостоянен. Все они содержат углерод (50-55%), водород (6,5-7,3%), кислород (21,5-23,5) и азот (15-18%), в состав многих входит сера (0,3-2,5%), некоторые содержат фосфор, железо, йод, медь.
Слайд 37 При нагревании с кислотами или со щелочами,
Слайд 38 Каждый организм из аминокислот, получаемых с белками
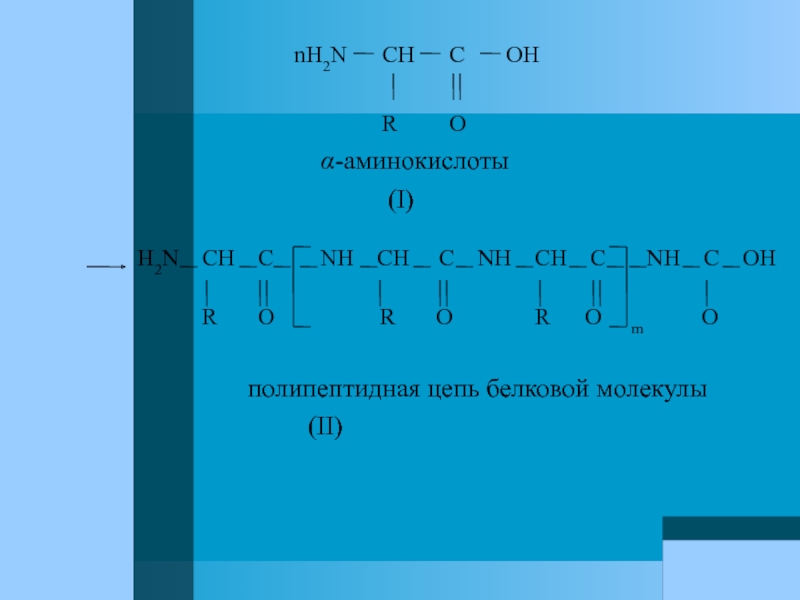
Слайд 39Строение белков.
Различные α-аминокислоты, образуя белки, соединяются
Слайд 40
R O
α-аминокислоты
(I)
H2N CH C NH CH C NH CH C NH C OH
R O R O R O m O
полипептидная цепь белковой молекулы
(II)
Слайд 41 Таким образом, белки, являющиеся природными высокомолекулярными соединениями,
Слайд 42 Природа белка определяется не только тем, какие
Слайд 43 Большое значение имеет образование между полипептидными цепями
Возникновение такого рода связей внутриполипептидных цепей также приводит к замыканию их в циклы различных размеров, к скручиванию, к образованию складок.
Слайд 44 Характерная особенность полипептидных цепей многих белков –
Слайд 45 Спирали и нити вторичной структуры,
Слайд 46Свойства белков.
Белки – высокомолекулярные
Белковые вещества разнообразны по своему агрегатному состоянию.
Слайд 47 Все белки нерастворимы в безводном
Белки, подобно аминокислотам, амфотерны и образуют соли как с кислотами, так и с основаниями. В их полипептидных цепях имеются свободные карбоксильные группы и аминогруппы.
Слайд 48 Наличие различных функциональных
Для всех белков характерны некоторые общие свойства: осаждение из растворов и цветные реакции.
Слайд 49Осаждение белков из растворов.
При
Слайд 50 Другие реагенты – соли
При нагревании многие белки также денатурируются – свертываются (например, яичный белок) и осаждаются из растворов, теряя способность растворяться в воде.
Слайд 51Цветные реакции белков. Биуретовая реакция.
Слайд 52 Таким образом, биуретовая реакция белков подтверждает наличие
Слайд 53Ксантопротеиновая реакция.
Если белки или их
Слайд 54 Например, если в полипептидной цепи
…HN CH CO… …NH CH CO …
CH2 C6H5 CH2 C6H4 NO2
звено фенилаланина нитросоединение
Слайд 55
В отличие
Слайд 56Классификация белков.
Среди белков
а) протеины, или простые белки, состоящие только из аминокислот и при гидролизе почти не образующие других продуктов;
б) протеиды, или сложные белки, состоящие из собственно белковой части, построенной из α-аминокислот, и из соединенной с ней небелковой части, иначе называемой простетической группой; при гидролизе эти белки кроме α-аминокислот образуют и другие вещества: углеводы, фосфорную кислоту, гетероциклические соединения и т.п.
Слайд 57 Среди протеинов выделяют несколько подгрупп, отличающихся
Протеиды подразделяют на подгруппы в зависимости от характера простетической группы, отщепляющейся при гидролизе от собственно белковой части.
Слайд 58 Белковые вещества классифицируются также по
а) фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму; к ним относят фиброин шелка, кератин шерсти;
б) глобулярные белки, молекулы которых имеют округлую форму; к ним относятся, например, альбумины, глобулины и ряд других, в том числе и сложные белки.
Слайд 59Ароматические амины
Производные ароматических углеводородов, содержащие
Слайд 60Номенклатура и изомерия
Для
C6H5 NH2 или NH2
анилин (фениламин)
Систематическое название анилина фениламин (фенил – одновалентный радикал бензола).
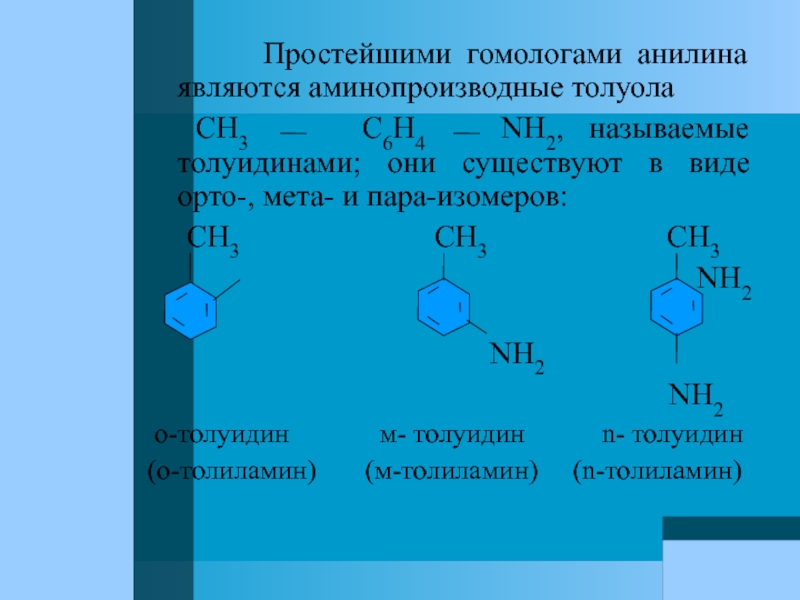
Слайд 61 Простейшими гомологами анилина являются аминопроизводные
CH3 C6H4 NH2, называемые толуидинами; они существуют в виде орто-, мета- и пара-изомеров:
CH3 CH3 CH3
NH2
NH2
NH2
о-толуидин м- толуидин n- толуидин
(о-толиламин) (м-толиламин) (n-толиламин)
Слайд 62 Толуидины по названию радикалов толуола можно
Ароматические амины, в которых, как в анилине, толуидинах, азот аминогруппы соединен только с одним ароматическим радикалом, являются первичными аминами; вторичные и третичные амины содержат в соединении с азотом соответственно два или три радикала и могут быть двух типов:
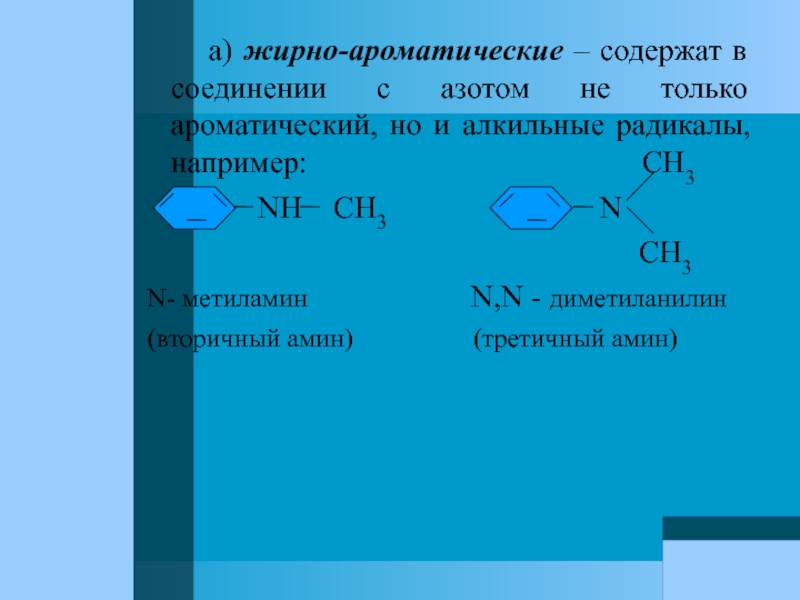
Слайд 63 а) жирно-ароматические – содержат в соединении
NH CH3 N
CH3
N- метиламин N,N - диметиланилин
(вторичный амин) (третичный амин)
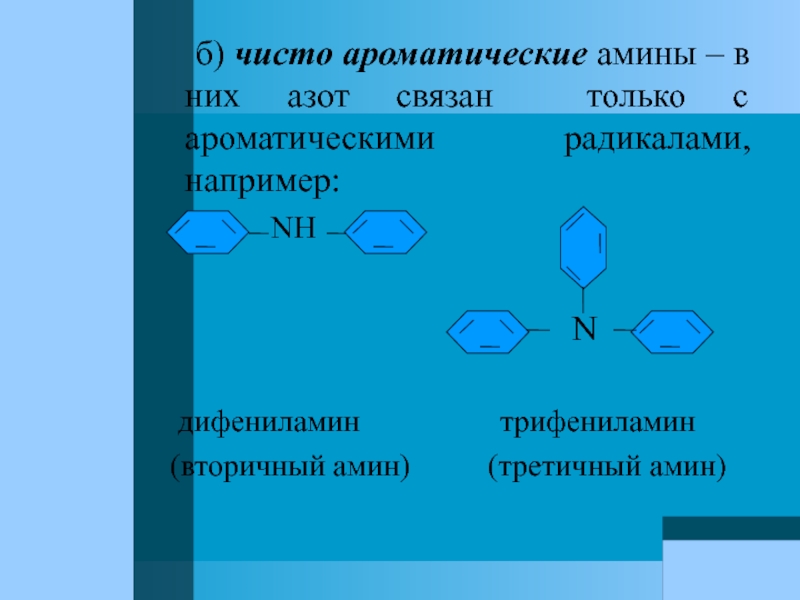
Слайд 64 б) чисто ароматические амины – в них
NH
N
дифениламин трифениламин
(вторичный амин) (третичный амин)
Слайд 65Химические свойства
Реакции за счет аминогруппы
Подобно
C6H5NH2 + HCl [ C6H5NH3 ] Cl
хлорид
фениламмония
C6H5NH2 + H2SO4 [ C6H5NH3 ]2 SO4
сульфат
фениламмония
Слайд 66 Основные свойства у ароматических аминов
Слайд 67Реакции с азотистой кислотой
+ +
NH3 Cl¯+ O = N OH N ≡ N Cl ¯
+ 2H2O
соль анилина азотистая диазосоединение
кислота (соль диазония)
Вторичные ароматические амины, подобно аминам жирного ряда, с азотистой кислотой образуют нитрозамины.
Слайд 68 Третичные ароматические амины, в отличии
(CH3)2 N H+HONO (CH3)2 N
+ NO+H2O
Слайд 69Реакции за счет
ароматического ядра
Аминогруппа как
NH2 NH2
Br Br
+ 3 Br2 + 3HBr
Br анилин 2,4,6 – триброманилин
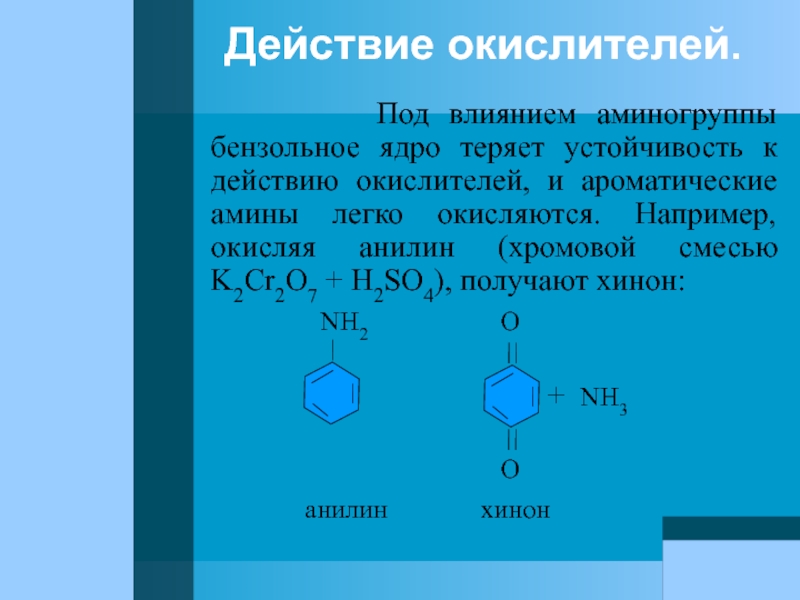
Слайд 70Действие окислителей.
Под влиянием аминогруппы бензольное
NH2 O
+ NH3
O
анилин хинон
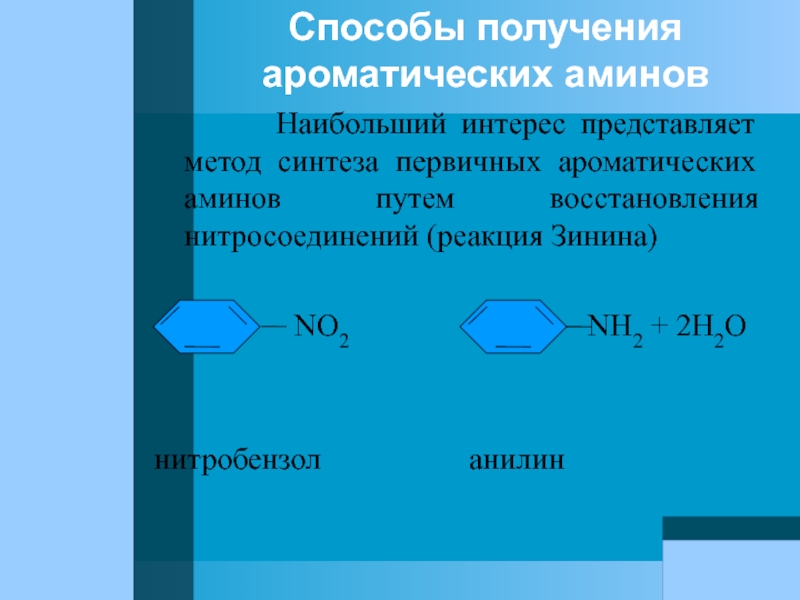
Слайд 71Способы получения ароматических аминов
Наибольший
NO2 NH2 + 2H2O
нитробензол анилин
Слайд 72Ароматические диазосоединения
и азосоединения (азокрасители)
Среди производных
N = N , называемую азогруппой.
Слайд 73 В диазосоединениях азогруппа связана только с
Ar N = N OH Ar N = N Ar
диазосоединение азосоединение
Слайд 74 Диазосоединения существуют в нескольких формах, легко превращающихся
формуле Ar N = N OH, называются диазогидроксидами, они обладают амфотерными свойствами. При взаимодействии с кислотами диазогидроксиды ведут себя как основания и образуют соли диазония:
+
Ar N = N OH + HCl Ar N N Cl¯ + H2O
диазогидроксид соль диазония
Слайд 75 Под действием щелочей соли диазония
+
Ar N N Cl¯ + NaOH Ar N = N OH + HCl
соль диазония диазогидроксид
Простейшее ароматическое диазосоединение является производным бензола. Соответствующая соль диазония, существующая в солянокислой среде, называется хлоридом бензолдиазония (это соединение называют также хлоридом фенилдиазония).
Слайд 76 Простейшее ароматическое диазосоединение является производным
Слайд 77 Образование этой соли под
N = N OH N+ N Cl¯
NaOH
диазогидроксид хлорид бензолдиазония
Соли диазония – наиболее важная форма диазосоединений.
Слайд 78Получение ароматических диазосоединений
Диазосоединения получаются при диазотировании
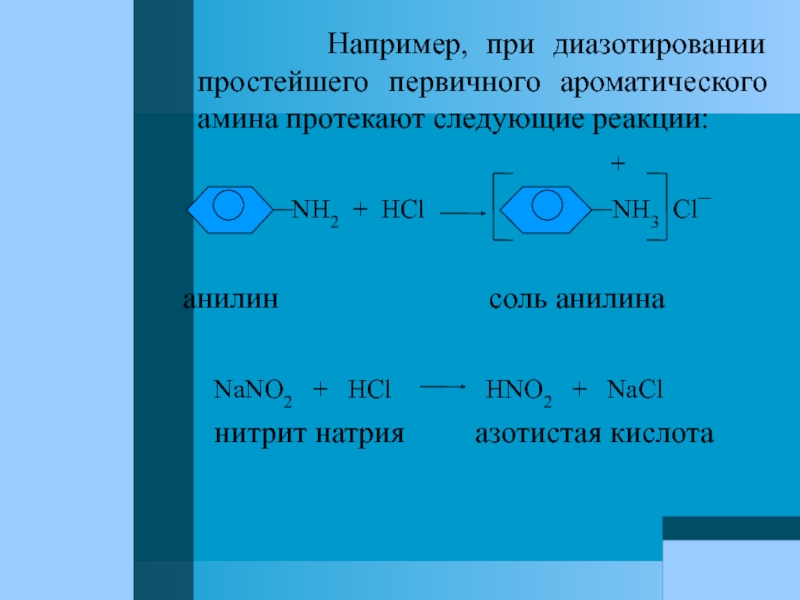
Слайд 79 Например, при диазотировании простейшего
+
NH2 + HCl NH3 Cl¯
анилин соль анилина
NaNO2 + HCl HNO2 + NaCl
нитрит натрия азотистая кислота
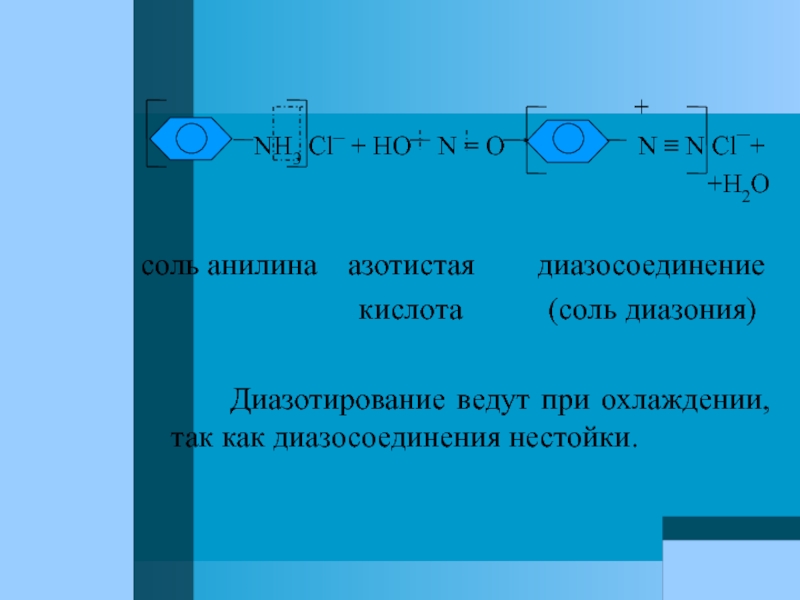
Слайд 80
NH3 Cl¯ + HO N = O N ≡ N Cl¯+
+H2O
соль анилина азотистая диазосоединение
кислота (соль диазония)
Диазотирование ведут при охлаждении, так как диазосоединения нестойки.
Слайд 81Химические свойства диазосоединений
Соли диазония – весьма
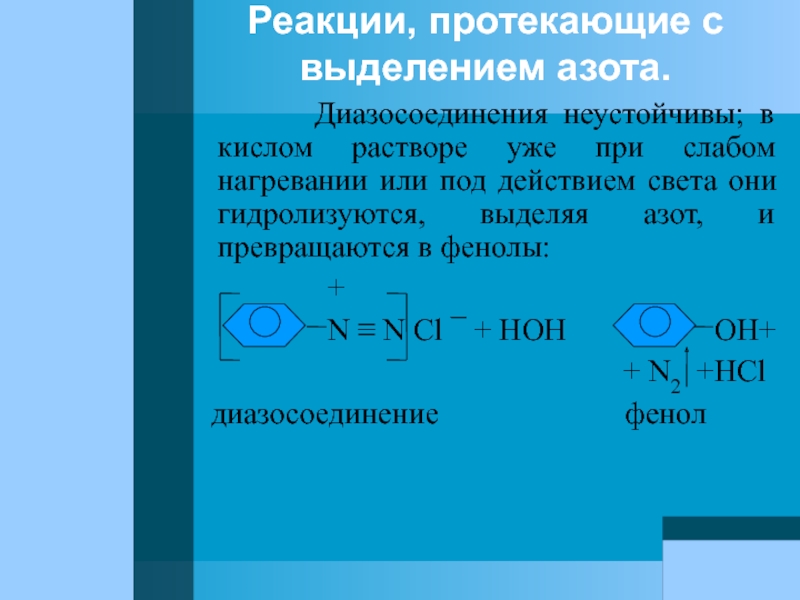
Слайд 82Реакции, протекающие с выделением азота.
Диазосоединения неустойчивы;
+
N ≡ N Cl ¯ + HOH OH+
+ N2 +HCl
диазосоединение фенол
Слайд 83 Если соль диазония – хлорид, бромид
+
N ≡ N Cl ¯ Cl + N2
хлорид бензолдиазония хлорбензол
Слайд 84Реакции, протекающие без выделения азота.
Простейшими азосоединениями является азобензол – вещество, в котором азогруппа
( N = N ) соединена с двумя остатками бензола:
N = N
Огромное значение имеют азосоединения, содержащие в ароматических ядрах гидроксильные группы или аминогруппы; они представляют собой большой класс красящих веществ, называемых азокрасителями.
Слайд 85Получение азосоединений
Азосоединения получают при взаимодействии
+
N ≡ N Cl¯ + H OH
диазосоединение фенол
из анилина
N = N OH + HCl
азокраситель
(гидроксиазосоединение)
Слайд 86 Если то же диазосоединение
С фенолами азосочетание ведут в щелочной среде, а с аминами в слабокислой или нейтральной.
Исходный для получения азокрасителей первичный ароматический амин, который путем диазотирования превращают в диазосоединение, называется диазосоставляющей, а фенол или амин, вводимый в азосочетание, – азосоставляющей красителя.
Слайд 87 Полная схема синтеза азокрасителя (азосоединения), известного
1) диазотирование +
O2N NH2 O2N NH3 Cl¯
n-нитроанилин соль нитроанилина
+ _
O2N N ≡ N Cl + 2H2O
диазосоединение
хлорид п-нитробензолдиазония
Слайд 88 2) азосочетание
+
O2N N ≡ N Cl¯ + H
β-нафтол (азосоставляющая)
OH
O2N N = N + HCl
азокраситель (паракрасный)
β-нафтол вступает в азосочетание за счет водорода в орто-положении к группе OH (заместителю I рода) (α-нафтол сочетается за счет водорода в пара положении к группе OH).
Слайд 89Рекомендуемая литература
Пример списка литературы
Коровин Николай Васильевич. Общая химия: Учебник. - 2-е
Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. – 2-е изд., перераб. и доп. – М.: Дрофа, 2002. – 448 с.: ил.
Ахметов Наиль Сибгатович. Общая и неорганическая химия: Учебник для студ. химико-технологических спец. вузов / Н.С.Ахметов. - 4-е изд., исп. - М.:Высш. шк.: Академия, 2001. - 743с.: ил.
Глинка Николай Леонидович. Общая химия: Учебное пособие для вузов / Н.Л.Глинка; Ермаков Л.И (ред.) – 29–е изд.; исп. – М.: Интеграл Пресс, 2002 – 727с.: ил.
Писаренко А.П., Хавин З.Я. Курс органической химии – М.: Высшая школа,1975,1985.
Альбицкая В.М., Серкова В.И. Задачи и упражнения по
органической химии. – М.: Высш. шк., 1983.
Грандберг И.И. Органическая химия – М.: Дрофа, 2001.
Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия М.: Высш. Шк., 1981
Иванов В.Г., Гева О.Н., Гаверова Ю.Г. Практикум по
органической химии – М.: Академия., 2000.