Орындаған:.
Тобы:
Қабылдаған: Серимбетова Қ.М.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Атомның кванты – механикалық моделі. Квант сандары презентация
Содержание
- 1. Атомның кванты – механикалық моделі. Квант сандары
- 2. Жоспары: I.Кіріспе II.Негізгі бөлім 1)Резерфордтың планетарлық
- 4. Атомның ішінде электр
- 5. Эрнест Резерфорд(1871-1937жж)
- 6. Ядро оң зарядталған, оның радиусы
- 7. Атомдар қалыпты жағдайда бейтарап болатындықтан, электрондардың заряды
- 8. Бор қағидалары, Бор постулаттары – даниялық физик Бордың – даниялық
- 9. 2. Сәуле шығару немесе жұту тек бiр
- 10. Сутекті атомның (Z — ядро заряды) Борлық
- 11. Бор теориясының негізгі кемшіліктері: Теория атомдардың спектрлік
- 12. Elements www.animationfactory.com 1924 жылы Луи де Бройль
- 13. Кванттық сандар Кванттық сандар– кванттық жүйелерді (атом
- 14. Атомдағы электронның кез келген тұрақты күйі белгілі
- 15. Магнит квант саны ml – бұлттар орбиатльдарының
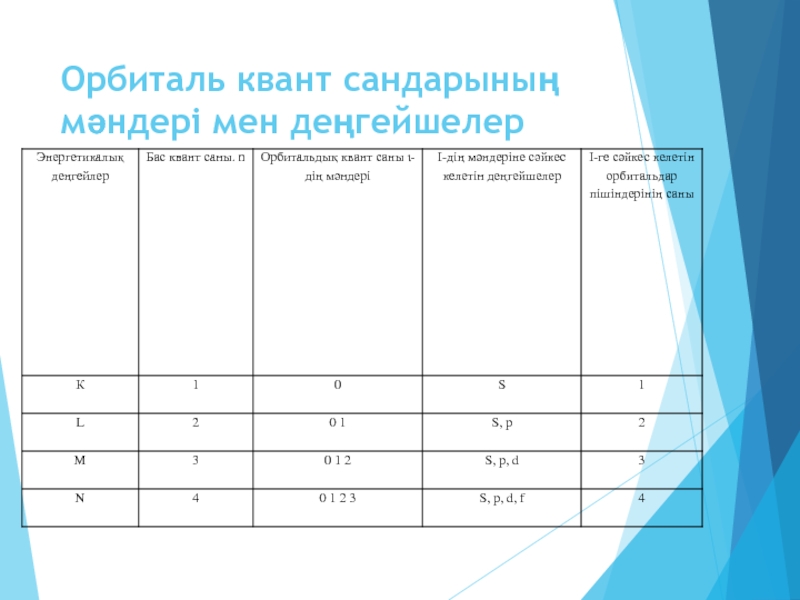
- 16. Орбиталь квант сандарының мәндері мен деңгейшелер
- 17. Магнит квант саны (ml ) орбитальдардың
- 18. Спинді кванттық саны. Спин
- 19. Атомдардағы электрондар Паули принципі:атомда
- 20. ж Қорытынды Кванттық механика бойынша
- 21. Пайдаланылған әдебиеттер: Патсаев Ә.Қ.,
- 22. Назар аударғандарыңызға рахмет!
Слайд 1Оңтүстік Қазақстан Мемлекеттік Фармацевтика Академиясы
Атомның кванты – механикалық моделі.Квант сандары
Фармакогнозия және
Слайд 2Жоспары:
I.Кіріспе
II.Негізгі бөлім
1)Резерфордтың планетарлық моделі
2)Бор постулаттары
3)Микробөлшектердің корпускулярлы – толқындық дуализмі
4)Квант сандарының
5)Атомда электрондардың таралу ережелері мен негізгі принциптері
III.Қорытынды
IV.Пайдаланылған әдебиеттер
Слайд 3
Д. И. Менделеев атомдық массаларының осу ретімен орналасқан химиялық элементтер қасиеттерінің периодты өзгеруінің себептерін айқындап бере алмады. Элементтердің қасиеттері не себепті олардың салыстырмалы атомдық массаларына периодты түрде тәуелді болатыны белгісіз еді. Бірақ Д. И. Менделеев элементтердің атом құрылысы айқындалған сайын бұл сұраққа жауап беруге болатынын алдын ала болжады.
ХХ ғасырда атом құрылысы айқындалып, оның құрылыс теориясы ұсынылды. Ғалымдар атомның ядродан және оның айналасында қозғалып жүретін электрондардан тұратынын анықтады.
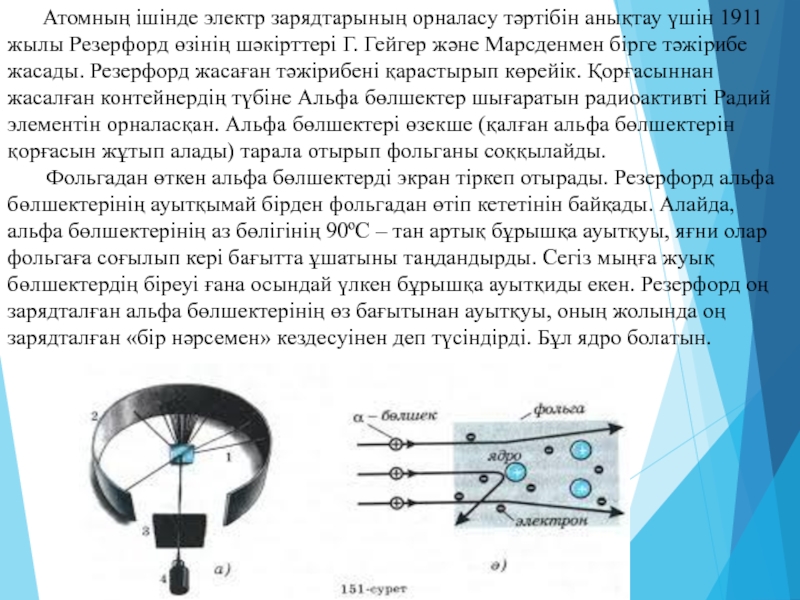
Слайд 4 Атомның ішінде электр зарядтарының орналасу тәртібін анықтау
Слайд 6
Ядро оң зарядталған, оның радиусы 10 – 13см. Атомның массасы түгел
Слайд 7Атомдар қалыпты жағдайда бейтарап болатындықтан, электрондардың заряды мен ядроның заряды бірін
Слайд 8
Бор қағидалары, Бор постулаттары – даниялық физик Бордың – даниялық физик Бордың атомның орнықты (стационар) күйін және
1. Атомдар, тек стационарлық күйлер деп аталатын қандай да бiр күйлерде ғана бола алады. Бұл күйдегi электрондар ядроны айнала үдей қозғалғанымен өзiнен сәуле шығармайды. Бірінші қағида немесе орнықты күйлер қағидасы: атомдағы электрондар кез келген энергиясы бар орбиталармен емес, тек белгілі бір энергиясы бар орбиталар бойымен қозғалады. Оларды орнықты орбиталар деп атайды. Орнықты орбиталардың энергиясы тек белгілі бір дискретті (үзікті) мәндерді ғана иеленеді. Электрондар мұндай орнықты орбита бойымен қозғалып жүргенде сәуле шығармайды.
Слайд 92. Сәуле шығару немесе жұту тек бiр стационарлық күйден екiншi стационарлық
Мұндағы En және Em осы стационар күйлердiң энергиясы, ал –h Планк тұрақтысы. Екінші қағида немесе сәуле шығарудың жиіліктік шарты: атом бір орнықты күйден екінші бір сондай күйге ауысқанда ғана жарықтың бір фотонын жұтады не шығарады. Шығарылған не жұтылған фотонның энергиясы (һν) екі орнықты күй энергияларының (En және Em) айырымына тең (һν = мұндағы ν – шығарылған не жұтылған сәуле фотонының жиілігі, һ – Планк тұрақтысы).
Атомдардың энергетикалық күйлерiн энергия деңгейлерi арқылы белгiлеп, сәуле шығару және жұту үрдiстерiн көрнектi түрде көрсету ыңғайлы.
3. Энергия үздіксіз емес, тек белгілі бір порция – квант түрінде бөлінеді не сіңіріледі.
Слайд 10Сутекті атомның (Z — ядро заряды) Борлық моделі, мұндағы теріс зарядты
Слайд 11Бор теориясының негізгі кемшіліктері:
Теория атомдардың спектрлік сипатының барлық көріністі бөліктерін түсіндіруге
Ол химиялық байланысты сандық тұрғыдан есептеуге мүмкіндік бермиді
Слайд 12Elements
www.animationfactory.com
1924 жылы Луи де Бройль корпускулалық – толқынды нанымды ұсынды, яғни
Слайд 13Кванттық сандар
Кванттық сандар– кванттық жүйелерді (атом ядросын, атомды, молекуланы, т.б.), жеке
Слайд 14Атомдағы электронның кез келген тұрақты күйі белгілі квант сандарының мәнімен сипатталады.
n – (бас квант саны ) атомдағы электронның энергиясын және энергетикалық деңгейін, яғни АО өлшемін анықтайды. Бас квант саны 1- 7 мәндерін ( периодтық жүйедегі период номеріне сәйкес) қабылдайды.
l – орбиталь квант саны атомдағы электронның энергиясын және электрондық орбитальдардың пішінін анықтайды,мәні 0 – ( n - 1 ) қабылдайды. l = 0,1,2,3 сәйкес атомдық орбитальдар s- , p-, d-, f – орбитальдар деп аталады.
l = 0 .... п – 1
n = 1, l = 0 (s)
п = 2, I = 0, 1 (s, p)
п = З, I = 0, 1, 2 (s, p, d)
п = 4, I = 0, 1, 2, З (s, p, d, f)
l = 0 болса, электронның пiшiнi шар, l =1 болса, гантель,
Слайд 15Магнит квант саны ml – бұлттар орбиатльдарының кеңістіктегі орналасуын сипаттау үшін
Спин квант саны ms – электронның ішкі қозғаласын,бағытын сипаттайды. Оның мәні: +1/2 және -1/2.
Слайд 17Магнит квант саны (ml ) орбитальдардың электрон бұлттарының кеңiстiкте орналасу
ml = - l .... 0 .... + l
l = 0 (s) ml = 0
l = 1 (p) ml = -1, 0, +1
l = 2 (d) ml = -2, -1, 0, +1, +2
l = 3 (f ) ml = -3, -2, -1, 0, +1, +2, +3
Слайд 18 Спинді кванттық саны. Спин – ол электронның өзінің
mS = + 1/2 Спинді сипаттау үшін төртінші кванттық санын m енгізеді, оны спиндік кванттық саны деп атайды. Ол тек екі мәнді +1/2 және -1/2 қабылдай алады.
Сонымен атомдағы электронның күйі төрт кванттық санының көмегімен өрнектеле алады: n, 1, m. Олар электронның энергиясын,оның формасын, түрі мен пішінін, орбитальдар мен спиннің қаныққандығын сипаттайды.
Слайд 19Атомдардағы электрондар
Паули принципі:атомда төрт квант сандарының мәндері бірдей
Слайд 20ж
Қорытынды
Кванттық механика бойынша электронның толқындық және бөлшектікіндей қасиеті болады.
Слайд 21
Пайдаланылған әдебиеттер:
Патсаев Ә.Қ., Махатов Б.Қ., Жайлау С.Ж.,Мамытова В.К. “Бейорганикалық химия“-Шымкент,
Патсаев Ә.Қ., Мамытова В.К.,Нарманов М.М., Серимбетова Қ.М. Бейорганикалық химия пәні бойынша студеттердің өзіндік жұмыстарына арналған (фарм.фак.үшін) қолданба.Шымкент 2006ж.
Интернет желісі: www.google.kz ,