- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Второе начало термодинамики презентация
Содержание
- 1. Второе начало термодинамики
- 2. Лекция № 3 Второе начало
- 3. Обратимым процессом называется такое изме- нение состояния
- 4. Процесс называют обратимым, если он протекает
- 5. Процесс называется необратимым, если он протекает
- 6. Свойством обратимости обладают только равновесные процессы.
- 7. При адиабатическом расширении газа условие
- 8. Адиабатный (адиабатический) процесс Это процесс, происходящий
- 9. Подставляя dT в уравнение:
- 10. уравнение Пуассона или уравнение адиабаты для идеального
- 12. Конечно, в реальных условиях и в этом
- 13. Второе начало термодинамики
- 14. Исторически второе начало термодинамики
- 15. КПД для обратимой машины
- 16. Если рассматривать процесс с точки
- 17. Отношение
- 18. В равенстве Клаузиуса Т – температура
- 19. Энтропией S называется
- 20. Понятие энтропии было впервые введено Рудольфом Клаузиусом
- 22. Изменение энтропии в изопроцессах
- 23. Таким образом, по этой формуле можно
- 24. Так как, а
- 25. Изменение энтропии ΔS1→2 идеального
- 26. изобарический:
- 27. Изменение энтропии в изопроцессах:
- 28. Поведение энтропии в процессах
- 29. 1. Переход вещества из твердого состо-яния (фазы)
- 30. 4. Закон плавления: количество тепла δQ, которое
- 31. Этот закон справедлив и для кристаллизации, правда,
- 32. Можно использовать термодинамичес-кий смысл энтропии: с точки
- 33. или
- 34. Так как температура системы в данном фазовом
- 35. Из этой формулы следует, что
- 36. Поэтому при равной температуре энтропия
- 37. Фазовый переход «жидкость – газ»
- 38. 2. При испарении система поглощает тепло, при
- 39. В процессе фазового перехода «жидкость – газ»
- 40. Коэффициент пропорции r в этом выражении, есть
- 41. Изменение энтропии в этом процес-се можно найти
- 42. При равных температурах фазовая область молекул газа
- 43. Изменения энтропии при обратимых и
- 44. Обратимый цикл Карно Мы
- 45. Изменение энтропии нагревателя:
- 46. то
- 47. Необратимый цикл Карно Мы знаем, что
- 48. Таким образом Это неравенство
- 49. Для
- 50. Различные формулировки
- 51. При любом необратимом
- 52. При обратимом процессе:
- 53. Первое и второе начала термодинамики в объединенной
- 54. Невозможность убывания энтропии привело к выводу
- 55. Третье начало термодинамики
- 57. Согласно Нернсту, изменение энтропии ΔS стремится к
- 58. Как первое и второе начала термодинамики, теорема
- 59. Следствием Третьего начала является то что,
- 60. ЛЕКЦИЯ ЗАКОНЧЕНА!
Слайд 2 Лекция № 3
Второе начало термодинамики.
1. Обратимые и необратимые процессы.
2. Энтропия. Второе начало термодинамики.
3. Неравенство Клаузиуса. Закон возраста-
ния энтропии.
4. Различные формулировки второго начала
термодинамики.
Слайд 3Обратимым процессом называется такое изме-
нение состояния системы (или одного отдельного тела),
Слайд 4 Процесс называют обратимым, если он протекает таким образом, что после окончания
Слайд 5 Процесс называется необратимым, если он протекает так, что после его
Слайд 6 Свойством обратимости обладают только равновесные процессы.
Например, обратимым можно считать процесс адиабатического расширения или сжатия газа.
Слайд 7 При адиабатическом расширении газа условие теплоизолированности системы исключает непосредственный
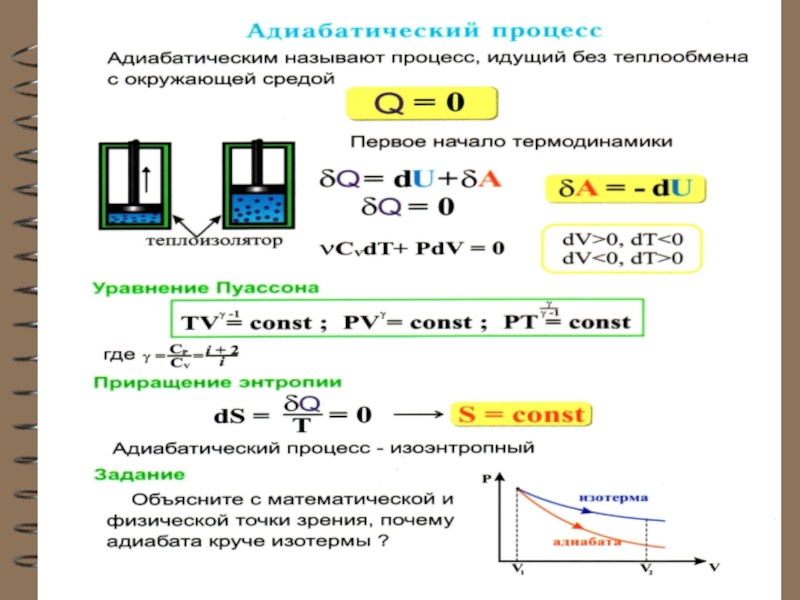
Слайд 8 Адиабатный (адиабатический) процесс
Это процесс, происходящий без теплообмена с окружающей средой,
При адиабатном процессе работа системы (или над системой) совершается за счет изме-нения внутренней энергии газа:
(из I начала ТД: при ).
Вывод уравнения адиабаты.
и δA = PdV :
Для 1 моля идеального газа:
Слайд 9 Подставляя dT в уравнение:
Делим на
где
Т.к. γ = const ( для одноатомного газа γ = 5/3,
для 2-х атомного γ = i+2/i =7/5=1,4 ), то:
Слайд 10уравнение Пуассона или уравнение адиабаты для идеального газа
Или
Слайд 12 Конечно, в реальных условиях и в этом случае всегда имеется некоторая
Слайд 13 Второе начало термодинамики
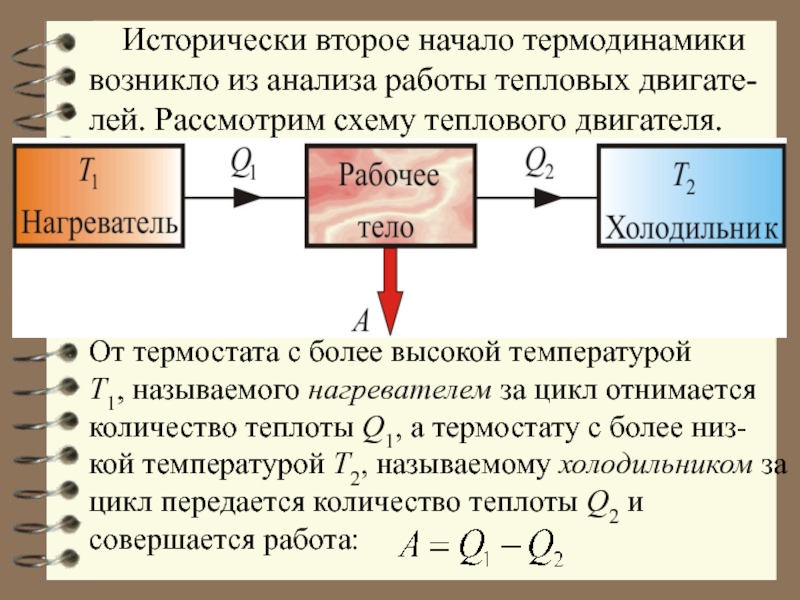
Слайд 14 Исторически второе начало термодинамики возникло из анализа работы тепловых
Слайд 16 Если рассматривать процесс с точки зрения изме-нений, происходящих в
полученное и соответственно отданное рабочим телом. Q1 и Q2 надо приписать противоположные знаки, т.е. Q1 > 0, a Q2 < 0. Тогда для необратимого процесса:
Для обратимого процесса:
Слайд 17 Отношение иногда называют, по Лоренцу,
сумма приведённых теплот равна нулю.
Система обратимым путём
переходит из состояния 1 в 2 состояние 2 и обратно, то
сумма приведённых теплот
равна:
Приведённое количество
теплоты в обратимом круго-
вом процессе равно нулю
(равенство Клаузиуса):
Слайд 18 В равенстве Клаузиуса Т – температура системы, при которой ей
- есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние, т.е. эта функция является функцией состояния.
Слайд 19 Энтропией S называется функция состояния системы, дифференциал
- для обратимого
процесса.
Изменение энтропии в обратимом процессе, переводящем систему из состояния 1 в 2:
Слайд 20 Понятие энтропии было впервые введено Рудольфом Клаузиусом
Слайд 21 Клаузиус
Слайд 22 Изменение энтропии в изопроцессах
Энтропия системы является
Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии:
Слайд 23 Таким образом, по этой формуле можно определить энтропию лишь с точностью
Слайд 25 Изменение энтропии ΔS1→2 идеального газа при переходе его
Слайд 26изобарический:
Слайд 28 Поведение энтропии в процессах
изменения агрегатного состояния
Фазовый переход «твердое тело – жидкость».
Из школьного курса физики хорошо
известны четыре факта об этом переходе.
Слайд 291. Переход вещества из твердого состо-яния (фазы) в жидкое называется плав-лением,
Слайд 304. Закон плавления: количество тепла δQ, которое необходимо для плавле-ния вещества
Слайд 31 Этот закон справедлив и для кристаллизации, правда, с одним отличием: δQ
Слайд 32Можно использовать термодинамичес-кий смысл энтропии: с точки зрения термодинамики энтропия –
Слайд 34 Так как температура системы в данном фазовом переходе не меняется и
Слайд 35 Из этой формулы следует, что при плавлении энтропия возрастает,
Слайд 36 Поэтому при равной температуре энтропия твердого тела меньше энтропии
Слайд 37Фазовый переход «жидкость – газ»
Этот переход обладает всеми свойствами
Существует четыре факта также знакомые из школьного курса физики.
1. Переход вещества из жидкости в газовую фазу называется испарением, а обратный переход – конденсацией.
Слайд 38 2. При испарении система поглощает тепло, при конденсации – теряет. 3. Процессы
Слайд 39 В процессе фазового перехода «жидкость – газ» температура остается постоянной и
Слайд 40 Коэффициент пропорции r в этом выражении, есть константа, зависящая от вещества
Слайд 41 Изменение энтропии в этом процес-се можно найти просто, считая процесс равновесным.
Т.е. при испарении энтропия возрастает, а при конденсации уменьшается.
Слайд 42 При равных температурах фазовая область молекул газа значительно больше фазовой области
Слайд 43 Изменения энтропии при обратимых и
Итак, энтропия – отношение полученной или отданной системой теплоты в обратимом процессе, к температуре, при которой происходит эта передача:
Энтропия – величина аддитивная, т.е. она равна сумме энтропий всех тел входящих в систему:
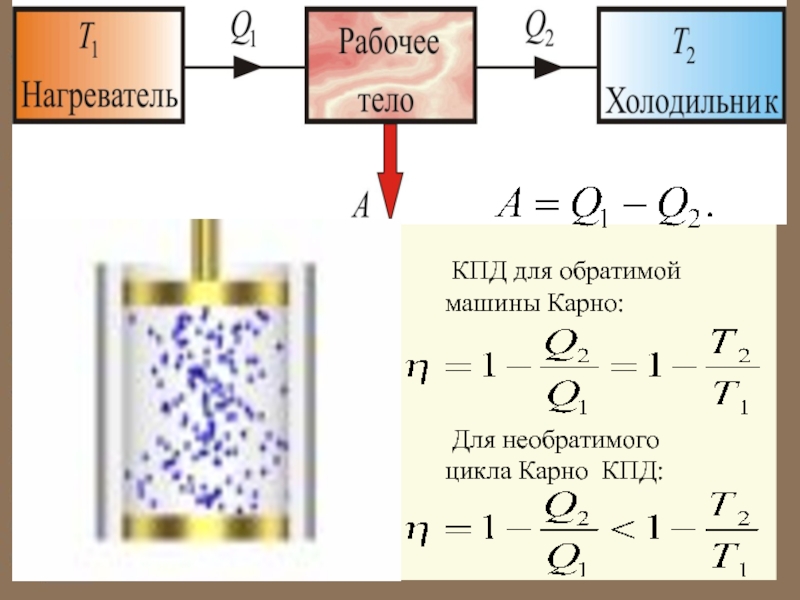
Слайд 44Обратимый цикл Карно
Мы знаем, что, в тепловой машине,
Изменение энтропии газа
так как газ возвращается в исходное состояние.
Слайд 48Таким образом Это неравенство Клаузиуса. Неравенство Клаузиуса является математической записью
Слайд 49 Для замкнутой системы
Для произвольного процесса,
где, знак равенства – для обратимого процесса; знак больше − для необратимого.
Слайд 50 Различные формулировки
второго начала термодинамики
Слайд 51 При любом необратимом процессе энтропия увеличивается до
Слайд 52 При обратимом процессе:
Слайд 53 Первое и второе начала термодинамики в объединенной форме имеют вид:
знак равенства – для обратимого процесса; знак больше − для необратимого процесса.
Слайд 54 Невозможность убывания энтропии привело к выводу о невозможности создания вечного
вторым началом термодинамики и имеет ряд формулировок:
1. Невозможен процесс, единственным результа- том которого является совершение работы, экви- валентной количеству теплоты, полученной от
нагревателя ( формулировка Кельвина).
2. Невозможен процесс, единственным результа- том которого является передача энергии в форме теплоты от холодного тела к горячему телу (формулировка Клаузиуса).
Слайд 55 Третье начало термодинамики
Недостатки первого и второго
На основании обобщения экспериментальных исследований свойств различных веществ при сверхнизких температурах был установлен закон, устранивший указанный недостаток. Сформулировал его в 1906 г. Нернст и называется он третьим началом термодинамики, или теоремой Нернста.
Слайд 56 Нернст Вальтер
Слайд 57Согласно Нернсту, изменение энтропии ΔS стремится к нулю при любых обратимых
Слайд 58 Как первое и второе начала термодинамики, теорема Нернста может рассматриваться как
Слайд 59 Следствием Третьего начала является то что, невозможно охладить тело до абсолютного
Принцип Нернста был развит Планком, предположившим, что при абсолютном нуле температуры энергия системы минимальна (но не равна нулю).