- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамические потенциалы презентация
Содержание
- 1. Термодинамические потенциалы
- 2. Термодинамические потенциалы (ТДП) – критерии самопроизвольности
- 14. Зависимость ТДП от параметров состояния системы ТДП
- 17. Методы расчета изменения энергии Гиббса в химических
- 18. Первый способ
- 19. Второй способ
- 20. Третий способ – по уравнению Тёмкина– Шварцмана
- 21. Понятие о химическом потенциале Полезная работа химической
- 22. μi – химический потенциал i-того компонента
- 23. Химический потенциал i-того компонента есть частная
- 24. Физический смысл химического потенциала
- 25. Химический потенциал – доля свободной энергии,
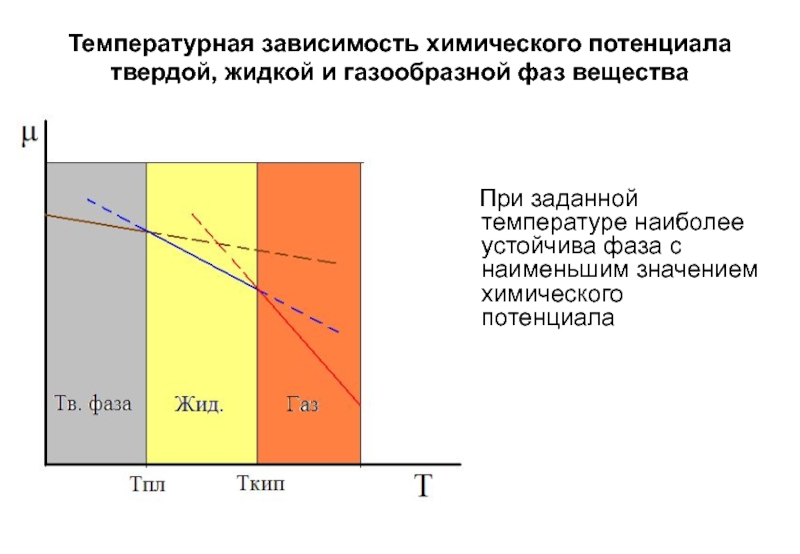
- 26. Температурная зависимость химического потенциала твердой, жидкой и
- 27. Зависимость химического потенциала от парциального давления (концентрации) вещества
Слайд 2
Термодинамические потенциалы (ТДП) – критерии самопроизвольности процесса в неизолированных системах. Определяют
Термодинамическим потенциалом может быть любая функция состояния системы, имеющая размерность энергии, за счет изменения которой система совершает полезную работу в заданных условиях проведения процесса.
Слайд 14Зависимость ТДП от параметров состояния системы
ТДП также называют характеристическими функциями, т.
Слайд 17Методы расчета изменения энергии Гиббса в химических реакциях
Большинство химических реакций осуществляют
Поэтому в повседневной химической практике для оценки самопроизвольности процесса рассчитывают изменение функций Гиббса ∆G(T, Р) или Гельмгольца ∆F(T, V), которые являются характеристическими в этих условиях.
Слайд 21Понятие о химическом потенциале
Полезная работа химической реакции – это работа химических
Химические силы, которые являются движущими силами реакции, называют химическими потенциалами (μi).
Слайд 22
μi – химический потенциал i-того компонента системы - индивидуальная характеристика данного
Фактором емкости при протекании химической реакции служит изменение числа молей i-того вещества ni.
Слайд 23
Химический потенциал i-того компонента есть частная производная любой функции состояния системы
Слайд 25 Химический потенциал – доля свободной энергии, которую 1 моль i-того
Любые самопроизвольные процессы превращения веществ (химическая реакция, фазовые превращения, растворение и т.п.) идут в направлении уменьшения химических потенциалов.
В состоянии фазового равновесия химические потенциалы одного и того же компонента в разных фазах, одинаковы.