- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Статистический метод описания презентация
Содержание
- 1. Статистический метод описания
- 2. Лекция № 4 Статистический метод
- 3. Состояние системы детально охарактери-зованное на уровне
- 4. Детальное описание состояний макроскопи-ческих систем, ввиду колоссальности
- 5. Основная задача статистической физики: найти наиболее вероятные
- 6. Элементарные сведения из теории
- 7. Статистические закономерности изучаются теорией вероятностей.
- 8. Если событие произойти не может, то
- 9. Математическое определение вероятности: вероятность какого-либо
- 10. По определению Лапласа, вероятность - отношение
- 11. События несовместимы, если появление одного
- 12. Сумма вероятностей всех единственно возможных и
- 13. Это соотношение часто называют условием
- 14. Если события А и В независимы
- 15. либо зелёным, либо красным (событие А), равна
- 16. Существует ещё одна интерпретация вероятности, применяющаяся
- 17. Важным понятием в теории вероятностей и
- 18. Отношение , т.е.
- 19. Введём понятие отклонения результатов отдельных измерений
- 20. Распространим полученные результаты на случай
- 21. Вероятность того, что результат измерений
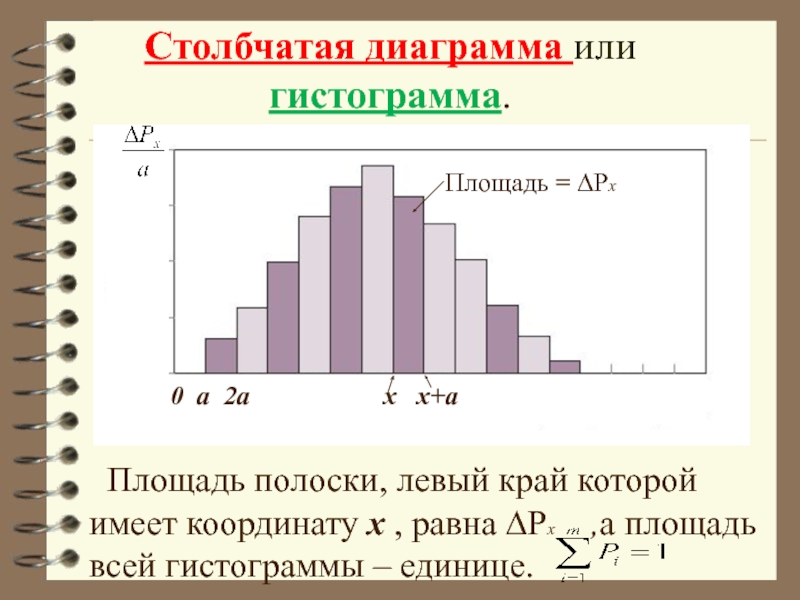
- 22. Столбчатая диаграмма или
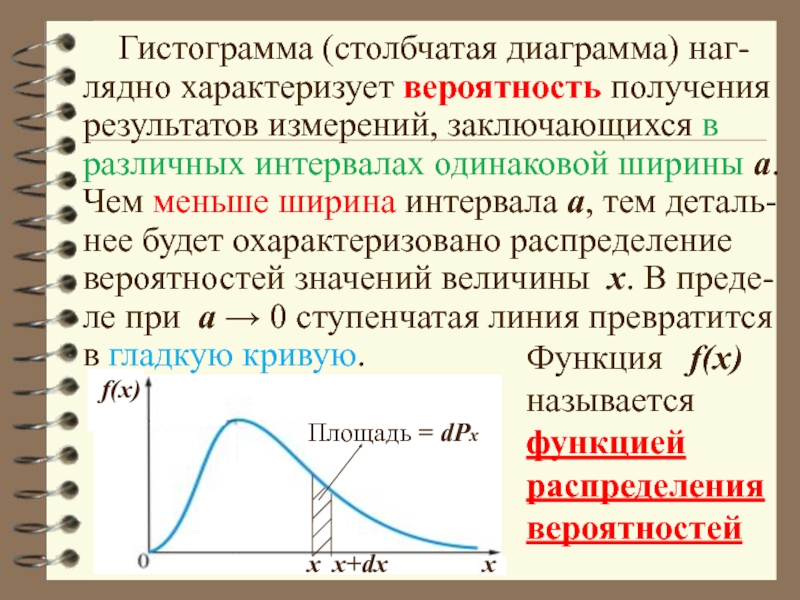
- 23. Гистограмма (столбчатая диаграмма) наг-лядно характеризует
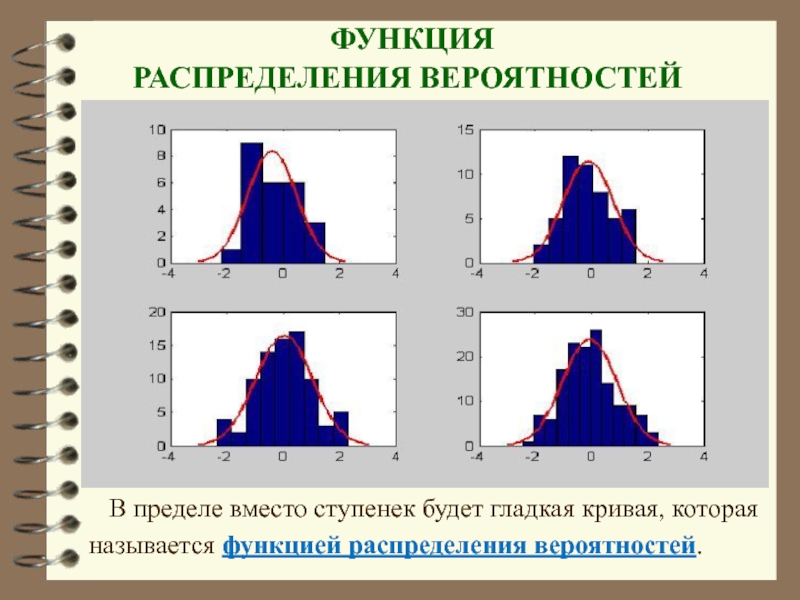
- 24. ФУНКЦИЯ РАСПРЕДЕЛЕНИЯ ВЕРОЯТНОСТЕЙ В
- 25. Площадь столбика ширины dx равна
- 26. Зная функцию распределения f(x) ,
- 27. Аналогичные рассуждения дают, что сред-нее значение
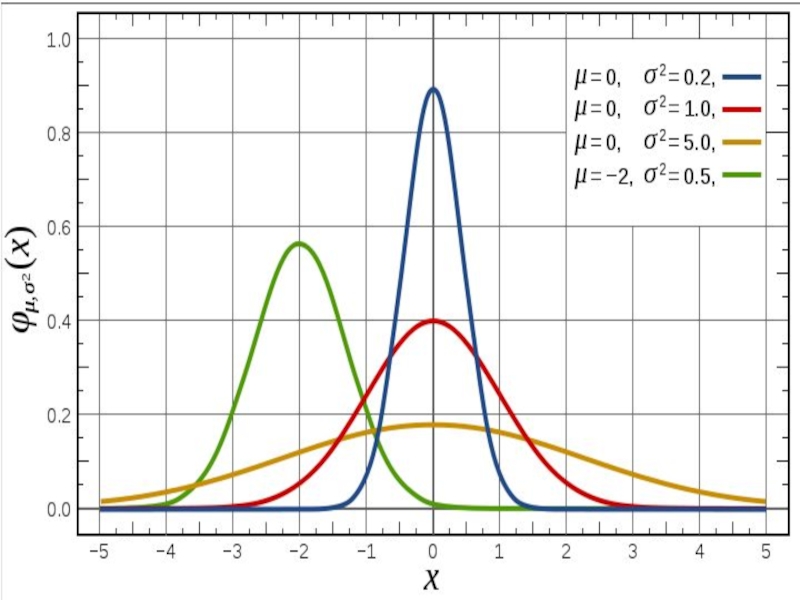
- 28. Закон распределения Гаусса.
- 31. Гаусс (Gauss) Карл Фридрих (30.4.1777, Брауншвейг, -
- 33. Закон распределения
- 34. друг друга всякие два противоположно направленные процесса.
- 35. Закон распределения скоростей
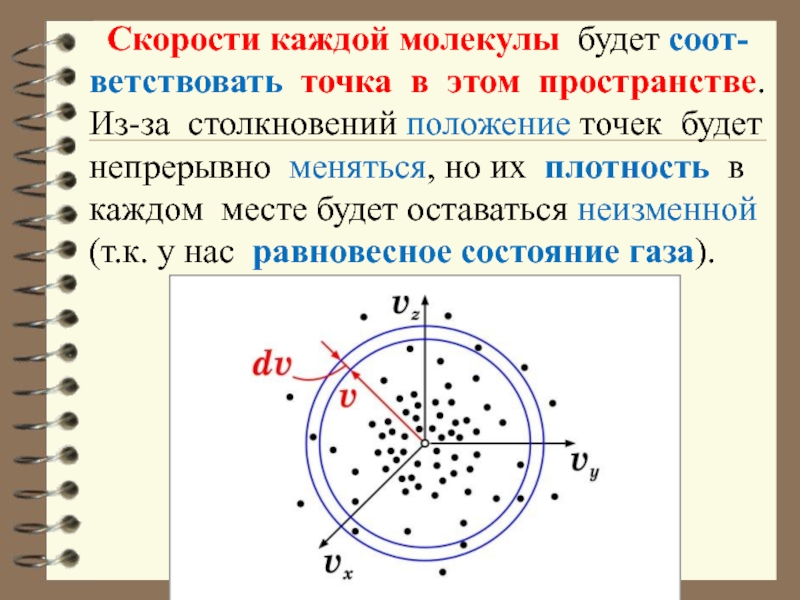
- 36. Скорости каждой молекулы будет соот-ветствовать точка
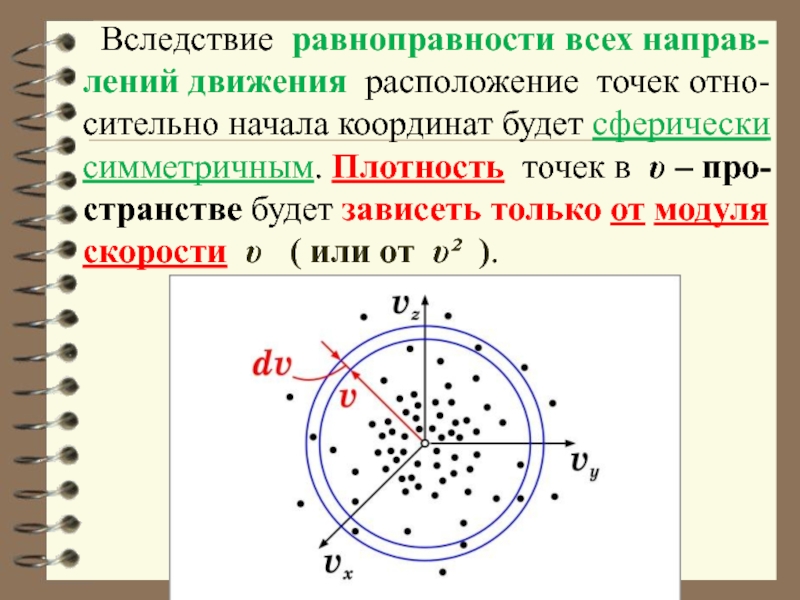
- 37. Вследствие равноправности всех направ-лений движения расположение
- 38. Молекулы движутся хаотически. Среди них есть
- 39. Мы будем искать число
- 40. Ясно так же, что Δn должно быть
- 42. Таким образом, f(υ)
- 43. Функция распределения Максвелла Пусть имеется n
- 44. В результате каждого столкно-вения
- 45. При этом, мы не можем ничего определенного
- 47. Скорость – векторная величина. Для проекции скорости
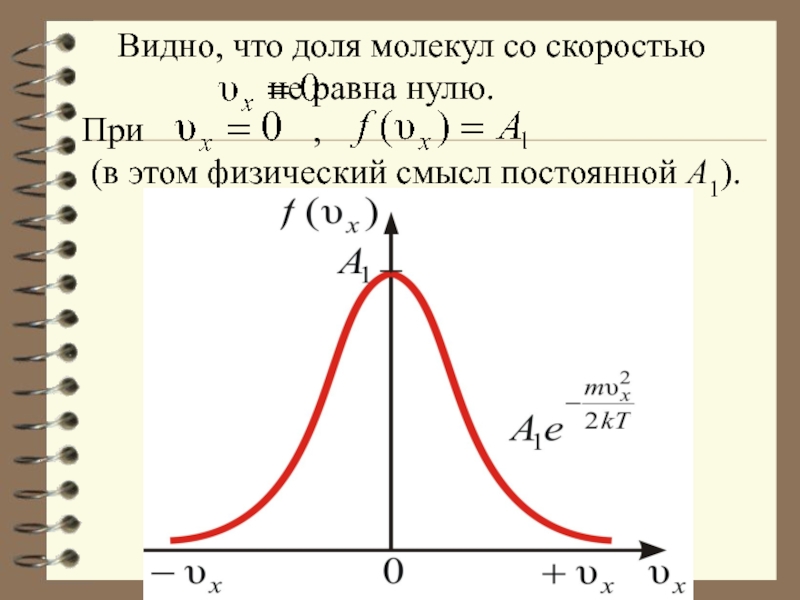
- 48. Видно, что
- 49. Приведённое выражение и график справедливы для распределения
- 50. Вероятность того, что скорость молекулы
- 51. Или
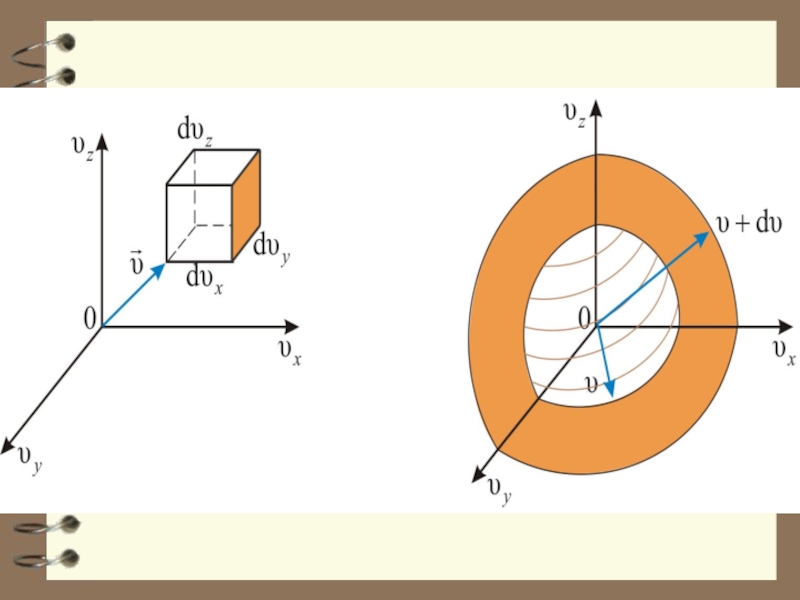
- 52. Величина dnxyz не может зависеть
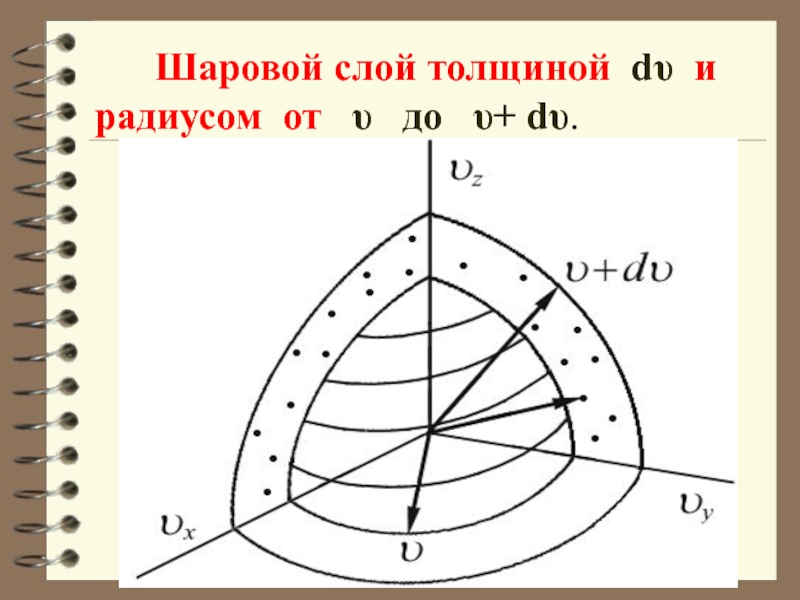
- 53. Шаровой слой толщиной dυ
- 55. Этот шаровой слой складывается из тех параллелепипедов,
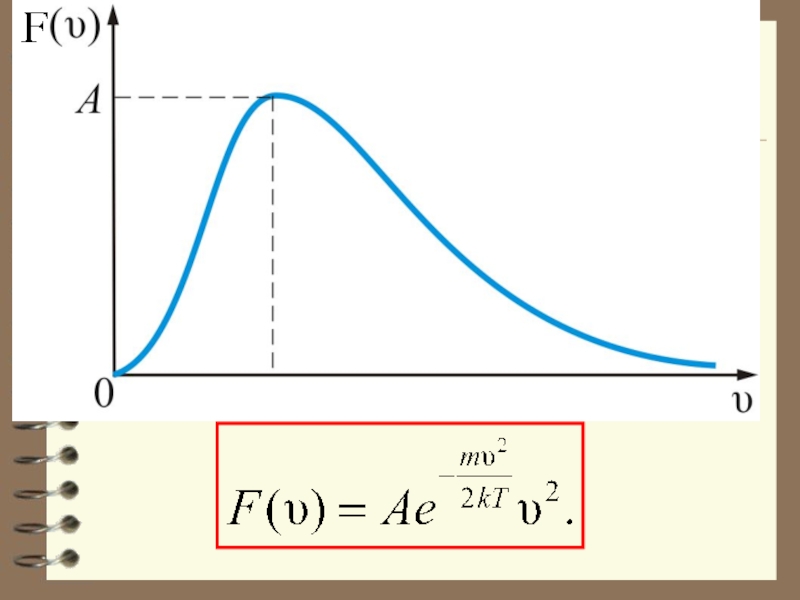
- 56. Отсюда следует закон Максвелла – распределение молекул
- 57. При
- 58. Обозначим
- 60. Выводы: - Вид распределения молекул газа
- 61. Распределение Максвелла характеризует распределение молекул по значениям
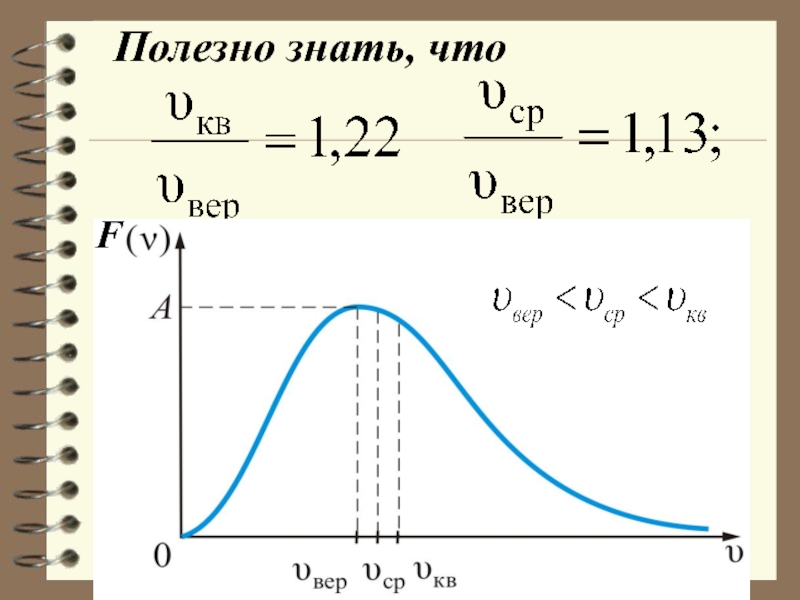
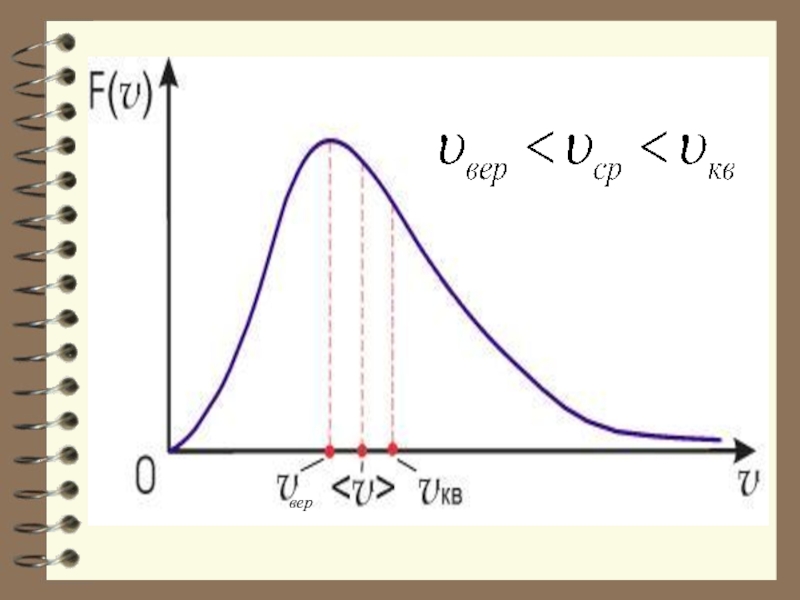
- 62. Характерные скорости (наиболее вероятная, среднеквадратичная и средняя
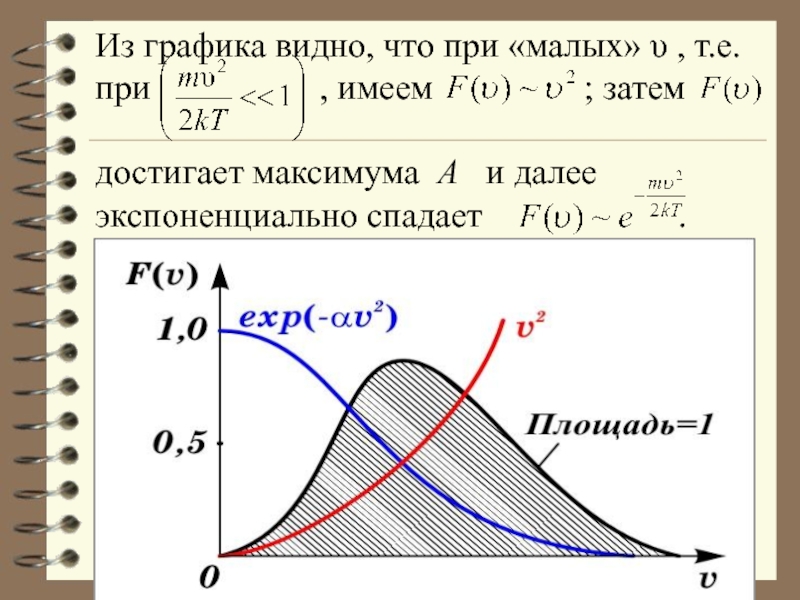
- 63. Из графика видно, что при «малых» υ
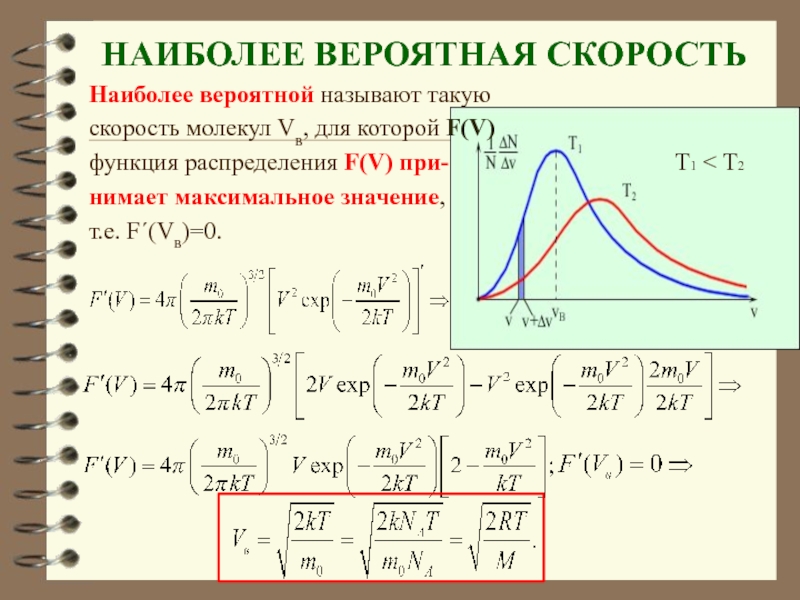
- 64. НАИБОЛЕЕ ВЕРОЯТНАЯ СКОРОСТЬ Наиболее вероятной называют такую
- 65. Величина скорости, на которую при-ходится
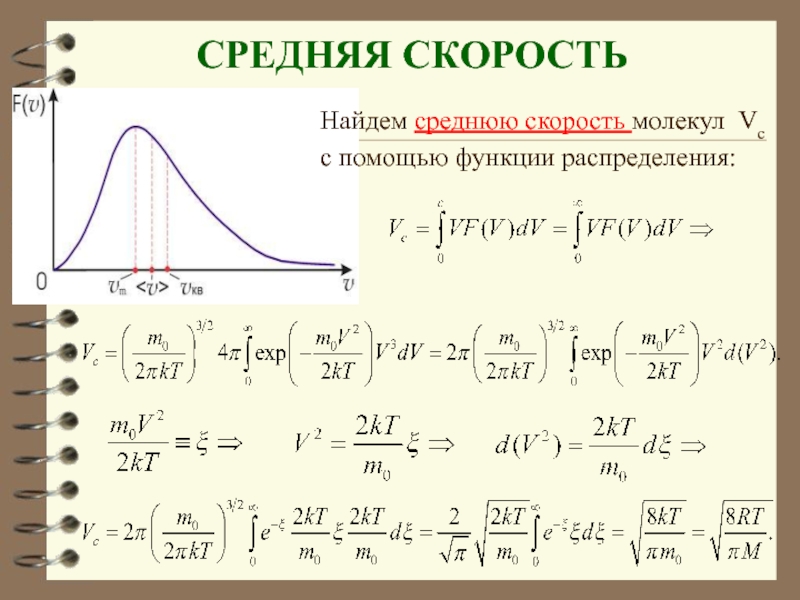
- 66. СРЕДНЯЯ СКОРОСТЬ Найдем среднюю скорость молекул Vc с помощью функции распределения:
- 67. Средняя
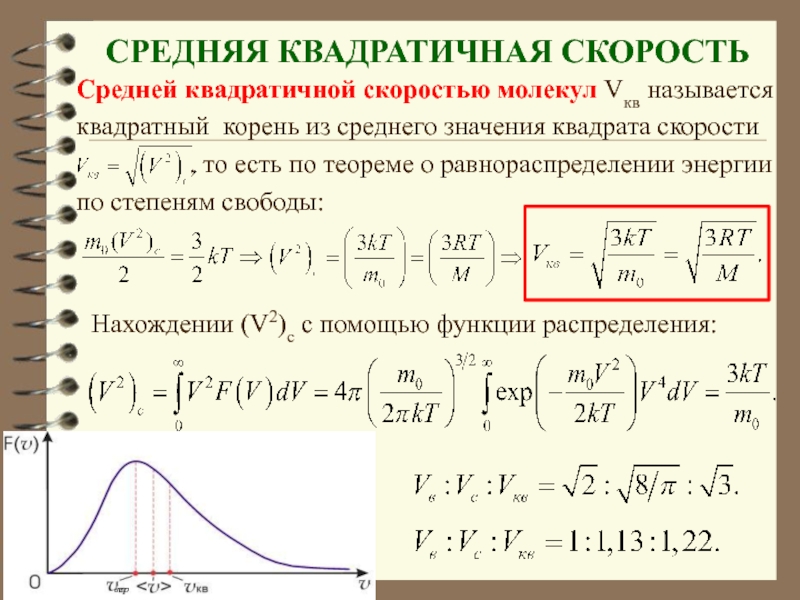
- 68. СРЕДНЯЯ КВАДРАТИЧНАЯ СКОРОСТЬ Средней квадратичной скоростью
- 70. Полезно знать, что
- 71. вер
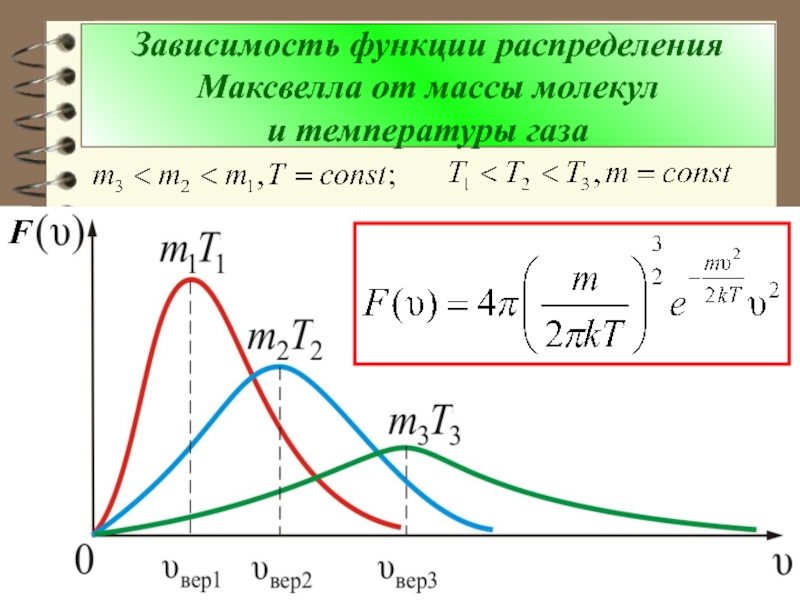
- 72. Зависимость функции распределения Максвелла от массы молекул и температуры газа F
- 73. Из рис. можно проследить за измене-нием
- 76. Лекция закончена !
Слайд 2 Лекция № 4
Статистический метод описания.
1. Основная задача статистической физики.
2. Элементарные сведения из теории вероятностей.
3.Функция распределения. Среднее значение.Дисперсия
Закон распределения Максвелла.
1. Пространство скоростей. Принцип детального равновесия.
2. Распределение молекул газа по скоростям
в условиях термодинамического равновесия.
3. Закон распределения скоростей Максвелла. Характерные скорости молекул.
Слайд 3 Состояние системы детально охарактери-зованное на уровне каждой частицы называется микросостоянием.
заданием в каждый момент времени коорди-нат и скоростей всех молекул, атомов, а так-же электронов, атомных ядер и прочих час-тиц, из которых построены тела системы.
Состояние системы описанное с помощью макроскопических параметров, характеризу-
ющих систему в целом (P ,V ,T, n, m) называется макросостоянием.
Слайд 4Детальное описание состояний макроскопи-ческих систем, ввиду колоссальности числа частиц в них,
Слайд 5Основная задача статистической физики: найти наиболее вероятные распределения молекул по скоростям,
Слайд 6 Элементарные сведения из теории
С точки зрения атомно-молекулярного строения вещества величины, встречающиеся в макроскопической физике, имеют смысл средних значений, которые принимают некоторые функции от микроскопических переменных системы. Величины такого рода называются статистическими. Примерами таких величин являются давление, температура, плотность и др.
Слайд 7 Статистические закономерности изучаются теорией вероятностей.
Событиями или случаями
Если при данных условиях событие обязательно произойдёт, то оно назы-вается достоверным событием.
Слайд 8 Если событие произойти не может, то его называют невозможным.
Слайд 9 Математическое определение вероятности: вероятность какого-либо события – это предел,
Слайд 10 По определению Лапласа, вероятность - отношение числа благоприятных случаев к
Если событие достоверно, то P = 1. Если со-бытие не может произойти вообще, то P = 0.
Слайд 11 События несовместимы, если появление одного из них исключает появление
Теорема сложения вероятностей.
Вероятность суммы несовместных собы-тий равна сумме вероятностей этих событий
Событие, состоящее в появлении либо события А , либо события В. Например, в ящике красные, зелёные и белые шары. Вероятность вынуть цветной шар:
Слайд 12 Сумма вероятностей всех единственно возможных и несовместимых событий равна единице:
дение является следствием теоремы сложе-ния вероятностей. Т.к. события единствен-но возможны, то появление одного из них (безразлично какого) есть событие досто-верное. Вероятность такого события равна единице. Но по теореме о сложении вероят-ностей вероятность этого события может быть представлена суммой
Слайд 13 Это соотношение часто называют условием нормировки вероятностей.
Теорема умножения
Вероятность произведения двух событий А и В равна произведению вероятности одного из них Р(А) на вероятность другого, вычисленную в предположении, что первое событие произошло Р(В/А) – это условная вероятность события В, при условии, что событие А произошло.
Слайд 14 Если события А и В независимы (их вероятности не зависят
вероятность произведения 2-х независи-мых событий равна произведению их вероятностей. Например, есть три шара: красный, зелёный и белый. Какова веро-ятность того, что при последовательном вынимании 2-х шаров они окажутся зе-лёным и красным? Если вынуть один шар, то вероятность, что он окажется
Слайд 15либо зелёным, либо красным (событие А), равна по теореме сложения вероятностей:
. Искомая вероятность по теореме умножения равна:
Слайд 16 Существует ещё одна интерпретация вероятности, применяющаяся в физике. Пусть в
- вероятность нахождения
молекулы в объёме V.
Слайд 17 Важным понятием в теории вероятностей и её приложениях является понятие
Среднее значение измеряемой величины определяется выражением:
Слайд 18 Отношение , т.е. отношение числа наб-людений при
что - вероятность события) и
т.д. для упрощения вместо lim пишут
и получаем среднее значение:
Слайд 19 Введём понятие отклонения результатов отдельных измерений от среднего значения
Дисперсия есть среднее арифметическое квадратов отклонений наблюдаемых значений (x1, x2,...,xm) случайной величины
от их среднего значения:
Среднее квадратичное отклонение:
Слайд 20 Распространим полученные результаты на случай когда характеризующая систему ве-личина
Возьмём очень малую величину а ( скажем,
а = 10‾¹º ) и получим ∆no измерений, при которых 0< x < a , ∆n1, при которых а< x < 2a,
…, ∆nx , при которых результат измерений находится в интервале от x до x + а и т.д.
Слайд 21 Вероятность того, что результат измерений окажется в интервале от
,
в интервале от а до 2а: ,…,
в интервале от x до x + а :
.
Начертим ось x и отложим вверх от неё полоски шириной а и высотой .
Получим столбчатую диаграмму,
которая называется гистограмма.
Слайд 22 Столбчатая диаграмма или
Площадь полоски, левый край которой имеет координату x , равна ∆Рx ,а площадь всей гистограммы – единице.
0 а 2а x x+a
Площадь = ∆Рx
Слайд 23 Гистограмма (столбчатая диаграмма) наг-лядно характеризует вероятность получения результатов измерений,
x
x
x+dx
Площадь = dРx
f(x)
Функция f(x) называется функцией
распределения
вероятностей
Слайд 24 ФУНКЦИЯ
РАСПРЕДЕЛЕНИЯ ВЕРОЯТНОСТЕЙ
В пределе вместо ступенек будет гладкая кривая,
называется функцией распределения вероятностей.
Слайд 25 Площадь столбика ширины dx равна ве-роятности того, что результат
Индекс “x” при dP указывают на то, что имеется в виду вероятность для интервала, левый край которого лежит в точке с коорди-натой x . Площадь, ограниченная кривой распределения, так же как и площадь гисто-граммы, равна единице. Это означает:
- условие нормировки
dPx = f(x)∙dx
Слайд 26 Зная функцию распределения f(x) , можно найти среднее значение
. Сумма всех возможных результатов равна:
Разделив это на число измерений N, полу-чим среднее значение величины x.
Слайд 27 Аналогичные рассуждения дают, что сред-нее значение некоторой функции φ(x) можно
Например:
Слайд 28 Закон распределения Гаусса.
Нормальное распределение,
где параметр μ — среднее значение (математи-ческое ожидание) случайной величины и указывает координату максимума кривой плотности распределения, а σ² — дисперсия.
Слайд 31Гаусс (Gauss) Карл Фридрих (30.4.1777, Брауншвейг, - 23.2.1855, Гёттинген), немецкий математик,
Слайд 33 Закон распределения скоростей молекул при тепловом равновесии
Возьмём газ, состоящий из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при определённой температуре Т ( т.е. в условиях термодинамического равновесия ). Предполагается, что силовые поля, действующие на газ, отсутствуют.
В газе в состоянии хаотического движения должны компенсировать
Слайд 34друг друга всякие два противоположно направленные процесса. Скорости таких противоположно направленных
Слайд 35 Закон распределения скоростей
Возьмём в воображаемом пространстве, которое назовём υ – пространством (пространством скоростей), прямоуго-льные координатные оси, по которым будем откладывать значения отдельных молекул (имеются в виду компоненты скорости по осям x, y, z, взятым в обычном пространстве).
Слайд 36 Скорости каждой молекулы будет соот-ветствовать точка в этом пространстве. Из-за
Слайд 37 Вследствие равноправности всех направ-лений движения расположение точек отно-сительно начала координат
Слайд 38 Молекулы движутся хаотически. Среди них есть и очень быстрые, и
Слайд 39 Мы будем искать число частиц (Δn) скорости которых
Слайд 40 Ясно так же, что Δn должно быть пропорционально концентрации молекул n
Слайд 41
Слайд 42 Таким образом, f(υ) – имеет смысл вероятности,
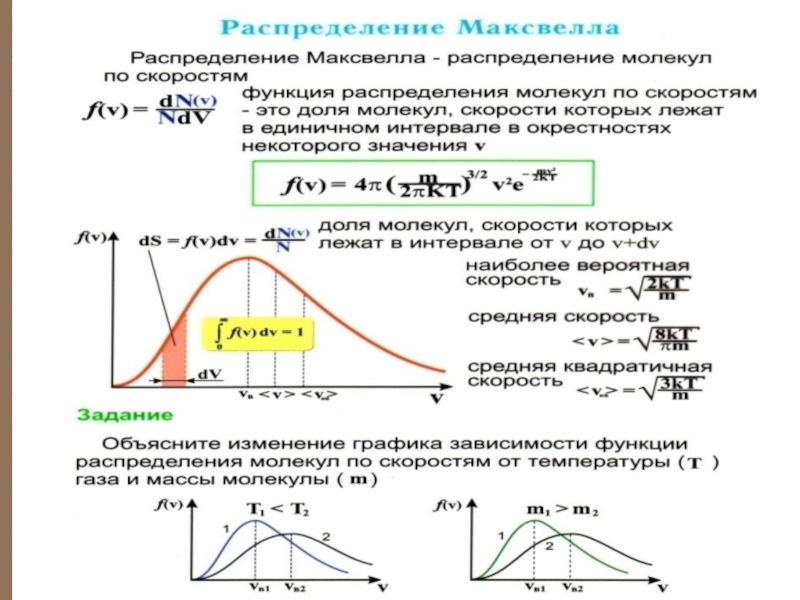
Слайд 43Функция распределения Максвелла
Пусть имеется n тождественных молекул, находящихся в состоянии
В результате невообразимо большого числа столкновений устанавливается стационарное равновесное состояние, когда число молекул в заданном интервале скоростей сохраняется постоянным.
Слайд 44 В результате каждого столкно-вения проекции скорости молекулы испытывают
Слайд 45 При этом, мы не можем ничего определенного сказать о точном значении
Слайд 46
Слайд 47 Скорость – векторная величина. Для проекции скорости на ось х (x-ой
Слайд 48
Видно, что доля молекул со скоростью
При , (в этом физический смысл постоянной А1).
Слайд 49 Приведённое выражение и график справедливы для распределения молекул газа по x-ым
Слайд 50 Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям:
Слайд 51Или
Слайд 52 Величина dnxyz не может зависеть от направления вектора скорости.
Слайд 55 Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось выше. Объём
Слайд 56 Отсюда следует закон Максвелла – распределение молекул по абсолютным значениям скоростей:
Слайд 57 При получаем
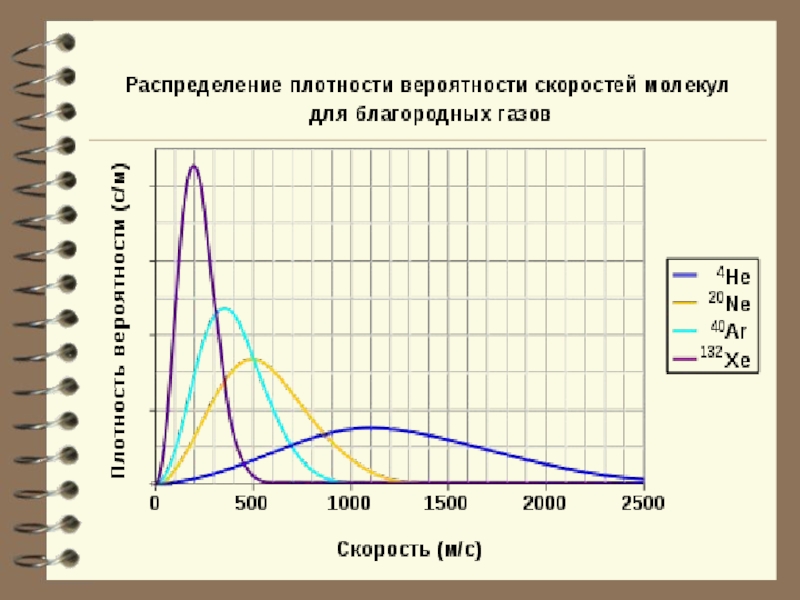
Слайд 60Выводы: - Вид распределения молекул газа по скоростям, для каждого газа
Слайд 61 Распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть
Слайд 62Характерные скорости (наиболее вероятная, среднеквадратичная и средняя скорости молекул газа).
Рассмотрим, как
Слайд 63Из графика видно, что при «малых» υ , т.е. при
Слайд 64НАИБОЛЕЕ ВЕРОЯТНАЯ СКОРОСТЬ
Наиболее вероятной называют такую
скорость молекул Vв, для которой F(V)
функция
нимает максимальное значение,
т.е. F΄(Vв)=0.
Слайд 65 Величина скорости, на которую при-ходится максимум зависимости
Слайд 67 Средняя скорость − υср где
Слайд 68 СРЕДНЯЯ КВАДРАТИЧНАЯ СКОРОСТЬ
Средней квадратичной скоростью молекул Vкв называется
квадратный корень из
, то есть по теореме о равнораспределении энергии
по степеням свободы:
Нахождении (V2)c с помощью функции распределения:
вер
Слайд 73 Из рис. можно проследить за измене-нием при