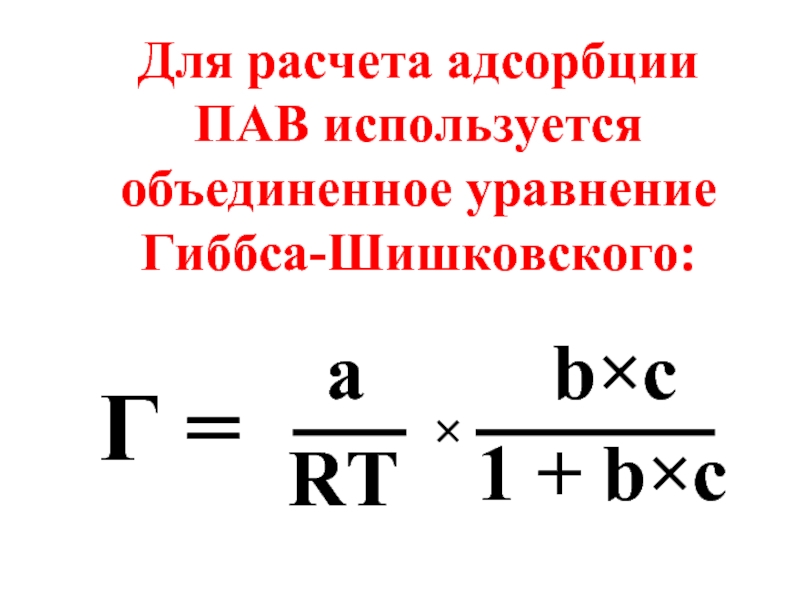- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Поверхностные явления. Лекция 15 презентация
Содержание
- 1. Поверхностные явления. Лекция 15
- 2. Тончайший мономолекулярный слой, расположенный на границе раздела
- 3. Поверхностное натяжение, адсорбция, адгезия и другие процессы,
- 4. Они осуществляются самопроизвольно за счет свободной поверхностной энергии.
- 5. Поверхностные явления играют важную роль в
- 6. Они протекают in vivo на развитых поверхностях
- 7. План 15.1 Поверхностная энергия и поверхностное натяжение
- 8. 15.1Энергетическое состояние молекул вещества в межфазном поверхностном слое и в глубине фазы различно.
- 9. Рассмотрим состояние молекул в однокомпонентной двухфазной системе: вода – водяной пар.
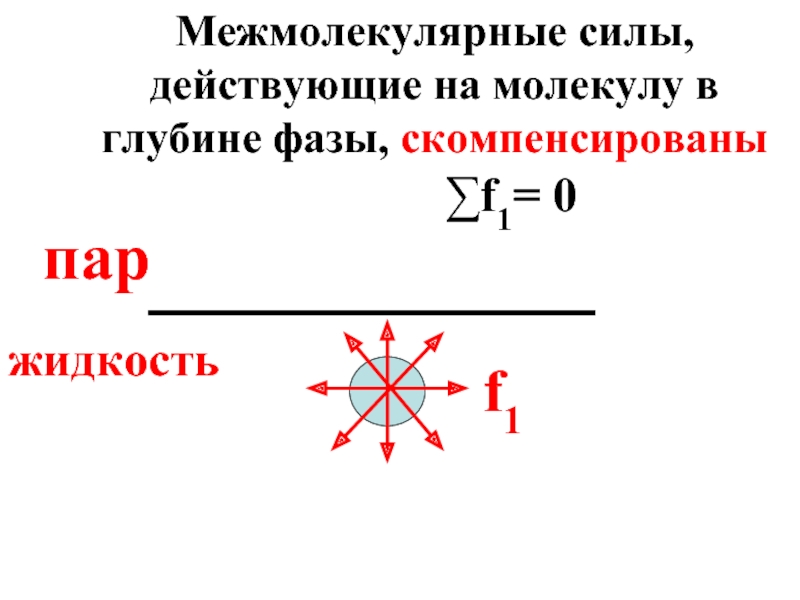
- 10. На молекулу воды, находящуюся в глубине фазы,
- 11. f1 пар жидкость ∑f1= 0 Межмолекулярные силы, действующие на молекулу в глубине фазы, скомпенсированы
- 12. Молекула на границе раздела фаз в большей
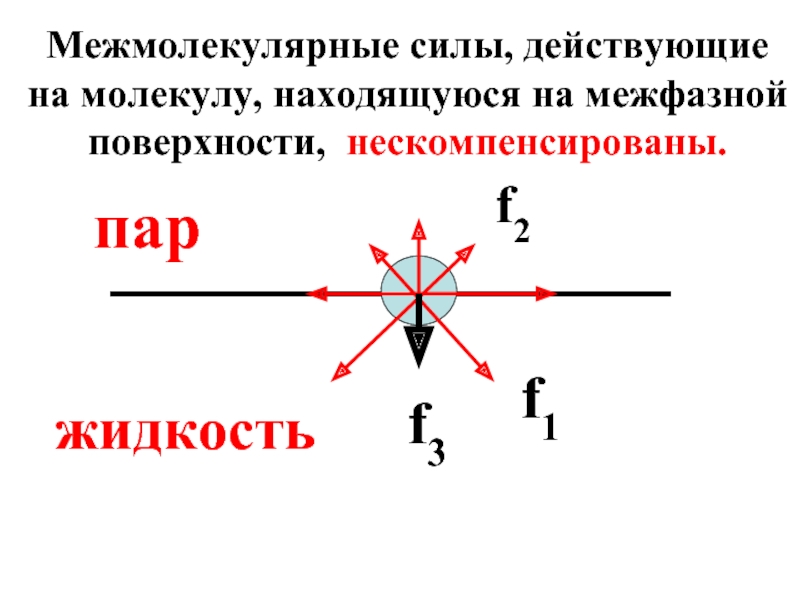
- 13. f2 f1 f3 пар жидкость Межмолекулярные
- 14. Сила f3 создает внутреннее (межмолекулярное) давление жидкости,
- 15. Вследствие нескомпенсированности сил межмолекулярного взаимодействия, поверхностный слой
- 16. где S – площадь поверхности раздела фаз,
- 18. Поверхностное натяжение – важная характеристика жидкостей; оно
- 19. С увеличением температуры поверхностное натяжение жидкостей уменьшается, т.к. разрывается часть связей межмолекулярного взаимодействия.
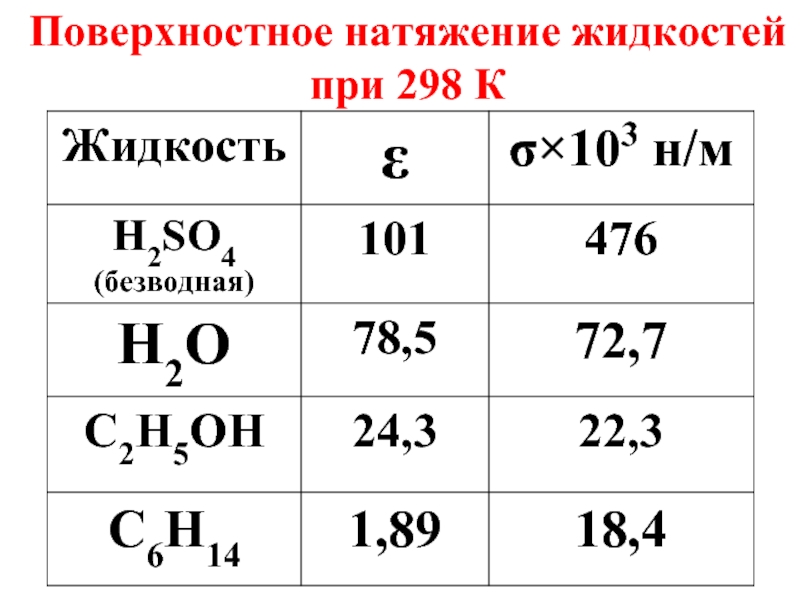
- 20. Чем выше полярность жидкости, тем больше ее
- 21. Поверхностное натяжение жидкостей при 298 К
- 22. Поверхностное натяжение – важная характеристика биологических жидкостей.
- 23. Измерение поверхностного натяжения крови - важный диагностический тест.
- 24. Изменения σ сыворотки крови свидетельствует о наличии
- 25. Наиболее принятым методом определения поверхностного натяжения является сталогмометрический метод.
- 26. Согласно второму закону термодинамики Gs → min.
- 27. б) за счет адсорбции, т.к. при адсорбции уменьшается поверхностное натяжение жидкостей.
- 28. 15.2. Адсорбцией называется концентрирование какого-либо вещества в
- 29. Активирован-ный уголь Молекулы газа
- 30. При адсорбции различают два понятия: Адсорбент, Адсорбат.
- 31. Адсорбент – вещество, на поверхности которого идет
- 32. Адсорбция (Г) выражается в г/м2 или моль/м2
- 33. В зависимости от природы сил, действующих между адсорбентом и адсорбатом, различают физическую и химическую адсорбцию.
- 34. Физическая адсорбция обусловлена межмолекулярным взаимодействием (силы Ван-дер-Ваальса).
- 35. Для физической адсорбции характерны: обратимость: одновременно
- 36. В соответствии с принципом Ле Шателье,
- 37. Химическая адсорбция (хемосорбция) осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической (ковалентной) связи.
- 38. Энергия связи при хемосорбции составляет 40-400 кДж/моль,
- 39. Повышение температуры усиливает хемосорбцию,
- 40. По характеру межфазной поверхности
- 41. 15.3 При растворении в воде какого-либо вещества
- 42. Б) повышение ее поверхностного натяжения. Такие вещества
- 43. В) поверхностное натяжение жидкости не изменяется. Такие
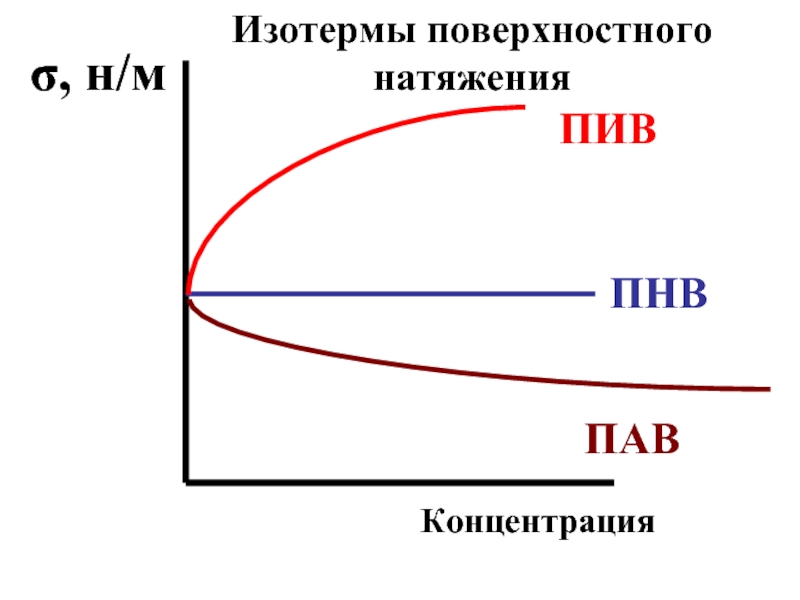
- 44. ПИВ ПНВ ПАВ σ, н/м Концентрация Изотермы поверхностного натяжения
- 45. Поверхностно-активными (ПАВ) называются вещества, уменьшающие поверхностное натяжение жидкостей.
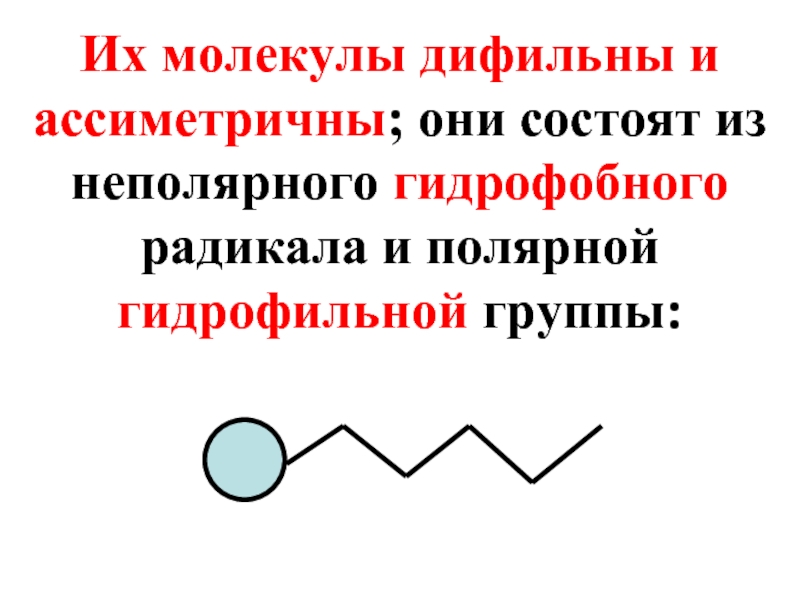
- 46. Их молекулы дифильны и ассиметричны; они состоят
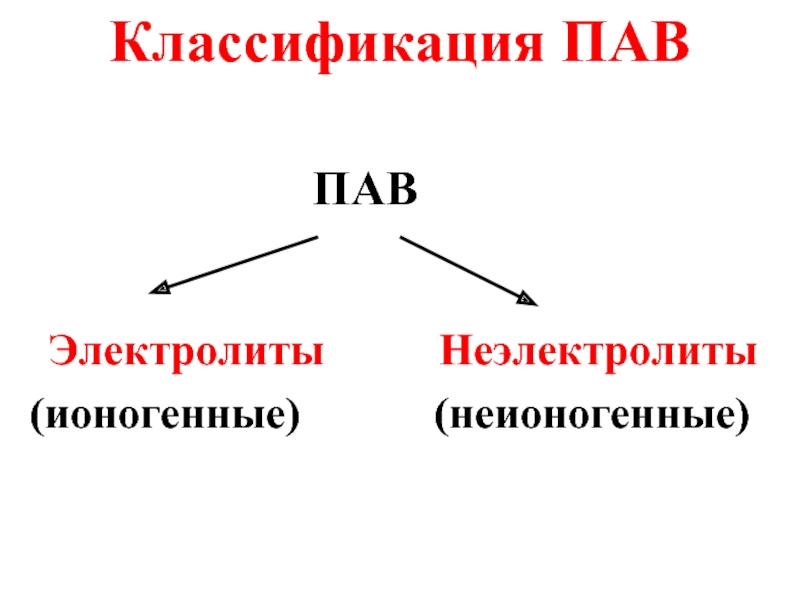
- 47. Классификация ПАВ ПАВ Электролиты Неэлектролиты (ионогенные) (неионогенные)
- 48. Ионогенные ПАВ делятся на: Катионоактивные: Соли и гидроксиды алкиламмония
- 49. Например, цетилтриметил аммоний бромид, используемый как антисептик [CH3- (CH2)15N (CH3)3]Br
- 50. 2) Аниононоактивные: Соли карбоновых кислот R-COOMe, Соли сульфокислот R-SO3Me
- 51. К неионогенным ПАВ относятся: Карбоновые кислоты R-COOH,
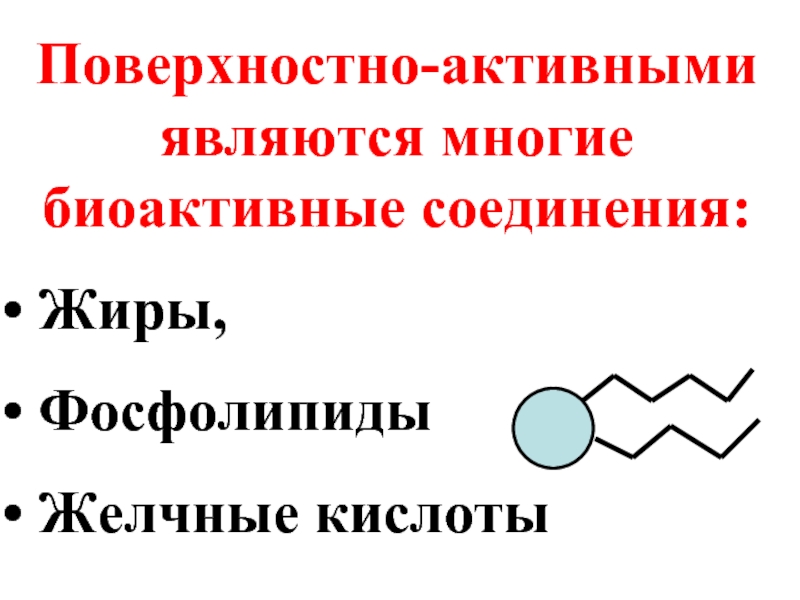
- 52. Поверхностно-активными являются многие биоактивные соединения: Жиры, Фосфолипиды Желчные кислоты
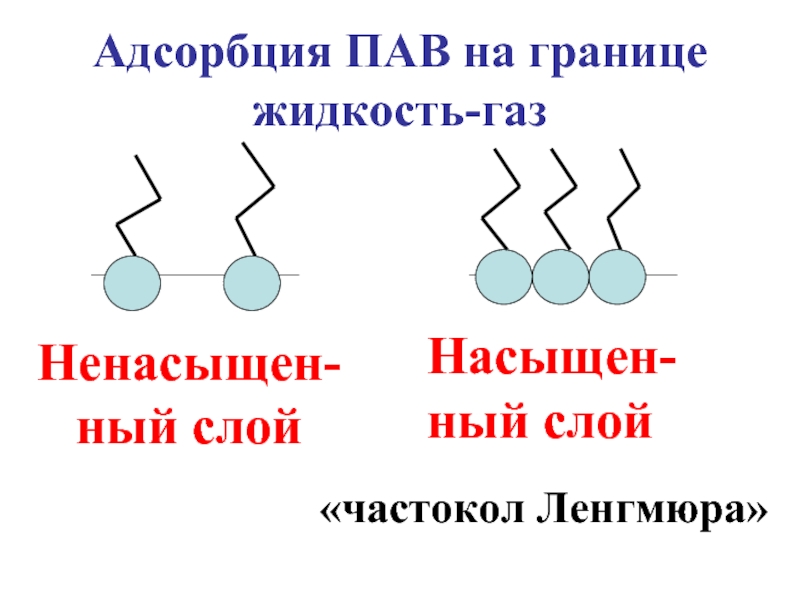
- 53. В соответствии с правилом «Подобное стремится к
- 54. Насыщен-ный слой
- 55. Поскольку молекулы ПАВ менее полярны, чем молекулы воды, силы поверхностного натяжения в поверхностном слое уменьшаются.
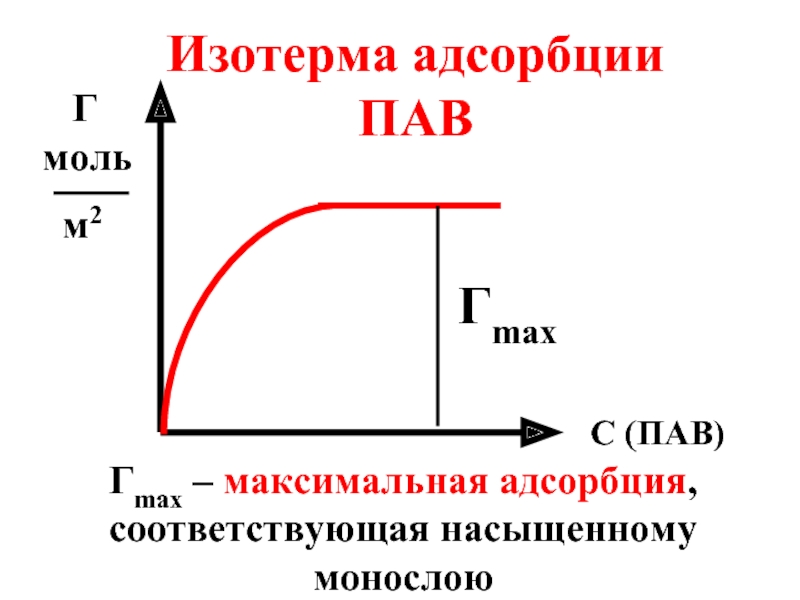
- 56. С (ПАВ) Г моль
- 57. Зная Гmax можно рассчитать а) длину молекулы
- 58. б) площадь, занимаемую молекулой ПАВ на границе
- 59. Важнейшей характеристикой ПАВ является их поверхностная активность
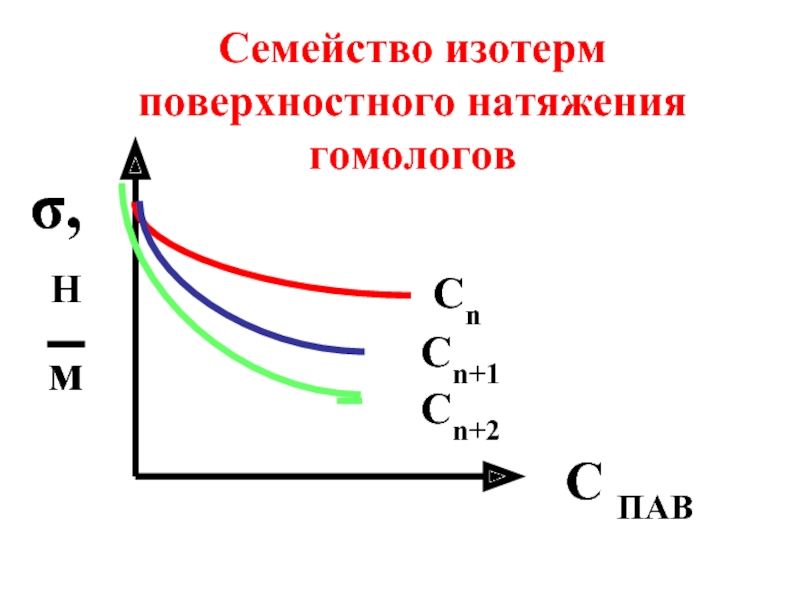
- 60. Правило Дюкло-Траубе (1888): с увеличением длины гидрофобного
- 61. Правило выполняется для членов одного гомологического ряда: спиртов, аминов, карбоновых кислот и т.д.
- 62. Сn Сn+1 Сn+2 C ПАВ σ, Н м Семейство изотерм поверхностного натяжения гомологов
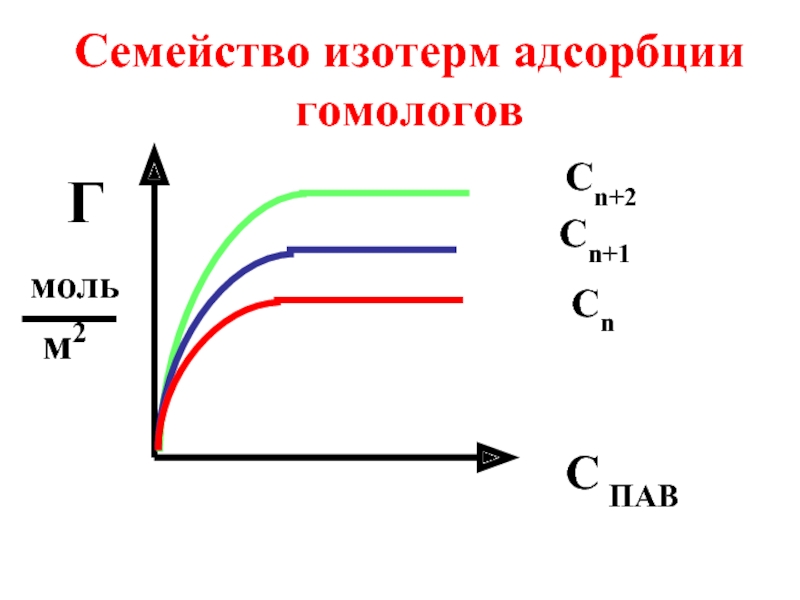
- 63. Семейство изотерм адсорбции гомологов С ПАВ Г моль м2 Сn+2 Сn+1 Сn
- 64. Зависимость адсорбции ПАВ от их концентрации в
- 65. Влияние концентрации ПАВ на поверхностное натяжение растворов
- 66. Для расчета адсорбции ПАВ используется объединенное уравнение
- 67. Применение ПАВ Как моющие средства:
- 68. Жир
- 69. 2) Как антисептики в хирургии: антимикробная активность
- 70. Обеззараживающее действие ПАВ объясняют их влиянием на
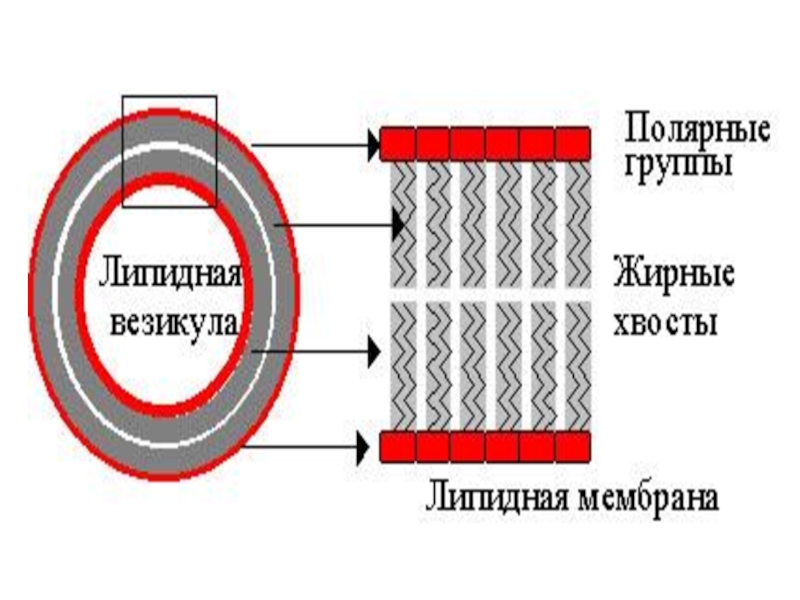
- 71. 3) Для производства липосом Липосома (греч. «липос»
- 73. Липосомы применяются для направленной доставки лекарственного препарата к пораженным органам и тканям.
- 74. Липосомы могут переносить широкий круг фармакологически активных
- 75. При этом препарат не отравляет здоровые ткани человека.
- 76. Как носители лекарств, наиболее широкое применение липосомы
- 77. Благодарим за внимание!!!
Слайд 2Тончайший мономолекулярный слой, расположенный на границе раздела двух фаз, накапливает огромный
Слайд 3Поверхностное натяжение, адсорбция, адгезия и другие процессы, протекающие на границе раздела
Слайд 6Они протекают in vivo на развитых поверхностях раздела:
поверхность кожи –
эритроцитов – 3000 м2
альвеол – 1000 м2
Слайд 7План
15.1 Поверхностная энергия и поверхностное натяжение
15.2 Адсорбция и ее виды
15.3
Слайд 815.1Энергетическое состояние молекул вещества в межфазном поверхностном слое и в глубине
Слайд 10На молекулу воды, находящуюся в глубине фазы, действуют силы межмолекулярного взаимодействия
Слайд 11
f1
пар
жидкость
∑f1= 0
Межмолекулярные силы, действующие на молекулу в глубине фазы, скомпенсированы
Слайд 12Молекула на границе раздела фаз в большей степени испытывает действие межмолекулярных
Слайд 13
f2
f1
f3
пар
жидкость
Межмолекулярные силы, действующие на молекулу, находящуюся на межфазной поверхности, нескомпенсированы.
Слайд 14Сила f3 создает внутреннее (межмолекулярное) давление жидкости, которое для воды
Межмолекулярное давление-это причина того, что жидкости практически несжимаемы.
Слайд 15Вследствие нескомпенсированности сил межмолекулярного взаимодействия, поверхностный слой имеет избыточную свободную энергию
Gs = σ× S
Слайд 16где S – площадь поверхности раздела фаз, м2
σ – коэффициент пропорциональности,
Слайд 17
σ = , =
S м2 м
Поверхностное натяжение – это поверхностная энергия единицы площади поверхности раздела фаз.
Слайд 18Поверхностное натяжение – важная характеристика жидкостей; оно зависит
б) от полярности среды.
Слайд 19С увеличением температуры поверхностное натяжение жидкостей уменьшается, т.к. разрывается часть связей
Слайд 20Чем выше полярность жидкости, тем больше ее поверхностное натяжение, т.к. с
Слайд 22Поверхностное натяжение – важная характеристика биологических жидкостей.
В норме σ крови
Слайд 24Изменения σ сыворотки крови свидетельствует о наличии онкологических заболеваний, анафилактическом шоке
Слайд 25Наиболее принятым методом определения поверхностного натяжения является сталогмометрический метод.
Слайд 26Согласно второму закону термодинамики Gs → min. Это стремление реализуется:
а) за
Слайд 2815.2. Адсорбцией называется концентрирование какого-либо вещества в поверхностном слое в результате
Слайд 31Адсорбент – вещество, на поверхности которого идет адсорбция. Адсорбат – вещество,
Слайд 32Адсорбция (Г) выражается в г/м2 или моль/м2 и рассчитывается по формулам:
Г
ν
S
m – масса адсорбата, г ν – количество адсорбата, моль S – площадь поверхности адсорбента, м2
Г =
m
S
Слайд 33В зависимости от природы сил, действующих между адсорбентом и адсорбатом, различают
Слайд 34Физическая адсорбция обусловлена межмолекулярным взаимодействием (силы Ван-дер-Ваальса). Энергия этих взаимодействий невелика
Слайд 35Для физической адсорбции характерны:
обратимость: одновременно с адсорбцией протекает десорбция,
неспецифичность:
экзотермичность (ΔадсН < О)
Слайд 36В соответствии с принципом
Ле Шателье, протеканию физической адсорбции способствует:
понижение
увеличение концентрации адсорбата,
повышение давления в системе (при адсорбции газа или пара).
Слайд 37Химическая адсорбция (хемосорбция) осуществляется при взаимодействии адсорбента с адсорбатом с образованием
Слайд 38Энергия связи при хемосорбции составляет 40-400 кДж/моль, что делает ее практически
Слайд 40По характеру межфазной поверхности
А) жидкость/газ,
Б) жидкость/жидкость,
В) твердое тело/жидкость,
Г) твердое тело/газ
Слайд 4115.3 При растворении в воде какого-либо вещества может наблюдаться:
А) понижение ее
Слайд 42Б) повышение ее поверхностного натяжения. Такие вещества называются
поверхностно-инактивными (ПИВ); к
Слайд 43В) поверхностное натяжение жидкости не изменяется. Такие вещества называются поверхностно-неактивными (ПНВ).
Слайд 45Поверхностно-активными (ПАВ) называются вещества, уменьшающие поверхностное натяжение жидкостей.
Слайд 46Их молекулы дифильны и ассиметричны; они состоят из неполярного гидрофобного радикала
Слайд 51К неионогенным ПАВ относятся:
Карбоновые кислоты R-COOH,
Сульфокислоты
Спирты R - OH,
Тиолы R - SH,
Амины R – NH2
Слайд 52Поверхностно-активными являются многие биоактивные соединения:
Жиры,
Фосфолипиды
Желчные кислоты
Слайд 53В соответствии с правилом «Подобное стремится к подобному», гидрофобные радикалы направлены
Слайд 55Поскольку молекулы ПАВ менее полярны, чем молекулы воды, силы поверхностного натяжения
Слайд 56С (ПАВ)
Г моль
м2
Изотерма адсорбции ПАВ
Гmax
Гmax – максимальная адсорбция,
Слайд 57Зная Гmax можно рассчитать
а) длину молекулы ПАВ (ℓ)
ℓ =
Г max
ρ
ρ – плотность ПАВ,
М- молярная масса ПАВ
Слайд 58б) площадь, занимаемую молекулой ПАВ на границе раздела фаз (s):
s =
1
Г max NA
где NA – число Авогадро
Слайд 59Важнейшей характеристикой ПАВ является их поверхностная активность (g):
g =
Δσ
ΔC
где Δσ
Слайд 60Правило Дюкло-Траубе (1888): с увеличением длины гидрофобного радикала на группу -CH2-
Слайд 61Правило выполняется для членов одного гомологического ряда: спиртов, аминов, карбоновых кислот
Слайд 64Зависимость адсорбции ПАВ от их концентрации в растворе описывается уравнением Гиббса
Г =
dσ
dс
C ПАВ
RT
×
Слайд 65Влияние концентрации ПАВ на поверхностное натяжение растворов описывается уравнением Шишковского (1909):
σ
где a и b – параметры уравнения (табл.), σ – поверхностное натяжение раствора, σо -поверхностное натяжение растворителя










































![Например, цетилтриметил аммоний бромид, используемый как антисептик[CH3- (CH2)15N (CH3)3]Br](/img/tmb/2/169871/38e4897706b0fc9a6678f95847acc02c-800x.jpg)