- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы молекулярно-кинетической теории презентация
Содержание
- 1. Основы молекулярно-кинетической теории
- 2. Основы молекулярно-кинетической теории Молекулярно-кинетическая теория (МКТ)
- 3. В основе МКТ строения вещества лежат три
- 4. Первое положение МКТ Молекула – наименьшая устойчивая
- 5. Второе положение МКТ Частицы, из которых состоит вещество, находятся в непрерывном хаотическом (беспорядочном) движении
- 6. Третье положение МКТ Частицы вещества взаимодействуют друг с другом – притягиваются и отталкиваются
- 7. График зависимости силы взаимодействия двух молекул от
- 8. Основные понятия МКТ Моль - количество вещества,
- 9. Количеством вещества ν (ню) - иногда обозначается
- 10. Количеством вещества ν (ню) По закону АвогадроПо
- 11. Основные понятия МКТ Идеальным газом называется газ,
- 12. Явления переноса Нарушение равновесия сопровождается возникновением потоков
- 13. Явления переноса 1.Диффузия – это обусловленное тепловым
- 14. Коэффициент диффузии ( jm —
- 15. Диффузия и осмос В том случае,
- 16. Диффузия и осмос Иначе говоря, осмос
- 19. Закон Вант-Гоффа 18521852-19111852-1911, голландский1852-1911, голландский химик Якоб
- 20. Явления переноса 2.Теплопроводность – это процесс переноса
- 21. Явления переноса 3.Внутреннее трение (вязкость) возникает вследствие
- 22. Идеальным газом называется газ, в котором молекулы
- 23. Основные параметры газа уравнение Менделеева-Клапейрона Р -
- 24. ГАЗОВЫЕ ЗАКОНЫ Изобарный процесс Закон Гей- Люссака:
- 25. ГАЗОВЫЕ ЗАКОНЫ Изохорный процесс Закон Шарля:
- 26. ГАЗОВЫЕ ЗАКОНЫ Изотермический процесс Закон Бойля-Мариотта: для
- 27. Уравнение Ван-дер-Ваальса Молекул в
- 29. Внутренняя энергия реального газа Внутренняя энергия
- 30. Влажность воздуха
- 31. Влажность воздуха
- 32. Измерение влажности воздуха
- 33. Измерение влажности воздуха
Слайд 2Основы
молекулярно-кинетической теории
Молекулярно-кинетическая теория (МКТ) – это учение, которое объясняет тепловые
Слайд 3В основе МКТ строения вещества лежат три положения:
Вещество состоит из
В состав этих частиц входят более мелкие элементарные частицы
Первое положение
Слайд 4Первое положение МКТ
Молекула – наименьшая устойчивая частица данного вещества.
Молекула обладает
Молекула является пределом деления вещества, то есть самой маленькой частью вещества, которая способна сохранять свойства этого вещества
Атом – это наименьшая частица данного химического элемента.
Слайд 5Второе положение МКТ
Частицы, из которых состоит вещество, находятся в непрерывном хаотическом
Слайд 6Третье положение МКТ
Частицы вещества взаимодействуют друг с другом – притягиваются и
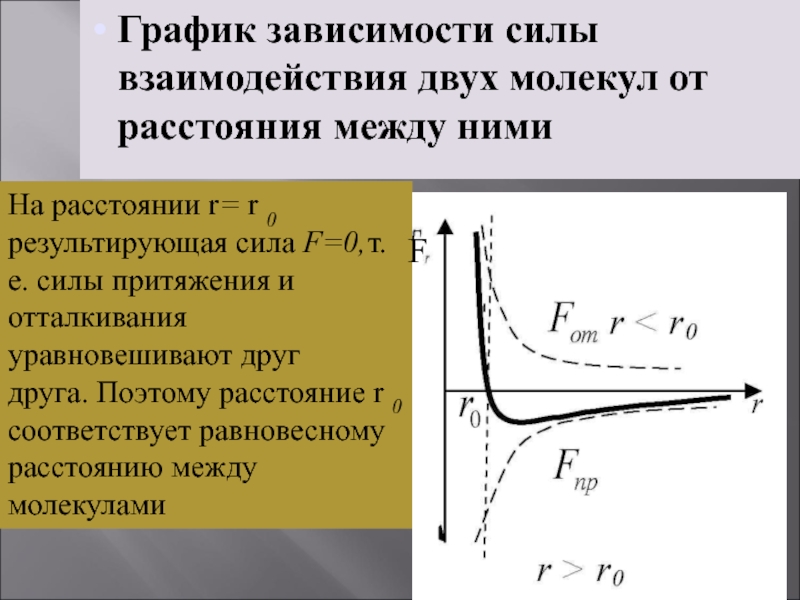
Слайд 7График зависимости силы взаимодействия двух молекул от расстояния между ними
На расстоянии
F
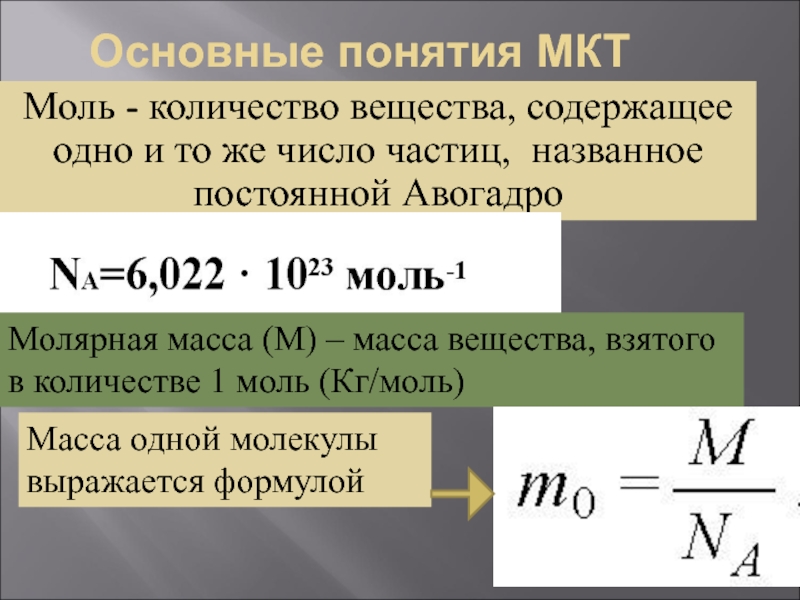
Слайд 8Основные понятия МКТ
Моль - количество вещества, содержащее одно и то же
Молярная масса (М) – масса вещества, взятого в количестве 1 моль (Кг/моль)
Масса одной молекулы выражается формулой
Слайд 9Количеством вещества ν (ню) - иногда обозначается n
физическая величинафизическая величина, характеризующая
Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы)
Единица измерения Единица измерения количества вещества в Международной системе единиц (СИ) Единица измерения количества вещества в Международной системе единиц (СИ) — моль
Слайд 10Количеством вещества ν (ню)
По закону АвогадроПо закону Авогадро, количество газообразного вещества
Слайд 11Основные понятия МКТ
Идеальным газом называется газ, в котором молекулы движутся свободно
Модель идеального газа удовлетворительно описывает достаточно разреженные газы.
Слайд 12Явления переноса
Нарушение равновесия сопровождается возникновением потоков либо молекул, либо тепла, либо
диффузия,
Теплопроводность
внутреннее трение
Слайд 13Явления переноса
1.Диффузия – это обусловленное тепловым движением молекул проникновение одних веществ
Явление диффузии для химически однородного газа подчиняется закону Фика:
(
jm — плотность потока массы
D —коэффициент диффузии
dρ/dx — градиент плотности
Слайд 14Коэффициент диффузии
(
jm — плотность потока массы
D —коэффициент диффузии
dρ/dx —
Коэффициент диффузии позволяет провести оценку количества вещества, прошедшего через единицу площади (квадратный метр) за единицу времени (секунду).
Единица измерения м²/с
Коэффициент диффузии определяется свойствами среды и типом диффундирующих частиц
Слайд 15Диффузия и осмос
В том случае, если диффундирующие вещества встречают на
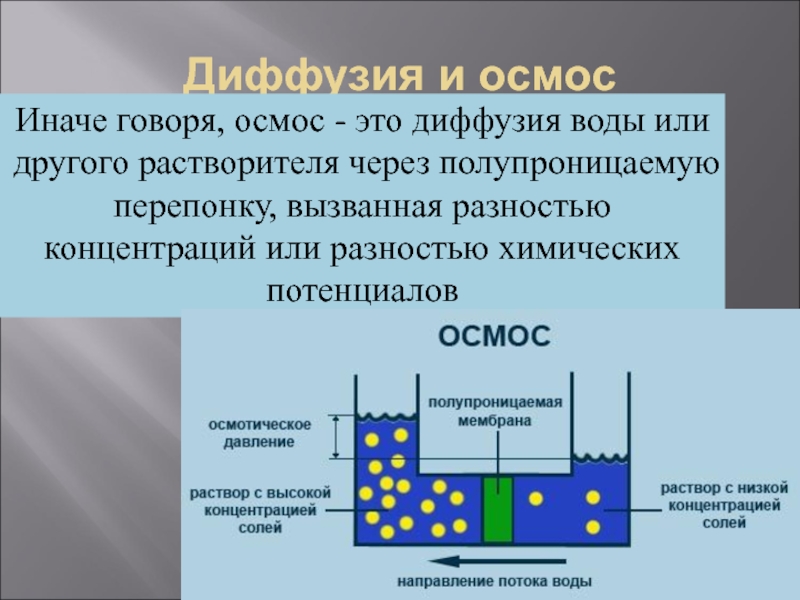
Слайд 16Диффузия и осмос
Иначе говоря, осмос - это диффузия воды или
Слайд 19Закон Вант-Гоффа
18521852-19111852-1911, голландский1852-1911, голландский химик
Якоб Хендрик Вант-Гофф
Мерой интенсивности протекания осмоса является
раствора (СМ ) и температуры (Т):
Росм=СМ∙R∙T,
где R – газовая
постоянная, равная 8,31Дж/моль∙К;
ИЛИ:
νRT
V
Слайд 20Явления переноса
2.Теплопроводность – это процесс переноса тепловой энергии, обусловленный хаотическим движением
Перенос энергии в форме теплоты подчиняется закону Фурье:
jE - плотность теплового потока
λ –теплопроводность
- градиент температуры
Слайд 21Явления переноса
3.Внутреннее трение (вязкость) возникает вследствие переноса импульса молекул между слоями
сила
(
η - динамическая вязкость
dv/dx - градиент скорости,
S - площадь, на которую действует сила F.
Слайд 22Идеальным газом называется газ, в котором молекулы движутся свободно и взаимодействуют
Модель идеального газа удовлетворительно описывает достаточно разреженные газы
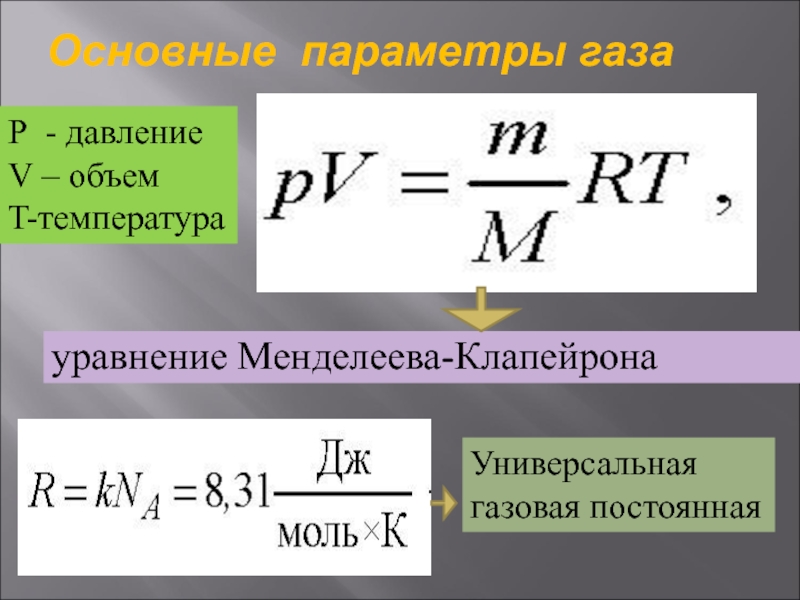
Слайд 23Основные параметры газа
уравнение Менделеева-Клапейрона
Р - давление
V – объем
T-температура
Универсальная газовая постоянная
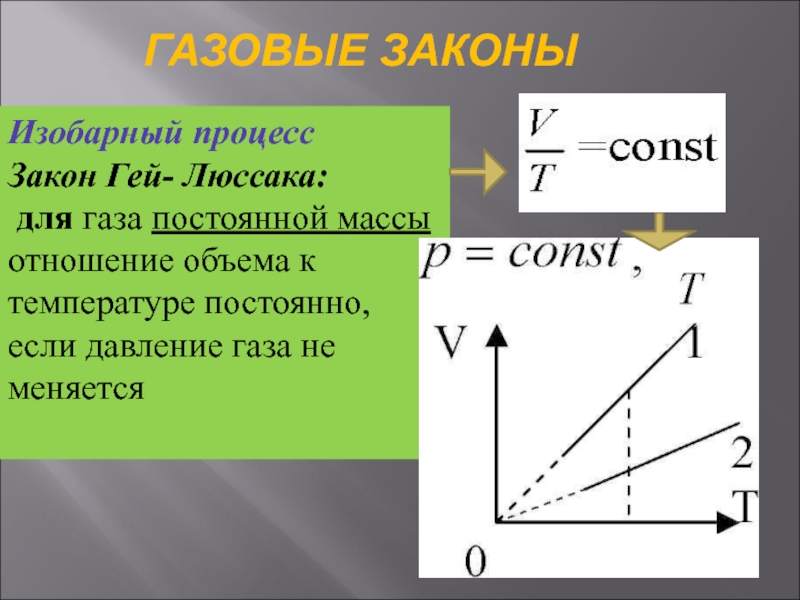
Слайд 24ГАЗОВЫЕ ЗАКОНЫ
Изобарный процесс
Закон Гей- Люссака:
для газа постоянной массы
отношение объема к
температуре
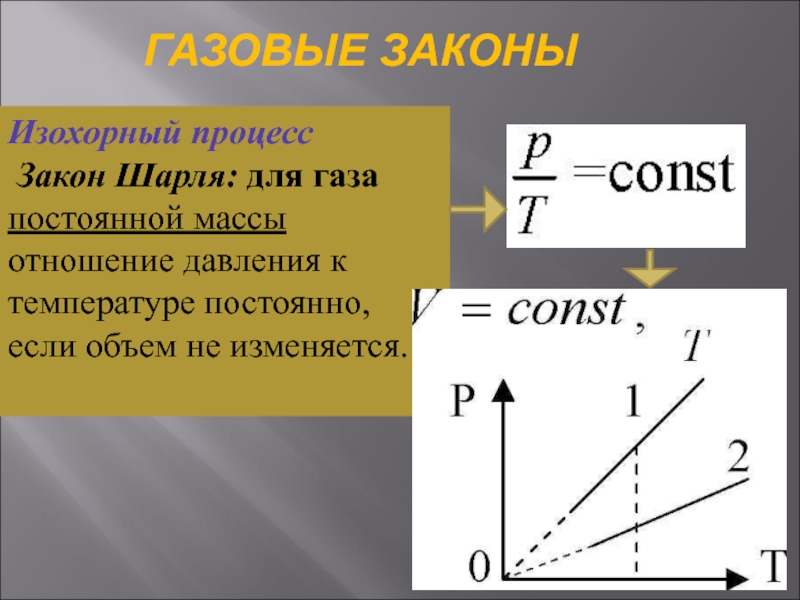
Слайд 25ГАЗОВЫЕ ЗАКОНЫ
Изохорный процесс
Закон Шарля: для газа постоянной массы отношение давления
Слайд 26ГАЗОВЫЕ ЗАКОНЫ
Изотермический процесс Закон Бойля-Мариотта: для газа постоянной массы произведение давления
Т=const
pV=const
открыт в 1662 годуоткрыт в 1662 году Робертом Бойлемоткрыт в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттомоткрыт в 1662 году Робертом Бойлем и независимо переоткрытый Эдмом Мариоттом в 1676 году
Слайд 27Уравнение Ван-дер-Ваальса
Молекул в реальной системе отлично от того, как это описывается
Наибольшее распространение вследствие простоты и физической наглядности получило уравнение
Ван-дер-Ваальса
Йоханнес Дидерик Ван дер Ваальс (1837 (1837-1923 (1837-1923, голландский (1837-1923, голландский физик
Слайд 29Внутренняя энергия
реального газа
Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической
где -СV молярная теплоёмкость при постоянном объёме, которая не зависит от температуры Т
:
а -поправка учитывает силы притяжения между молекулами
V -объем газа