- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методы аналитического контроля в производстве материалов современной энергетики. Физические основы методов презентация
Содержание
- 1. Методы аналитического контроля в производстве материалов современной энергетики. Физические основы методов
- 2. Типы энергетических уровней и переходов
- 3. Таблица 1 – Области электромагнитных волн
- 4. Поглощение энергии Е = Еэл. + Екол.+
- 5. Основной закон светопоглощения Связь между интенсивностями световых
- 6. Спектр поглощения – зависимость интенсивности поглощения от
- 7. Спектр поглощения является качественной характеристикой исследуемого вещества,
- 8. Диаграмма состояний (Яблонского)
- 9. Колебательная релаксация –
- 10. Ограничения 1. Закон Бера справедлив для
- 11. Фотоколориметрия (color – цвет) (фотометрический и
- 12. Спектры поглощения Рис.1.4. Способы представления спектров поглощения
- 13. Основные характеристики спектра Рис.1.5. Полоса
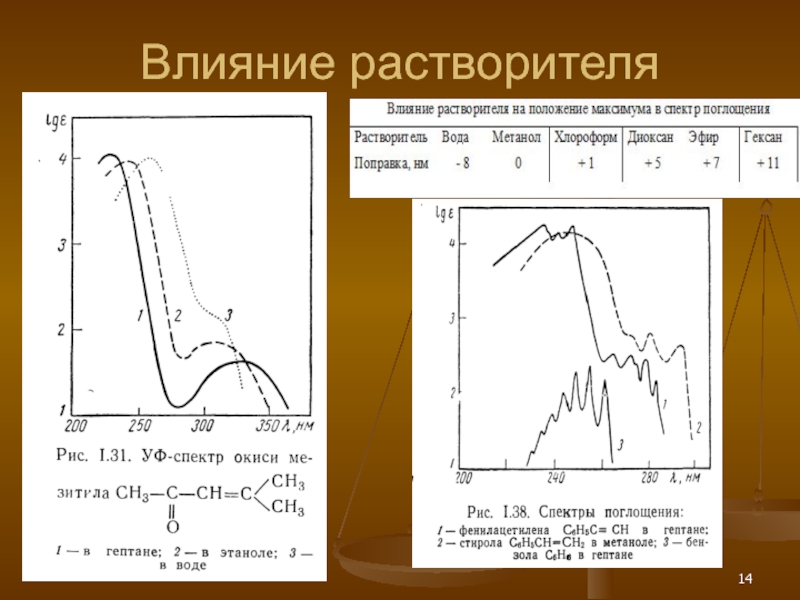
- 14. Влияние растворителя
- 15. Регистрация спектров поглощения Рис.1.6. Блок-схема приборов для
- 16. Регистрация спектров поглощения Оптическая схема спектрофотометра СФ-26
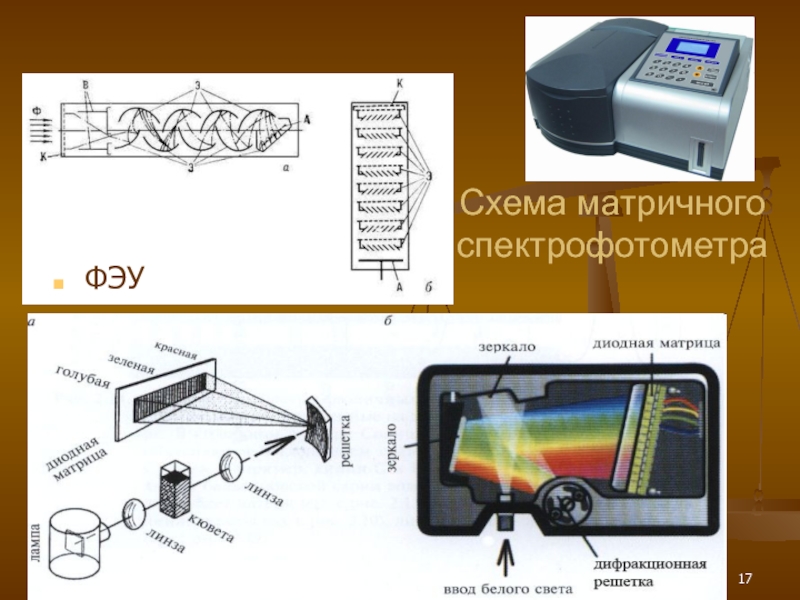
- 17. Схема матричного спектрофотометра ФЭУ
- 18. Детектирование ионов – электронный умножитель Схема действия
- 19. Спектральные характеристики отсекающих светофильтров Спектральные характеристики интерференционных светофильтров
- 20. фотоколориметры Принципиальная схема фотоколориметра: Многофункциональный спектрофотометр с uv-диапазоном LEKI SS2107UV
- 21. Основные этапы анализа в фотометрии
- 22. Метрологические характеристики метода Чувствительность характеризуется
- 23. Метрологические характеристики метода Воспроизводимость. ΔС/C имеет
- 24. Анализ однокомпонентных систем фотометрическим методом Метод
- 25. Анализ однокомпонентных систем фотометрическим методом Метод
- 26. Метод дифференциальной фотометрии Метод высокого поглощения
- 27. Определение смеси светопоглощающих веществ Спектры поглощения
- 28. Принципы разложения спектров
- 29. Другие области применения молекулярной абсорбционной спектроскопии
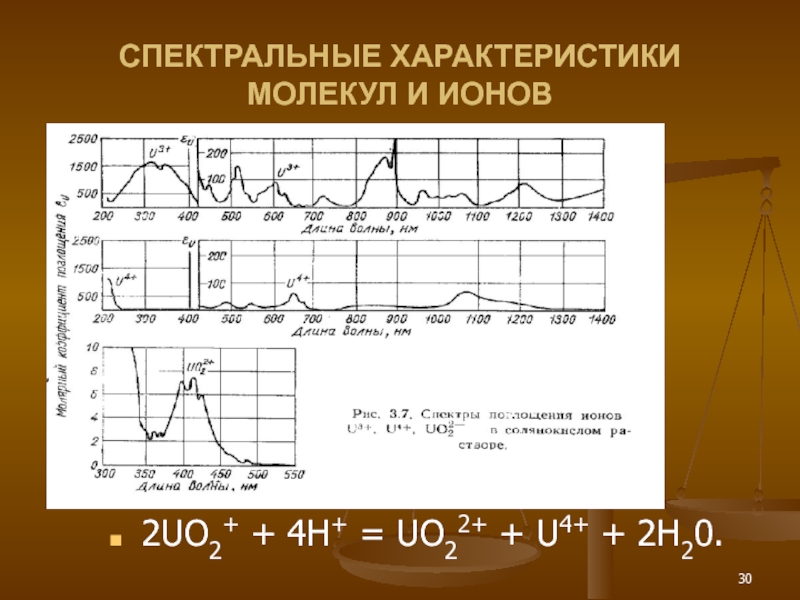
- 30. СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ МОЛЕКУЛ И ИОНОВ 2UО2+ + 4Н+ = UO22+ + U4+ + 2Н20.
- 31. Неорганические ионы уранилацетат UO2(OCOCH3)2*2H2O
- 32. Органические соединения Аромати-ческие соединения Диены
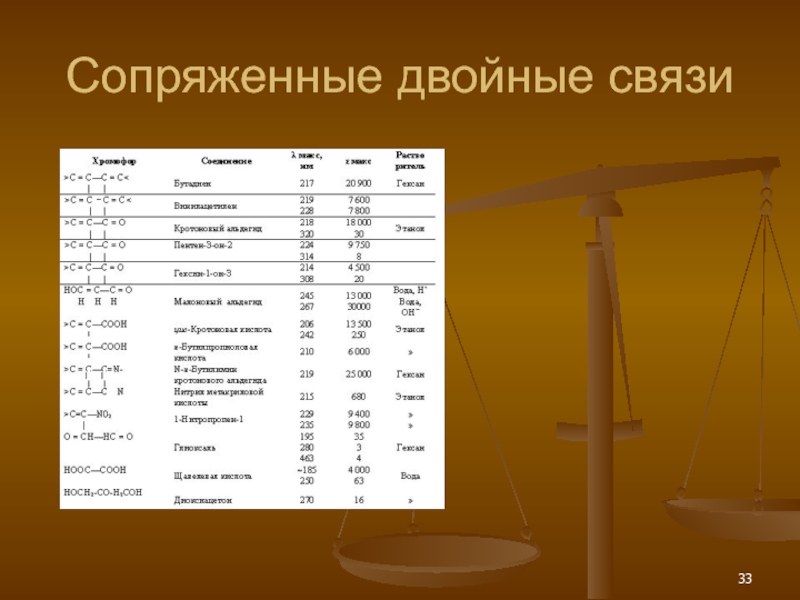
- 33. Сопряженные двойные связи
- 34. Спектры поглощения органических соединений ε ≥
- 35. Влияние структуры молекулы на λмакс
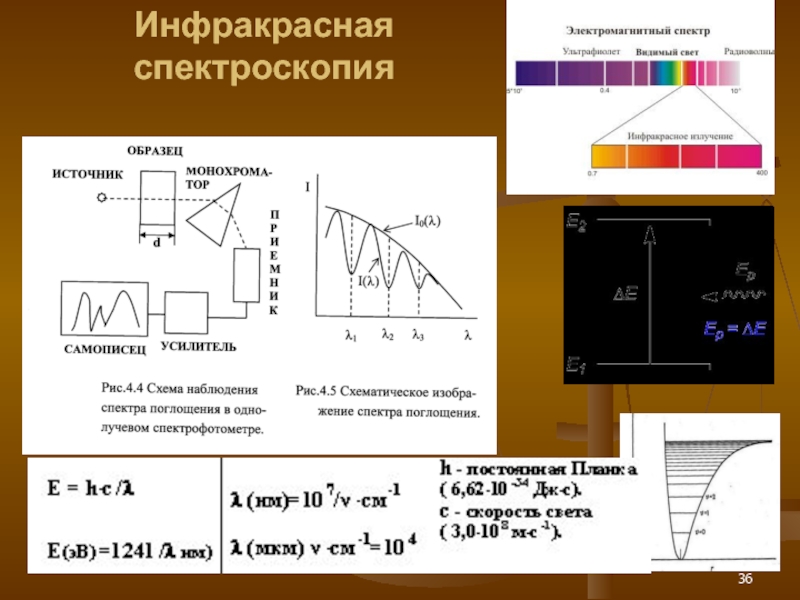
- 36. Инфракрасная спектроскопия
- 37. Источники ИК- излучения Глобар Газоразрядный лазер, генерирующий
- 38. Детекторы ИК-излучения 1 - цилиндр самописца, 2
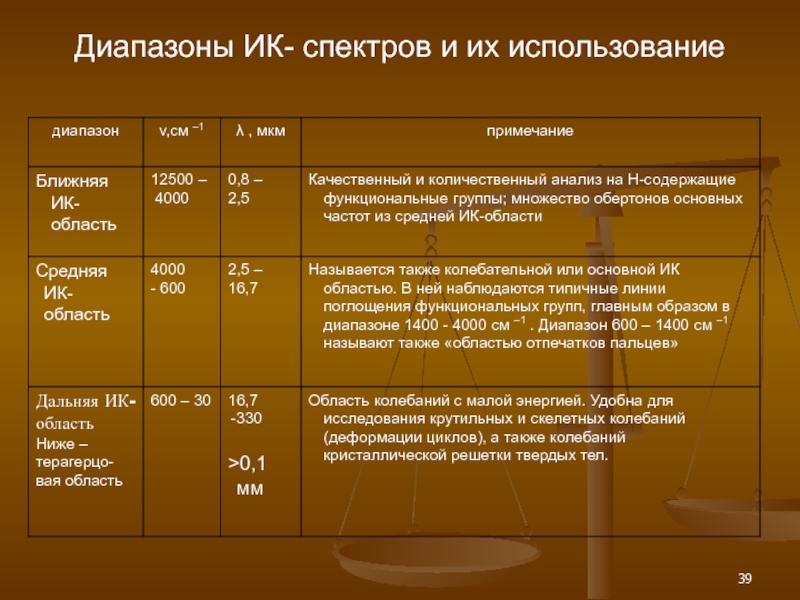
- 39. Диапазоны ИК- спектров и их использование
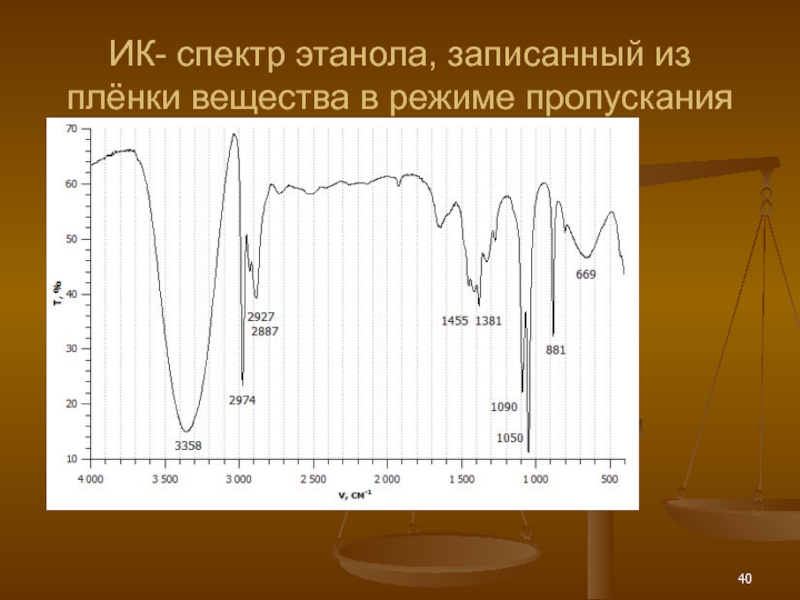
- 40. ИК- спектр этанола, записанный из плёнки вещества в режиме пропускания
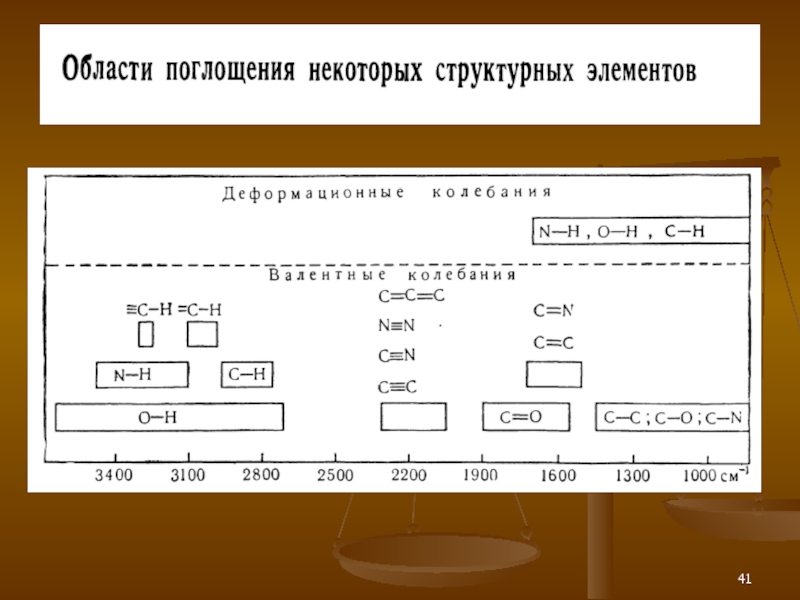
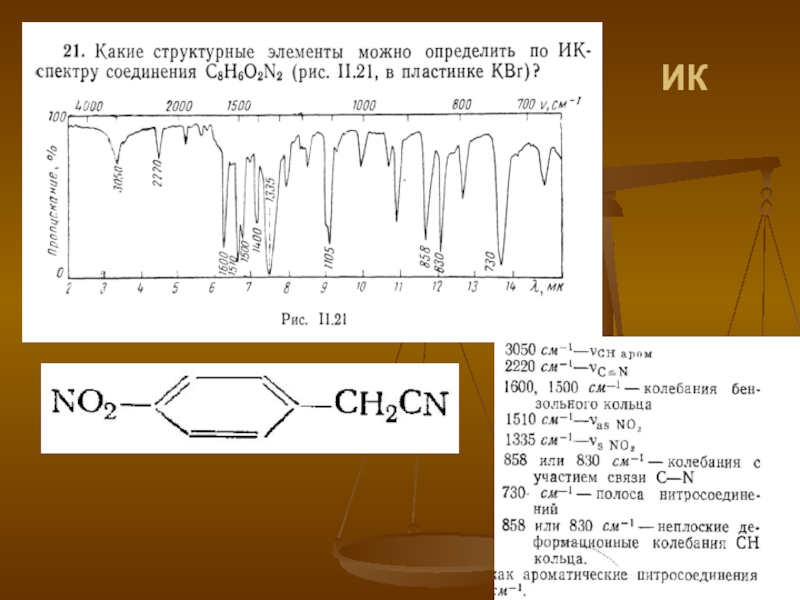
- 42. ИК
- 43. Терагерцовое излучение Максимальный допустимый диапазон ТГц частот
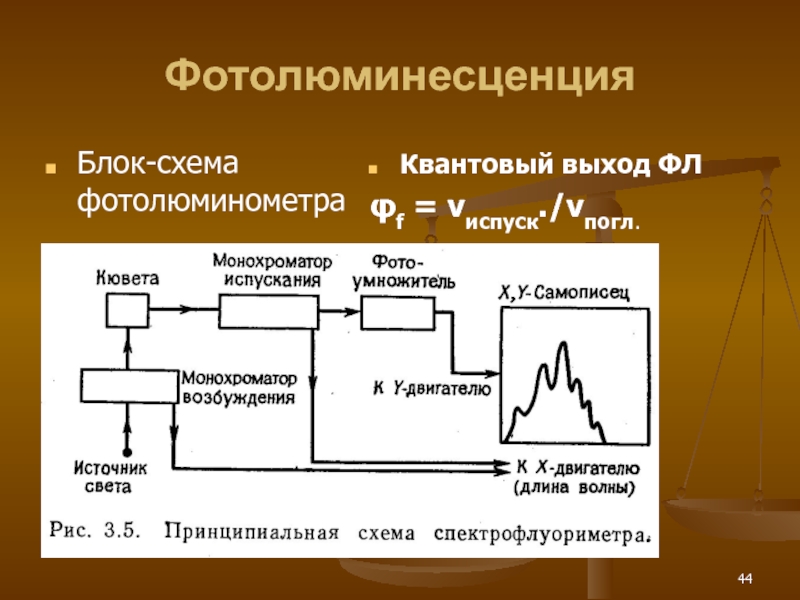
- 44. Фотолюминесценция Блок-схема фотолюминометра Квантовый выход ФЛ φf = vиспуск./vпогл.
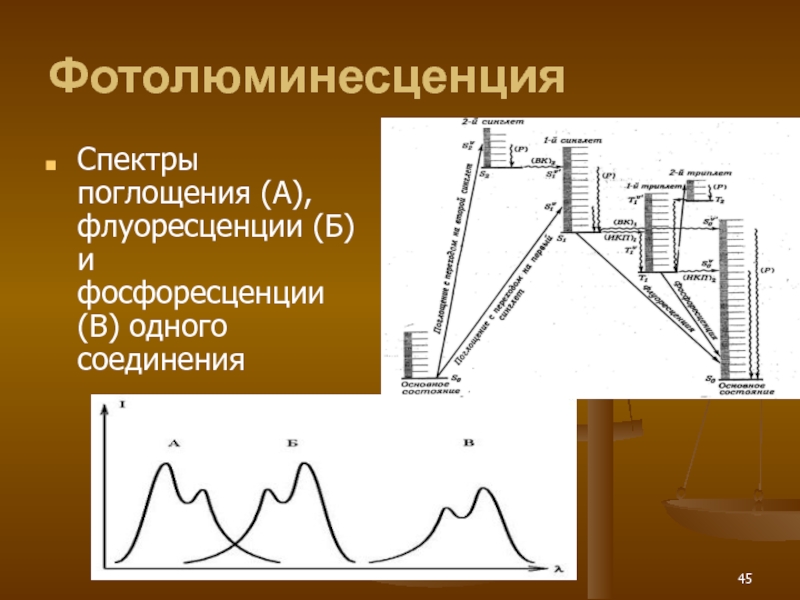
- 45. Фотолюминесценция Спектры поглощения (А), флуоресценции (Б) и фосфоресценции (В) одного соединения
- 46. Кинетика и тушение ФЛ Константа тушения Штерна-Фольмера,
- 47. Светосоставы постоянного действия (РЛИ) РЛИ Спектральный диапазон:
- 48. Литература Аналитическая химия. Проблемы и подходы.
Слайд 1Методы аналитического контроля в производстве материалов
современной энергетики
Часть 1
1 ФИЗИЧЕСКИЕ ОСНОВЫ МЕТОДОВ
Слайд 4Поглощение энергии
Е = Еэл. + Екол.+ Евр.
в соответствии с принципом Франка-Кондона:
в ионизируемой молекуле не изменяются.
Слайд 5Основной закон светопоглощения
Связь между интенсивностями световых потоков I0, I с концентрацией
закон Бугера-Ламберта-Бера.
Слайд 6Спектр поглощения – зависимость интенсивности поглощения от энергии падающего на образец
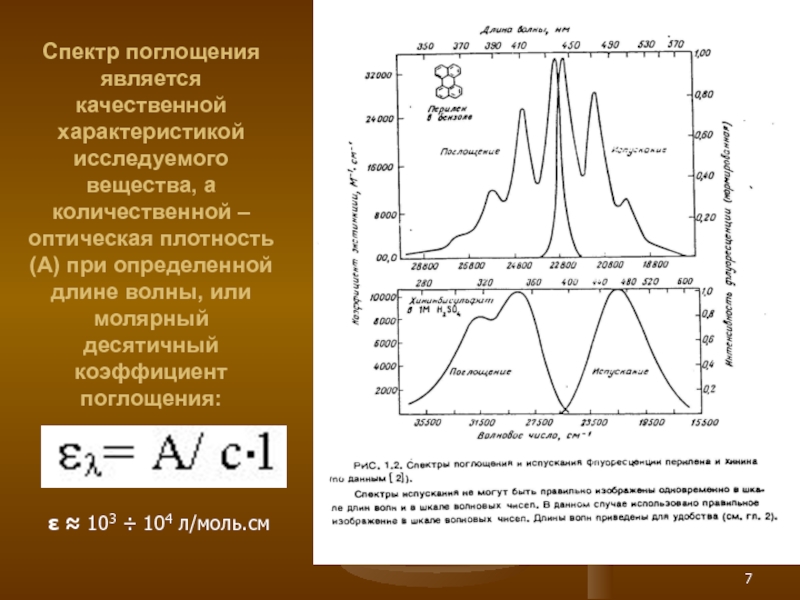
Слайд 7Спектр поглощения является качественной характеристикой исследуемого вещества, а количественной – оптическая
ε ≈ 103 ÷ 104 л/моль.см
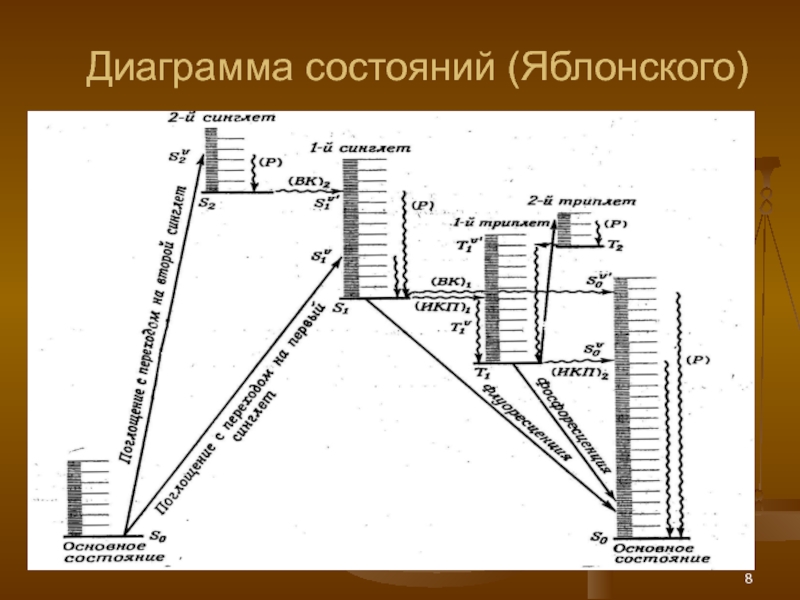
Слайд 9
Колебательная релаксация – очень быстрый процесс.
Внутренняя конверсия до S1– 10-13
Флуоресценция (S1 → S0 + hv) за 10-7 – 10-11
Интеркомбинационная конверсия (S1 → Т n ) – 10-13 – 10-8 с.
Внутренняя конверсия до Т 1 – 10-13 – 10-11 с.
ИКК до (Т1 → S0 ) 10-3 –10+1 с.
Фосфоресценция (Т1→ S0 + hv)
Слайд 10Ограничения
1. Закон Бера справедлив для разбавленных растворов.
2. Закон справедлив
3. Температура
4. Пучок света должен быть параллельным.
5. Свет поглощает только один тип частиц , т.е. отсутствует химическое заимодействие.
Слайд 11
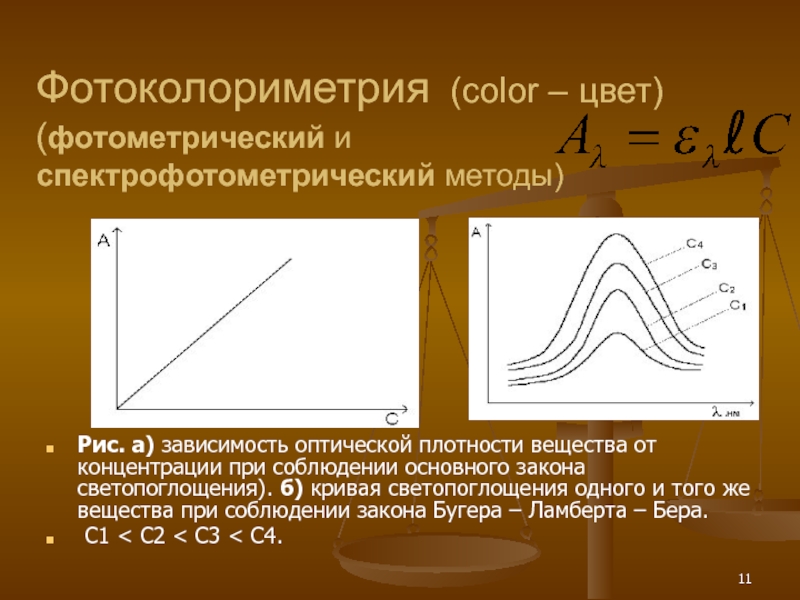
Фотоколориметрия (color – цвет)
(фотометрический и спектрофотометрический методы)
Рис. а) зависимость оптической плотности
С1 < С2 < С3 < С4.
Слайд 12Спектры поглощения
Рис.1.4. Способы представления спектров поглощения одних
и тех же растворов.
(С1
Евр / Екол / Еэл =
= 1 / 102 / 103
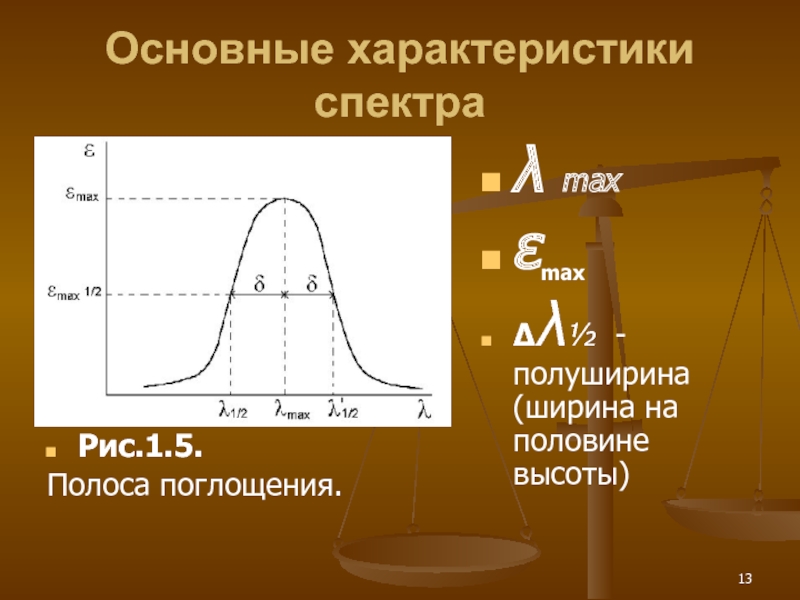
Слайд 13Основные характеристики спектра
Рис.1.5.
Полоса поглощения.
λ max
εmax
Δλ½ - полуширина (ширина
Слайд 15Регистрация спектров поглощения
Рис.1.6. Блок-схема приборов для измерения поглощения излучения. 1 –
2 – монохроматор; 3 – кюветы с исследуемым раствором и растворителем; 4 – приемник излучения; 5 – измерительное или регистрирующее устройство.
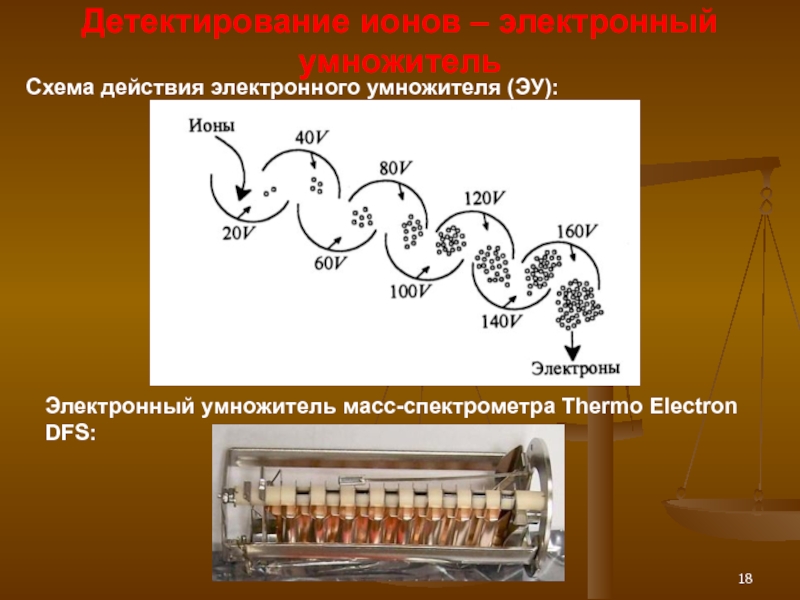
Слайд 18Детектирование ионов – электронный умножитель
Схема действия электронного умножителя (ЭУ):
Электронный умножитель масс-спектрометра
DFS:
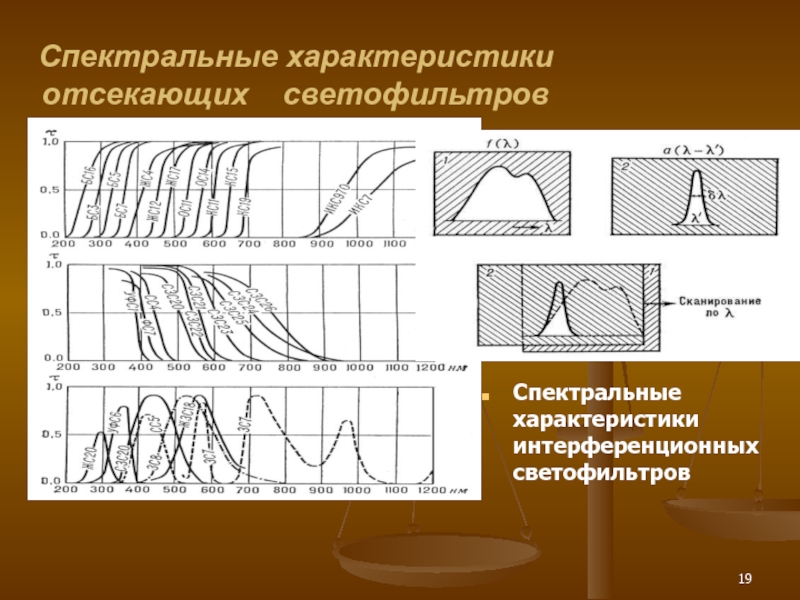
Слайд 19Спектральные характеристики отсекающих светофильтров
Спектральные характеристики интерференционных светофильтров
Слайд 20фотоколориметры
Принципиальная схема фотоколориметра:
Многофункциональный спектрофотометр с uv-диапазоном LEKI SS2107UV
Слайд 21Основные этапы анализа в фотометрии
– перевод анализируемого образца в раствор
– выбор фотометрической формы вещества и проведение химических реакций для получения окрашенного соединения (если определяемое вещество не обладает интенсивным собственным поглощением)
– установление области концентраций, в которой выполняется основной закон светопоглощения:
– измерение оптической плотности исследуемого раствора;
– расчет содержания вещества в анализируемой пробе и его метрологическая оценка.
Слайд 22 Метрологические характеристики метода
Чувствительность характеризуется углом наклона градуировочного графика. Тангенс угла
При величинах ε ≈ 105 чувствительность определения может составлять 10–7–10–6 М.
Слайд 23Метрологические характеристики метода
Воспроизводимость. ΔС/C имеет минимальное значение при Т = 0,37
А в интервале 0,1–1,0
Правильность.
отклонения от закона Бера
немонохроматичность
наличии примесей
Точность Обычная относительная погрешность фотометрических методов составляет 1–2%.
Слайд 24Анализ однокомпонентных систем фотометрическим методом
Метод сравнения оптических плотностей стандартного и исследуемого
Метод молярного коэффициента
поглощения
Метод градуировочного
графика
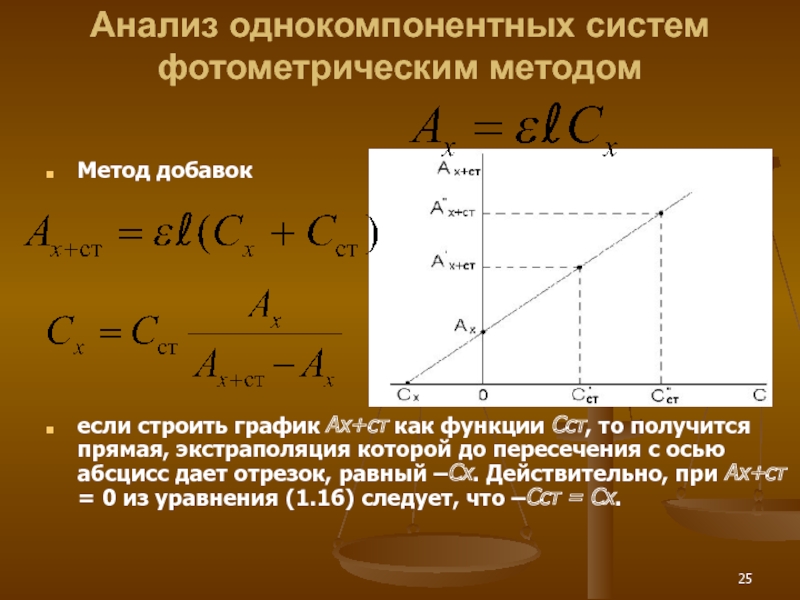
Слайд 25Анализ однокомпонентных систем фотометрическим методом
Метод добавок
если строить график Ах+ст как
Слайд 26Метод дифференциальной фотометрии
Метод высокого поглощения
(Со < Сх).
Метод низкого поглощения
(Со > Сх).
Метод двухстороннего дифференцирования
(метод предельной точности)
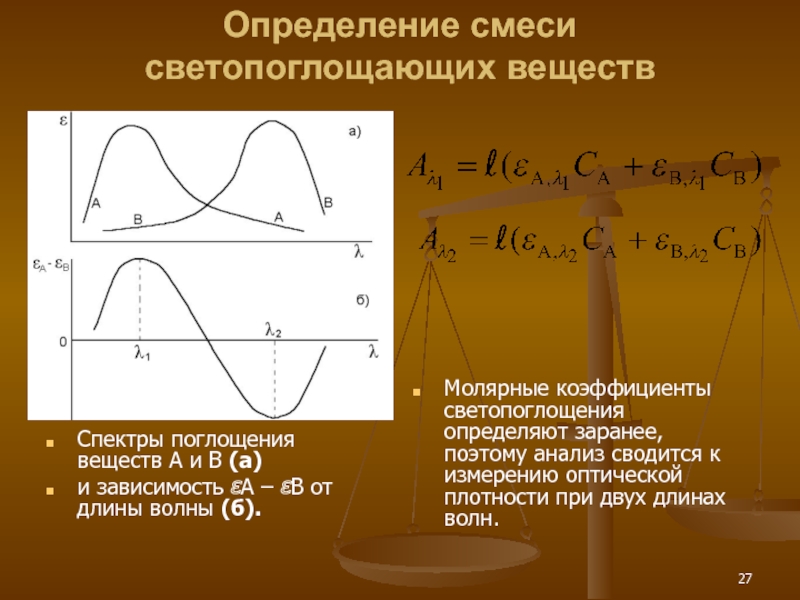
Слайд 27Определение смеси светопоглощающих веществ
Спектры поглощения веществ А и В (а)
и зависимость
Молярные коэффициенты светопоглощения определяют заранее, поэтому анализ сводится к измерению оптической плотности при двух длинах волн.
Слайд 29Другие области применения молекулярной
абсорбционной спектроскопии
Фотометрическое титрование.
Исследование равновесий в растворах.
Слайд 34Спектры поглощения органических соединений
ε ≥ 103
(
ароматические соединения, а также непредельные производные альдегидов, кетонов, кислот и аналогичных веществ, в молекулах которых имеется сопряжение как минимум двух кратных связей.
Слайд 35Влияние структуры молекулы
на λмакс
λмакс = 215 + Δλнм
λмакс = 197
Фурилполиеновые альдегиды
Слайд 37Источники ИК- излучения
Глобар
Газоразрядный лазер, генерирующий излучение на колебательно-вращательных переходах молекулы СО
Непрерывный газовый лазер на молекулах СО2 .
Инфракрасные спектрометры с преобразованием Фурье
Слайд 38Детекторы ИК-излучения
1 - цилиндр самописца, 2 - кюветное отделение, 3 -
Слайд 43Терагерцовое излучение
Максимальный допустимый диапазон ТГц частот 1011—1013 Гц, диапазон длин волн
Слайд 45Фотолюминесценция
Спектры поглощения (А), флуоресценции (Б) и фосфоресценции (В) одного соединения
Слайд 46Кинетика и тушение ФЛ
Константа тушения Штерна-Фольмера, определяемая из уравнения:
F/Fо = 1/(
KШФ τ [Q]1/2 = 1
Квантовый выход ФЛ про РЛИ
φf = vиспуск./vпогл.
Слайд 47Светосоставы постоянного действия (РЛИ)
РЛИ
Спектральный диапазон: 120 нм – 2000 нм
Интенсивность светового
до 1012 квант/см2 .с
Слайд 48Литература
Аналитическая химия. Проблемы и подходы. Кн.2. –М.: Мир, 2004.-728 с.
Харитонов Ю.Я.
Васильев В.П. Аналитическая химия. Кн. 2. Физико-химические методы анализа. – М.: Дрофа, 2004. - 383 с.
Пикаев А.К. Современная радиационная химия. Основные положения. Экспериментальная техника и методы. - М.: Наука, 1985. - 375 с.
Инструментальные методы анализа функциональных групп органических соединений /Под ред. С. Сиггиа – М.: Мир, 1974. - 465с.
Мельников М.Я. Электронно - возбужденные радикалы. В сб. Физическая химия. Современные проблемы. - М., Химия, 1987. - С. 48 - 88.
Дайер Д.Р. Приложения адсорбционной спектроскопии органических соединений. - М., Химия, 1970. - 163 с.


























![Кинетика и тушение ФЛКонстанта тушения Штерна-Фольмера, определяемая из уравнения:F/Fо = 1/( 1 + KШФ[Q]) KШФ](/img/tmb/5/484944/6939f3973c61203f1ca2815ab3dfbbda-800x.jpg)







