- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физико-химия поверхностных явлений презентация
Содержание
- 1. Физико-химия поверхностных явлений
- 2. Самопроизвольные процессы, протекающие на границе раздела двух
- 3. План 8.1 Поверхностная энергия и поверхностное натяжение.
- 4. 8.1 Свободную поверхностную энергию Gs накапливают молекулы
- 5. На молекулу воды, находящуюся в глубине жидкой
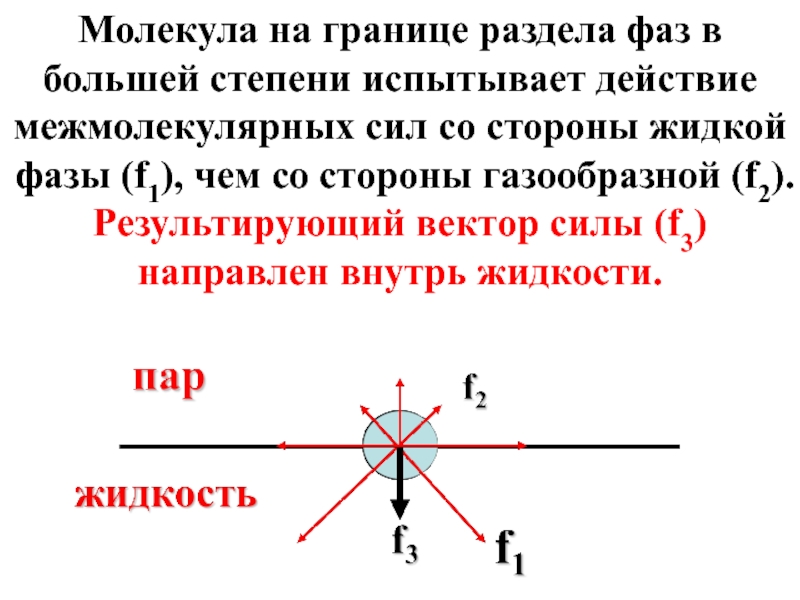
- 6. Молекула на границе раздела фаз в большей
- 7. Сила f3 создает внутреннее (межмолекулярное) давление жидкости,
- 8. Вследствие нескомпенсированности сил межмолекулярного взаимодействия, поверхностный слой
- 10. Поверхностное натяжение – важная характеристика жидкостей, зависящая
- 11. С увеличением температуры поверхностное натяжение жидкостей уменьшается,
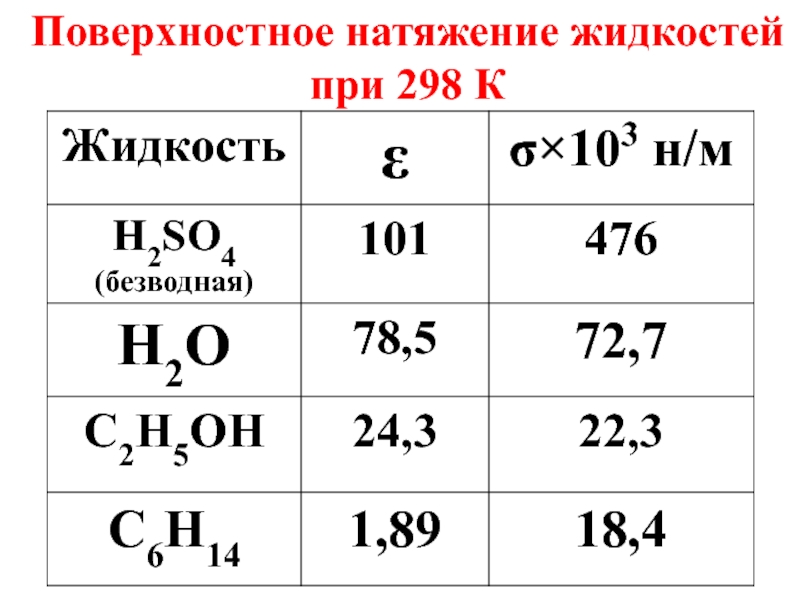
- 12. Поверхностное натяжение жидкостей при 298 К
- 13. Поверхностное натяжение – важная характеристика биологических жидкостей.
- 14. Согласно второму закону термодинамики
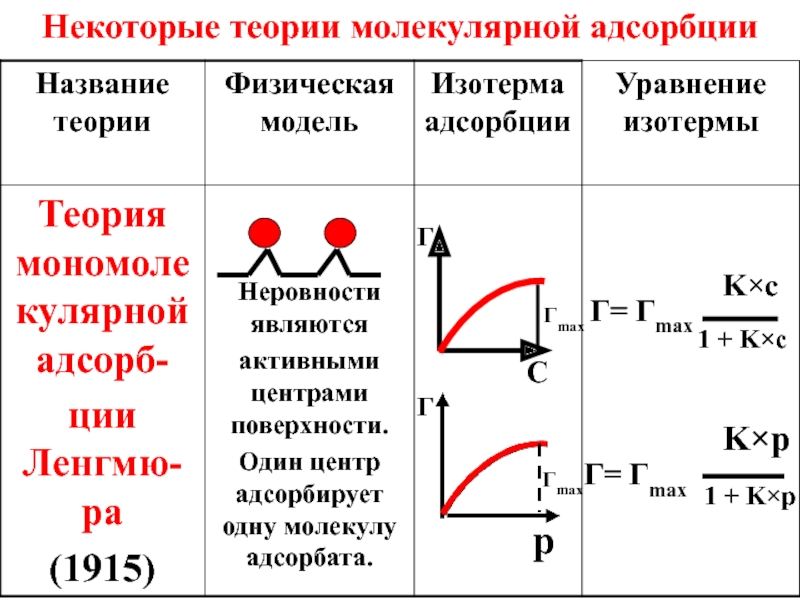
- 15. 8.2. Адсорбцией называется концентрирование какого-либо вещества в
- 16. Активирован-ный уголь Молекулы газа
- 17. Участниками сорбционного процесса являются адсорбент – вещество,
- 18. Адсорбция (Г) выражается в г/м2 или моль/м2
- 19. В зависимости от природы сил, действующих между адсорбентом и адсорбатом, различают физическую и химическую адсорбцию.
- 20. Физическая адсорбция обусловлена межмолекулярным взаимодействием адсорбата и
- 21. Для физической адсорбции характерны: обратимость: одновременно
- 22. Химическая адсорбция (хемосорбция) протекает тогда, когда между
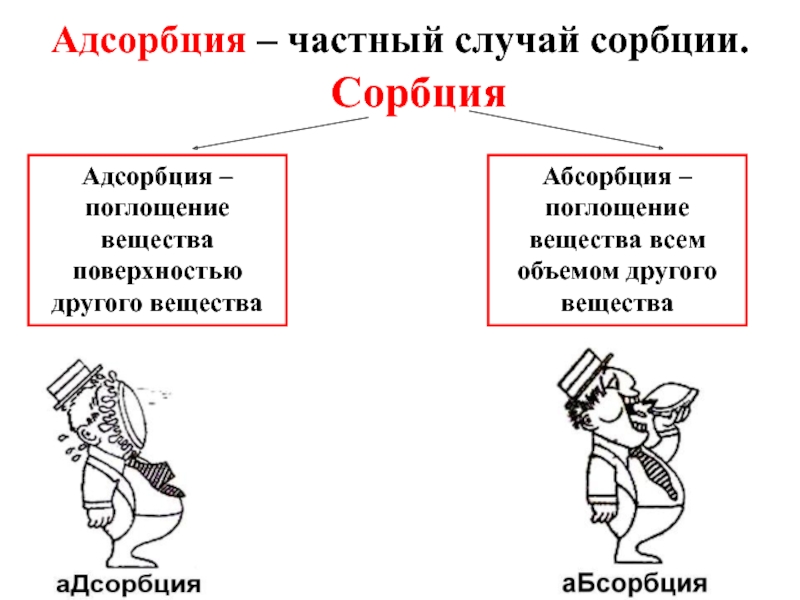
- 23. Адсорбция – частный случай сорбции. Сорбция Адсорбция
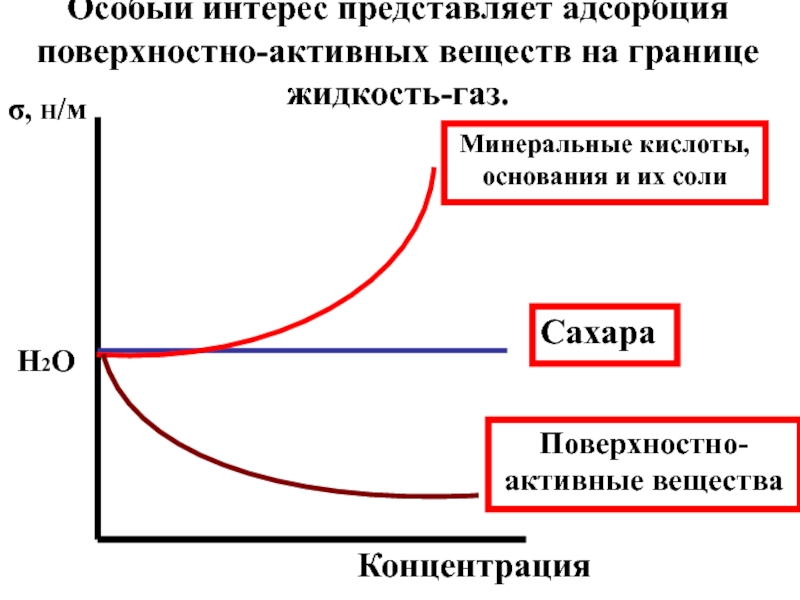
- 24. σ, Н/м Концентрация Особый интерес
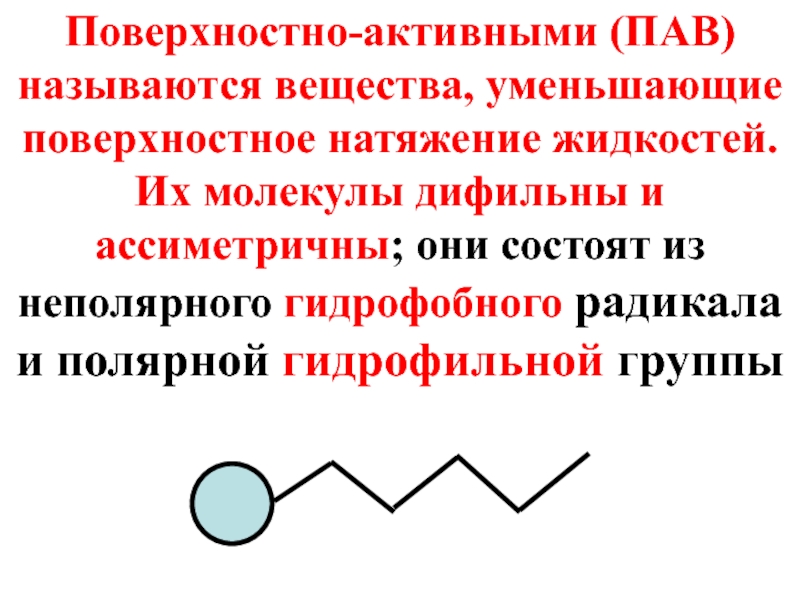
- 25. Поверхностно-активными (ПАВ) называются вещества, уменьшающие поверхностное натяжение
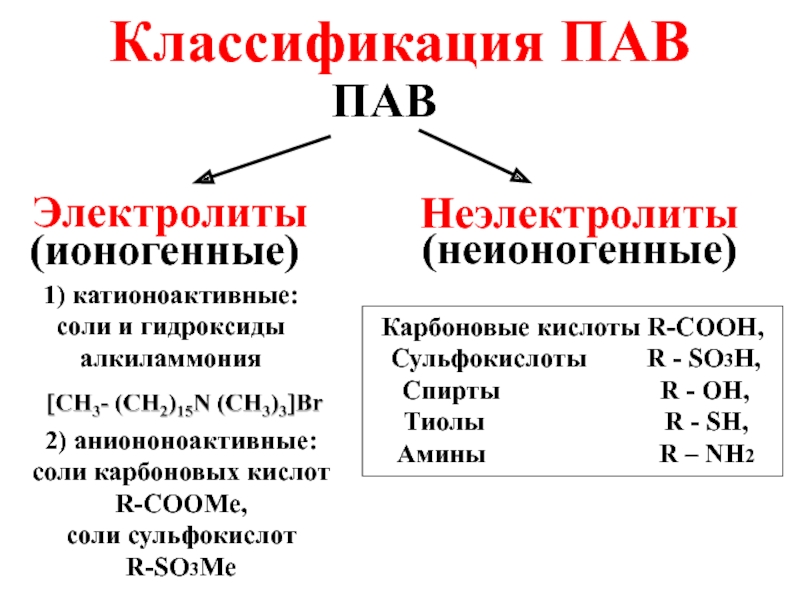
- 26. Классификация ПАВ ПАВ Электролиты Неэлектролиты (ионогенные) (неионогенные)
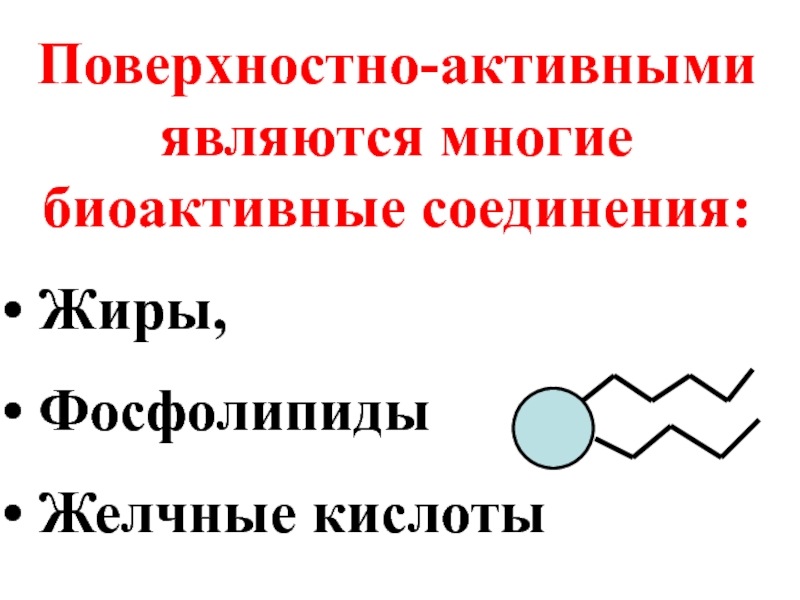
- 27. Поверхностно-активными являются многие биоактивные соединения: Жиры, Фосфолипиды Желчные кислоты
- 28. В соответствии с правилом «Подобное стремится к
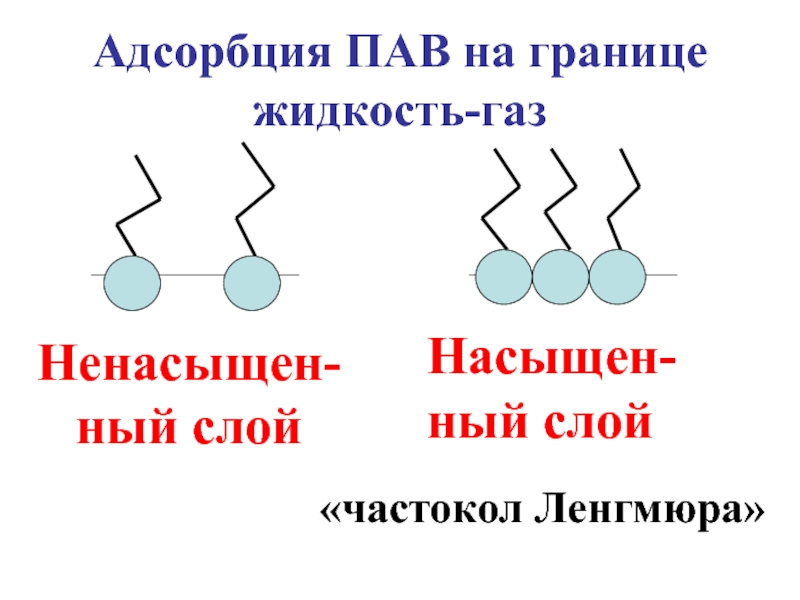
- 29. Насыщен-ный слой
- 30. Поскольку молекулы ПАВ менее полярны, чем молекулы воды, силы поверхностного натяжения в поверхностном слое уменьшаются.
- 31. С (ПАВ) Г моль
- 32. Зная Гmax можно рассчитать а) длину молекулы
- 33. Важнейшей характеристикой ПАВ является их поверхностная активность
- 34. Для членов одного гомологического ряда (спиртов, аминов
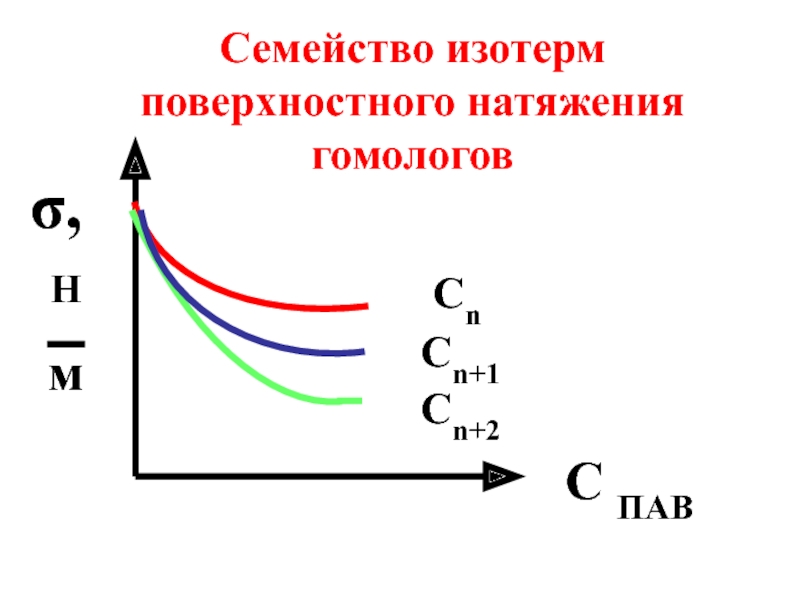
- 35. Сn Сn+1 Сn+2 C
- 36. Зависимость адсорбции ПАВ от их концентрации в
- 37. Влияние концентрации ПАВ на поверхностное натяжение растворов
- 38. Для расчета адсорбции ПАВ используется объединенное уравнение
- 39. Применение ПАВ Как моющие средства: молекулы ПАВ
- 40. 2) Как антисептики в хирургии: антимикробная активность
- 41. 3) Для производства липосом. Липосома (греч. «липос»
- 42. Липосомы применяются для направленной доставки лекарственного препарата к пораженным органам и тканям.
- 43. 8.3 Твердые адсорбенты – это природные или
- 44. Важнейшей характеристикой твердых адсорбентов является их активная
- 45. Классификация твердых адсорбентов 1)
- 46. 3) цеолиты – алюмосиликаты с высоким содержанием
- 47. целлюлоза, пектин и лигнин, являющиеся важным компонентом питания человека. 6. Пищевые волокна -
- 48. Виды адсорбции на твердых адсорбентах Молекулярная
- 49. Молекулярной называют адсорбцию неэлектролитов и слабых электролитов из жидкой или газообразной фазы твердыми адсорбентами.
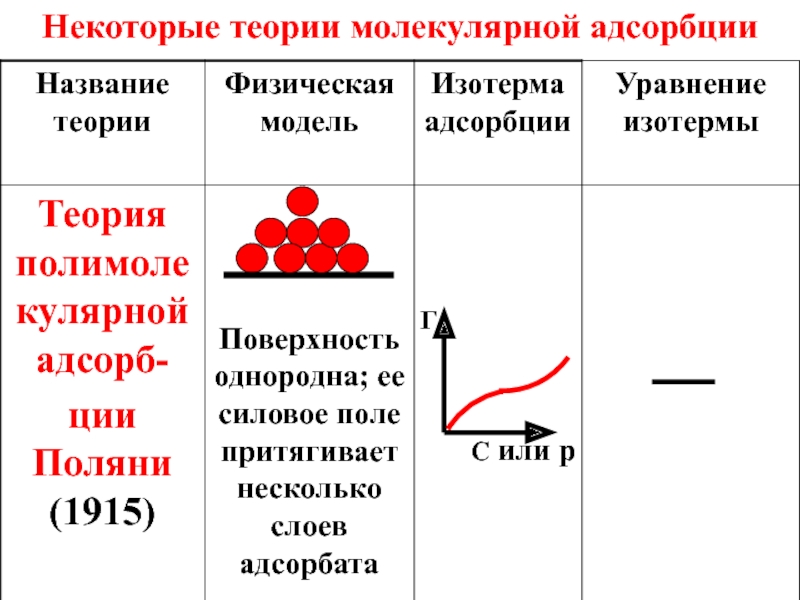
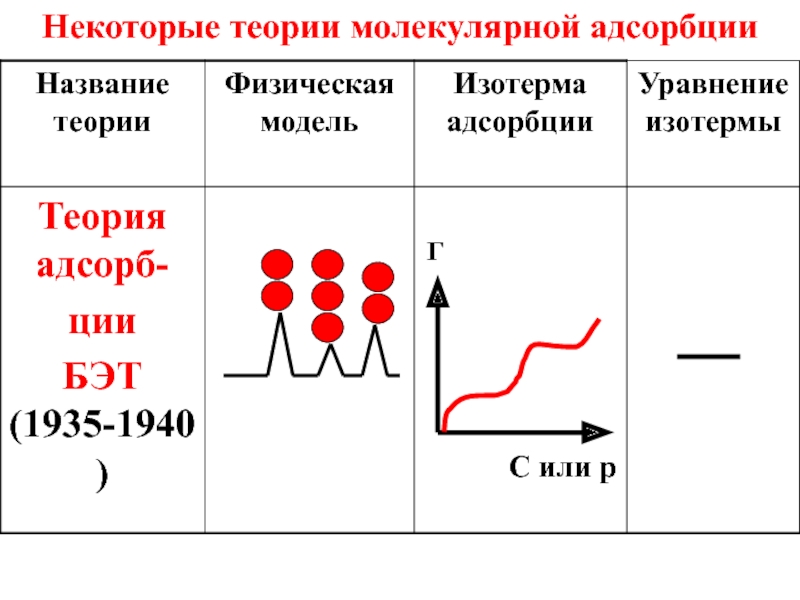
- 50. Некоторые теории молекулярной адсорбции
- 51. Некоторые теории молекулярной адсорбции
- 52. Некоторые теории молекулярной адсорбции
- 53. Для вычисления молекулярной адсорбции используют эмпирическое уравнение
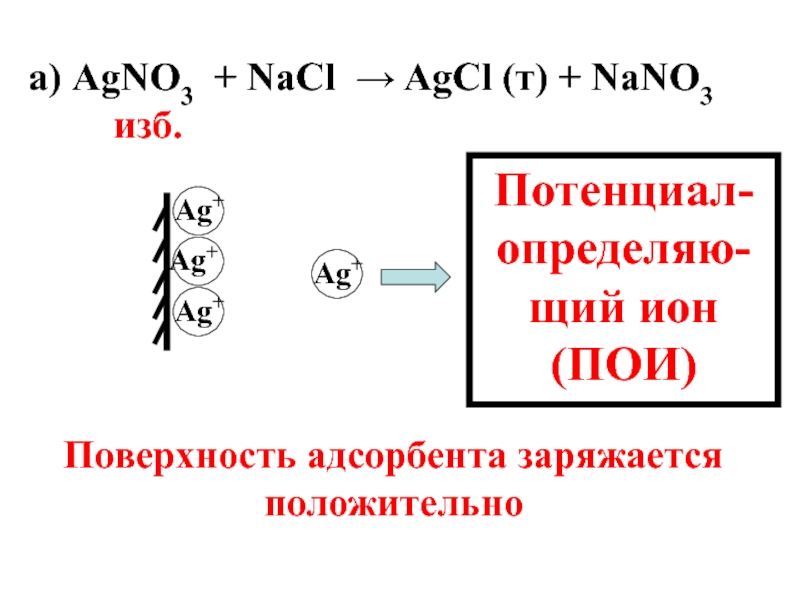
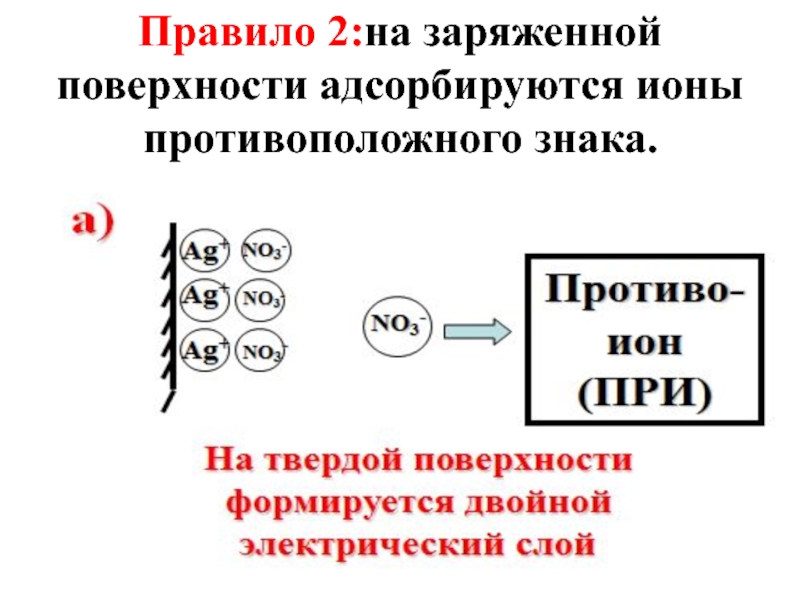
- 54. Избирательная адсорбция электролитов из растворов описывается правилами Панета-Фаянса.
- 55. Правило 1: на твердой поверхности адсорбируются преимущественно
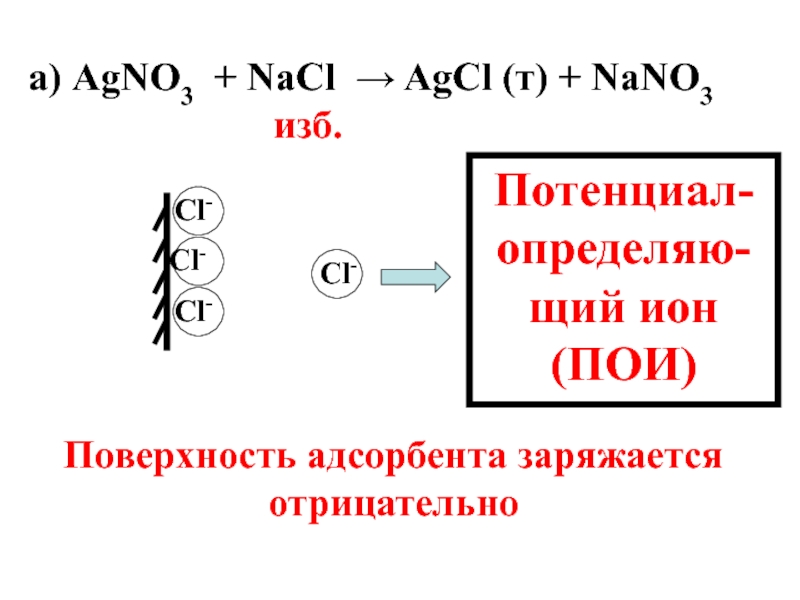
- 56. а) AgNО3 + NaCl → AgCl
- 57. а) AgNО3 + NaCl → AgCl
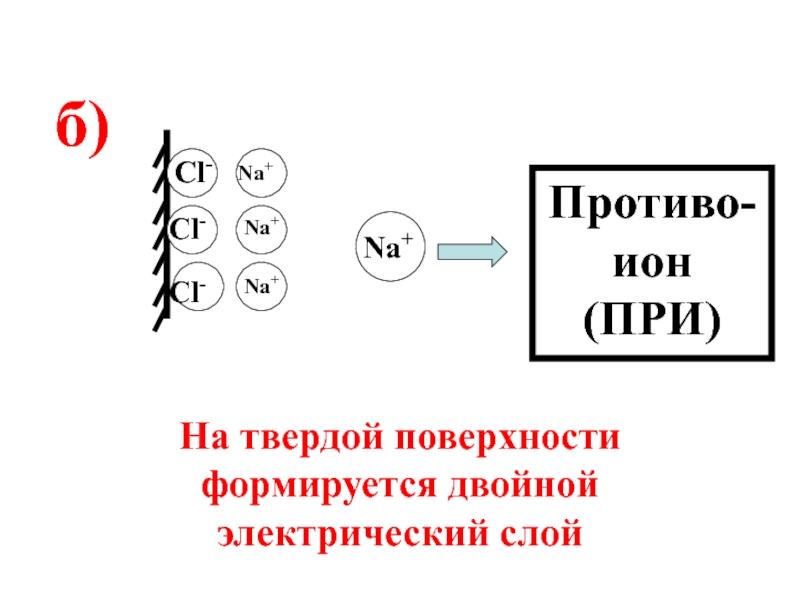
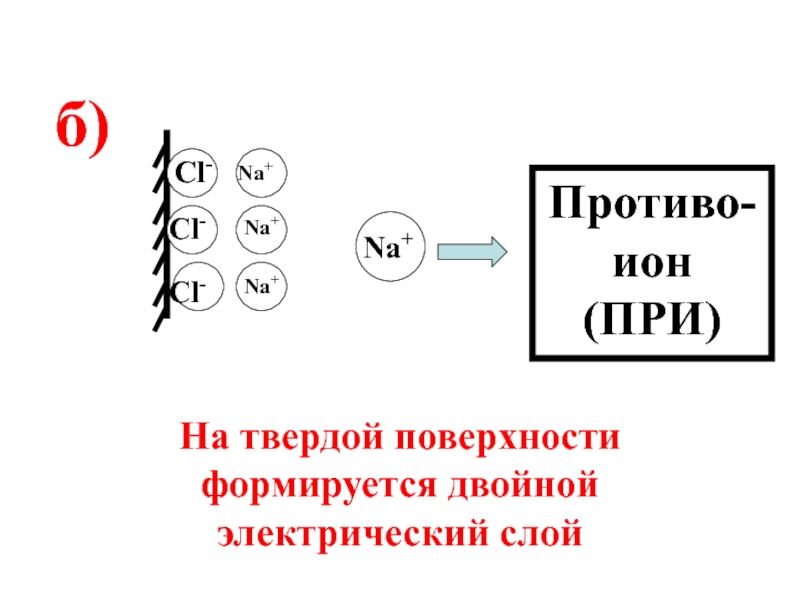
- 58. Правило 2:на заряженной поверхности адсорбируются ионы противоположного знака.
- 59. Cl- Cl- Cl-
- 60. Cl- Cl- Cl-
- 61. Ионообменная адсорбция - это процесс, в котором
- 62. Сорбенты, способные к обмену ионов, называются ионообменниками или ионитами. Иониты Катиониты Аниониты
- 63. Адсорбционная терапия применяется для удаления токсинов и
- 65. Энтеросорбция – это метод лечения, основанный на
- 66. «Будущее не за вводящей, а за выводящей медициной» проф. Ю.М. Лопухин
- 67. Благодарим за внимание!!!
Слайд 2Самопроизвольные процессы, протекающие на границе раздела двух фаз, называются поверхностными явлениями.
Поверхность кожи – 1,5 м2,
эритроцитов – 3000 м2
альвеол – 1000 м2
Слайд 3План
8.1 Поверхностная энергия и поверхностное натяжение.
8.2 Адсорбция ПАВ на границе жидкость-газ.
Слайд 48.1 Свободную поверхностную энергию Gs накапливают молекулы поверхностного слоя, что связано
Слайд 5На молекулу воды, находящуюся в глубине жидкой фазы, действуют силы межмолекулярного
Слайд 6Молекула на границе раздела фаз в большей степени испытывает действие межмолекулярных
Слайд 7Сила f3 создает внутреннее (межмолекулярное) давление жидкости, которое для воды
Межмолекулярное давление-это причина того, что жидкости практически несжимаемы.
Слайд 8Вследствие нескомпенсированности сил межмолекулярного взаимодействия, поверхностный слой имеет избыточную свободную энергию
Gs = σ× S
где S – площадь поверхности раздела фаз, м
σ – коэффициент пропорциональности, называемый поверхностным натяжением.
2
Слайд 9
σ = , =
S м2 м
Поверхностное натяжение – это поверхностная энергия единицы площади поверхности раздела фаз.
Слайд 10Поверхностное натяжение – важная характеристика жидкостей, зависящая
б) от полярности среды.
Слайд 11С увеличением температуры поверхностное натяжение жидкостей уменьшается, т.к. разрывается часть связей
Слайд 13Поверхностное натяжение – важная характеристика биологических жидкостей.
В норме σ крови
Слайд 14Согласно второму закону термодинамики Gs → min.
за счет уменьшения площади поверхности раздела двух фаз: жидкости принимают форму шара, а маленькие капли сливаются в большие.
Слайд 158.2. Адсорбцией называется концентрирование какого-либо вещества в поверхностном слое в результате
Слайд 17Участниками сорбционного процесса являются адсорбент – вещество, на поверхности которого идет
Слайд 18Адсорбция (Г) выражается в г/м2 или моль/м2 :
Г =
ν
S
m – масса
Г =
m
S
Слайд 19В зависимости от природы сил, действующих между адсорбентом и адсорбатом, различают
Слайд 20Физическая адсорбция обусловлена межмолекулярным взаимодействием адсорбата и адсорбента. Энергия такого взаимодействия
Слайд 21Для физической адсорбции характерны:
обратимость: одновременно с адсорбцией протекает десорбция,
неспецифичность:
экзотермичность (ΔадсН < О)
Слайд 22Химическая адсорбция (хемосорбция) протекает тогда, когда между адсорбентом и адсорбатом образуются
Слайд 23Адсорбция – частный случай сорбции.
Сорбция
Адсорбция – поглощение вещества поверхностью другого вещества
Абсорбция
Слайд 24
σ, Н/м
Концентрация
Особый интерес представляет адсорбция поверхностно-активных веществ на границе жидкость-газ.
Минеральные
Сахара
Поверхностно-активные вещества
H2O
Слайд 25Поверхностно-активными (ПАВ) называются вещества, уменьшающие поверхностное натяжение жидкостей. Их молекулы дифильны
Слайд 26Классификация ПАВ
ПАВ
Электролиты
Неэлектролиты
(ионогенные)
(неионогенные)
1) катионоактивные: соли и гидроксиды алкиламмония
2) аниононоактивные:
соли карбоновых кислот
R-COOMe,
соли
R-SO3Me
Карбоновые кислоты R-COOH,
Сульфокислоты R - SO3H,
Спирты R - OH,
Тиолы R - SH,
Амины R – NH2
Слайд 27Поверхностно-активными являются многие биоактивные соединения:
Жиры,
Фосфолипиды
Желчные кислоты
Слайд 28В соответствии с правилом «Подобное стремится к подобному», гидрофобные радикалы направлены
Слайд 30Поскольку молекулы ПАВ менее полярны, чем молекулы воды, силы поверхностного натяжения
Слайд 31
С (ПАВ)
Г моль
м2
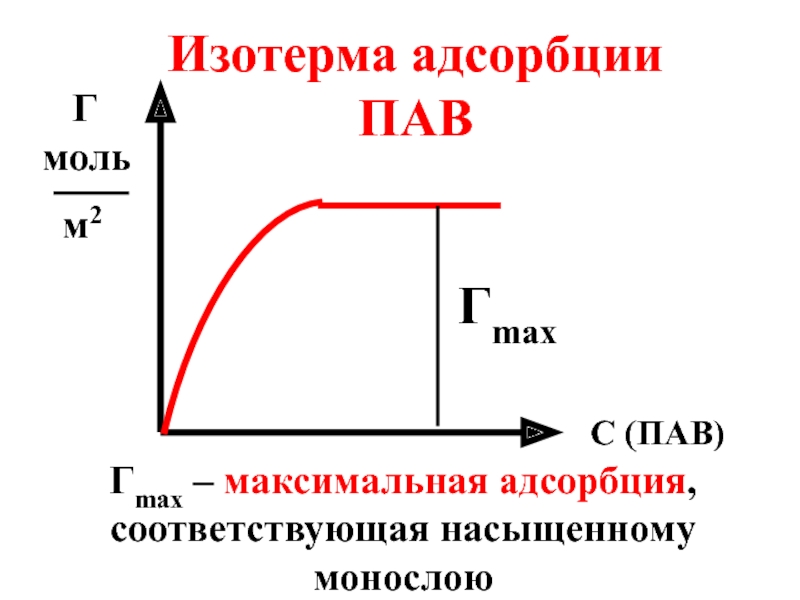
Изотерма адсорбции ПАВ
Гmax
Гmax – максимальная адсорбция,
Слайд 32Зная Гmax можно рассчитать
а) длину молекулы ПАВ (ℓ)
ℓ =
Г max
ρ
ρ – плотность ПАВ, М- молярная масса ПАВ
б) площадь, занимаемую молекулой ПАВ на границе раздела фаз (s):
Слайд 33Важнейшей характеристикой ПАВ является их поверхностная активность (g):
g =
Δσ
ΔC
где Δσ
Слайд 34Для членов одного гомологического ряда (спиртов, аминов или карбоновых кислот) выполняется
Слайд 36Зависимость адсорбции ПАВ от их концентрации в растворе описывается уравнением Гиббса
Г =
dσ
dс
C ПАВ
RT
×
Слайд 37Влияние концентрации ПАВ на поверхностное натяжение растворов описывается уравнением Шишковского (1909):
σ
где a и b – параметры уравнения (табл.), σ – поверхностное натяжение раствора, σо -поверхностное натяжение растворителя
Слайд 38Для расчета адсорбции ПАВ используется объединенное уравнение Гиббса-Шишковского:
Г =
a
RT
b×c
1 + b×c
×
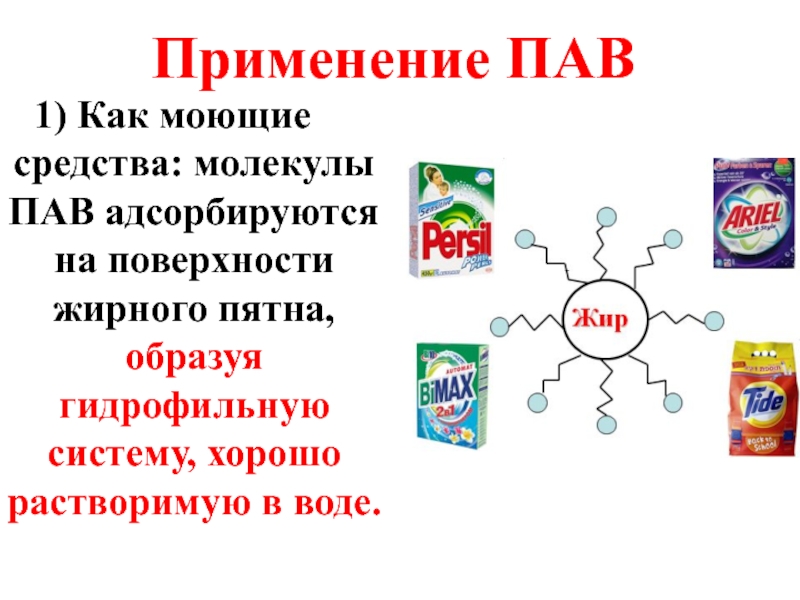
Слайд 39Применение ПАВ
Как моющие средства: молекулы ПАВ адсорбируются на поверхности жирного пятна,
Слайд 402) Как антисептики в хирургии:
антимикробная активность ионогенных ПАВ значительно выше (до
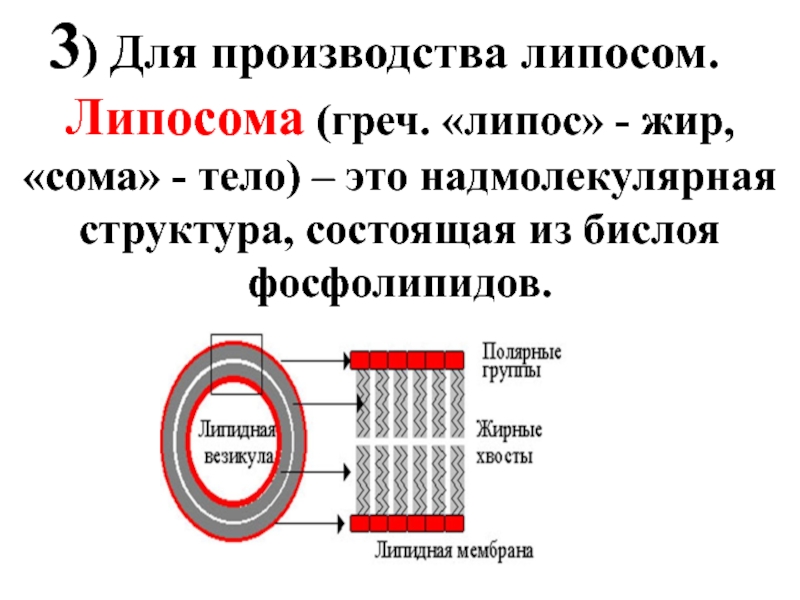
Слайд 413) Для производства липосом.
Липосома (греч. «липос» - жир, «сома» - тело)
Слайд 42Липосомы применяются для направленной доставки лекарственного препарата к пораженным органам и
Слайд 438.3 Твердые адсорбенты – это природные или синтетические вещества с развитой
Слайд 44Важнейшей характеристикой твердых адсорбентов является их активная (удельная) поверхность (Sa), выражаемая
Sa (активированный уголь) = = 1×103 м2/г
Sa (силикагель) = 465 м2/г
Слайд 45Классификация твердых адсорбентов
1) Углеродные сорбенты (активированный уголь);
Например, каолин (белая глина) AI2О3×SiO2×2 H2O;
Слайд 463) цеолиты – алюмосиликаты с высоким содержанием натрия и кальция;
Слайд 47целлюлоза, пектин и лигнин, являющиеся важным компонентом питания человека.
6. Пищевые
Слайд 48Виды адсорбции на твердых адсорбентах
Молекулярная адсорбция
2. Избирательная адсорбция электролитов из
3. Ионообменная адсорбция из растворов
Слайд 49Молекулярной называют адсорбцию неэлектролитов и слабых электролитов из жидкой или газообразной
Слайд 53Для вычисления молекулярной адсорбции используют эмпирическое уравнение Фрейндлиха:
æ = kс1/n æ
æ – масса адсорбата на 1 грамме адсорбента,
р – равновесное давление в газовой фазе,
с – равновесная концентрация в жидкой фазе,
k – константа Фрейндлиха,
n – параметр уравнения.
Слайд 55Правило 1: на твердой поверхности адсорбируются преимущественно те ионы, которые входят
Слайд 56 а) AgNО3 + NaCl → AgCl (т) + NaNO3
Ag+
Ag+
Ag+
Ag+
Потенциал-определяю-щий ион (ПОИ)
Поверхность адсорбента заряжается положительно
Слайд 57 а) AgNО3 + NaCl → AgCl (т) + NaNO3
Cl-
Cl-
Cl-
Cl-
Потенциал-определяю-щий ион (ПОИ)
Поверхность адсорбента заряжается отрицательно