- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физико-химия дисперсных систем (лекция 9) презентация
Содержание
- 1. Физико-химия дисперсных систем (лекция 9)
- 2. ПЛАН 9.1 Дисперсные системы и их классификация.
- 3. Дисперсионная
- 4. Классификация дисперсных систем 1) По степени дисперсности
- 5. 2) По степени взаимодействия дисперсной фазы и
- 6. Лиофильные - это системы, в которых сильно
- 7. 3) По отсутствию или наличию межмолекулярного взаимодействия
- 8. 4) По агрегатному состоянию дисперсной фазы и дисперсионной среды
- 11. 9.2 Для получения коллоидных растворов используют: 1)метод диспергирования, 2)метод конденсации
- 12. Метод диспергирования– дробление крупных частиц до коллоидной степени дисперсности.
- 13. Диспергирование можно осуществлять : а) механическим дроблением
- 14. г) метод пептизации- дробление свежеприготовленных осадков на
- 15. Ионы электролита-пептизатора адсорбируются на поверхности частиц осадка,
- 16. Пептизация имеет большое биологическое значение:
- 17. Метод конденсации – соединение
- 18. В основе химической конденсации лежат химические реакции, протекающие с образованием труднорастворимых соединений.
- 19. ОВР H[AuCl4] + 3 H2O2
- 20. гидролиз FeCl3 + 3 H2O
- 21. Получение дисперсных систем методом физической конденсации выполняют:
- 22. В организме превалирующим является конденсационный метод. Одним
- 23. Методы очистки золей Диализ и электродиализ–
- 24. диализат ЗОЛЬ мембрана Простейший диализатор Вода Диализ
- 25. Диализ протекает медленно, но он может быть
- 26. Ультрафильтрация осуществляется путем продавливания золя через плотные
- 27. Процесс ультрафильтрации лежит в основе работы почек.
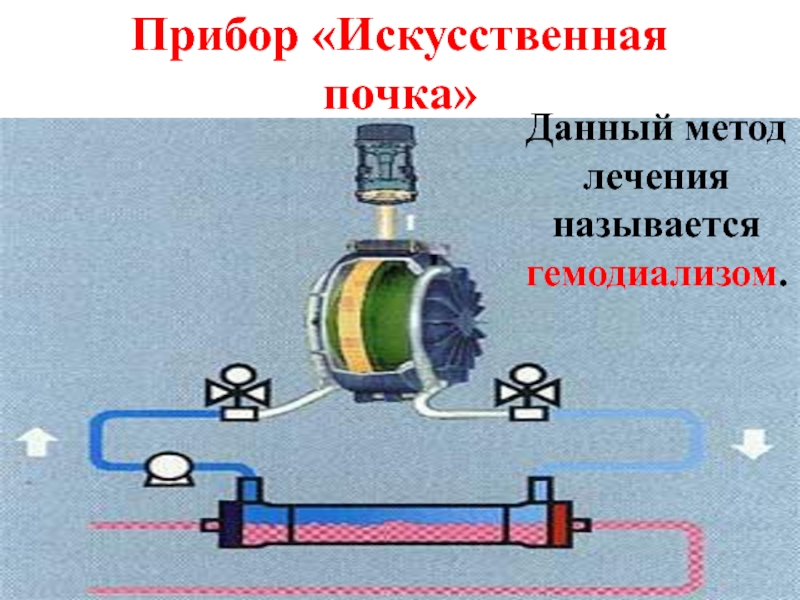
- 28. Прибор «Искусственная почка» Данный метод лечения называется гемодиализом.
- 29. 9.3 Согласно мицеллярной теории, золь состоит из мицелл и интермицеллярной жидкости.
- 30. Мицелла – это электронейтральная частица дисперсной фазы,
- 31. Основу мицеллы составляют микрокристаллы трудно-растворимого вещества, называемые
- 32. Пример. Рассмотрим строение мицеллы золя AgI, образующегося
- 33. Электролит в избытке (AgNO3) является стабилизатором т.к.
- 34. Формула мицеллы AgI {[m AgI] n
- 35. ПОИ – потенциалопредляющие ионы, адсорбирующиеся на поверхности
- 36. Коллоидная частица (гранула) – это часть мицеллы,
- 37. Образование двойного электрического слоя (ДЭС) приводит к
- 38. ξ– потенциал служит мерой устойчивости коллоидных частиц, мерой размеров межклеточных пространств in vivo.
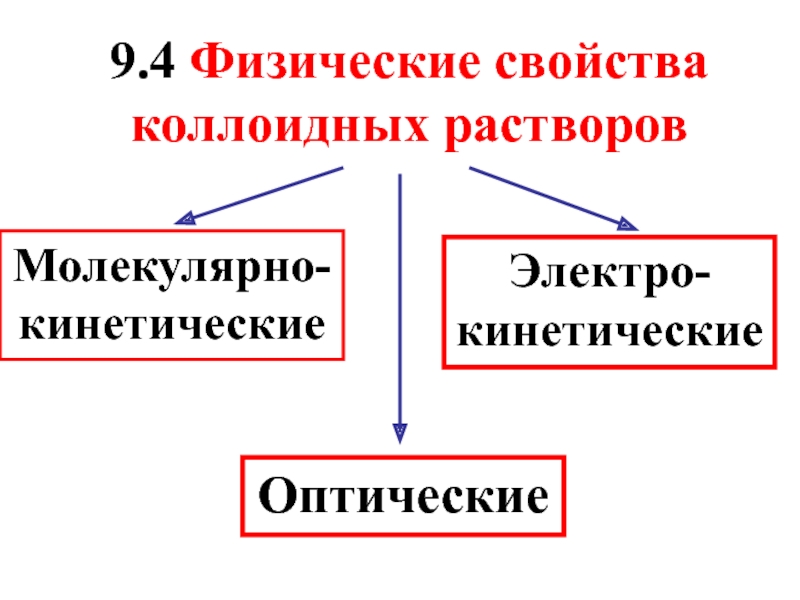
- 39. 9.4 Физические свойства коллоидных растворов Молекулярно-кинетические Оптические Электро-кинетические
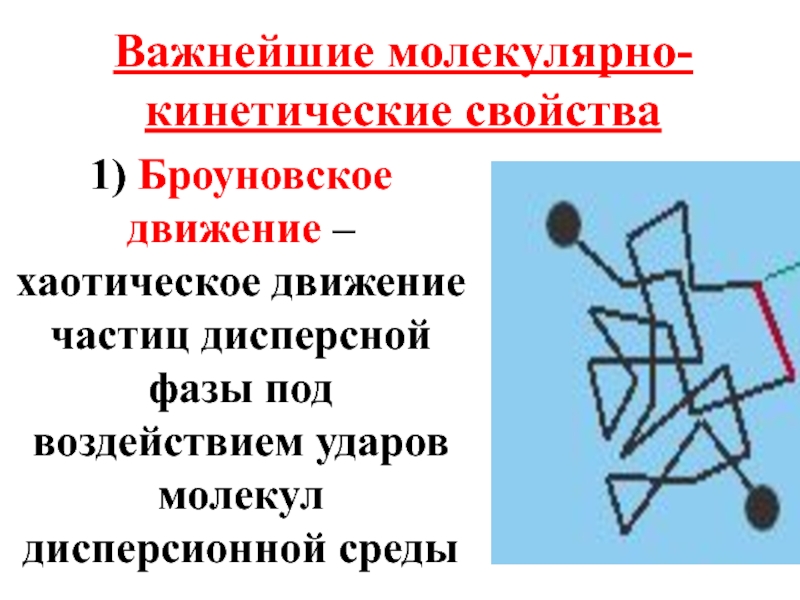
- 40. Важнейшие молекулярно-кинетические свойства 1) Броуновское движение –
- 41. 2) Диффузия – самопроизвольный процесс выравнивания концентраций
- 42. Особые оптические свойства дисперсных систем обусловлены тем,
- 43. Если луч света направить на коллоидный раствор,
- 44. Электрокинетическими явлениями называются процессы, протекающие в золях
- 45. Электрофорез- это направленное движение коллоидных частиц под
- 46. Электрофорез применяется для диагностики и контроля за
- 47. Электроосмос – это движение дисперсионной среды относительно
- 48. 9.5 Под устойчивостью дисперсной системы понимают
- 49. Причиной кинетической устойчивости является броуновское движение, которое противодействует оседанию частиц под действием силы тяжести.
- 50. Агрегативная устойчивость золей обусловлена наличием у коллоидных
- 51. Чем больше заряд частицы, тем выше ее электрокинетический потенциал и стабильнее золь.
- 52. При нарушении агрегативной устойчивости золей происходит их коагуляция.
- 53. Коагуляция - процесс объединения коллоидных частиц в
- 54. Коагуляцию может вызывать:
- 55. Коагуляция электролитами протекает в живом организме,
- 56. Все сильные электролиты вызывают коагуляцию золей при
- 57. Порог коагуляции (γ) – это минимальное количество
- 58. Коагулирующие действие электролитов описывается правилом Шульце –
- 59. Дерягин и Ландау показали, что γI
- 60. Правило Шульце - Гарди носит приблизительный характер,
- 61. Ионы с одинаковыми зарядами, но различными ионными
- 62. Процесс коагуляции золя характеризуется определенной величиной скорости
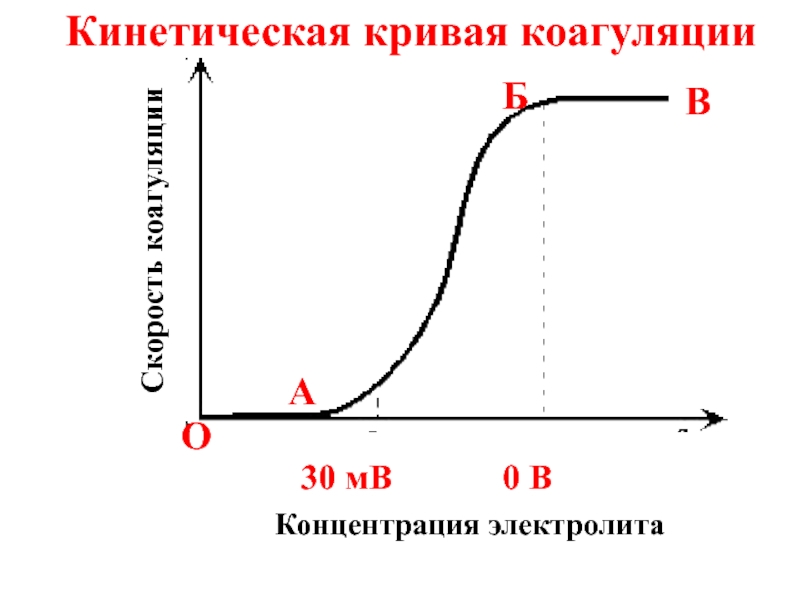
- 63. Кинетическая кривая коагуляции Скорость коагуляции Концентрация электролита 0 В 30 мВ O A Б B
- 64. Отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость.
- 65. В точке А начинается явная коагуляция, которая
- 66. На участке БВ скорость коагуляции достигает максимального
- 67. При коагуляции золя смесью электролитов можно наблюдать:
- 68. в) явление синергизма - усиление
- 69. Коагуляция может происходить при смешении золей с различными знаками заряда их частиц (взаимная коагуляция).
- 70. Такой тип коагуляции применяется в санитарно-гигиенической практике
- 71. Благодарим за внимание!!!
Слайд 2ПЛАН
9.1 Дисперсные системы и их классификация.
9.2 Получение и очистка коллоидных растворов.
9.3
9.4 Физические свойства золей.
9.5 Устойчивость коллоидных растворов. Коагуляция.
Слайд 3
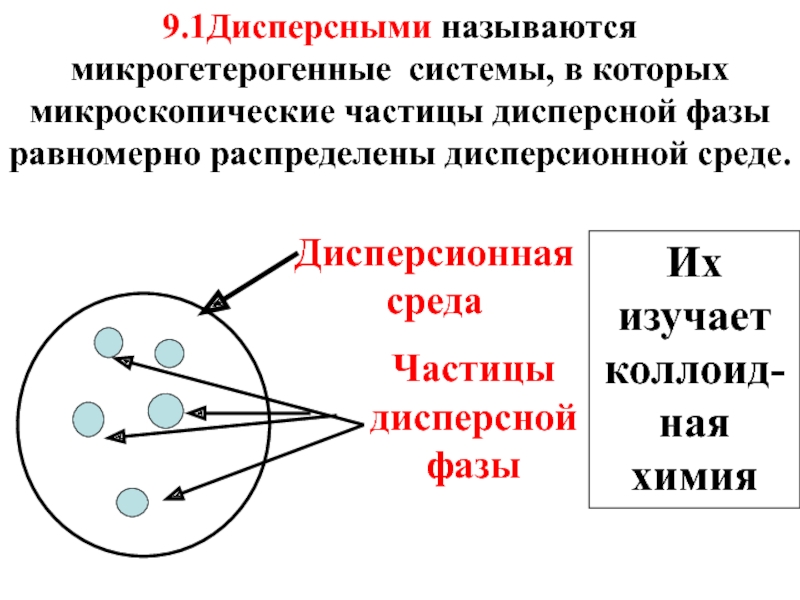
Дисперсионная среда
Частицы дисперсной фазы
9.1Дисперсными называются микрогетерогенные системы, в которых микроскопические частицы
Их изучает коллоид-ная химия
Слайд 4Классификация дисперсных систем
1) По степени дисперсности
Коллоидно-дисперсные
Грубо- дисперсные
10‾7< α < 10‾5м
α- диаметр частицы дисперсной фазы
Слайд 52) По степени взаимодействия дисперсной фазы и дисперсионной среды
Под их взаимодействием
Слайд 6Лиофильные - это системы, в которых сильно выражен эффект сольватации (растворы
Лиофобные - это системы, в которых эффект сольватации отсутствует (дисперсии металлов и труднорастворимых солей). Они не устойчивы; их образование протекает не самопроизвольно.
Дисперсные системы
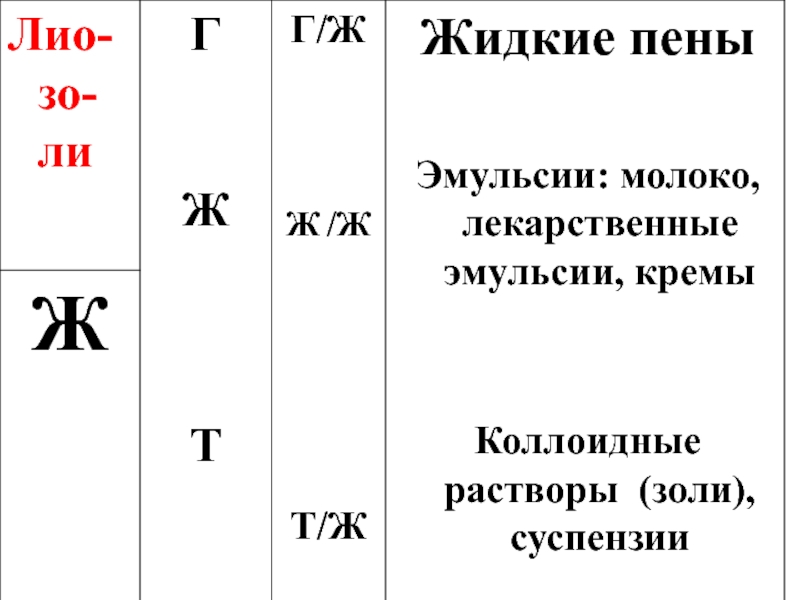
Слайд 73) По отсутствию или наличию межмолекулярного взаимодействия между частицами дисперсной фазы
Свободно-дисперсные
Связно-дисперсные – частицы связаны между собой; их движение затруднено (гели, студни)
Слайд 119.2 Для получения коллоидных растворов используют:
1)метод диспергирования,
2)метод конденсации
Слайд 13Диспергирование можно осуществлять :
а) механическим дроблением (шаровые, коллоидные мельницы);
б) электрическим распылением
в) действием ультразвука;
Слайд 14г) метод пептизации- дробление свежеприготовленных осадков на отдельные коллоидные частицы при
Слайд 15Ионы электролита-пептизатора адсорбируются на поверхности частиц осадка, сообщая им одноименный электрический
Слайд 16Пептизация имеет большое биологическое значение:
рассасывание атеросклеротических бляшек, почечных и печеночных
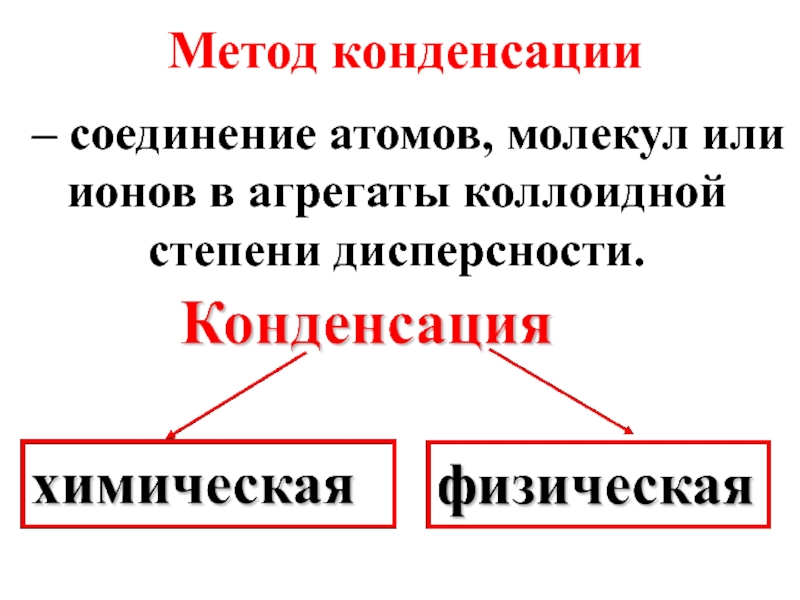
Слайд 17 Метод конденсации
– соединение атомов, молекул или ионов в агрегаты
Слайд 18В основе химической конденсации лежат химические реакции, протекающие с образованием труднорастворимых
Слайд 19 ОВР
H[AuCl4] + 3 H2O2 → 2 Au ↓+
+
получение дисперсии радиоактивного золота для лечения онкологических заболеваний
Слайд 20 гидролиз
FeCl3 + 3 H2O ⮀ Fe(OH)3↓ + 3 HCl
ионный
AgNO3 + KI → AgI↓ + KNO3
Получение протаргола (сильнодействующего антисептика)
Слайд 21Получение дисперсных систем методом физической конденсации выполняют: (а)путем замены растворителя (в
Слайд 22В организме превалирующим является конденсационный метод. Одним из немногих примеров диспергирования
Слайд 23Методы очистки золей
Диализ и электродиализ– очистка золей от электролитов
Ультрафильтрация-отделение дисперсной
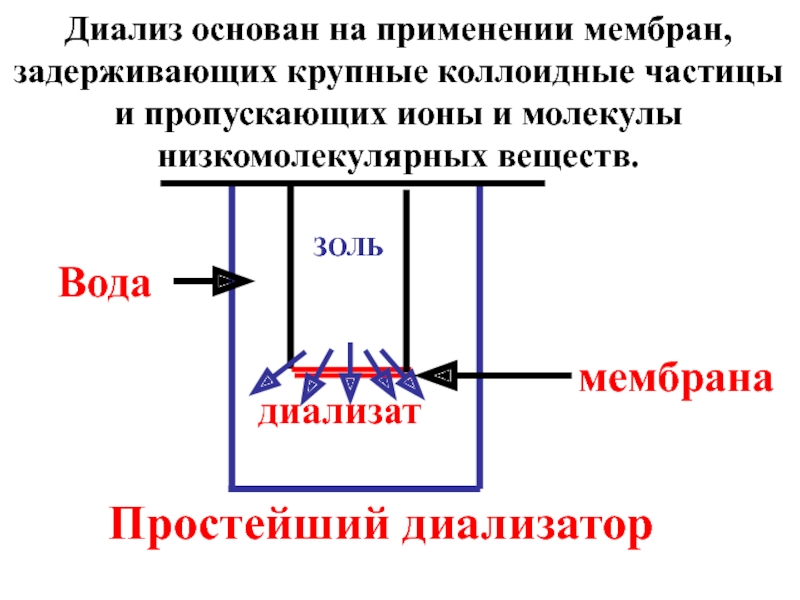
Слайд 24диализат
ЗОЛЬ
мембрана
Простейший диализатор
Вода
Диализ основан на применении мембран, задерживающих крупные коллоидные частицы и
Слайд 25Диализ протекает медленно, но он может быть ускорен путем пропускания электрического
Слайд 26Ультрафильтрация осуществляется путем продавливания золя через плотные фильтры, непроницаемые для частиц
Слайд 27Процесс ультрафильтрации лежит в основе работы почек. Примером сочетания диализа и
Слайд 30Мицелла – это электронейтральная частица дисперсной фазы, окруженная двойным электрическим слоем
Интермицеллярная жидкость – это дисперсионная среда, разделяющая мицеллы
Слайд 31Основу мицеллы составляют микрокристаллы трудно-растворимого вещества, называемые агрегатом. В результате избирательной
Слайд 32Пример. Рассмотрим строение мицеллы золя AgI, образующегося в результате реакции:
AgNO3 +
изб.
твердая фаза
Слайд 33Электролит в избытке (AgNO3) является стабилизатором т.к. сообщает устойчивость коллоидным частицам.
Слайд 34Формула мицеллы AgI
{[m AgI] n Ag+ (n - x)NO3-}x+x NO3-
агрегат
ядро
Адсорбционный слой
Коллоидная частица
мицелла
Диффузный слой
Слайд 35ПОИ – потенциалопредляющие ионы, адсорбирующиеся на поверхности агрегата,
ПРИ – противоионы, адсорбирующиеся
Слайд 36Коллоидная частица (гранула) – это часть мицеллы, состоящая из агрегата и
+n -1(n-х) = +n – n + х = + x
Слайд 37Образование двойного электрического слоя (ДЭС) приводит к тому, что на поверхности
Слайд 38ξ– потенциал служит
мерой устойчивости коллоидных частиц,
мерой размеров межклеточных пространств
Слайд 399.4 Физические свойства коллоидных растворов
Молекулярно-кинетические
Оптические
Электро-кинетические
Слайд 40Важнейшие молекулярно-кинетические свойства
1) Броуновское движение – хаотическое движение частиц дисперсной фазы
Слайд 412) Диффузия – самопроизвольный процесс выравнивания концентраций частиц по всему объему
Слайд 42Особые оптические свойства дисперсных систем обусловлены тем, что размеры коллоидных частиц
Это приводит к рассеянию света, проходящего через золь.
Слайд 43Если луч света направить на коллоидный раствор, то его путь будет
в виде светящегося конуса, называемого конусом Тиндаля.
Слайд 44Электрокинетическими явлениями называются процессы, протекающие в золях под воздействием внешнего электрического
электрофорез и
электроосмос.
Слайд 45Электрофорез- это направленное движение коллоидных частиц под действием внешнего электрического поля
Слайд 46Электрофорез применяется для диагностики и контроля за ходом болезни.
Его используют
Слайд 47Электроосмос – это движение дисперсионной среды относительно неподвижной дисперсной фазы через
Слайд 489.5 Под устойчивостью дисперсной системы понимают постоянство во времени ее
Кинетическая (седиментационная)
Агрегативная
Слайд 49Причиной кинетической устойчивости является броуновское движение, которое противодействует оседанию частиц под
Слайд 50Агрегативная устойчивость золей обусловлена наличием у коллоидных частиц одноименных электрических зарядов,
Слайд 53Коагуляция - процесс объединения коллоидных частиц в более крупные агрегаты вследствие
Слайд 54Коагуляцию может вызывать:
Слайд 55Коагуляция электролитами протекает в живом организме,
Слайд 56Все сильные электролиты вызывают коагуляцию золей при увеличении их концентрации в
Слайд 57Порог коагуляции (γ) – это минимальное количество электролита, которое надо добавить
Слайд 58Коагулирующие действие электролитов описывается правилом Шульце – Гарди: коагуляцию вызывают ионы,
Слайд 60Правило Шульце - Гарди носит приблизительный характер,
т.к. не учитывает влияние
Слайд 61Ионы с одинаковыми зарядами, но различными ионными радиусами, образуют лиотропные ряды:
Li+
Увеличение коагулирующей способности ионов
Слайд 62Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить
Слайд 64Отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою
Слайд 65В точке А начинается явная коагуляция, которая соответствует уменьшению ξ-потенциала коллоидных
Слайд 66На участке БВ скорость коагуляции достигает максимального значения; этот отрезок кинетической
Слайд 67При коагуляции золя смесью электролитов можно наблюдать:
а) явление аддитивности - суммирование
б) явление антагонизма - ослабление коагулирующего действия одного иона в присутствии другого;















![ОВРH[AuCl4] + 3 H2O2 → 2 Au ↓+ + 8 HCl + 3 O2получение](/img/tmb/5/487577/5a365ad1519eb039cc3b637252ae679e-800x.jpg)












![Формула мицеллы AgI{[m AgI] n Ag+ (n - x)NO3-}x+x NO3- агрегат ПОИ ПРИ](/img/tmb/5/487577/46ce9c206726ad4df45dc7ddcb2a7af1-800x.jpg)