- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Абсолютная температура как мера средней кинетической энергии частиц презентация
Содержание
- 1. Абсолютная температура как мера средней кинетической энергии частиц
- 2. ПЛАН ЗАНЯТИЯ Модель идеального газа. Микро- и
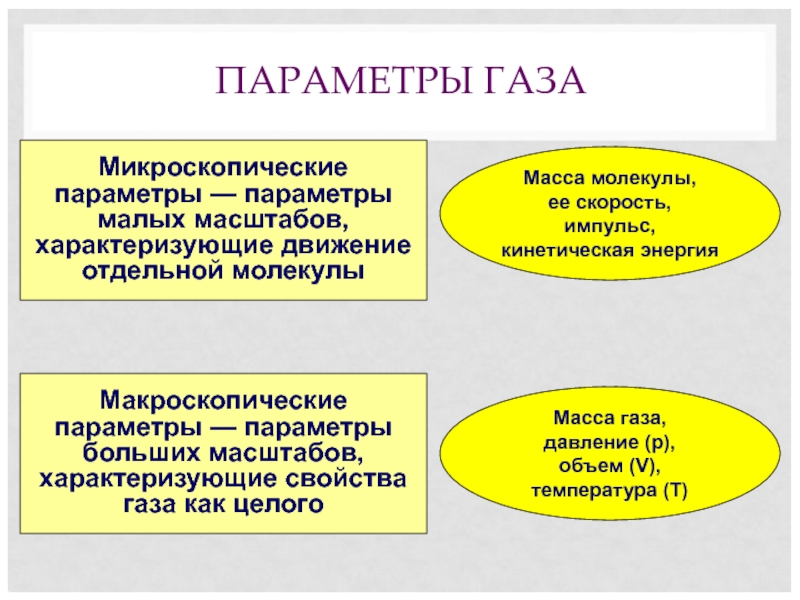
- 3. ПАРАМЕТРЫ ГАЗА Микроскопические параметры — параметры малых
- 4. Это означает, что в системе не меняются
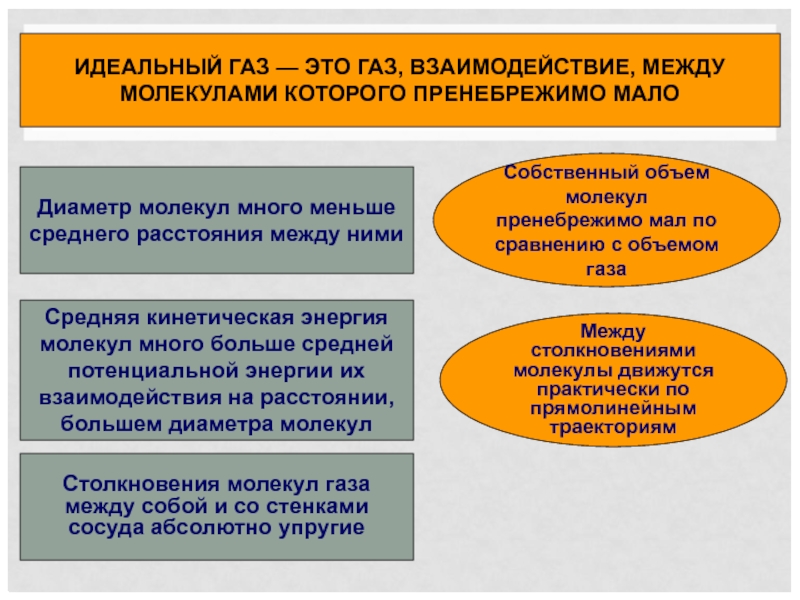
- 5. ИДЕАЛЬНЫЙ ГАЗ — ЭТО ГАЗ, ВЗАИМОДЕЙСТВИЕ, МЕЖДУ
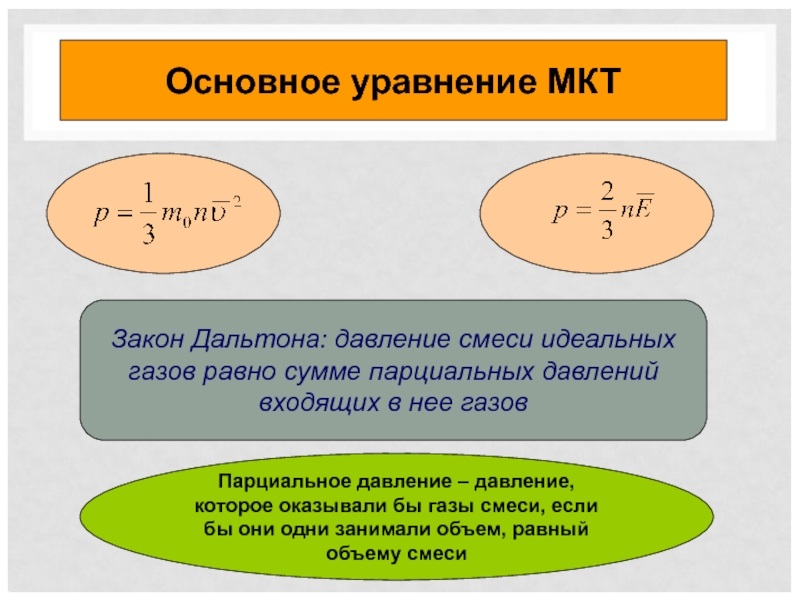
- 6. Основное уравнение МКТ Закон Дальтона:
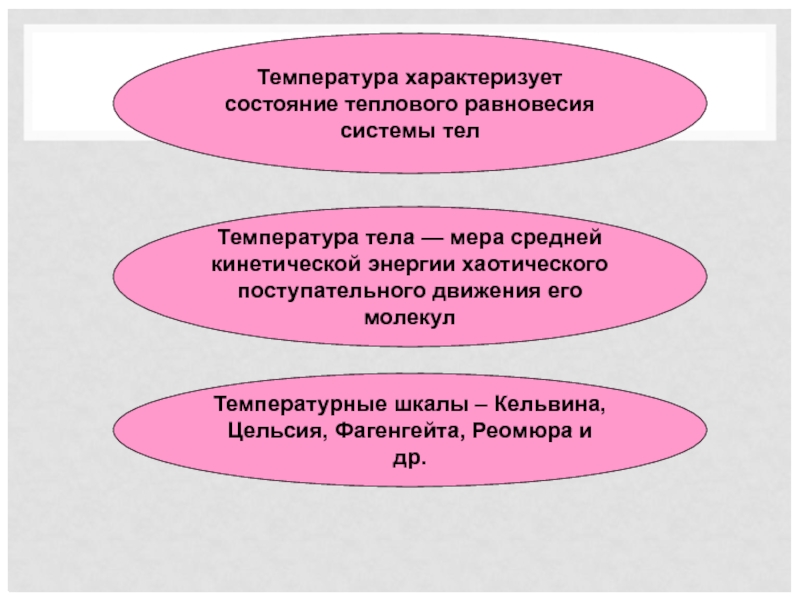
- 7. Температура характеризует состояние теплового равновесия системы тел
- 8. Абсолютный нуль температуры – предельная температура, при
- 9. Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре
- 10. Зависимость давления от концентрации и температуры
- 11. Наиболее вероятная Средняя арифметическая
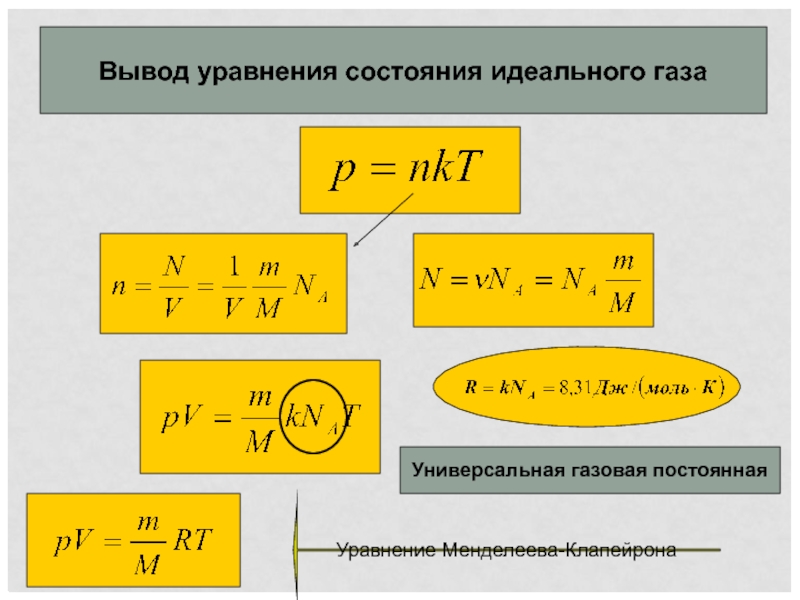
- 12. Вывод уравнения состояния идеального газа Универсальная газовая постоянная Уравнение Менделеева-Клапейрона
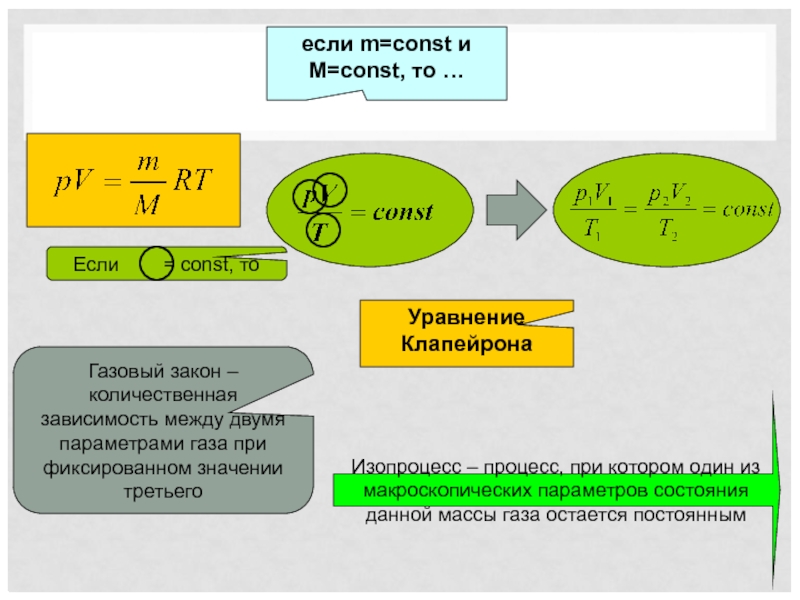
- 13. если m=const и M=const, то …
- 14. Соотношение было открыто в
- 15. Дыхание можно объяснить так: межреберные мышцы и
- 16. T1 < T2 p1 < p2 V1 < V2 Изотерма
- 17. Равновесное состояние - состояние, при котором температура
- 18. Соотношение было открыто в
- 19. T1 < T2 p1 < p2 V1
- 20. Соотношение было открыто в
- 21. T1 < T2 p1 < p2 V1
Слайд 1УРАВНЕНИЕ СОСТОЯНИЯ. ИЗОПРОЦЕССЫ
АБСОЛЮТНАЯ ТЕМПЕРАТУРА КАК МЕРА СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИИ ЧАСТИЦ
Слайд 2ПЛАН ЗАНЯТИЯ
Модель идеального газа. Микро- и макроскопические параметры
Основное уравнение МКТ идеального
Абсолютная температура как мера средней кинетической энергии частиц
Уравнение состояния
Изопроцессы
Слайд 3ПАРАМЕТРЫ ГАЗА
Микроскопические параметры — параметры малых масштабов, характеризующие движение отдельной молекулы
Масса
ее скорость,
импульс, кинетическая энергия
Макроскопические параметры — параметры больших масштабов, характеризующие свойства газа как целого
Масса газа,
давление (p),
объем (V), температура (T)
Слайд 4Это означает, что в системе не меняются объем и давление, не
Тепловым равновесием называют такое состояние тел, при котором все макроскопические параметры сколь угодно долго остаются неизменными
Слайд 5ИДЕАЛЬНЫЙ ГАЗ — ЭТО ГАЗ, ВЗАИМОДЕЙСТВИЕ, МЕЖДУ МОЛЕКУЛАМИ КОТОРОГО ПРЕНЕБРЕЖИМО МАЛО
Диаметр
Собственный объем молекул пренебрежимо мал по сравнению с объемом газа
Средняя кинетическая энергия молекул много больше средней потенциальной энергии их взаимодействия на расстоянии, большем диаметра молекул
Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие
Между столкновениями молекулы движутся практически по прямолинейным траекториям
Слайд 6
Основное уравнение МКТ
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных
Парциальное давление – давление, которое оказывали бы газы смеси, если бы они одни занимали объем, равный объему смеси
Слайд 7Температура характеризует состояние теплового равновесия системы тел
Температура тела — мера
Температурные шкалы – Кельвина, Цельсия, Фагенгейта, Реомюра и др.
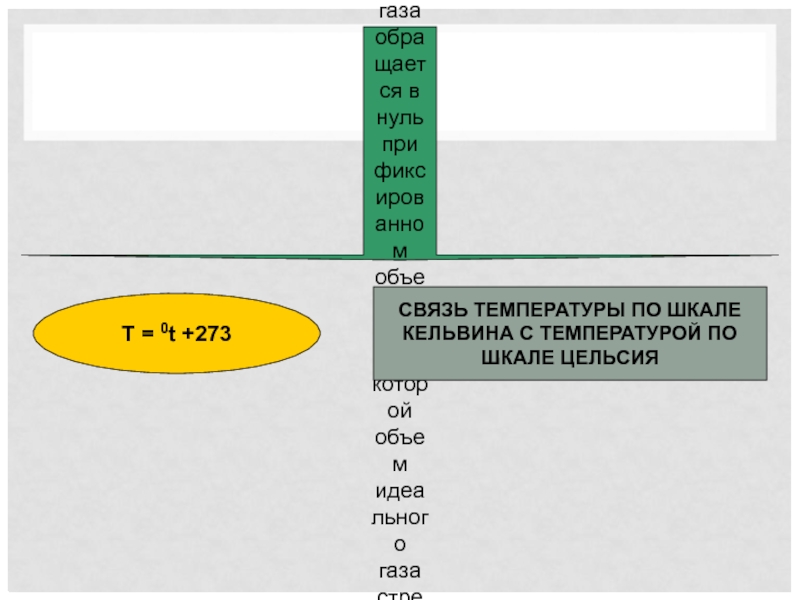
Слайд 8Абсолютный нуль температуры – предельная температура, при которой давление идеального газа
T = 0t +273
СВЯЗЬ ТЕМПЕРАТУРЫ ПО ШКАЛЕ КЕЛЬВИНА С ТЕМПЕРАТУРОЙ ПО ШКАЛЕ ЦЕЛЬСИЯ
Слайд 9
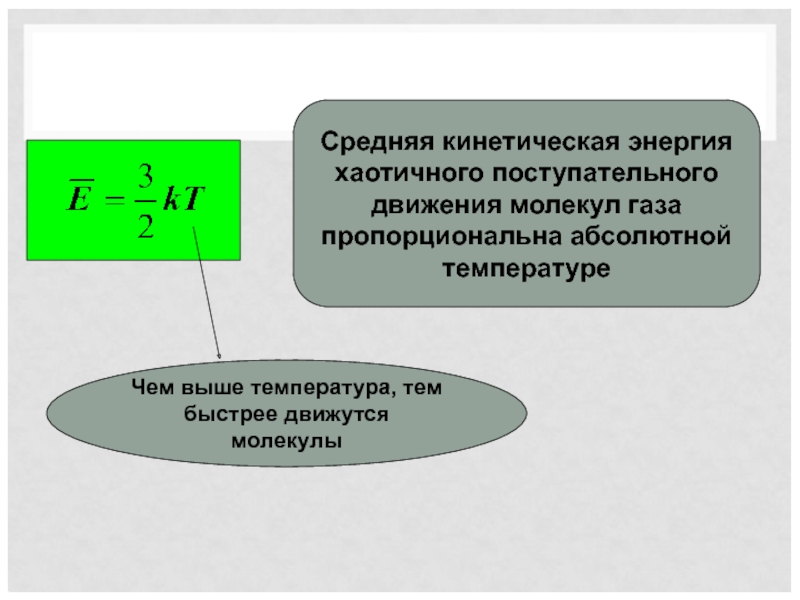
Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре
Слайд 10
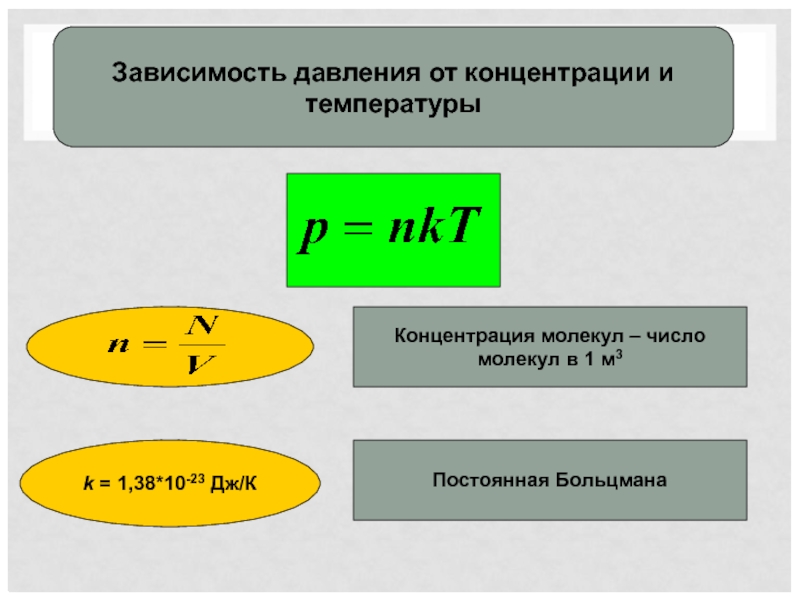
Зависимость давления от концентрации и температуры
Концентрация молекул – число молекул в
k = 1,38*10-23 Дж/К
Постоянная Больцмана
Слайд 11
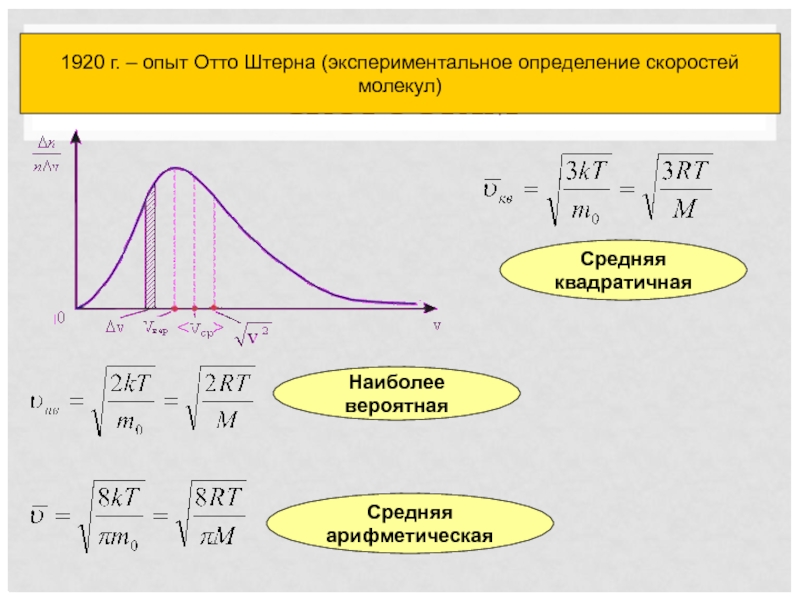
Наиболее вероятная
Средняя арифметическая
Средняя квадратичная
РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ГАЗА ПО СКОРОСТЯМ
1920 г. – опыт
Слайд 12
Вывод уравнения состояния идеального газа
Универсальная газовая постоянная
Уравнение Менделеева-Клапейрона
Слайд 13если m=const и M=const, то …
Уравнение Клапейрона
Газовый закон – количественная зависимость
Изопроцесс – процесс, при котором один из макроскопических параметров состояния данной массы газа остается постоянным
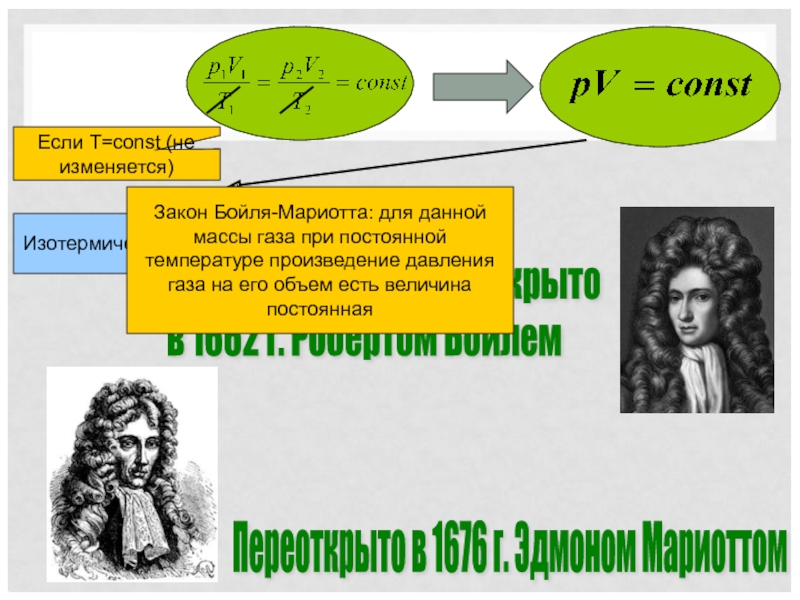
Слайд 14
Соотношение было открыто
в 1662 г. Робертом Бойлем
Переоткрыто в 1676 г.
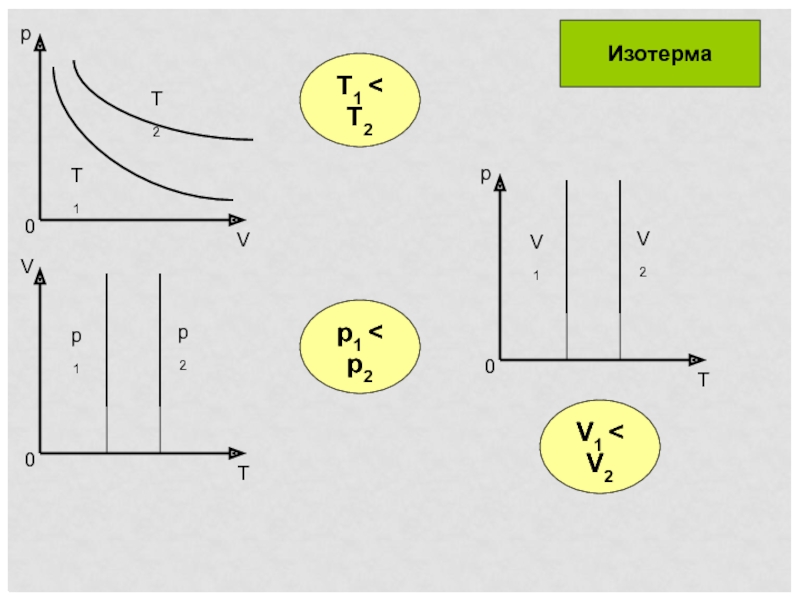
Если T=const (не изменяется)
Изотермический процесс
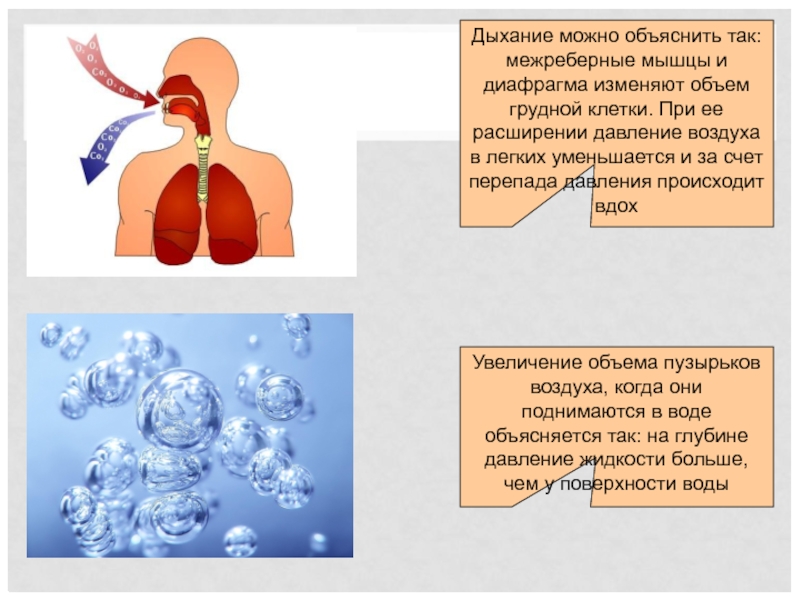
Слайд 15Дыхание можно объяснить так: межреберные мышцы и диафрагма изменяют объем грудной
Увеличение объема пузырьков воздуха, когда они поднимаются в воде объясняется так: на глубине давление жидкости больше, чем у поверхности воды
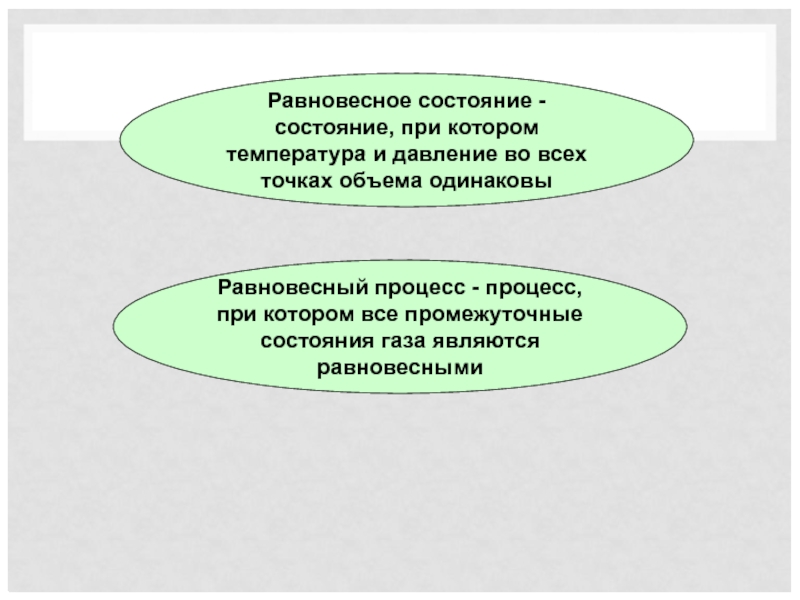
Слайд 17Равновесное состояние - состояние, при котором температура и давление во всех
Равновесный процесс - процесс, при котором все промежуточные состояния газа являются равновесными
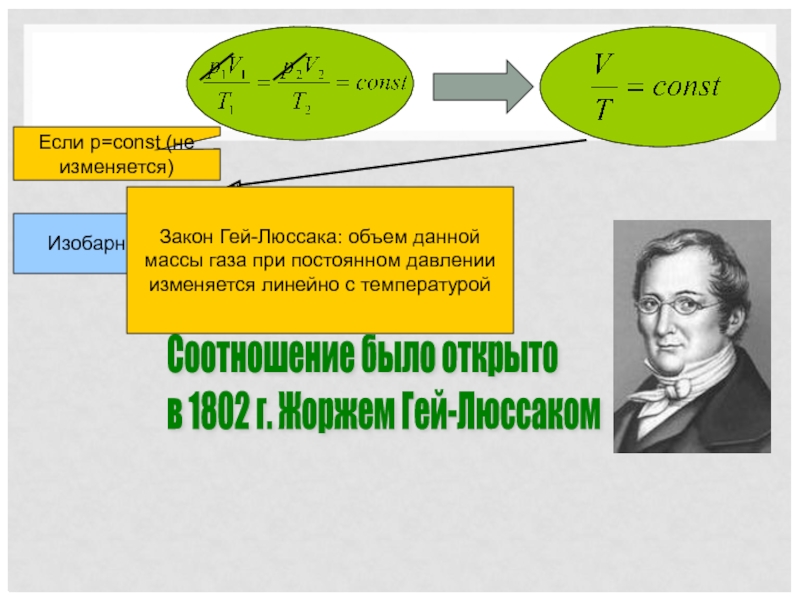
Слайд 18
Соотношение было открыто
в 1802 г. Жоржем Гей-Люссаком
Если p=const (не изменяется)
Изобарный
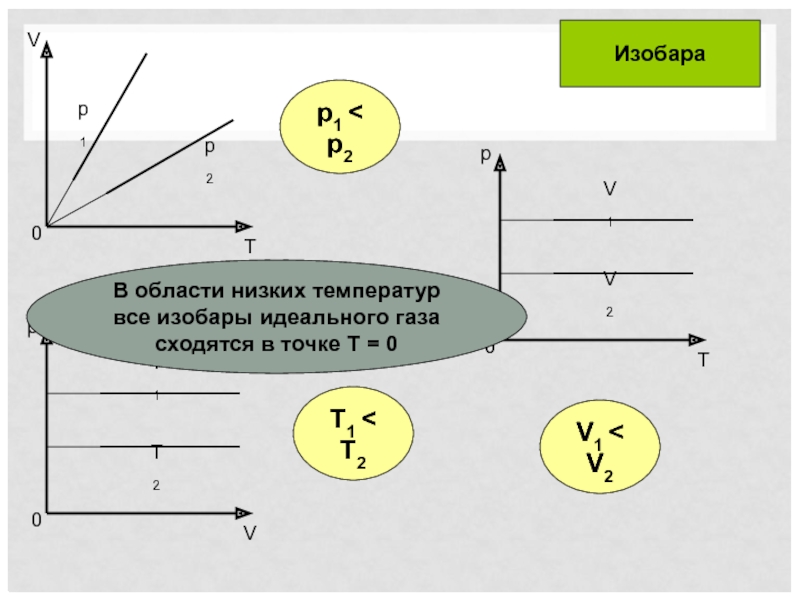
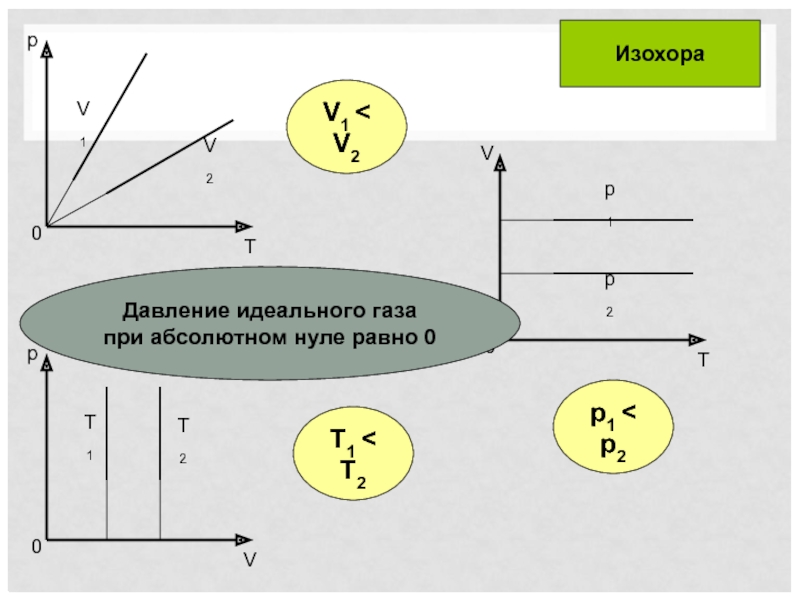
Слайд 19T1 < T2
p1 < p2
V1 < V2
Изобара
В области низких температур все
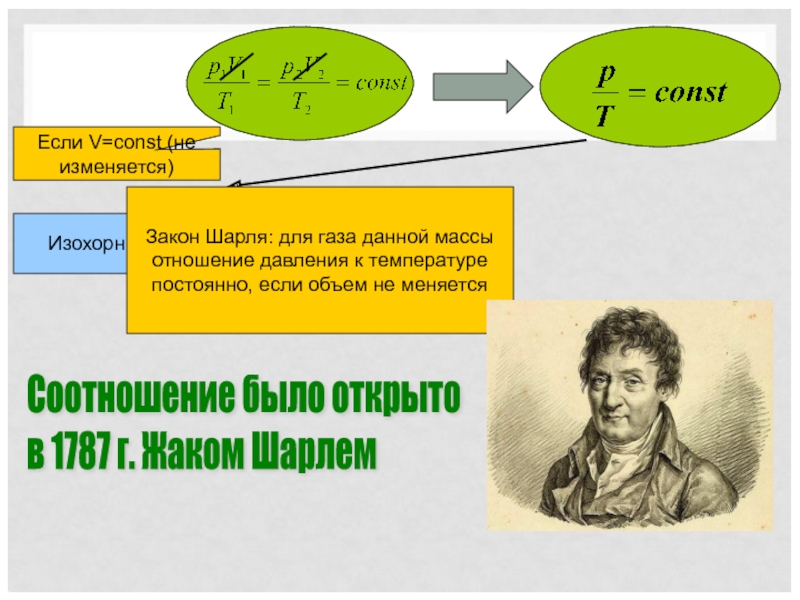
Слайд 20
Соотношение было открыто
в 1787 г. Жаком Шарлем
Если V=const (не изменяется)
Изохорный