- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Вода в житті людини презентация
Содержание
- 1. Вода в житті людини
- 2. Вода, яка біжить крізь гірські породи, взаємодіє
- 3. Твердість води та способи її усунення.
- 4. Будова: складається з одного атома Оксигену та
- 5. Запаси води 1386 млн. Км3 - запаси
- 6. Добова норма води для людини: 2,5л на
- 7. Вода – життєдайна сила Помиляється той
- 8. Твердість води
- 9. Загальна твердість води складається: Карбоатної (тимчасової).
- 10. Види твердості води. Одиниця твердості води. Одиниця
- 11. Способи усунення твердості води 1.Карбонатної твердості: а)
- 12. Легенда У повісті Г.Хаггарда “Клеопатра – володарка
- 13. Видалення накипу з нагрівних поверхонь побутових приладів.
- 14. Вимоги до якості води В Україні якість
- 15. Питна вода є джерелом Кальцію та Магнію
- 16. Карбонатна твердість обумовлена присутністю у воді солей:
- 17. Усунення карбонатної твердості кип’ятінням ілюструє іонне
- 18. Прислів’я та приказки які заставляють мислити:
- 19. Дякую за увагу!
Слайд 2Вода, яка біжить крізь гірські породи, взаємодіє з природнім вуглекислим газом,
що є в повітрі і перетворює нерозчинні карбонати на розчинні гідрогенкарбонати.
CaCO3+CO2+H2O=Ca(HCO3)2;
MgCO3+CO2+H2O=Mg(HCO3)2.
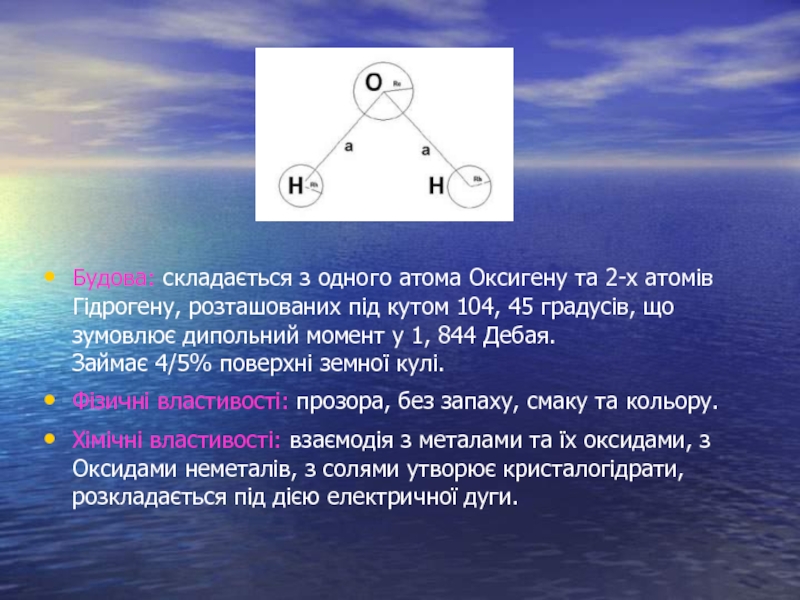
Слайд 4Будова: складається з одного атома Оксигену та 2-х атомів Гідрогену, розташованих
під кутом 104, 45 градусів, що зумовлює дипольний момент у 1, 844 Дебая. Займає 4/5% поверхні земної кулі.
Фізичні властивості: прозора, без запаху, смаку та кольору.
Хімічні властивості: взаємодія з металами та їх оксидами, з Оксидами неметалів, з солями утворює кристалогідрати, розкладається під дією електричної дуги.
Фізичні властивості: прозора, без запаху, смаку та кольору.
Хімічні властивості: взаємодія з металами та їх оксидами, з Оксидами неметалів, з солями утворює кристалогідрати, розкладається під дією електричної дуги.
Слайд 5Запаси води
1386 млн. Км3 - запаси води на планеті;
З них
97,5% - солона або мінералізована вода;
2,5% - прісна вода;
З 2,5% - 71% льодовики;
60% суходолу відчуває дефіцит води.
2,5% - прісна вода;
З 2,5% - 71% льодовики;
60% суходолу відчуває дефіцит води.
Слайд 6Добова норма води для людини:
2,5л на добу;
З їжею – 1,3л;
Питна вода
– 1,2л;
За життя людина споживає50-60 тонн води;
Вміст в організмі – понад 60%,
в м’язах – 78%, в мозку 88%, в крові – 77,82%, в кістках – від 20%.
За життя людина споживає50-60 тонн води;
Вміст в організмі – понад 60%,
в м’язах – 78%, в мозку 88%, в крові – 77,82%, в кістках – від 20%.
Слайд 7Вода – життєдайна сила
Помиляється той – хто не п’є воду а
лише чай та каву, адже ці напої сприяють виведеню рідини з організму.
Слайд 8
Твердість води - властивість зумовлена наявністю в ній розчинних
солей – Кальцію та Магнію. Розрізняють воду тверду, що містить розчинні солі, або м’яку яка цих солей не містить.
Слайд 9Загальна твердість води складається:
Карбоатної (тимчасової).
Спричинена наявністю у воді гідрогенкарбонатів,
Кальцію та Магнію.
Некарбонатної (сталої).
Обумовлена наявністю у воді сульфатів, хлоридів та нітратів йонів Кальцію та Магнію.
Слайд 10Види твердості води. Одиниця твердості води.
Одиниця твердості води –міліеквівалент,що включає 20,04
мг/г йонів Са2+ пбо 12.16 мг/г йонів Мg2+.
Види твердості води:
Мяка-вода з твердістю менше 4 міліеквівалент/л;
Середньої твердості-вода з твердістю 4-8 міліеквівалент/л відповідних йонів;
Дуже тверда-вода,з твердіст. 8-12 міліеквівалент/л йонів;
Морська ж вода має загальну твердість 65 міліеквівалентів/л.
Види твердості води:
Мяка-вода з твердістю менше 4 міліеквівалент/л;
Середньої твердості-вода з твердістю 4-8 міліеквівалент/л відповідних йонів;
Дуже тверда-вода,з твердіст. 8-12 міліеквівалент/л йонів;
Морська ж вода має загальну твердість 65 міліеквівалентів/л.
Слайд 11Способи усунення твердості води
1.Карбонатної твердості:
а) кипіння:
Ca (HCO3)2 = CaCO3 +H2O+СО2
;
б)додавання соди:
Mg (HCO3)2+Na2CO3=Mg CO3 +2NaHCo3;
в)додавання гашеного вапнау (у промисловості):
Ca(HCO3)+ Ca(OH)2=2CaCO3 +2H2O;
2.Некарбонатної твердості:
а)содовий метод:
CaSO4+Na2CO3=CaCO3 +Na2SO4;
б)фосфатний метод:
3MgSO4+2Na3Po4= Mg3(PO4)2 + 3Na2SO4.
б)додавання соди:
Mg (HCO3)2+Na2CO3=Mg CO3 +2NaHCo3;
в)додавання гашеного вапнау (у промисловості):
Ca(HCO3)+ Ca(OH)2=2CaCO3 +2H2O;
2.Некарбонатної твердості:
а)содовий метод:
CaSO4+Na2CO3=CaCO3 +Na2SO4;
б)фосфатний метод:
3MgSO4+2Na3Po4= Mg3(PO4)2 + 3Na2SO4.
Слайд 12Легенда
У повісті Г.Хаггарда “Клеопатра – володарка зорі”, розповідається наступне:
“Вона
вийняла з вуха одну із величезних перлин...і... опустила її в оцет. Запала мовчанка, вражені гості, завмерши, спостерігали, як незрівняна перлина повільно розчиняється в міцному оцті. Коли від неї не залишилося й сліду, Клеопатра підняла кубок, покрутила його і випила все до останьої каплі”.
Слайд 14Вимоги до якості води
В Україні якість питної води визначається нормативними документами,
зокрема міждержавним стандартом
ГОСТ 2874 -82
Джерелом забруднення води є:
отруйні відходи виробництв
відходи тваринництва
нерозчинні домішки змиті з полів
потрапляння домішок миючих засобів
вплив сміттязвалищ
ГОСТ 2874 -82
Джерелом забруднення води є:
отруйні відходи виробництв
відходи тваринництва
нерозчинні домішки змиті з полів
потрапляння домішок миючих засобів
вплив сміттязвалищ
Слайд 15Питна вода є джерелом Кальцію та Магнію для людського організму.
Нестача
Магнію в організмі людини зумовлює хронічну втому, гіпертонію, судинні порушення, інфаркт міокарда.
Дефіцитом Кальцію викликано близько 150 захворювань, він є практично “людським клеєм”, що зміцнює весь організм.
Важливим для організму є наявність атомарного Оксигену.
З порушенням рівноваги метаболічних процесів в яких беруть участь Оксиген та Кальцій пов’язаний процес старіння.
Ці знання необхідні людині для ведення правильного способу життя.
Постійна твердість є шкідливою для людини?
Дефіцитом Кальцію викликано близько 150 захворювань, він є практично “людським клеєм”, що зміцнює весь організм.
Важливим для організму є наявність атомарного Оксигену.
З порушенням рівноваги метаболічних процесів в яких беруть участь Оксиген та Кальцій пов’язаний процес старіння.
Ці знання необхідні людині для ведення правильного способу життя.
Постійна твердість є шкідливою для людини?
Слайд 16Карбонатна твердість обумовлена присутністю у воді солей:
а)CaSO4; MgSO4 ;
б)Ca (HCO3)2 ;
Mg (HCO3)2
Дуже тверда вода має:
а)10-12 міліеквівалентів/л йонів;
б)4-8 міліеквівалентів/л йонів;
в)8-12 міліеквівалентів/л йонів.
Дуже тверда вода має:
а)10-12 міліеквівалентів/л йонів;
б)4-8 міліеквівалентів/л йонів;
в)8-12 міліеквівалентів/л йонів.
Слайд 17 Усунення карбонатної твердості кип’ятінням ілюструє іонне рівняння:
а)Са2+ +CO32-=CaCO3;
б)Са2+ 2HCO3 -
= CaCO3 + H2O+CO2;
в)2HCO3-=CO2+H2O+CO32-;
г)Mg2+ + 2OH- =Mg (OH)2.
Усунення некарбонатної твердості кип’ятінням ілюструє іонне рівняння:
а)Са2+ +CO32-=CaCO3;
б)Са2+ 2HCO3 - = CaCO3 + H2O+CO2;
в)2HCO3-=CO2+H2O+CO32-;
г)Mg2+ + 2OH- =Mg (OH)2.
в)2HCO3-=CO2+H2O+CO32-;
г)Mg2+ + 2OH- =Mg (OH)2.
Усунення некарбонатної твердості кип’ятінням ілюструє іонне рівняння:
а)Са2+ +CO32-=CaCO3;
б)Са2+ 2HCO3 - = CaCO3 + H2O+CO2;
в)2HCO3-=CO2+H2O+CO32-;
г)Mg2+ + 2OH- =Mg (OH)2.
Слайд 18Прислів’я та приказки які заставляють мислити:
Щоб спрагу вгасити, треба води
попити;
Із брудної води ще ніхто чистим не вийшов;
Зіпсував воду, не буде честі твоєму роду;
Вода крапля по краплі і камінь довбе.
Із брудної води ще ніхто чистим не вийшов;
Зіпсував воду, не буде честі твоєму роду;
Вода крапля по краплі і камінь довбе.