- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Трансляция. Переход от нуклеиновых кислот к белкам презентация
Содержание
- 1. Трансляция. Переход от нуклеиновых кислот к белкам
- 2. The three roles of RNA in protein
- 4. Предтрансляционный этап ГЕНЕТИЧЕСКИЙ КОД КАК СИСТЕМА
- 5. Assigning codons using synthetic mRNAs containing a single ribonucleotide. Assigning codons using mixed polynucleotides.
- 6. Свойства генетического кода: Все кодоны однозначны, то
- 7. Свойства генетического кода: Генетический код содержит также
- 8. Неоднозначное спаривание: Однозначность кода в направлении кодон
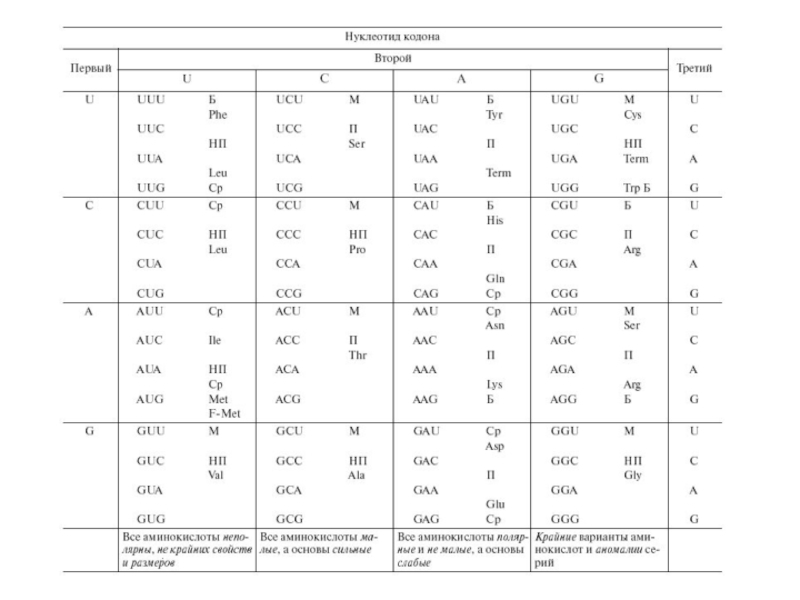
- 11. Система генетического кода: Анализ таблицы генетического кода
- 12. Групповые свойства кода: Легко заметить, что столбцы
- 14. Предтрансляционный этап Строение и функции тРНК
- 15. Основное назначение транспортной РНК (тРНК) - доставлять
- 16. Общие сведения: Впервые нуклеотидная последовательность молекулы тРНК
- 17. Первичная структура тРНК: тРНК - относительно небольшие
- 18. Для всех молекул тРНК характерно присутствие большого
- 20. Вторичная структура тРНК Анализ нуклеотидной последовательности
- 21. Третичная структура тРНК: Общие принципы складывания цепей
- 23. Аминоацил-тРНК-синтетазы: Как уже указывалось, для каждой
- 24. Механизм аминоацилирования: На первой стадии происходит активация
- 26. Точность работы: Исключительно низкая частота ошибок при аминоацилировании тРНК (
- 27. Основы узнавания тРНК аминоацил-тРНК-синтетазами: Набор узнавания, естественно
- 28. Отбор аминокислот: Аминокислоты построены из специфического радикала,
- 29. Аминоацил-тРНК-синтетазы: Несмотря на то что эти белки
- 30. Классификация АСРаз:
- 31. ГИПОТЕЗЫ О ПРОИСХОЖДЕНИИ АРСаз: Оказалось, что
- 32. Гипотеза Шиммеля: П. Шиммель выдвинул гипотезу, согласно
- 33. Гипотеза Шиммеля: Для обеспечения такого древнего синтеза
- 34. Синтез белка: общие сведения: Процесс создания химической
- 35. Рибосома: Химически рибосома есть рибонуклеопротеид: она состоит
- 36. ПРИНЦИП № 1: ДВЕ НЕРАВНЫЕ СУБЧАСТИЦЫ
- 38. ПРИНЦИП № 2: САМОСВОРАЧИВАНИЕ РИБОСОМНОЙ РНК В
- 39. ПРИНЦИП № 3: СБОРКА РАЗНООБРАЗНЫХ БЕЛКОВ НА
- 41. Каталитические центры рибосом Асп - центр специфического
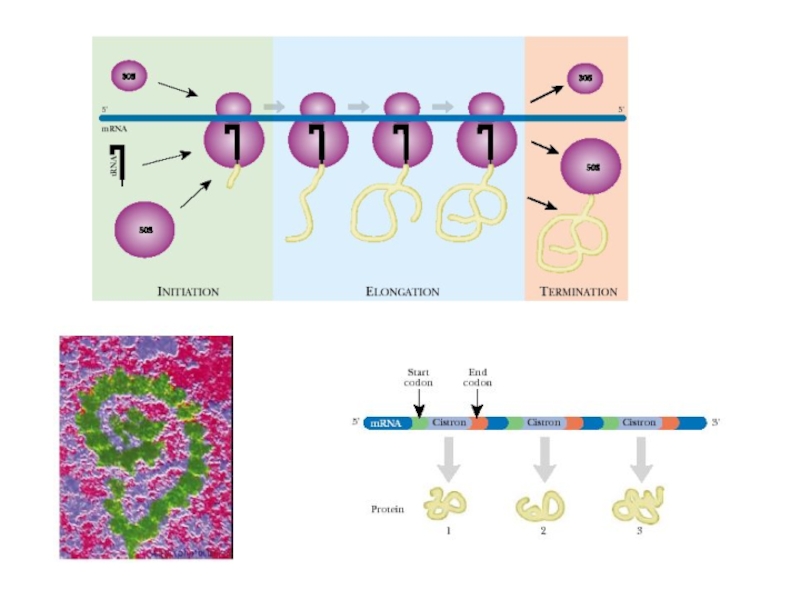
- 43. Синтез полипептидов на рибосоме 1. Инициация
- 45. У прокариот перед каждым геном и соответственно
- 46. Bacterial initiation of protein synthesis.
- 47. Eukaryotic initiation of protein synthesis.
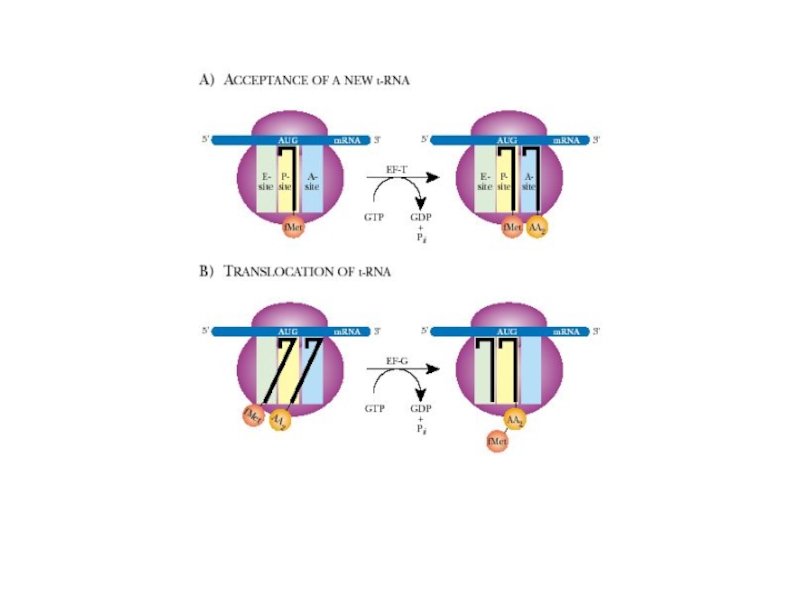
- 48. 2. Элонгация: - поступление аминоацил-тРНК в рибосому - транспептидация - транслокация
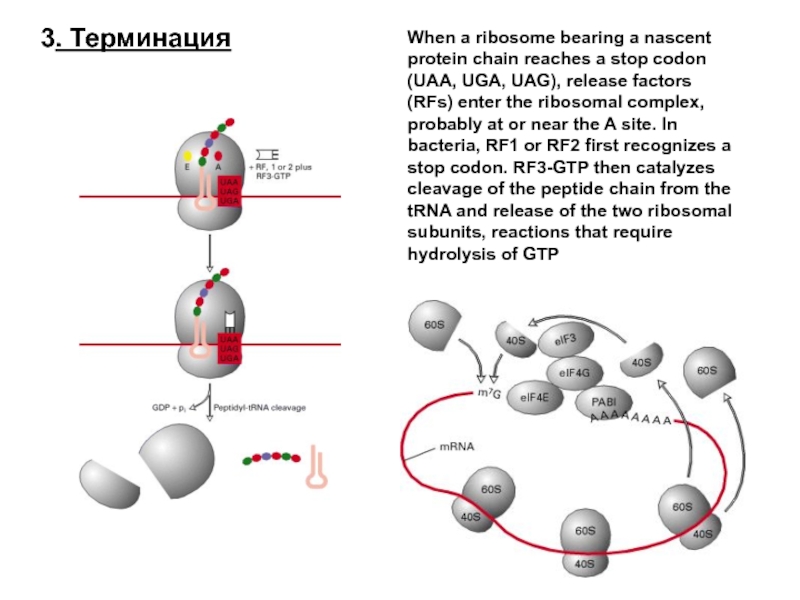
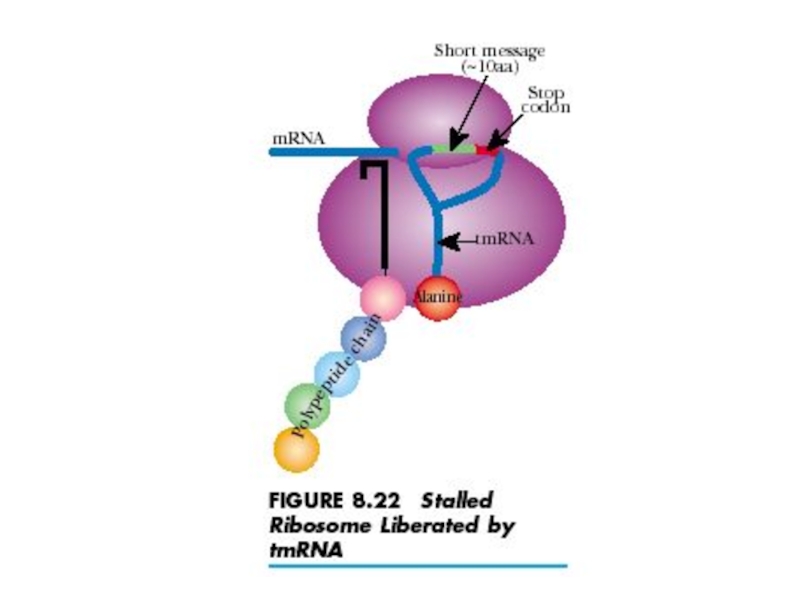
- 50. 3. Терминация When a ribosome bearing a
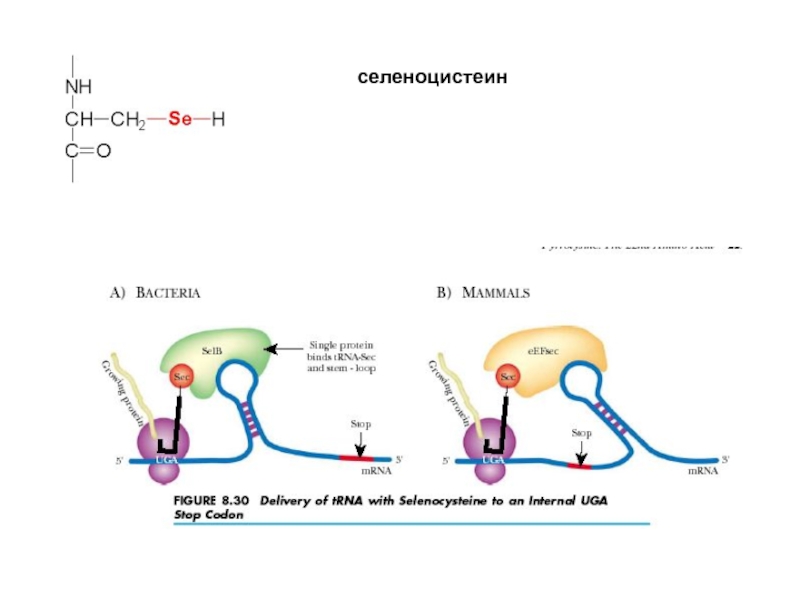
- 56. селеноцистеин
Слайд 1Трансляция
Переход от нуклеиновых кислот к белкам
Генетическая информация, находящаяся в клетке в
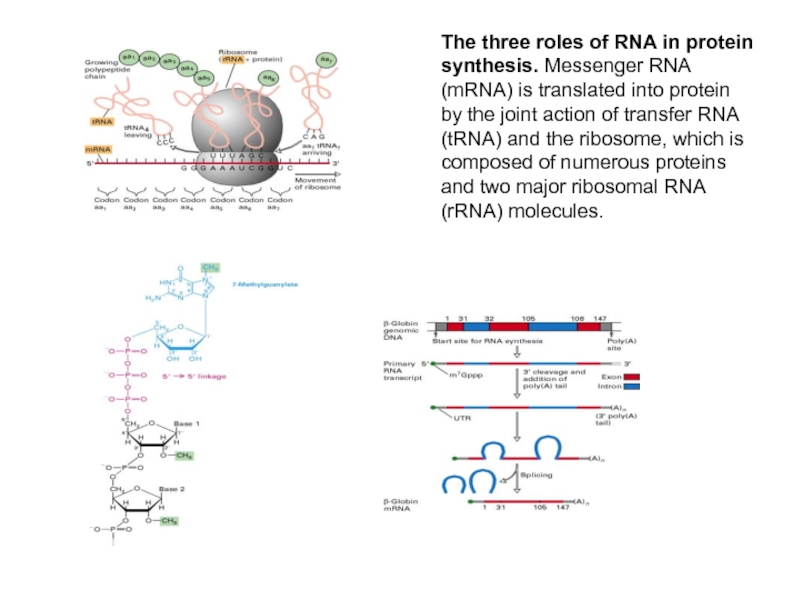
Слайд 2The three roles of RNA in protein synthesis. Messenger RNA (mRNA)
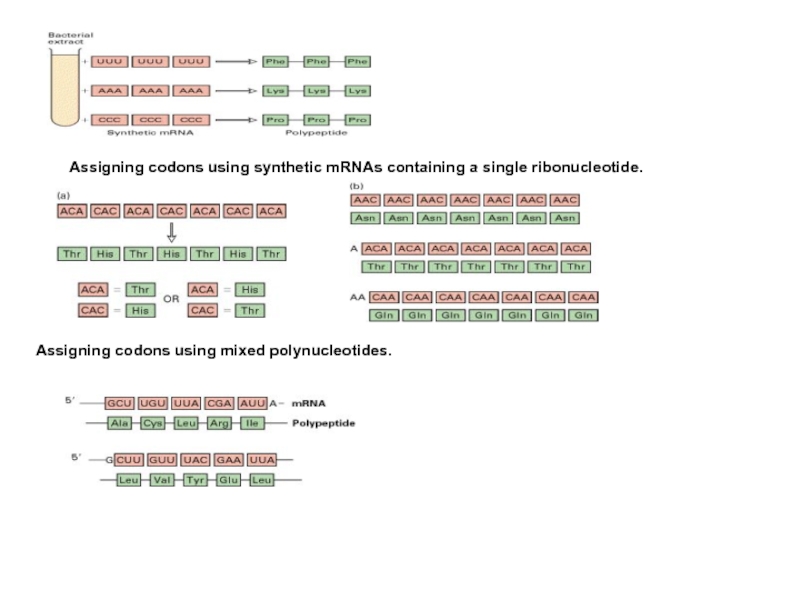
Слайд 5Assigning codons using synthetic mRNAs containing a single ribonucleotide.
Assigning codons
Слайд 6Свойства генетического кода:
Все кодоны однозначны, то есть каждый кодирует единственную аминокислоту.
2. Обратное соответствие в направлении аминокислота => кодон неоднозначно, и это свойство называется вырожденностью. Отдельные аминокислоты кодируются группами (сериями) кодонов-синонимов. 18 серий из 20 содержат от двух до шести кодонов, две серии (Меt и Тrр) не вырождены, содержат по одному кодону. Средняя вырожденность генетического кода приблизительно три кодона на серию.
Слайд 7Свойства генетического кода:
Генетический код содержит также знаки
пунктуации
Кодоны AUG, UUG и GUG у прокариот помимо кодирования аминокислот кодируют также инициацию трансляции.
Однако однозначность кодирования при этом не нарушается, так как инициирующие знаки локализованы в определенном окружении (контексте), способном образовывать самокомплементарные "шпильки".
Три "вакантных" триплета— UAA (ochre), UAG (amber) и UGA (ораl) — не кодируют аминокислот, а выполняют роль терминальных знаков трансляции (стоп-кодонов, нонсенс-кодонов или терминальных нонсенсов).
В норме ими заканчиваются все цистроны, то есть транслируемые гены, единицы трансляции. Мутационное возникновение нонсенсов внутри гена приводит к преждевременной терминации трансляции и обрыву белка.
Слайд 8Неоднозначное спаривание:
Однозначность кода в направлении кодон => аминокислота обеспечивается строгой специфичностью
Каждая АА-тРНК-синтетаз узнает единственную аминокислоту, поэтому неоднозначность исключена или маловероятна.
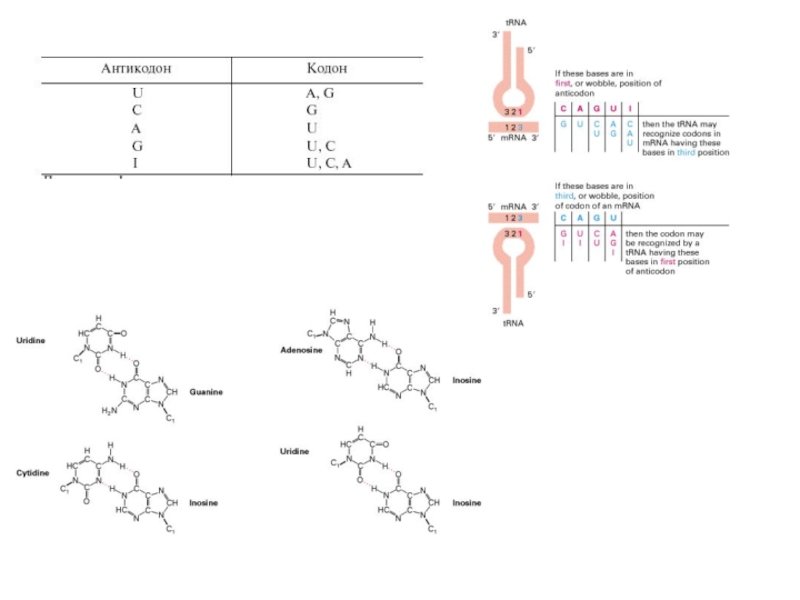
В основе систематической вырожденности лежат правила неоднозначности спаривания кодон— антикодон, установленные Ф. Криком. Один антикодон может узнавать один, два или три кодона, различающиеся по третьей позиции.
Согласно правилам неоднозначного спаривания, систематическая вырожденность в парах кодонов обеспечивается отдельными фракциями т-РНК, имеющими U, G или I (инозин) в трех позициях антикодонов.
Всего генетический код требует не менее 32 фракций т-РНК.
Слайд 11Система генетического кода:
Анализ таблицы генетического кода как целого позволяет выявить удивительные
Обозначим позиции нуклеотидов в кодонах (5'—1—2—3—3') через х -- у -- z, где х - приставка, у - корень, z - окончание, а ху — основа кодона.
Эти термины отражают сходные понятия лингвистики.
Корни слов определяют их смысл. Все мутации, затрагивающие корень (у) кодона, также изменяют кодовую серию, то есть нарушают смысл кодона.
Приставки слов тоже участвуют в определении смысла, хотя и не так жестко, а многие их изменения меняют смысл слов. Замены в приставках (х) кодонов чаще всего изменяют их смысл, но иногда являются синонимическими.
Окончания слов обычно участвуют в словоизменении, то есть в синонимических преобразованиях. Аналогично 70% замен в окончаниях (z) кодонов синонимические.
Наконец, приставка и корень слова образуют его основу, несущую полную или доминирующую смысловую нагрузку. Основа кодона (ху) тоже играет ключевую роль в особенностях генетического кода.
Слайд 12Групповые свойства кода:
Легко заметить, что столбцы генетического кода отвечающие определенным корням
Третий столбец (корень А) содержит полярные аминокислоты немалые по размеру, а все основы кодонов слабые.
Второй столбец (корень С) содержит аминокислоты, малые по размеру, а все основы кодонов сильные.
Первый столбец (корень U) включает неполярные аминокислоты разных (но не крайних) размеров, а свойства кодонов неоднозначны.
Четвертый столбец (корень G) содержит все крайние и аномальные варианты аминокислот и кодовых серий: самую реактивную аминокислоту (Суs), самую большую и плоскую (Тrр), самую большую и корявую (Агg), самую маленькую (Glу), часть единственной несвязной серии (Sег) и неоднозначный терминальный нонсенс (UAG), который в ряде случаев кодирует 21-ю аминокислоту - селеноцистеин (Sес).
Таким образом, если групповые свойства корней (и столбцов) отвечают каким-то общим правилам их возникновения, то четвертый столбец скорее напоминает свалку всего, что не попало в первые три столбца по групповым правилам их формирования.
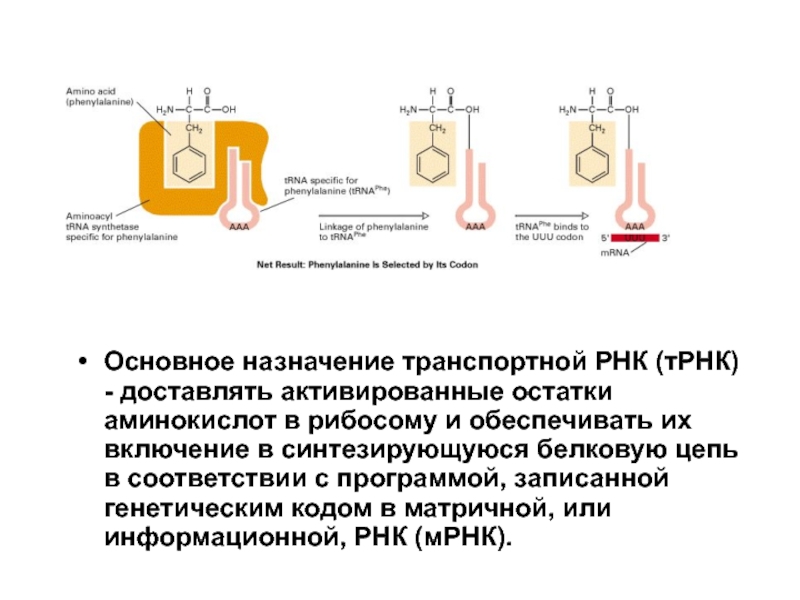
Слайд 15Основное назначение транспортной РНК (тРНК) - доставлять активированные остатки аминокислот в
Слайд 16Общие сведения:
Впервые нуклеотидная последовательность молекулы тРНК — дрожжевой аланиновой тРНК, была
С тех пор были опубликованы данные о нуклеотидной последовательности (называемой первичной структурой) более чем 1700 видов различных тРНК из прокариотических и эукариотических организмов.
Все тРНК имеют общие черты как в их первичной структуре, так и в способе складывания полинуклеотидной цепи во вторичную структуру за счет взаимодействий между основаниями нуклеотидных остатков.
Помимо цитоплазматических тРНК, кодируемых ядерной ДНК, в эукариотических клетках имеются особые виды тРНК, кодируемые автономными геномами митохондрий и хлоропластов.
Слайд 17Первичная структура тРНК:
тРНК - относительно небольшие молекулы, длина их цепей варьирует
Все тРНК имеют одинаковый З'-конец, построенный из двух остатков цитозина и одного — аденозина (ССА-конец).
Именно З'-концевой аденозин связывается с аминокислотным остатком при образовании аминоацил-тРНК.
ССА-конец присоединяется ко многим тРНК с помощью специального фермента. В других случаях он считывается с кодирующего данную тРНК гена.
Нуклеотидный триплет, комплементарный кодону для аминокислоты (антикодон), находится приблизительно в середине цепи тРНК.
В отдельных положениях последовательности практически у всех видов тРНК встречаются одни и те же (консервативные) нуклеотидные остатки. В некоторых положениях могут находиться или только пуриновые, или только пиримидиновые основания (их называют полуконсервативными остатками).
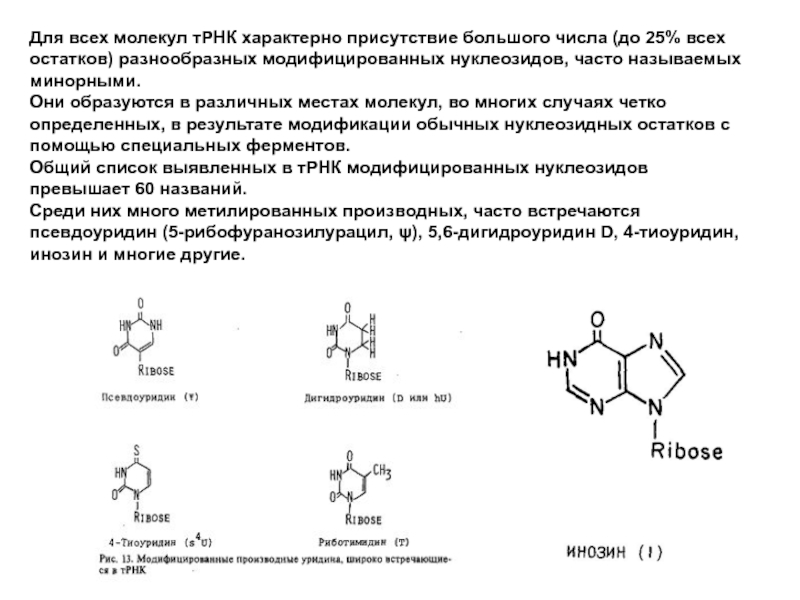
Слайд 18Для всех молекул тРНК характерно присутствие большого числа (до 25% всех
Они образуются в различных местах молекул, во многих случаях четко определенных, в результате модификации обычных нуклеозидных остатков с помощью специальных ферментов.
Общий список выявленных в тРНК модифицированных нуклеозидов превышает 60 названий.
Среди них много метилированных производных, часто встречаются псевдоуридин (5-рибофуранозилурацил, ψ), 5,6-дигидроуридин D, 4-тиоуридин, инозин и многие другие.
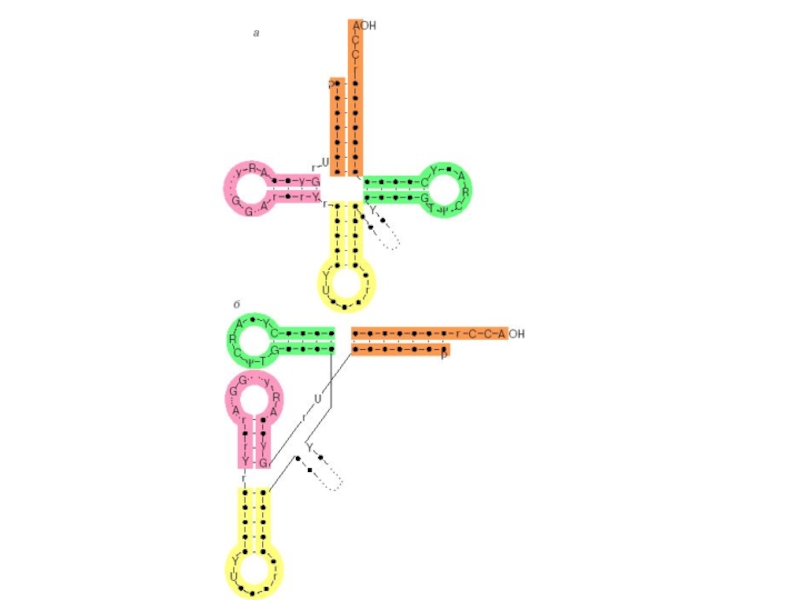
Слайд 20Вторичная структура тРНК
Анализ нуклеотидной последовательности уже первой расшифрованной дрожжевой аланиновой
Три фрагмента цепи оказываются комплементарными при складывании их на себя, образуя шпилькообразные структуры. Кроме того, 5'-конец комплементарен участку, близкому к З'-концу цепи, при их антипараллельном расположении; они формируют так называемый акцепторный стебель.
В результате образуется структура, характеризующаяся наличием четырех стеблей и трех петель, которая получила название "клеверного листа".
Стебель с петлей формируют ветвь.
Слева и справа от антикодоновой ветви расположены D- и Т-ветви, соответственно названные так из-за присутствия в их петлях необычных консервативных нуклеозидов дигидроуридина (D) и тимидина (Т).
Нуклеотидные последовательности всех изученных тРНК могут быть сложены в аналогичные структуры. В дополнение к трем петлям клеверного листа в структуре тРН К выделяют также дополнительную, или вариабельную, петлю (V-петлю).
Ее размеры резко различаются у разных тРНК, варьируя от 4 до 21 нуклеотида.
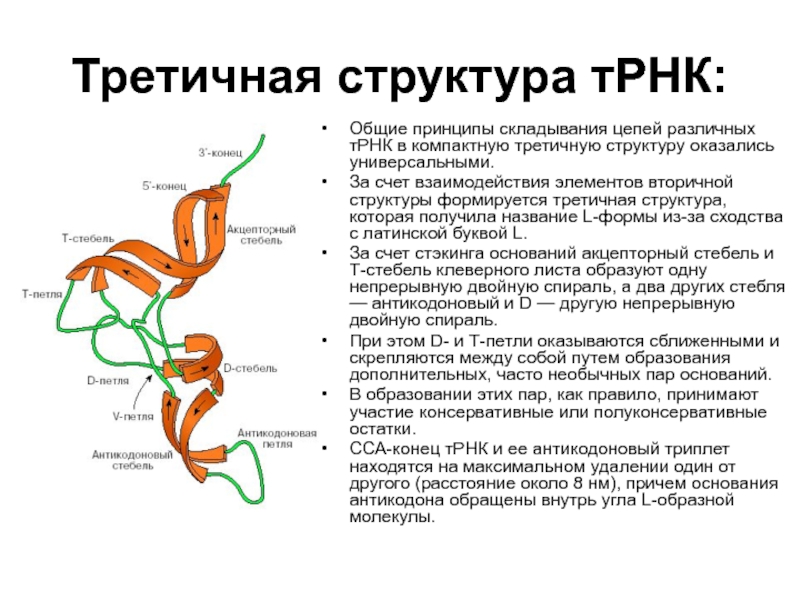
Слайд 21Третичная структура тРНК:
Общие принципы складывания цепей различных тРНК в компактную третичную
За счет взаимодействия элементов вторичной структуры формируется третичная структура, которая получила название L-формы из-за сходства с латинской буквой L.
За счет стэкинга оснований акцепторный стебель и Т-стебель клеверного листа образуют одну непрерывную двойную спираль, а два других стебля — антикодоновый и D — другую непрерывную двойную спираль.
При этом D- и Т-петли оказываются сближенными и скрепляются между собой путем образования дополнительных, часто необычных пар оснований.
В образовании этих пар, как правило, принимают участие консервативные или полуконсервативные остатки.
ССА-конец тРНК и ее антикодоновый триплет находятся на максимальном удалении один от другого (расстояние около 8 нм), причем основания антикодона обращены внутрь угла L-образной молекулы.
Слайд 23Аминоацил-тРНК-синтетазы:
Как уже указывалось, для каждой из 20 аминокислот в клетках
Все ферменты этой группы катализируют реакции аминоацилирования тРНК по принципиально сходному механизму.
Реакция сопряжена с расщеплением аденозин-5'-трифосфата (АТР) и протекает в две стадии.
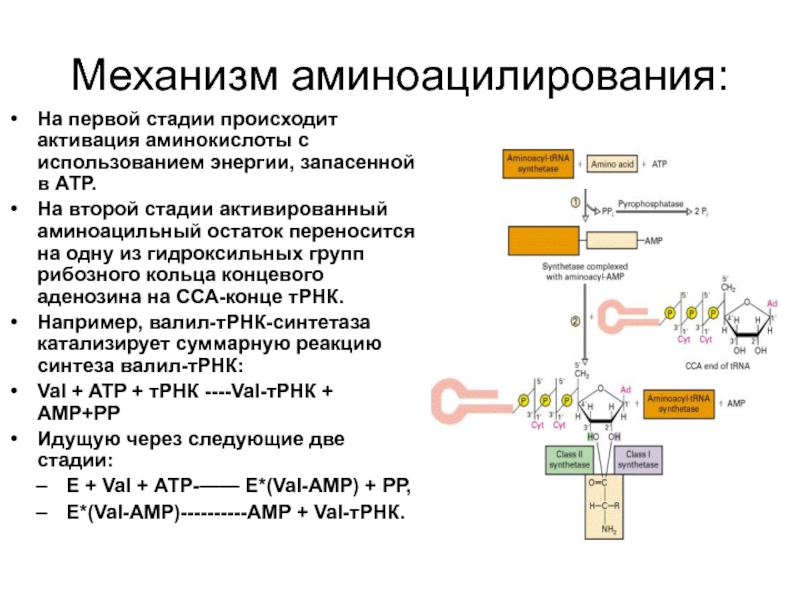
Слайд 24Механизм аминоацилирования:
На первой стадии происходит активация аминокислоты с использованием энергии, запасенной
На второй стадии активированный аминоацильный остаток переносится на одну из гидроксильных групп рибозного кольца концевого аденозина на ССА-конце тРНК.
Например, валил-тРНК-синтетаза катализирует суммарную реакцию синтеза валил-тРНК:
Val + ATP + тРНК ----Val-тРНК + АМР+РР
Идущую через следующие две стадии:
Е + Val + АТР-—— Е*(Val-АМР) + РР,
Е*(Val-АМР)----------АМР + Val-тРНК.
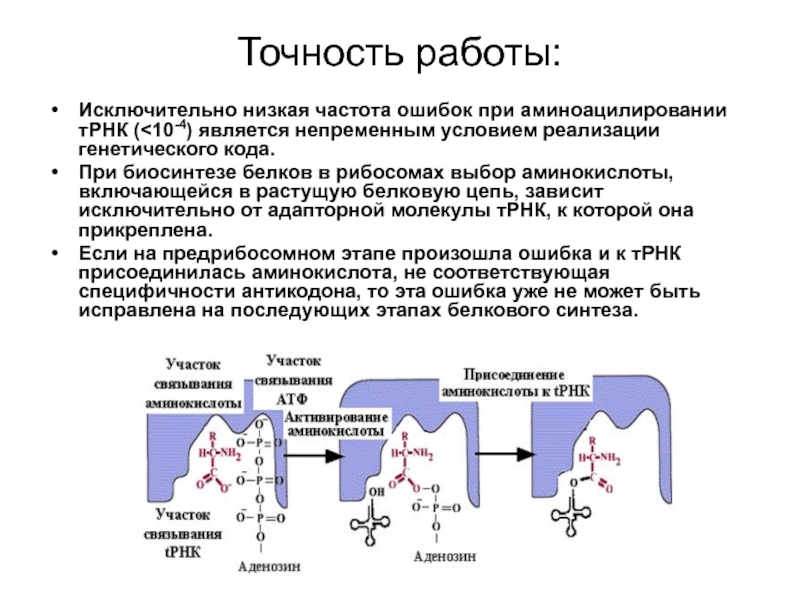
Слайд 26Точность работы:
Исключительно низкая частота ошибок при аминоацилировании тРНК (
При биосинтезе белков в рибосомах выбор аминокислоты, включающейся в растущую белковую цепь, зависит исключительно от адапторной молекулы тРНК, к которой она прикреплена.
Если на предрибосомном этапе произошла ошибка и к тРНК присоединилась аминокислота, не соответствующая специфичности антикодона, то эта ошибка уже не может быть исправлена на последующих этапах белкового синтеза.
Слайд 27Основы узнавания тРНК аминоацил-тРНК-синтетазами:
Набор узнавания, естественно разный для разных пар тРНК
Это следующие участки тРНК:
1. Антикодон (остатки 34—36). Участие антикодона, определяющего на рибосоме включение аминокислоты в растущую цепь белка, еще и в отборе этой аминокислоты на стадии реакции аминоацилирования тРНК, предполагалось еще в 60-е годы исходя из уникальности этого элемента в структуре молекулы.
2. Нуклеотид 73, предшествующий ССА-концу. Присутствие в этом положении того или другого пуринового нуклеотида (А или G) коррелирует с типом аминокислот, присоединяемых к тРНК. Если в этом положении находится А, то тРНК акцептирует гидрофобные аминокислоты, а если G — то полярные.
3. Первые три пары нуклеотидов акцепторного стебля (1-72, 2—71, 3-70). В разных случаях в узнавании синтетазой может вовлекаться от одной до трех пар нуклеотидов акцепторного стебля.
Слайд 28Отбор аминокислот:
Аминокислоты построены из специфического радикала, аминогруппы и карбоксильной группы.
Вклад
Было показано для различных аминоацил-тРНК-синтетаз, что необходимым элементом узнавания всех аминокислот является аминогруппа. Модификация этой группы приводит к резкому падению сродства аминокислоты к ферменту.
Как принято считать, карбоксильная группа играет меньшую роль на стадии первичного связывания аминокислоты, однако безусловно важна на последующих каталитических этапах реакции аминоацилирования.
Специфическое распознавание аминокислот аминоацил-тРНК-синтетазами осуществляется за счет взаимодействий со специфическими радикалами аминокислот.
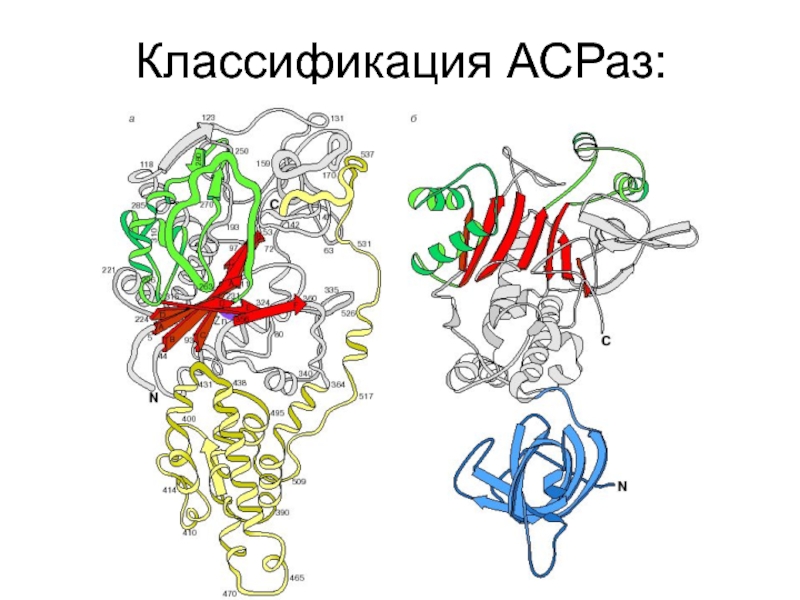
Слайд 29Аминоацил-тРНК-синтетазы:
Несмотря на то что эти белки катализируют одну реакцию, они оказались
Например, молекулярные массы АРСаз кишечной палочки варьируют от 51 000 до 384 000, при этом часть ферментов функционирует в виде мономеров, часть — в виде димеров, встречаются также и тетрамеры.
Оказалось, что между всеми АРСазами действительно нет сходства, но их можно разделить на два класса и внутри каждого из классов обнаруживаются характерные последовательности аминокислот (так называемые мотивы) и сходные элементы третичной структуры.
Слайд 31ГИПОТЕЗЫ О ПРОИСХОЖДЕНИИ АРСаз:
Оказалось, что N-концевой участок аланиновой АРСазы длиной
При этом урезанный фермент, представляющий собой собственно центральный каталитический домен АРСазы аминоацилирует тРНК хуже, чем полный фермент, а аминоацилирование мини-спиралей осуществляется с одинаковой эффективностью как целой АРСазой, так и ее N-концевым доменом.
Слайд 32Гипотеза Шиммеля:
П. Шиммель выдвинул гипотезу, согласно которой и антикодоновый домен тРНК,
Исходная, предковая тРНК представляла собой короткую шпильку типа микроспирали, к которой присоединялись аминокислоты при помощи предков современных АРСаз — коротких полипептидов, содержащих нуклеотидсвязывающие мотивы.
В "дорибосомную" эпоху синтез коротких полипептидов осуществлялся непосредственно на молекуле предковой тРНК путем переноса аминокислоты, присоединенной к З'-гидроксильной группе концевого рибозного остатка, на аминогруппу аминокислоты, присоединенной к 2'-гидроксилу того же остатка рибозы.
Аналогичным образом происходит современный биосинтез белка на рибосоме, за исключением того, что растущий пептид переносится с одной молекулы тРНК на другую.
Слайд 33Гипотеза Шиммеля:
Для обеспечения такого древнего синтеза пептидов необходимы были по крайней
Эти ферменты и стали родоначальниками двух классов современных АРСаз.
В дальнейшем белоксинтезирующий аппарат стал более сложным, для хранения информации о большом количестве разнообразных белков возник генетический код, и для обеспечения запрограммированного синтеза белка на РНК-матрице к предковым тРНК присоединился антикодоновый домен, а к АРСазам - дополнительные модули, позволяющие узнавать антикодон тРНК и таким образом повысить специфичность и точность аминоацилирования.
Слайд 34Синтез белка: общие сведения:
Процесс создания химической структуры белка (синтез полипептидной цепи)
Количество рибосом в клетке сильно варьирует — от тысяч до десятков тысяч на клетку — в зависимости от интенсивности белкового синтеза в данном типе клеток.
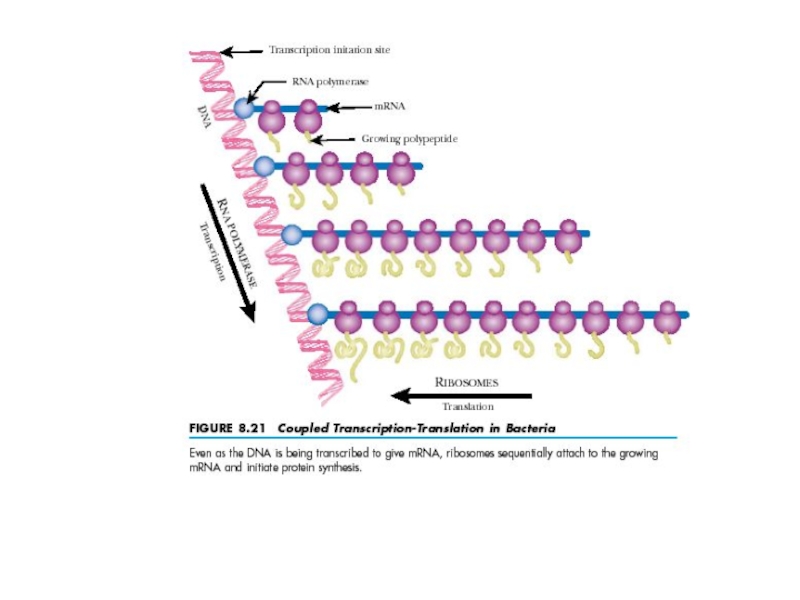
Каждая рибосома полностью прочитывает одну молекулу мРНК и в соответствии с ее программой синтезирует одну молекулу белка, после чего может быть запрограммирована другой молекулой мРНК и произвести другую молекулу белка и т.д.
Обычно одна молекула мРНК читается сразу несколькими рибосомами, двигающимися вдоль мРНК друг за другом и, таким образом, независимо синтезирующими идентичные молекулы белка, но с соответствующим отставанием. Такой динамический комплекс одной мРНК с несколькими рибосомами называется полирибосомой.
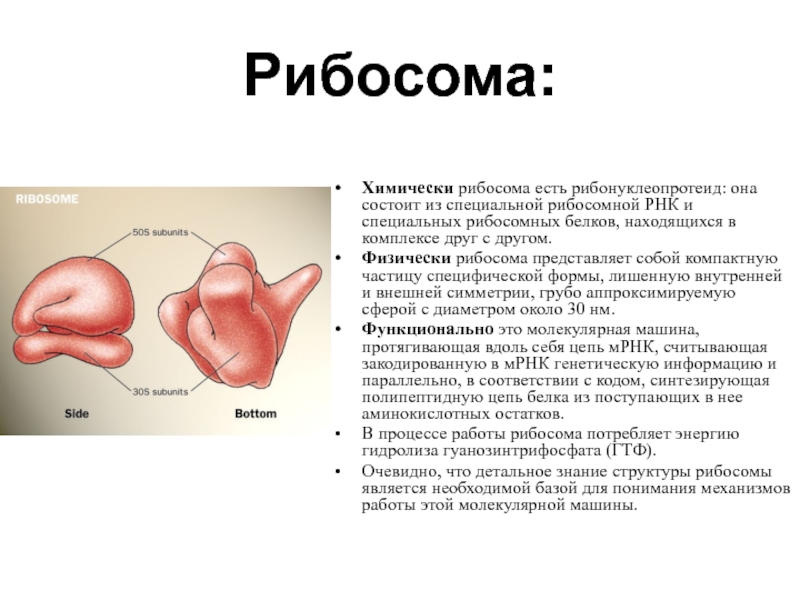
Слайд 35Рибосома:
Химически рибосома есть рибонуклеопротеид: она состоит из специальной рибосомной РНК и
Физически рибосома представляет собой компактную частицу специфической формы, лишенную внутренней и внешней симметрии, грубо аппроксимируемую сферой с диаметром около 30 нм.
Функционально это молекулярная машина, протягивающая вдоль себя цепь мРНК, считывающая закодированную в мРНК генетическую информацию и параллельно, в соответствии с кодом, синтезирующая полипептидную цепь белка из поступающих в нее аминокислотных остатков.
В процессе работы рибосома потребляет энергию гидролиза гуанозинтрифосфата (ГТФ).
Очевидно, что детальное знание структуры рибосомы является необходимой базой для понимания механизмов работы этой молекулярной машины.
Слайд 36ПРИНЦИП № 1:
ДВЕ НЕРАВНЫЕ СУБЧАСТИЦЫ
Электронно-микроскопические изображения рибосом ясно показывают, что
Действительно, если в среде, окружающей рибосомы, понизить концентрацию ионов магния или каким-либо еще образом увеличить электростатическое отталкивание фосфатных групп рибосомной РНК, то рибосомная частица диссоциирует на две неравные субчастицы с соотношением их масс около 2:1.
Полные рибосомные частицы и их субчастицы принято обозначать в соответствии с их коэффициентами седиментации (скоростями осаждения) в ультрацентрифуге, выражаемыми в единицах Сведберга (S).
Бактериальная рибосома с молекулярной массой около 3•106 имеет коэффициент седиментации 70S и обозначается как 70S-частица, а несколько более крупная рибосома эукариотических организмов предстает как 80S-частица.
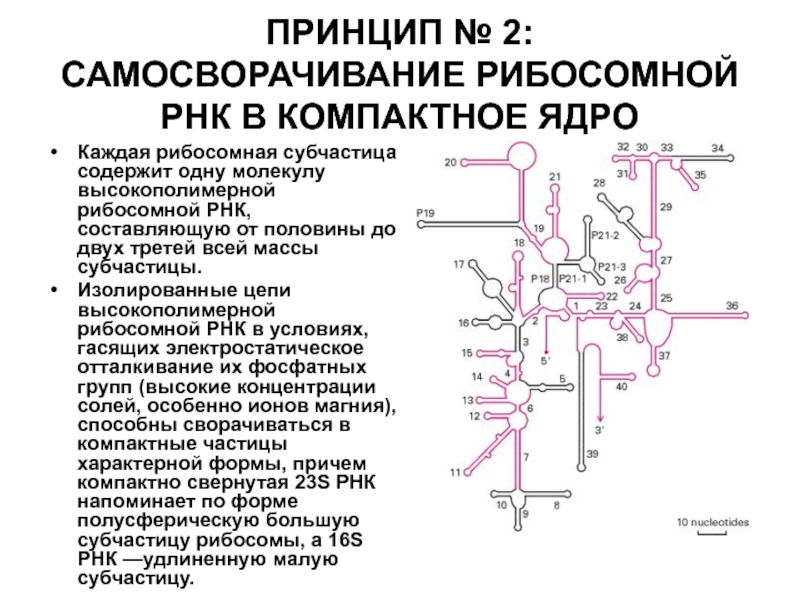
Слайд 38ПРИНЦИП № 2:
САМОСВОРАЧИВАНИЕ РИБОСОМНОЙ РНК В КОМПАКТНОЕ ЯДРО
Каждая рибосомная субчастица
Изолированные цепи высокополимерной рибосомной РНК в условиях, гасящих электростатическое отталкивание их фосфатных групп (высокие концентрации солей, особенно ионов магния), способны сворачиваться в компактные частицы характерной формы, причем компактно свернутая 23S РНК напоминает по форме полусферическую большую субчастицу рибосомы, а 16S РНК —удлиненную малую субчастицу.
Слайд 39ПРИНЦИП № 3: СБОРКА РАЗНООБРАЗНЫХ БЕЛКОВ НА РНК
Каждая рибосомная субчастица содержит
Многочисленные рибосомные белки могут играть двоякую роль в современной рибосоме.
С одной стороны, они могут непосредственно участвовать в функциях связывания субстратов и каталитических функциях рибосомы, локализуясь в соответствующих функциональных центрах и обеспечивая их своими активными группами.
С другой — рибосомные белки могут служить стабилизаторами или модификаторами определенных локальных структур рибосомной РНК и таким образом поддерживать их в функционально активном состоянии или способствовать их переключениям из одного состояния в другое.
В частности, в отношении главной каталитической функции рибосомы — ее пептидил-трансферазной активности, ответственной за образование пептидных связей, имеются все основания полагать, что эта активность обеспечивается локальной структурой рибосомной РНК большой субчастицы, но некоторые рибосомные белки оказываются необходимыми для поддержания (стабилизации) этой структуры.
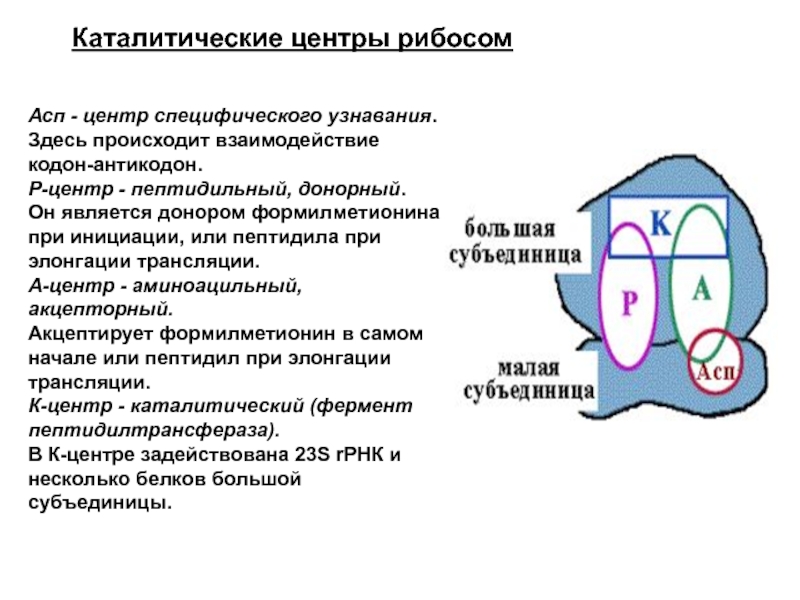
Слайд 41Каталитические центры рибосом
Асп - центр специфического узнавания.
Здесь происходит взаимодействие кодон-антикодон.
Р-центр - пептидильный, донорный. Он является донором формилметионина при инициации, или пептидила при элонгации трансляции.
А-центр - аминоацильный, акцепторный. Акцептирует формилметионин в самом начале или пептидил при элонгации трансляции.
К-центр - каталитический (фермент пептидилтрансфераза). В К-центре задействована 23S rРНК и несколько белков большой субъединицы.
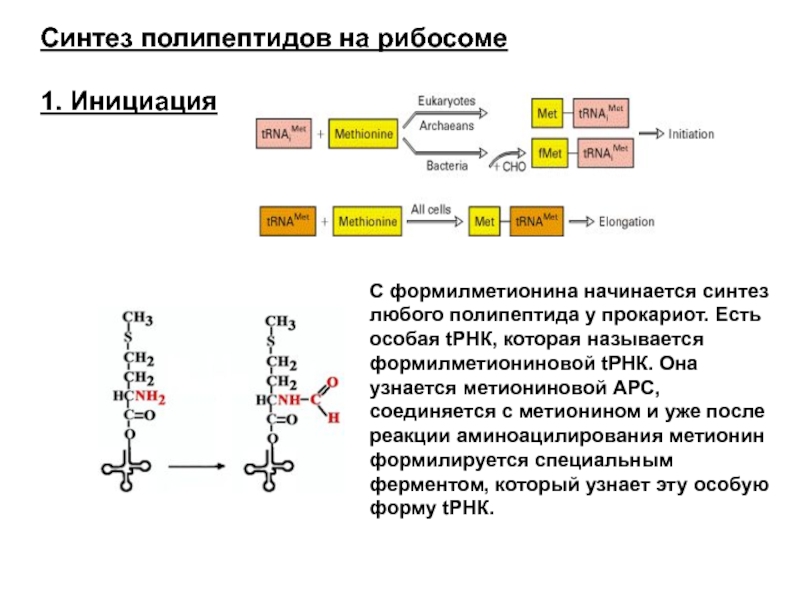
Слайд 43Синтез полипептидов на рибосоме
1. Инициация
С формилметионина начинается синтез любого полипептида у
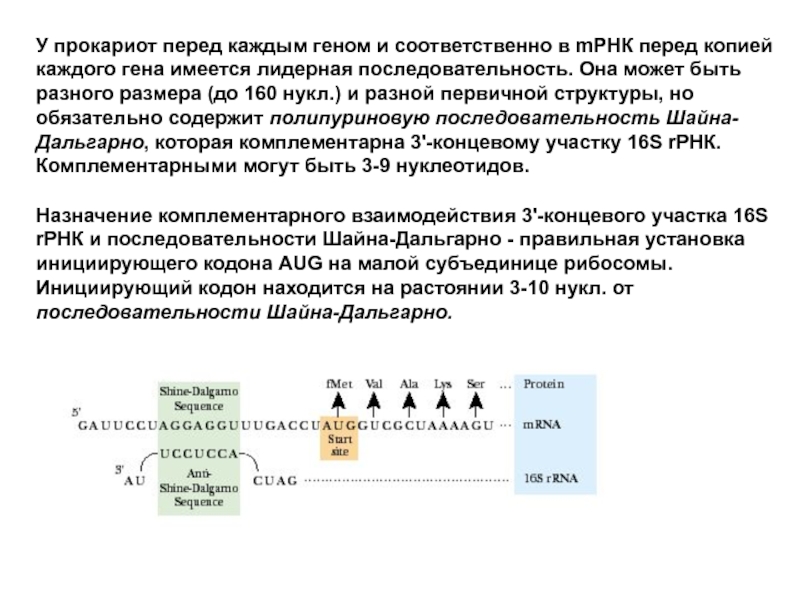
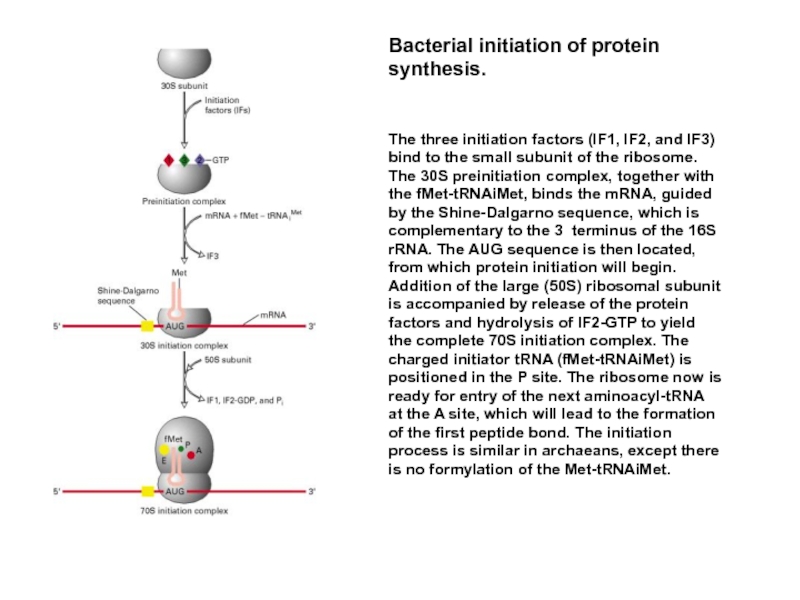
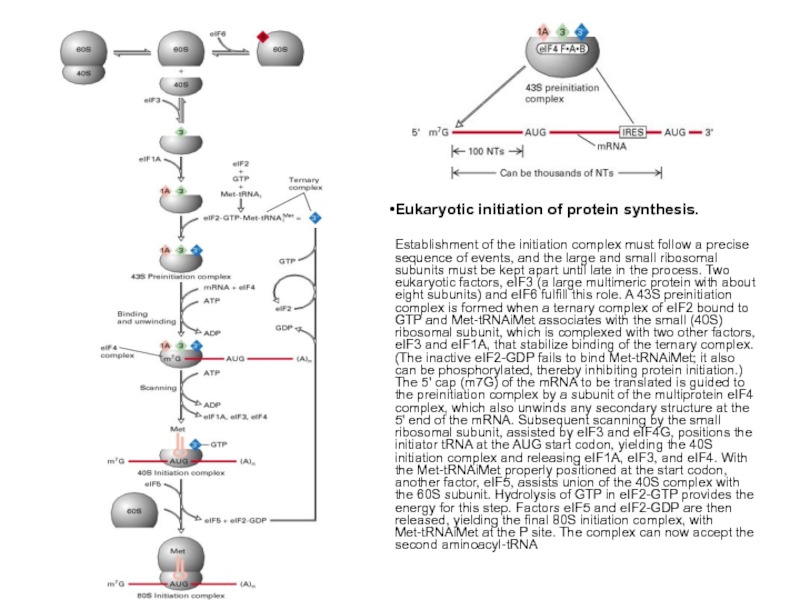
Слайд 45У прокариот перед каждым геном и соответственно в mРНК перед копией
Назначение комплементарного взаимодействия 3'-концевого участка 16S rРНК и последовательности Шайна-Дальгарно - правильная установка инициирующего кодона AUG на малой субъединице рибосомы. Инициирующий кодон находится на растоянии 3-10 нукл. от последовательности Шайна-Дальгарно.