действия ферментов
4. Регуляция активности ферментов: активаторы и ингибиторы.
5. Влияние температуры и рН среды на активность ферментов
6. Механизм действия ферментов
7. Классификация ферментов
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменты. Особенности ферментов презентация
Содержание
- 1. Ферменты. Особенности ферментов
- 2. Понятие о роли ферментов в организме Обмен
- 3. Особенности ферментов
- 4. Строение ферментов Большой размер Ферменты —
- 5. Строение ферментов
- 6. Кофакторы ферментов 1. Простетическая группа — прочно
- 7. Коферменты: 1) Синтезируются из водорастворимых витаминов: В1
- 8. Коферменты: 2) функция : участвуют в химических
- 9. Строение фермента
- 10. Активный центр фермента Это узкое
- 11. Активный центр - Формируется 12-16 а/к остатками
- 12. Аллостерический центр - Характерен для ферментов-олигомеров
- 13. Специфичность действия ферментов Это способность ферментов выбирать
- 14. Изменение активности ферменов: 1. активирование (повышение активности)
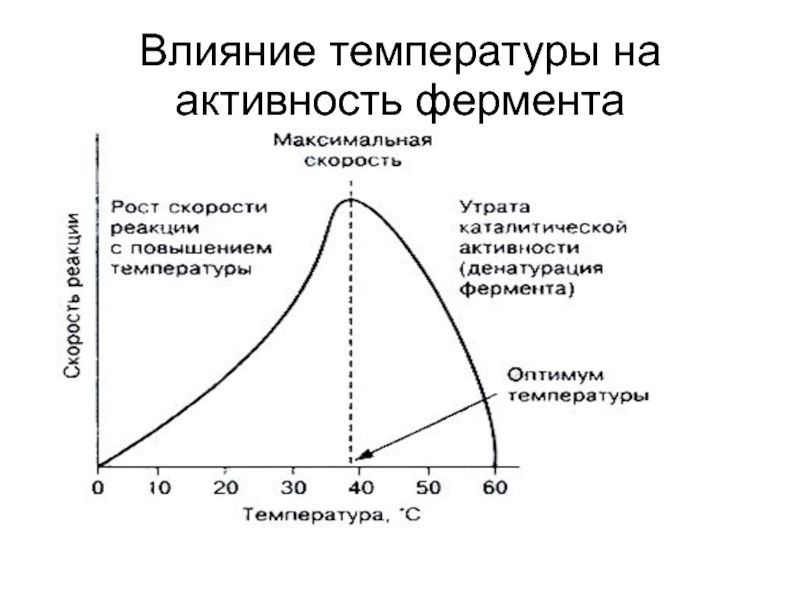
- 15. Влияние температуры на активность фермента
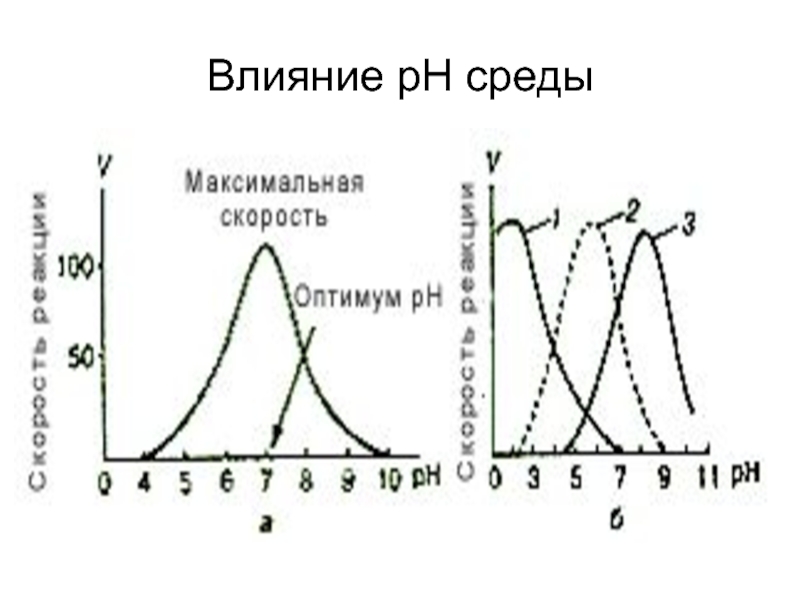
- 16. Влияние рН среды
- 17. Механизм действия ферментов Ферментативная реакция описывается:
- 18. Механизм действия ферментов I. Узнавание и присоединение.
- 19. Механизм действия ферментов III. Катализ реакции превращения
- 21. Механизм действия ферментов IV. образование продукта реакции.
- 22. Классификация ферментов
- 23. Классы ферментов По типу катализируемых реакций все
Слайд 1Ферменты
1. Общее понятие о ферментах как биологических катализаторах
2. Строение ферментов
3. Специфичность
Слайд 2Понятие о роли ферментов в организме
Обмен веществ (метаболизм) — это совокупность
химических реакций в живом организме. Состоит из реакций анаболизма (синтез) и катаболизма (распад). Все реакции протекают одновременно, поэтому происходит регуляция их скорости, начала и конца. Регуляторами всех реакций являются ФЕРМЕНТЫ. Это белки катализаторы (ускорители реакций). В организме человека все хим.реакции протекают с участием ферментов.
Слайд 3Особенности ферментов
ФЕРМЕНТЫ —
БЕЛКИ:
1. высокая эффективность действия (ускоряют реакции в 106-1012 раз выше)
2. высокая специфичность действия (избирательность к субстрату и реакции)
3. способность к регуляции активности (можно изменять активность фермента — повышать или понижать)
4. мягкие условия функционирования
1. высокая эффективность действия (ускоряют реакции в 106-1012 раз выше)
2. высокая специфичность действия (избирательность к субстрату и реакции)
3. способность к регуляции активности (можно изменять активность фермента — повышать или понижать)
4. мягкие условия функционирования
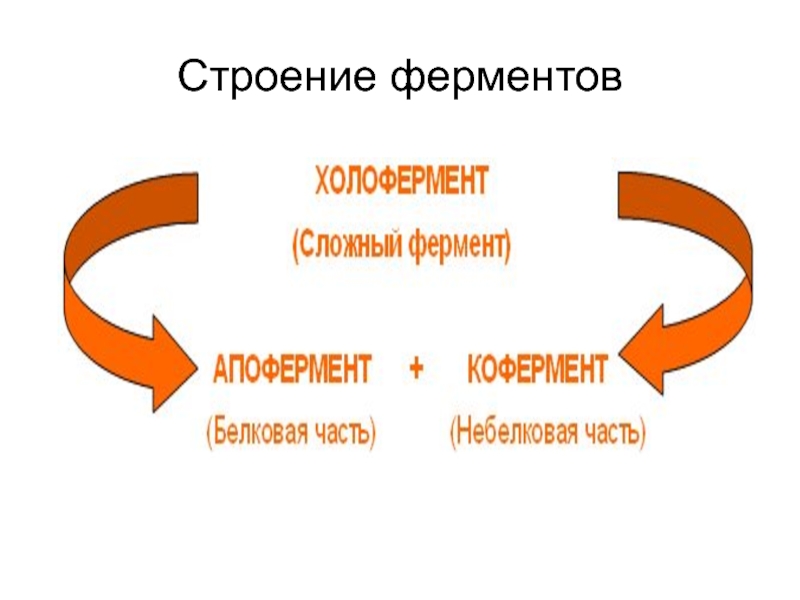
Слайд 4Строение ферментов
Большой размер
Ферменты — простые (только из аминокислот), сложные (белковый
компонент + дополнительный компонент)
Слайд 6Кофакторы ферментов
1. Простетическая группа — прочно связаны с апоферментом (ионы металлов,
ФМН, ФАД)
Коферменты — легко диссоциируют (органические соединения: НАД, НАДФ, ПФ, КоА и др.)
Коферменты — легко диссоциируют (органические соединения: НАД, НАДФ, ПФ, КоА и др.)
Слайд 7Коферменты:
1) Синтезируются из водорастворимых витаминов:
В1 (тиамин) — ТДФ (тиаминдифосфат)
В2 (рибофлавин) —
ФАД (флавинадениндинуклеотид)
В3 (пантотеновая кислота) — КоА (коэнзимА)
В5 (никотинамид) — НАД (никотинамидадениндинуклеотид)
В6 (пиридоксамин) — ПФ (пиридоксальфосфат)
В3 (пантотеновая кислота) — КоА (коэнзимА)
В5 (никотинамид) — НАД (никотинамидадениндинуклеотид)
В6 (пиридоксамин) — ПФ (пиридоксальфосфат)
Слайд 8Коферменты:
2) функция : участвуют в химических реакциях — претерпевает хим.изм-я, противоположные
субстрату (практически являются вторым субстратом для фермента)
3) в отсутствии кофермента фермент не активен
4) присоединяются в каталитическом участке активного центра фермента
3) в отсутствии кофермента фермент не активен
4) присоединяются в каталитическом участке активного центра фермента
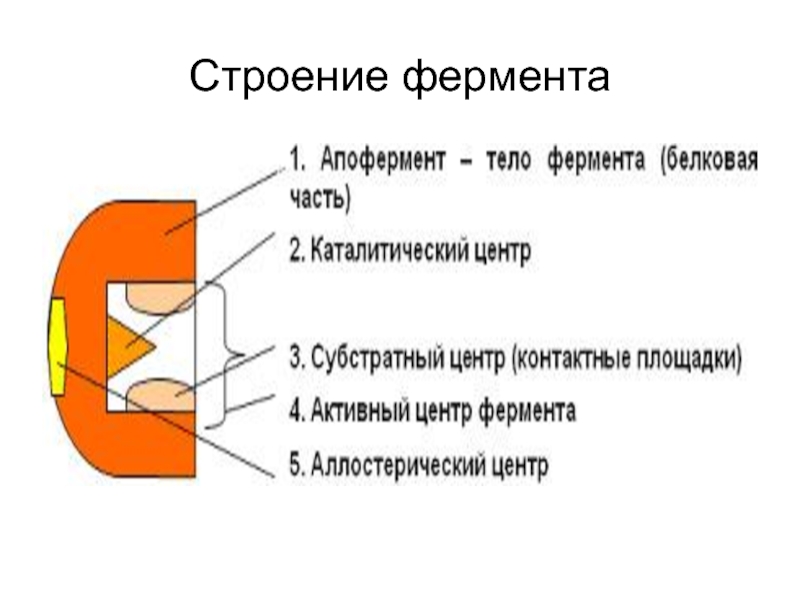
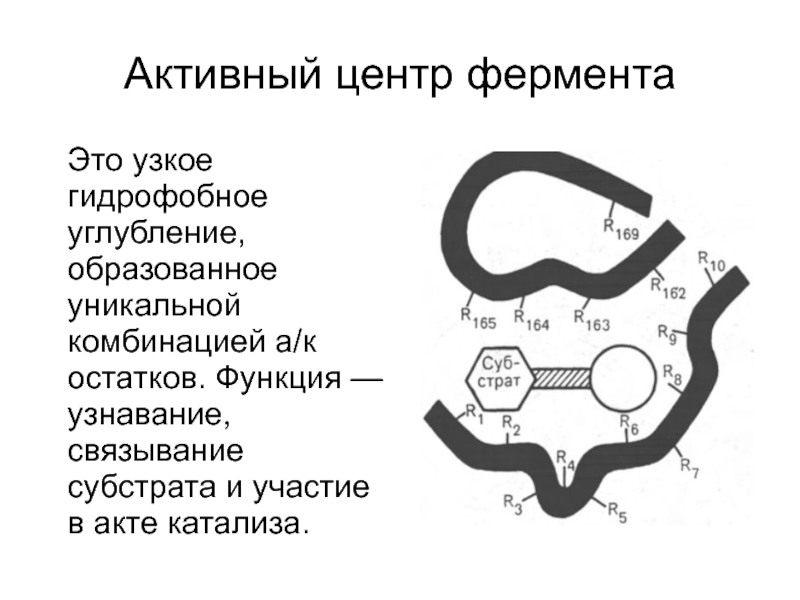
Слайд 10Активный центр фермента
Это узкое гидрофобное углубление, образованное уникальной комбинацией
а/к остатков. Функция — узнавание, связывание субстрата и участие в акте катализа.
Слайд 11Активный центр
- Формируется 12-16 а/к остатками
- субстрат и акт.центр имеют геометрическое
соответствие, связываются слабыми связями (гидроф., ионная, водор.), т. е. устанавливается электронное или химическое соответствие = комплементарность
Слайд 12Аллостерический центр
- Характерен для ферментов-олигомеров
- Связывает эффектор
- Функция — регуляция активности
ферментов
Слайд 13Специфичность действия ферментов
Это способность ферментов выбирать определенный субстрат и катализировать определенную
реакцию
Имеется несколько видов специфичности. Наиболее узкая специфичность — абсолютная, широкая специфичность - групповая
Имеется несколько видов специфичности. Наиболее узкая специфичность — абсолютная, широкая специфичность - групповая
Слайд 14Изменение активности ферменов:
1. активирование (повышение активности) под действием активаторов: неорг.в-ва (HСl
для пепсина), органич.в-ва (цистеин для папаина), ионы Ме
2. Ингибирование (понижение активности)
а) обратимое: конкурентное и неконкурентное
б) необратимое
2. Ингибирование (понижение активности)
а) обратимое: конкурентное и неконкурентное
б) необратимое
Слайд 18Механизм действия ферментов
I. Узнавание и присоединение. Избирательное присоединение субстрата за счет
слабых связей (многоточечное).
II. Ориентирование S в активном центре (переходное состояние).
S ориентируется с помощью контактных участков таким образом, чтобы обеспечить доступ каталитическим группам к реакционному центру
II. Ориентирование S в активном центре (переходное состояние).
S ориентируется с помощью контактных участков таким образом, чтобы обеспечить доступ каталитическим группам к реакционному центру
Слайд 19Механизм действия ферментов
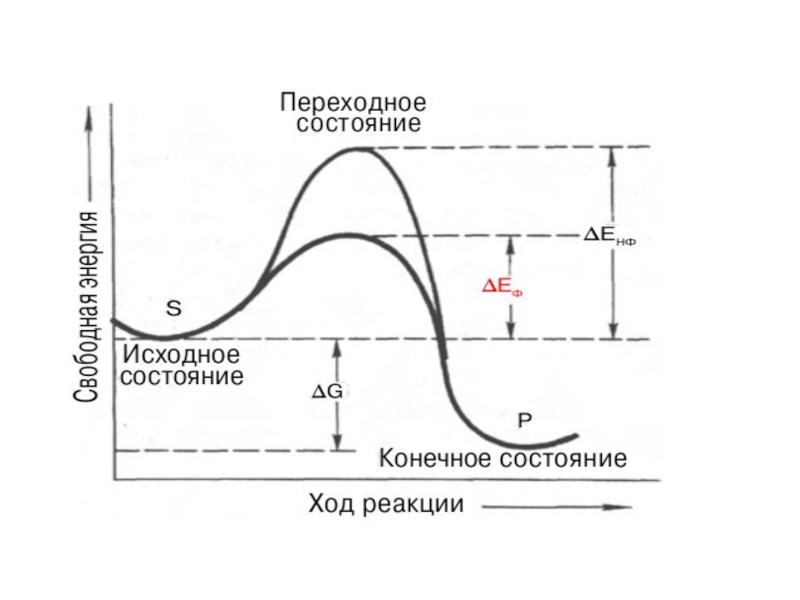
III. Катализ реакции превращения S. Теория столкновений: молекулы должны
сталкиваться и для продуктивности, они должны обладать энергией, достаточной для преодоления энергетического барьера.
Роль фермента: фермент снижает свободную энергию переходного состояния путем увеличения доли активных соударений (многоточечность связывания).
Роль фермента: фермент снижает свободную энергию переходного состояния путем увеличения доли активных соударений (многоточечность связывания).
Слайд 21Механизм действия ферментов
IV. образование продукта реакции. Продукт имеет другую конформацию, чем
субстрат, поэтому комплементарность снижается или исчезает — происходит диссоциация. Фермент возвращается в исходное состояние.
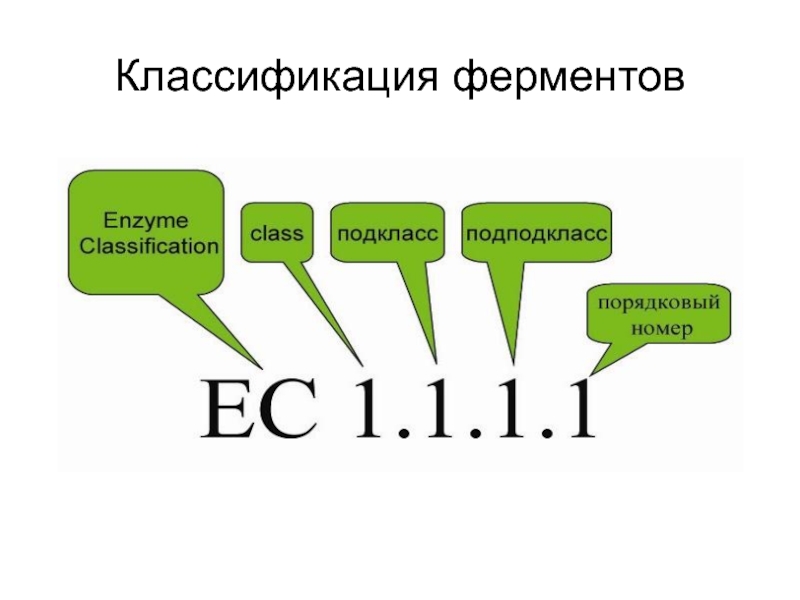
Слайд 23Классы ферментов
По типу катализируемых реакций все ферменты делят на 6 классов:
1.
Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы (синтетазы)
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы (синтетазы)