- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные радиационные и биологические факторы, определяющие радиобиологические эффекты презентация
Содержание
- 1. Основные радиационные и биологические факторы, определяющие радиобиологические эффекты
- 2. Основные радиационные и биологические факторы, определяющие радиобиологические эффекты
- 3. Радиобиологический эффект зависит от радиационных и биологических
- 4. Основные радиационные факторы, определяющие радиобиологические эффекты Место
- 5. 1. Место расположения источника излучения по
- 6. Пути инкорпорирования радионуклидов (РН) в организм Проникновение
- 7. Распределение радионуклидов в организме Инкорпорированные в организм
- 8. В зависимости от типа распределения в организме
- 9. Снижение содержания РН в организме Уменьшение количества
- 10. 2. Вид ионизирующего излучения
- 11. Опасность α-излучения при внутреннем облучении чрезвычайно высока!
- 12. Опасность β-излучения Проникающая способность β‑излучения занимает промежуточное
- 13. 3. Пространственное распределение дозы ионизирующего излучения в
- 14. Летальный (т.е. смертельный) исход для организма при
- 15. Равномерное и неравномерное облучение Важно понимать,
- 16. 4. Временнóе распределение дозы ионизирующего излучения
- 17. Типы временнóго распределения дозы В зависимости
- 18. Многообразие типов временнóго распределения дозы Перечисленные
- 19. Радиобиологический эффект снижается при уменьшении мощности дозы
- 20. Диапазон наиболее выраженных изменений радиобиологических эффектов до
- 21. Почему радиационный эффект ослабляется при снижении мощности
- 22. Что такое «двунитевый разрыв» ДНК?
- 23. Как могут возникать двунитевые разрывы ДНК? Двунитевые
- 24. Образование двунитевого разрыва ДНК в результате двусобытийного
- 25. Образование двунитевого разрыва ДНК в результате однособытийного
- 26. Зависимость радиационного эффекта от мощности дозы для
- 27. 5. Доза облучения Наиболее важным фактором,
- 28. Дозовые кривые гибели и выживаемости В
- 29. ЛД50, МАЛД и МЛД Дозовая кривая
- 30. Летальные, сублетальные и сверхлетальные дозы Дозы
- 31. Переходим к рассмотрению основных биологических факторов, определяющих радиобиологические эффекты.
- 32. Основные биологические факторы, определяющие радиобиологические эффекты Вид
- 33. 1. Вид живого организма Величина радиобиологического эффекта
- 34. Значения ЛД50 для различных биообъектов при остром общем однократном γ- или рентгеновском облучении
- 35. Как видно из этой таблицы, наиболее радиочувствительными
- 36. 2. Возраст (или стадия онтогенетического развития) живого
- 37. Значения ЛД50 для различных стадий онтогенетического развития
- 38. Возрастные изменения радиочувствительности у млекопитающих В целом
- 39. Радиочувствительность млекопитающих в период пренатального (внутриутробного) развития
- 40. Радиочувствительность млекопитающих на разных стадиях пренатального развития
- 41. Эффекты облучения на разных стадиях пренатального
- 42. Уродства – аномалии структурного характера Это могут
- 43. Экстраполяция экспериментальных данных на человека R. Rugh
- 44. Умственная отсталость людей, облученных в плодный период
- 45. Зависимость частоты появления умственной отсталости от дозы
- 46. Увеличение риска возникновения рака у детей, облученных
- 47. 3. Пол живого организма Общей закономерности относительно
- 48. 4. Физиологическое состояние живого организма Физиологическое состояние
- 49. 5. Используемая пища Развитие лучевого поражения в
- 50. Продолжительность жизни после облучения и радиационные синдромы у млекопитающих
- 51. Продолжительность жизни после облучения Облучение ионизирующим излучением
- 52. Борис Раевский (1893-1974) Борис Раевский (Boris Rajewsky,
- 53. Зависимость СПЖ мышей от дозы облучения Зависимость
- 54. Дозовая зависимость СПЖ у других видов млекопитающих
- 55. «Смерть под лучем» При дозах свыше 1000 Гр
- 56. СПЖ в диапазоне доз 1-3 Гр При
- 57. СПЖ при дозах < 0,5 Гр Первая
- 58. Гормезис Гормезис (от греч. hórmēsis – быстрое
- 59. Понятие критических систем или органов Возвращаясь к
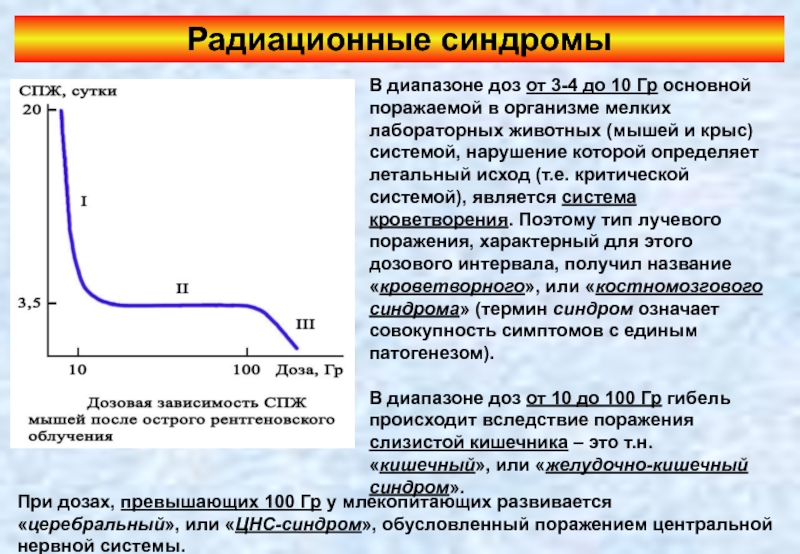
- 60. Радиационные синдромы В диапазоне доз от 3-4
- 61. Рассмотрим более подробно наиболее часто встречаемые лучевые синдромы – костномозговой (кроветворный) и кишечный.
- 62. Кроветворение Кроветворением (гемопоэзом) называют процесс образования, развития
- 63. Система кроветворения Система кроветворения включает органы, главной
- 64. Костный мозг У взрослого человека и крупных
- 65. Расположение костного мозга Красный костный мозг расположен:
- 66. Кроветворные стволовые клетки – ключевой компонент кроветворения
- 67. Правило (закон) Бергонье–Трибондо Кроветворная ткань представляет собой
- 68. Интерфазная и митотическая (репродуктивная) гибель клеток В
- 69. Сколько делящихся клеток красного костного мозга гибнет
- 70. Опустошение кроветворных органов В результате постлучевой гибели
- 71. Нейтрофилы: пострадиационная динамика (1) У всех исследованных
- 72. У многих видов млекопитающих наиболее глубокая нейтропения
- 73. Глубокая нейтропения – основная причина гибели организма
- 74. Тромбоциты: пострадиационная динамика Динамика изменения количества тромбоцитов
- 75. Важная роль тромбопении в лучевой гибели млекопитающих
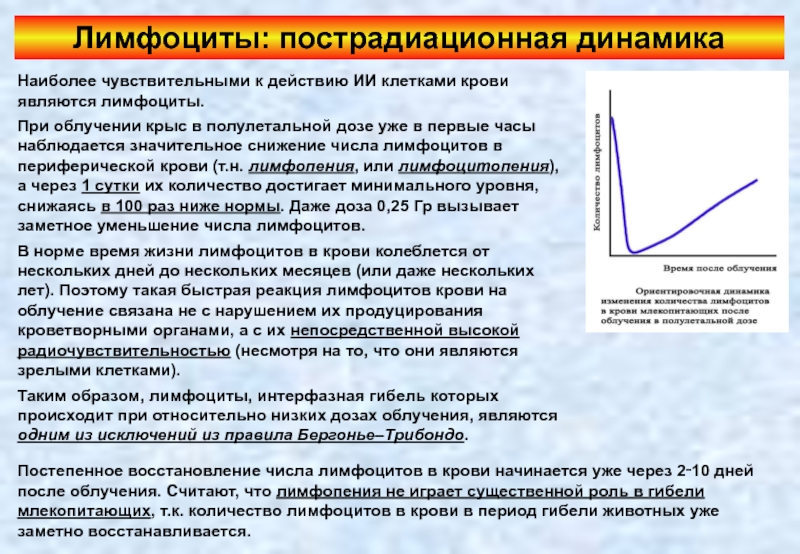
- 76. Лимфоциты: пострадиационная динамика Наиболее чувствительными к действию
- 77. Эритроциты: пострадиационная динамика Содержание эритроцитов в периферической
- 78. Основные причины гибели при кроветворном синдроме Итак,
- 79. Переходим к рассмотрению лучевого кишечного синдрома.
- 80. Кишечник Кишечником называется часть пищеварительного тракта, начинающаяся
- 81. Структура тонкой кишки В тонкой кишке различают
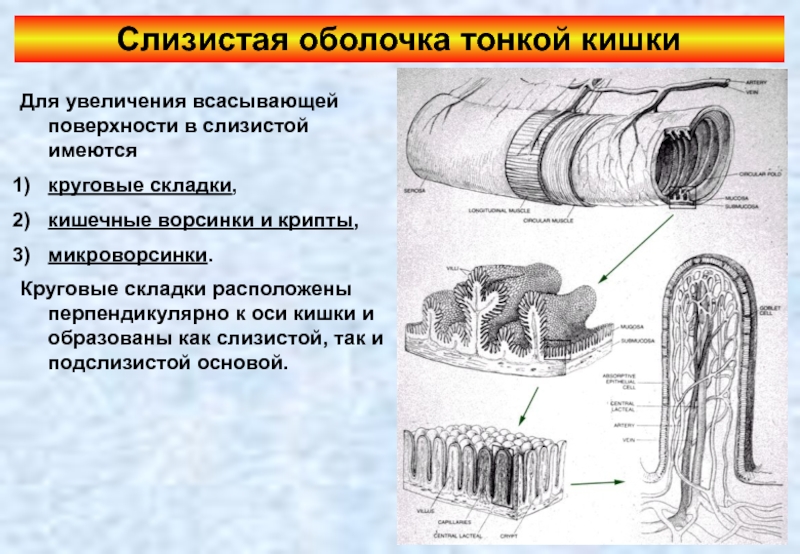
- 82. Слизистая оболочка тонкой кишки Для увеличения всасывающей
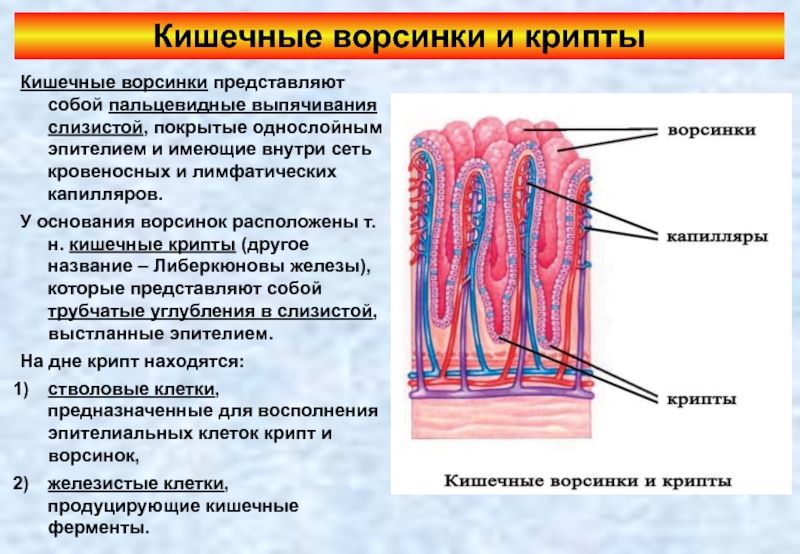
- 83. Кишечные ворсинки и крипты Кишечные ворсинки представляют
- 85. Всасывающая поверхность тонкой кишки у человека
- 86. Клетки крипт и ворсинок как единая система
- 87. Клетки крипт наиболее радиочувствительны Таким образом, эпителиальные
- 88. Опустошение слизистой После облучения в дозах, превышающих
- 89. Главные последствия опустошения слизистой Опустошение эпителия слизистой
- 90. Основные проявления кишечного синдрома Для кишечного синдрома
- 91. Снижение клеточности слизистой кишечника при более низких
- 92. Рассмотренные выше кроветворный и кишечный синдромы лучевого
- 93. Лучевая болезнь человека.
- 94. Лучевая болезнь человека может принимать разнообразные
- 95. острая лучевая болезнь (ОЛБ); хроническая лучевая
- 96. Острой лучевой болезнью (ОЛБ) называют совокупность клинических
- 97. ОЛБ при относительно равномерном и неравномерном общем
- 98. ОЛБ при относительно равномерном общем облучении
- 99. Период формирования ОЛБ Период формирования ОЛБ, в
- 100. Фаза первичной реакции Показатели первичной реакции: тошнота;
- 101. Фаза кажущегося клинического благополучия Продолжительность этой фазы
- 102. Фаза выраженных клинических проявлений В зависимости от
- 103. Фаза раннего восстановления Фаза раннего восстановления начинается
- 104. Классификация ОЛБ по степени тяжести В зависимости
- 105. Характеристика ОЛБ I степени (легкой)
- 106. Характеристика ОЛБ II степени (средней)
- 107. Характеристика ОЛБ III степени (тяжелой)
- 108. Характеристика ОЛБ IV степени (крайне тяжелой)
- 109. Характеристика ОЛБ IV степени (крайне тяжелой) (продолжение)
- 110. Острые лучевые поражения у человека при
- 111. Острые лучевые поражения у человека при локальном
- 112. Местные лучевые поражения руки Эритема и отек
- 113. Местные лучевые поражения кожи ноги Из книги:
- 114. Местные лучевые поражения кисти руки Вид ладони
- 115. Местные лучевые поражения кожи и груди Из
- 116. Местные лучевые поражения при облучении половых
- 117. Хронической лучевой болезнью (ХЛБ) называют клинический синдром,
- 118. ХЛБ человека. Синдромы Ведущим синдромом ХЛБ в
- 119. Отдаленные последствия облучения Не надо путать ХЛБ
- 120. Терапия острой лучевой болезни Основное направление в
- 121. Общие принципы терапии ОЛБ Главная задача терапии
- 122. Основные методы терапии острой лучевой болезни Облучение
Слайд 3Радиобиологический эффект зависит от радиационных и биологических факторов
Ионизирующее излучение вызывает в
Степень и характер проявления радиобиологических эффектов зависят от различных радиационных факторов, характеризующих условия облучения, и от биологических факторов, характеризующих объект облучения.
Слайд 4Основные радиационные факторы, определяющие радиобиологические эффекты
Место расположения источника излучения по отношению
Вид ионизирующего излучения.
Пространственное распределение дозы ионизирующего излучения в организме.
Временнóе распределение дозы ионизирующего излучения.
Доза облучения.
Слайд 51. Место расположения источника излучения
по отношению к облучаемому организму
В зависимости
ВНЕШНИМ — когда источник излучения находится во внешней среде вне облучаемого организма;
ВНУТРЕННИМ — когда облучение происходит в результате воздействия излучения от попавших в организм радиоактивных веществ (радионуклидов);
КОМБИНИРОВАННЫМ — в реальной экологической обстановке встречается наиболее часто.
Слайд 6Пути инкорпорирования радионуклидов (РН) в организм
Проникновение (инкорпорирование) в организм радиоактивных веществ
1) ингаляционным путем (т.е. с вдыхаемым воздухом);
2) алиментарным, или пероральным путем (т.е. через рот – с пищей и водой;
3) перкутанным путем (т.е. через кожу);
4) через слизистые оболочки глаза;
5) через раны.
Слайд 7Распределение радионуклидов в организме
Инкорпорированные в организм радионуклиды в зависимости от своих
Для большинства радионуклидов характерна органотропность, т.е. неравномерность распределения в организме.
Слайд 8В зависимости от типа распределения в организме (т.е. от того в
Типы распределения РН в организме
Соответственно органы и ткани, в которых накапливается тот или иной радионуклид, подвергаются бóльшему радиационному поражению при поступлении в организм этих радионуклидов
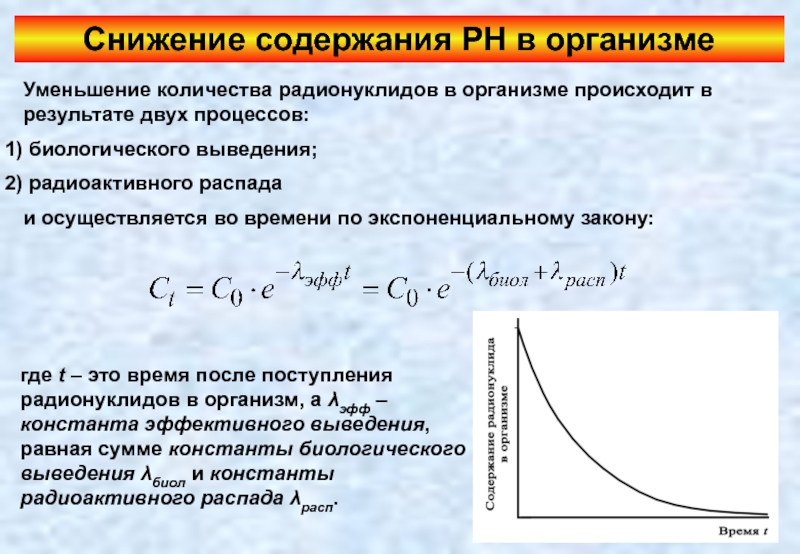
Слайд 9Снижение содержания РН в организме
Уменьшение количества радионуклидов в организме происходит в
биологического выведения;
радиоактивного распада
и осуществляется во времени по экспоненциальному закону:
где t – это время после поступления радионуклидов в организм, а λэфф – константа эффективного выведения, равная сумме константы биологического выведения λбиол и константы радиоактивного распада λрасп.
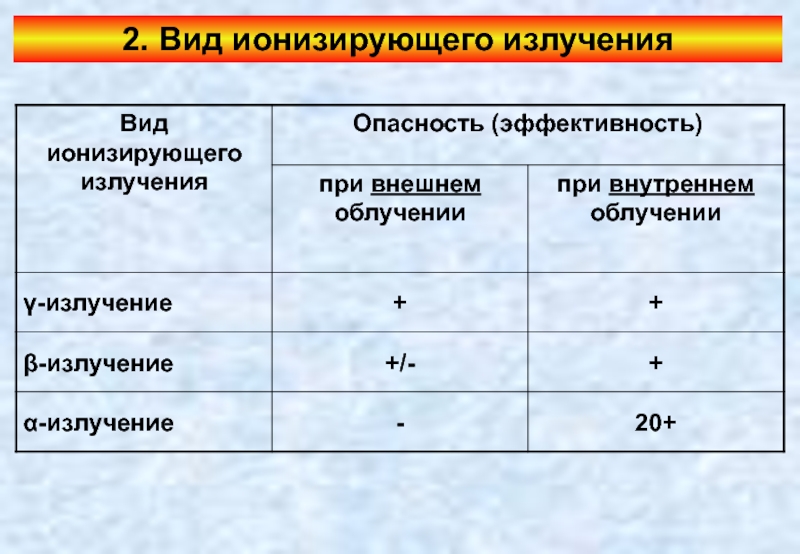
Слайд 11Опасность α-излучения при внутреннем облучении чрезвычайно высока!
α-Излучение из-за низкой проникающей способности
Однако при ВНУТРЕННЕМ облучении биологических объектов (т.е., когда процесс α-распада радионуклидов, попавших в организм, осуществляется в непосредственной близости от жизненно важных клеток организма) α-излучение является чрезвычайно опасным, т.к. является ПЛОТНИИОНИЗИРУЮЩИМ.
В внутреннем облучении α-излучение при одинаковой поглощенной дозе гораздо опаснее γ-излучения — в среднем способность α-излучения повреждать клетки в 20 раз выше, чем у γ‑излучения.
Слайд 12Опасность β-излучения
Проникающая способность β‑излучения занимает промежуточное положение между α- и γ‑излучениями:
Поэтому при ВНЕШНЕМ облучении относительно крупных организмов (например, человека) поражающему действию β‑излучения подвержены в основном только внешние ткани — кожа и глаза.
Наибольшую опасность β‑излучение представляет (как и α‑излучение) при ВНУТРЕННЕМ облучении.
При ВНУТРЕННЕМ облучении опасность β‑излучения такая же, как у γ‑излучения (при одинаковой поглощенной дозе)
Слайд 133. Пространственное распределение дозы ионизирующего излучения в организме
В зависимости от того,
– ОБЩЕЕ (или ТОТАЛЬНОЕ) облучение — воздействию излучения подвергается все тело;
– СУБТОТАЛЬНОЕ облучение — воздействию излучения подвергается бóльшая часть тела при защитном экранировании (например, свинцовыми пластинами) отдельных его областей или органов (например, головы, области живота, грудной клетки, конечностей, половых органов, и т.д.);
– ПАРЦИАЛЬНОЕ облучение — воздействию излучения подвергается отдельная область тела (например, голова, живот, грудная клетка и т.д.);
– ЛОКАЛЬНОЕ облучение — воздействию узких пучков излучения подвергается отдельный орган или небольшой участок тела.
Слайд 14Летальный (т.е. смертельный) исход для организма при ОБЩЕМ облучении наблюдается обычно
Поэтому локальное или парциальное облучение (особенно тех областей тела, которые не играют определяющего значения для выживания организма) даже в таких высоких дозах, которые значительно превышают смертельную дозу, характерную для общего облучения, могут не привести к летальному исходу.
Общее облучение – наиболее опасно!
Слайд 15Равномерное и неравномерное облучение
Важно понимать, что ОБЩЕЕ облучение НЕ ПОДРАЗУМЕВАЕТ наличия
Даже в условиях помещения облучаемого организма в равномерное поле глубокопроникающего γ-излучения более удаленные от источника излучения области тела получают меньшую поглощенную дозу излучения вследствие экранирования их менее удаленными областями тела.
В экспериментальных исследованиях с крупными биологическими объектами для достижения бóльшей равномерности облучения вместо рентгеновских лучей используют γ‑излучение 60Co, обладающее более высокой проникающей способностью.
Бóльшую равномерность облучения крупных биологических объектов достигают также путем использования двустороннего, четырехстороннего или многостороннего облучения.
Принято считать, что облучение является РАВНОМЕРНЫМ, если различия в распределении поглощенной дозы в облучаемом организме не превышает ±10%.
Равномерное облучение встречается практически исключительно только в экспериментальных условиях. В большинстве аварийных ситуаций наблюдается неравномерное облучение.
Слайд 164. Временнóе распределение дозы ионизирующего излучения
Для большинства радиобиологических эффектов исключительно
1) длительность облучения, а также
2) наличие или отсутствие перерывов в облучении.
Основным показателем, характеризующим распределение дозы во времени, является мощность дозы.
Например, мощность поглощенной дозы — это отношение приращения поглощенной дозы излучения dD за интервал времени dt к этому интервалу времени:
Одну и ту же дозу можно дать за короткий интервал времени (т.е. с высокой мощностью дозы) или за длительный интервал времени (т.е. с низкой мощностью дозы).
Слайд 17Типы временнóго распределения дозы
В зависимости от длительности облучения, величины используемой
ОСТРОЕ (или КРАТКОВРЕМЕННОЕ) облучение — лучевое воздействие при большой мощности дозы (ориентировочно от 0,1 Гр/мин и выше) длительностью от нескольких секунд до 2 часов;
ПРОЛОНГИРОВАННОЕ (или ПРОТЯЖЕННОЕ) облучение — лучевое воздействие при сравнительно небольшой мощности дозы (от 0,1 Гр/час и ниже) длительностью от 2 часов до нескольких недель;
ДРОБНОЕ (или ФРАКЦИОНИРОВАННОЕ) облучение — многократное лучевое воздействие с любой мощностью дозы (чаще при высокой мощности дозы в каждой фракции) с временными интервалами между фракциями облучения;
ХРОНИЧЕСКОЕ облучение — лучевое воздействие длительностью от нескольких месяцев до нескольких лет, осуществляемое:
– либо постоянно (т.е. без перерывов) при низкой мощности дозы (порядка 0,01 Гр/сут и ниже);
– либо фракционированно (т.е. с перерывами) в небольших разовых дозах при любой мощности дозы.
Слайд 18Многообразие типов временнóго распределения дозы
Перечисленные типы временнóго распределения дозы не
Слайд 19Радиобиологический эффект снижается при уменьшении мощности дозы и наличии перерывов
Снижение мощности
Эффект ослабления наблюдается только при действии редкоионизирующего излучения и практически отсутствует при действии плотноионизирующего излучения (α-излучения).
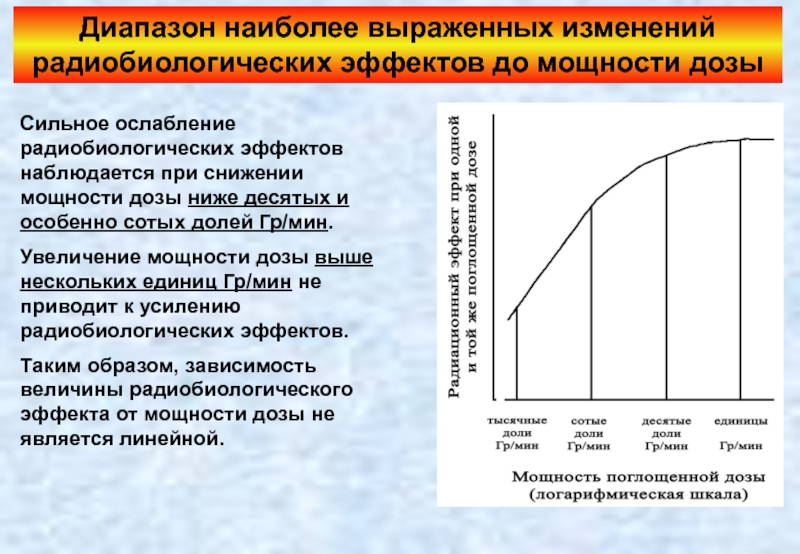
Слайд 20Диапазон наиболее выраженных изменений радиобиологических эффектов до мощности дозы
Сильное ослабление радиобиологических
Увеличение мощности дозы выше нескольких единиц Гр/мин не приводит к усилению радиобиологических эффектов.
Таким образом, зависимость величины радиобиологического эффекта от мощности дозы не является линейной.
Слайд 21Почему радиационный эффект ослабляется при снижении мощности дозы?
Ослабление радиобиологического эффекта при
Как известно, наиболее губительны для клетки двунитевые разрывы ДНК, т.к. в большинстве случаев они не могут быть правильно репарированы.
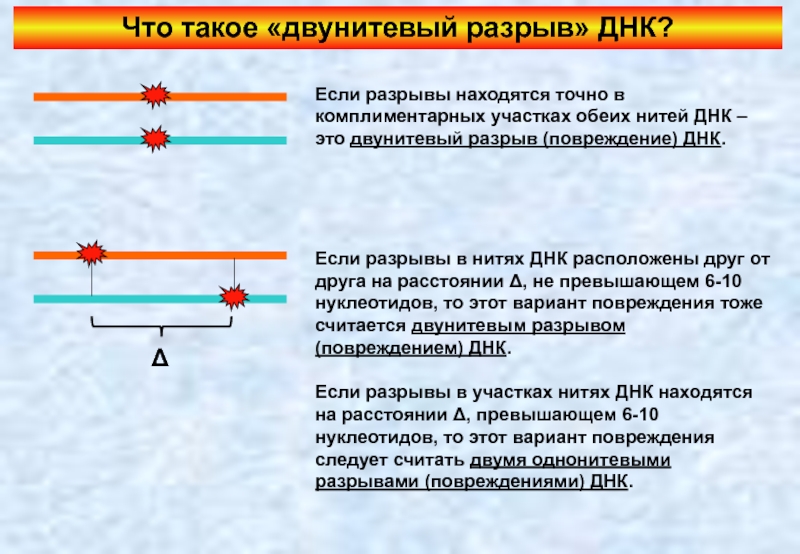
Слайд 22Что такое «двунитевый разрыв» ДНК?
Если разрывы находятся точно в комплиментарных участках
Δ
Если разрывы в нитях ДНК расположены друг от друга на расстоянии Δ, не превышающем 6-10 нуклеотидов, то этот вариант повреждения тоже считается двунитевым разрывом (повреждением) ДНК.
Если разрывы в участках нитях ДНК находятся на расстоянии Δ, превышающем 6-10 нуклеотидов, то этот вариант повреждения следует считать двумя однонитевыми разрывами (повреждениями) ДНК.
Слайд 23Как могут возникать двунитевые разрывы ДНК?
Двунитевые разрывы ДНК могут возникнуть:
1) при
2) при пролете 1-й плотноионизирующей частицы (α-частицы), вызвавших разрывы в комплиментарных участках ОБЕИХ нитей ДНК – это т.н. однособытийный процесс образования двунитевого разрыва.
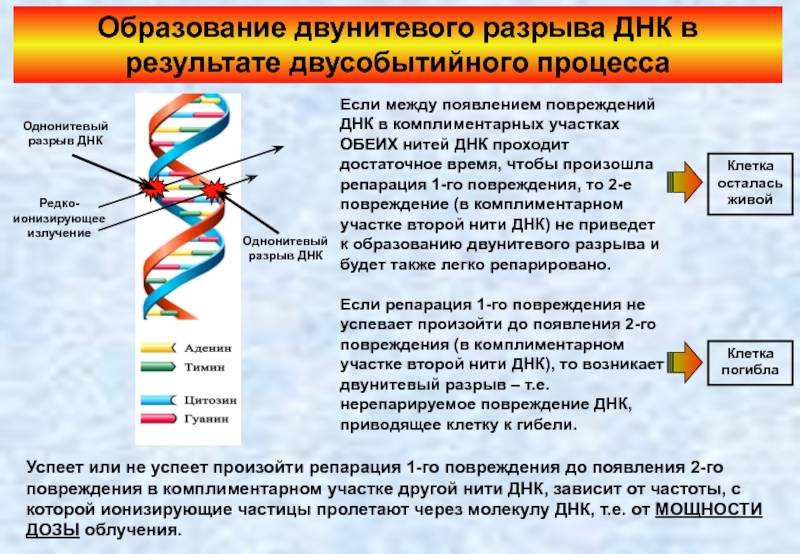
Слайд 24Образование двунитевого разрыва ДНК в результате двусобытийного процесса
Редко-ионизирующее излучение
Однонитевый
разрыв ДНК
Однонитевый
разрыв ДНК
Если
Если репарация 1-го повреждения не успевает произойти до появления 2-го повреждения (в комплиментарном участке второй нити ДНК), то возникает двунитевый разрыв – т.е. нерепарируемое повреждение ДНК, приводящее клетку к гибели.
Успеет или не успеет произойти репарация 1-го повреждения до появления 2-го повреждения в комплиментарном участке другой нити ДНК, зависит от частоты, с которой ионизирующие частицы пролетают через молекулу ДНК, т.е. от МОЩНОСТИ ДОЗЫ облучения.
Клетка
погибла
Клетка
осталась
живой
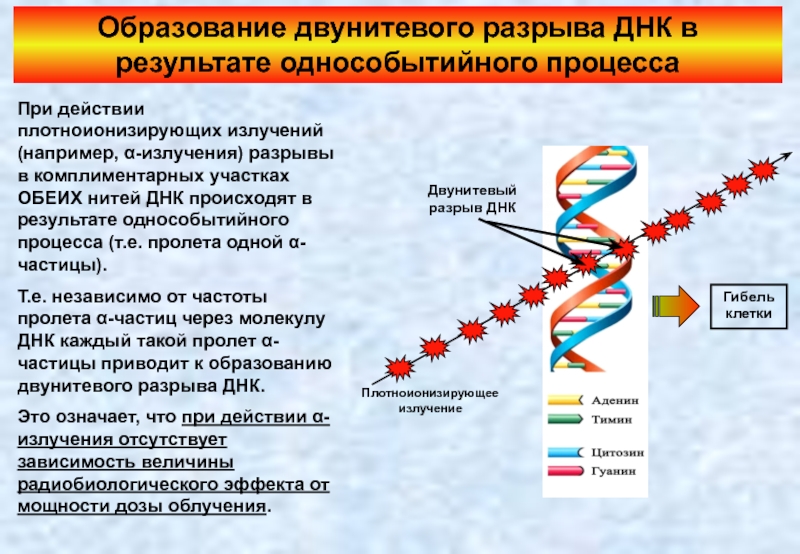
Слайд 25Образование двунитевого разрыва ДНК в результате однособытийного процесса
При действии плотноионизирующих излучений
Т.е. независимо от частоты пролета α-частиц через молекулу ДНК каждый такой пролет α-частицы приводит к образованию двунитевого разрыва ДНК.
Это означает, что при действии α-излучения отсутствует зависимость величины радиобиологического эффекта от мощности дозы облучения.
Плотноионизирующее излучение
Двунитевый
разрыв ДНК
Гибель
клетки
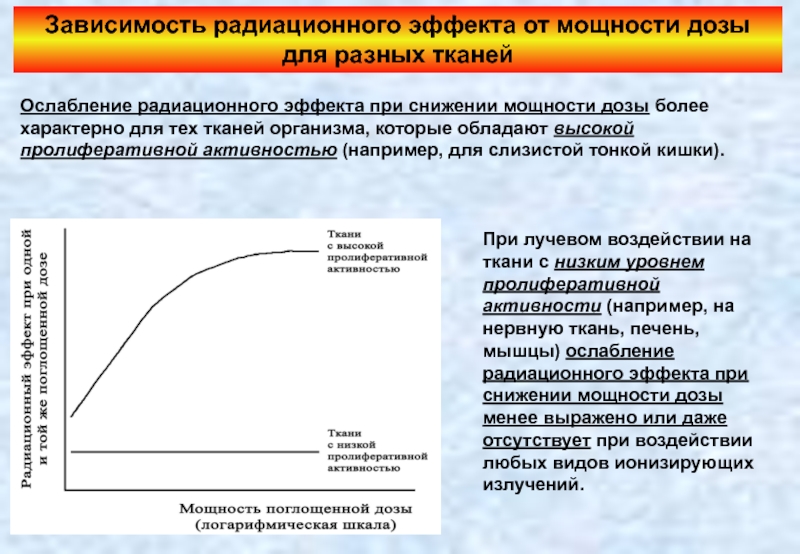
Слайд 26Зависимость радиационного эффекта от мощности дозы для разных тканей
Ослабление радиационного эффекта
При лучевом воздействии на ткани с низким уровнем пролиферативной активности (например, на нервную ткань, печень, мышцы) ослабление радиационного эффекта при снижении мощности дозы менее выражено или даже отсутствует при воздействии любых видов ионизирующих излучений.
Слайд 275. Доза облучения
Наиболее важным фактором, определяющим в конечном итоге степень радиационного
Поэтому в радиобиологических экспериментах наиболее распространенным является исследование дозовой (или дозной) зависимости какого-либо радиационного эффекта, отражающего ту или иную сторону лучевого поражения организма.
Одним из наиболее часто применяемых критериев оценки действия излучения на биологические объекты является такой четко регистрируемый интегральный показатель как гибель организма, являющаяся конечным итогом многочисленных нарушений, происходящих при лучевом поражении.
Оценку летального действия излучения на биологические объекты проводят исследуя зависимость гибели или выживаемости организмов от дозы облучения (т.е. от поглощенной дозы).
Подобные зависимости, представленные графически, получили название дозовой кривой гибели и дозовой кривой выживаемости.
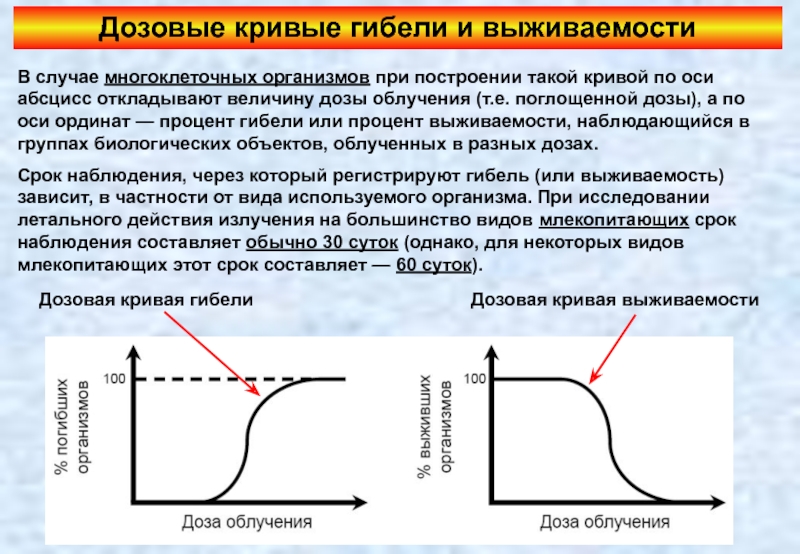
Слайд 28Дозовые кривые гибели и выживаемости
В случае многоклеточных организмов при построении такой
Срок наблюдения, через который регистрируют гибель (или выживаемость) зависит, в частности от вида используемого организма. При исследовании летального действия излучения на большинство видов млекопитающих срок наблюдения составляет обычно 30 суток (однако, для некоторых видов млекопитающих этот срок составляет — 60 суток).
Дозовая кривая гибели
Дозовая кривая выживаемости
Слайд 29ЛД50, МАЛД и МЛД
Дозовая кривая гибели (и выживаемости) имеет типичную S-образную
Одна из них – это точка, значение ординаты которой составляет 50% гибели облученных организмов. Значение дозы, соответствующее абсциссе этой точки называется полулетальной дозой. Т.о., полулетальная доза – это доза облучения, при действии которой погибает 50% облученных организмов. Эту дозу обозначают как ЛД50 или ЛД50/30 (ЛД50/60), где в знаменателе подстрочного индекса указывают срок (в сутках), через который подсчитывают гибель. Величина ЛД50 очень широко используется в радиобиологии .
Вторая характеристическая точка имеет в качестве абсциссы т.н. минимальную абсолютно летальную дозу (МАЛД), т.е. минимальную дозу, вызывающую гибель всех облученных организмов (ордината – 100% гибели).
Третья характеристическая точка имеет в качестве абсциссы т.н. минимальную летальную дозу (МЛД), т.е. практически ту максимальную дозу, которая не вызывает гибели ни одного из облученных организмов (ордината – 0% гибели).
Строго говоря термины «минимальная абсолютно летальная доза» и «минимальная летальная доза» не совсем правомерны, т.к. кривая гибели приближается к отметкам 100% и 0% ассимптотически. Поэтому обычно за МАЛД принимают дозу, вызывающую гибель 99% объектов (ЛД99), а за МЛД – дозу, вызывающую гибель 1% объектов (ЛД1).
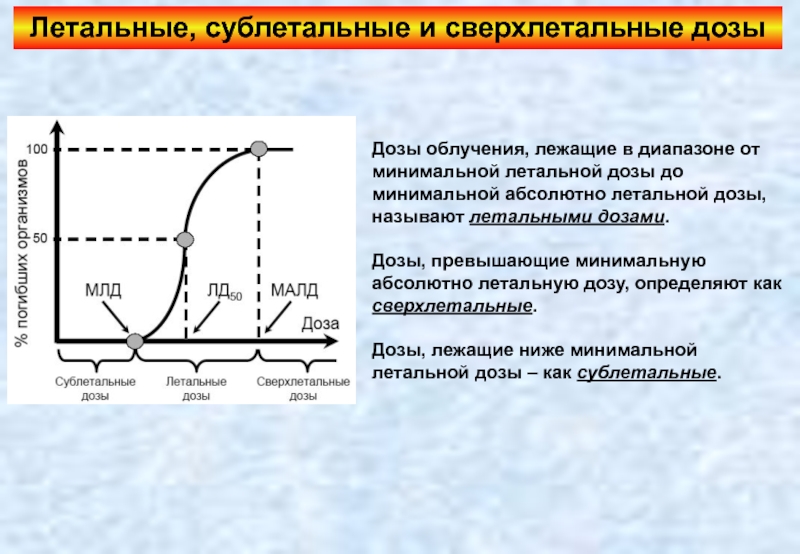
Слайд 30Летальные, сублетальные и сверхлетальные дозы
Дозы облучения, лежащие в диапазоне от минимальной
Дозы, превышающие минимальную абсолютно летальную дозу, определяют как сверхлетальные.
Дозы, лежащие ниже минимальной летальной дозы – как сублетальные.
Слайд 31Переходим к рассмотрению
основных биологических факторов, определяющих радиобиологические эффекты.
Слайд 32Основные биологические факторы, определяющие радиобиологические эффекты
Вид живого организма.
Возраст (или стадия онтогенетического
Пол.
Физиологическое состояние.
Используемая пища.
Слайд 331. Вид живого организма
Величина радиобиологического эффекта (при одной и той же
Иными словами, биологические объекты обладают различной радиочувствительностью.
Термин радиочувствительность широко используется в радиобиологии и означает поражаемость биологических объектов ионизирующим излучением, оцениваемую по критерию их гибели.
Т.е. синонимом термина «радиочувствительность» является термин «радиопоражаемость».
Антонимом термина «радиочувствительность» является термин «радиорезистентность», или «радиоустойчивость».
Радиочувствительность живых организмов широко варьирует в зависимости от их видовой принадлежности. Сравнение радиочувствительности обычно проводят по величине полулетальной дозы ЛД50.
Чем выше значение ЛД50, тем ниже радиочувствительность; чем ниже значение ЛД50, тем выше радиочувствительность.
Слайд 34Значения ЛД50 для различных биообъектов при остром общем однократном γ- или
Слайд 35Как видно из этой таблицы, наиболее радиочувствительными являются млекопитающие, для которых
Напротив, наиболее высокой радиоустойчивостью (радиорезистентностью) обладают простейшие, бактерии и вирусы, для которых ЛД50 может достигать нескольких тысяч грей.
Таким образом в целом по мере усложнения биологической организации радиочувствительность существенно повышается.
Однако, встречаются и исключения, когда среди низших филогенетических групп обнаруживаются отдельные виды, радиочувствительность которых очень высока и сравнима с таковой для млекопитающих (или даже превышает ее).
В целом для низших филогенетических групп характерна значительно большая вариабельность радиочувствительности, чем для высших.
Одним из наиболее радиорезистентных биологических объектов является бактерия Micrococcus radiodurans (Микрококк радиоустойчивый), которая впервые была обнаружена в консервах, подвергнутых стерилизации большими дозами γ-излучения. Позже эти бактерии были обнаружены и в воде охлаждающего канала ядерного реактора, где они прекрасно себя чувствовали, размножались и не погибали.
Следует отметить, что значительные колебания радиочувствительности могут наблюдаться даже для различных штаммов, линий, сортов одного и того же биологического вида живого организма.
Видовые различия радиочувствительности – комментарии
Слайд 362. Возраст (или стадия онтогенетического развития) живого организма
Приведенные выше данные о
Однако, в процессе онтогенетического развития радиочувствительность организма может существенно изменяться.
Слайд 37Значения ЛД50 для различных стадий онтогенетического развития дрозофилы
Радиочувствительность с возрастом резко
Плодовая (или фруктовая) мушка (Drosophila melanogaster, пер с лат. языка – «любительница росы с черным желудком») – излюбленный объект биологов, в частности генетиков.
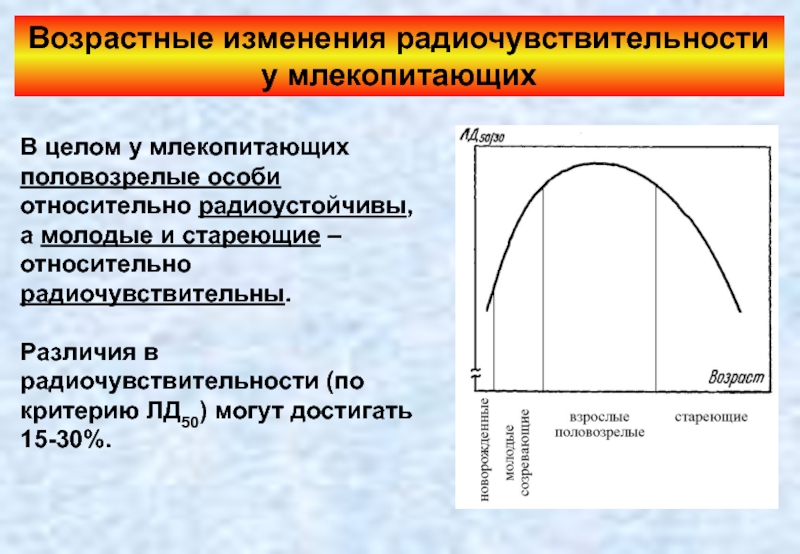
Слайд 38Возрастные изменения радиочувствительности у млекопитающих
В целом у млекопитающих половозрелые особи относительно
Различия в радиочувствительности (по критерию ЛД50) могут достигать 15-30%.
Слайд 39Радиочувствительность млекопитающих в период пренатального (внутриутробного) развития
До этого мы рассматривали радиочувствительность
Однако, оказалось, что наиболее чувствительным к действию ИИ является период пренатального (внутриутробного) развития.
Слайд 40Радиочувствительность млекопитающих на разных стадиях пренатального развития
пренатальной (внутриутробной) гибели,
гибели новорожденных (неонатальной
различных уродств (аномалий структурной природы) у новорожденных
L. Russell & W. Russell (1954) исследовали частоту
после облучения в дозе 2 Гр самок мышей на разных стадиях беременности.
Слайд 41
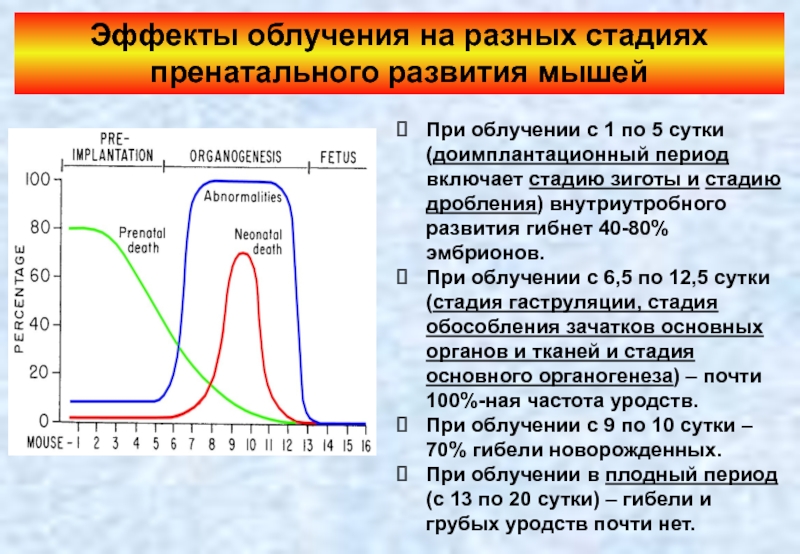
Эффекты облучения на разных стадиях пренатального развития мышей
При облучении с 1
При облучении с 6,5 по 12,5 сутки (стадия гаструляции, стадия обособления зачатков основных органов и тканей и стадия основного органогенеза) – почти 100%-ная частота уродств.
При облучении с 9 по 10 сутки – 70% гибели новорожденных.
При облучении в плодный период (с 13 по 20 сутки) – гибели и грубых уродств почти нет.
Слайд 42Уродства – аномалии структурного характера
Это могут быть аномалии:
ГОЛОВНОГО МОЗГА (включая отсутствие
СКЕЛЕТА (уменьшение или деформация черепа, врожденный вывих бедер, уменьшение и деформация хвоста, конечностей, пальцев и т.д.),
ГЛАЗ (включая полное отсутствие – анофтальмию, микрофтальмию, отсутствие хрусталика или сетчатки и др.),
ДРУГИХ ОРГАНОВ (врожденный порок сердца, деформация уха, лица, депигментация или гиперпигментация кожи, дегенерация гонад, отсутствие почки и т.д.).
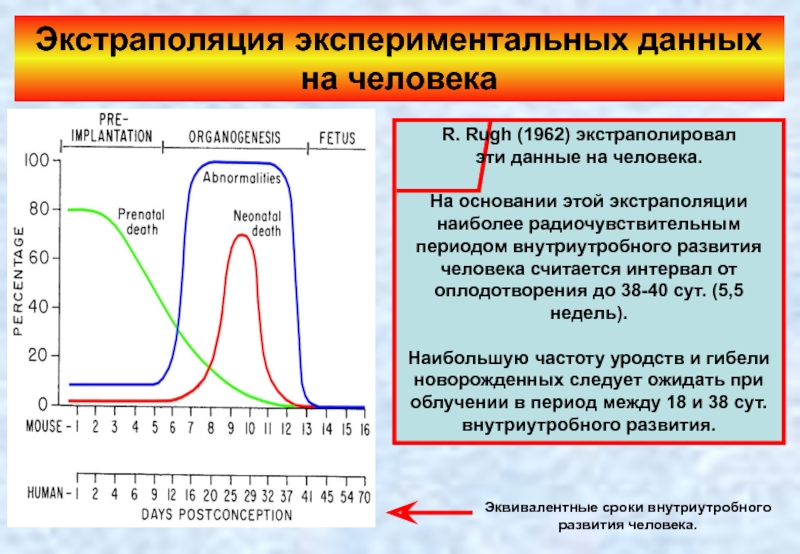
Слайд 43Экстраполяция экспериментальных данных на человека
R. Rugh (1962) экстраполировал
эти данные на
На основании этой экстраполяции наиболее радиочувствительным периодом внутриутробного развития человека считается интервал от оплодотворения до 38-40 сут. (5,5 недель).
Наибольшую частоту уродств и гибели новорожденных следует ожидать при облучении в период между 18 и 38 сут. внутриутробного развития.
Эквивалентные сроки внутриутробного развития человека.
Слайд 44Умственная отсталость людей, облученных в плодный период внутриутробного развития
Облучение в плодный
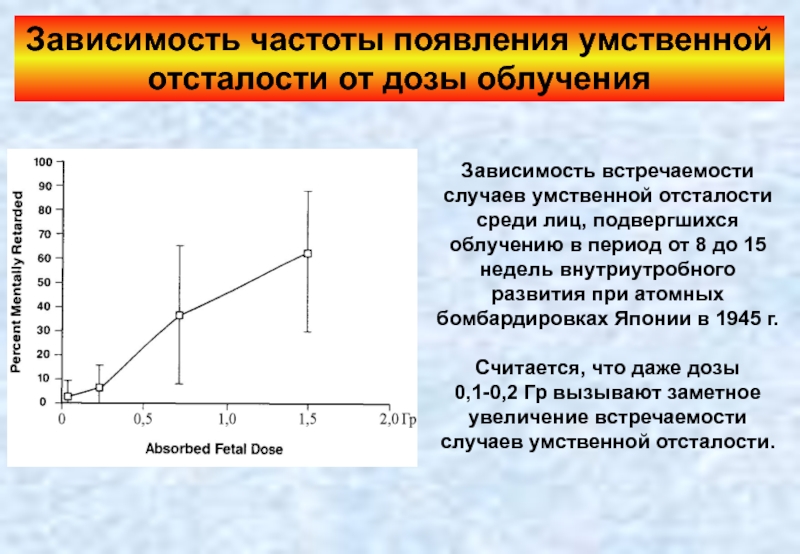
Слайд 45Зависимость частоты появления умственной отсталости от дозы облучения
Зависимость встречаемости случаев умственной
Считается, что даже дозы 0,1-0,2 Гр вызывают заметное увеличение встречаемости случаев умственной отсталости.
Слайд 46Увеличение риска возникновения рака у детей, облученных в период внутриутробного развития
Риск
При облучении даже в малых дозах (порядка 0,01 Гр) этот риск возрастает в 1,5-2 раза по сравнению со спонтанным уровнем.
Это данные по результатам применения облучения с медицинскими целями.
Слайд 473. Пол живого организма
Общей закономерности относительно половых различий в радиочувствительности живых
Даже разные линии животных одного вида (например, мышей) могут иметь противоположные половые различия в радиочувствительности: у одних линий более радиочувствительными являются самки, у других — самцы.
Но все же обычно самки более устойчивы к действию облучения.
Однако, обычно половые различия в радиочувствительности не превышают 10‑15%.
Слайд 484. Физиологическое состояние живого организма
Физиологическое состояние животных может вносить определенные изменения
Так, известны эксперименты, в которых при облучении животных, находящихся в состоянии естественной спячки (например, у сусликов), развитие лучевого поражения существенно замедлялось. Однако, после пробуждения лучевое поражение обычно (но не всегда) развивалось также, как и у бодрствующих животных, т.е. выживаемость не изменялась, увеличивалось лишь время жизни животных.
Известны также эксперименты, в которых животные, невпадающие в естественную спячку, но находящиеся в состоянии глубокого охлаждения во время облучения, проявляли более высокую постлучевую выживаемость по сравнению с неохлажденными во время облучения животными.
Таким образом, состояние обмена веществ в организме в момент облучения может в определенной степени влиять на развитие лучевого поражения: в большинстве случаев повышение интенсивности обмена веществ в момент облучения увеличивает радиочувствительность.
Слайд 495. Используемая пища
Развитие лучевого поражения в некоторой степени зависит и от
Наличие в пище витаминов, различных микроэлементов, повышающих общую резистентность организма, увеличивает и его радиоустойчивость.
Имеется большое количество сообщений о благоприятном влиянии витаминов Е, А, β-каротина и других, которое проявляется в частичном предотвращении лучевых эффектов и более быстром восстановлении.
Известны также эксперименты, в которых включение в состав стандартной для лабораторных животных диеты определенной растительной пищи или экстрактов некоторых растений приводило к увеличению выживаемости облучаемых животных.
В большинстве случаев для проявления благоприятного воздействия какого-либо пищевого компонента необходимо его длительное скармливание животным перед облучением — в течение не менее 1‑2 недель. Защитные эффекты пищевых компонентов, однако, не велики. Эффективность благоприятного воздействия пищевых компонентов при их скармливании после облучения обычно ниже, чем при скармливании до облучения.
Слайд 51Продолжительность жизни после облучения
Облучение ионизирующим излучением при достаточно высоких дозах вызывает
Впервые детальные исследования зависимости средней продолжительности жизни (СПЖ) погибших животных от дозы облучения были проведены в 1940-50-х годах Б. Раевским в экспериментах на мышах, подвергнутых общему однократному облучению рентгеновским излучением.
Слайд 52Борис Раевский (1893-1974)
Борис Раевский (Boris Rajewsky, 1893-1974) – известный немецкий ученый
Один из основателей биофизики и радиобиологии. Его работы создали научную основу радиационной безопасности и радиационной защиты.
Им осуществлены масштабные исследования концентрации радона в шахтах в районе г. Шнееберг (Саксония, 1936 г.), позволившие приблизиться к пониманию того, что заболевания шахтеров раком легких связаны с большими концентрациями радона в воздухе.
Исследовал изменение продолжительности жизни млекопитающих после облучения.
С 1934 г. по 1937 г. – директор Института физических основ медицины, с 1937 г. по 1965 г. – директор Института биофизики Общества Кайзера Вильгельма (с 1948 г. – Общества Макса Планка). Ректор (1949‑1951), проректор (1952‑1954) Франкфуртского университета им. И.В. Гёте.
Слайд 53Зависимость СПЖ мышей от дозы облучения
Зависимость СПЖ погибших мышей от дозы
Начальная часть кривой (участок I), охватывающая интервал доз примерно от 3-4 Гр до 10 Гр, соответствует изменению СПЖ погибших животных от 20 до 6 суток (необлученные мыши живут примерно 1,5 года).
В диапазоне доз от 10 Гр до 100 Гр (участок II) СПЖ составляет 3-5 суток (в среднем 3,5 суток) и мало зависит от величины дозы. Этот участок кривой получил название «плато Раевского», а сам эффект независимости СПЖ от величины дозы – «эффект Раевского».
При дозах выше 100 Гр (участок III) СПЖ опять становится зависимой от дозы облучения и снижается от 3 суток до нескольких часов.
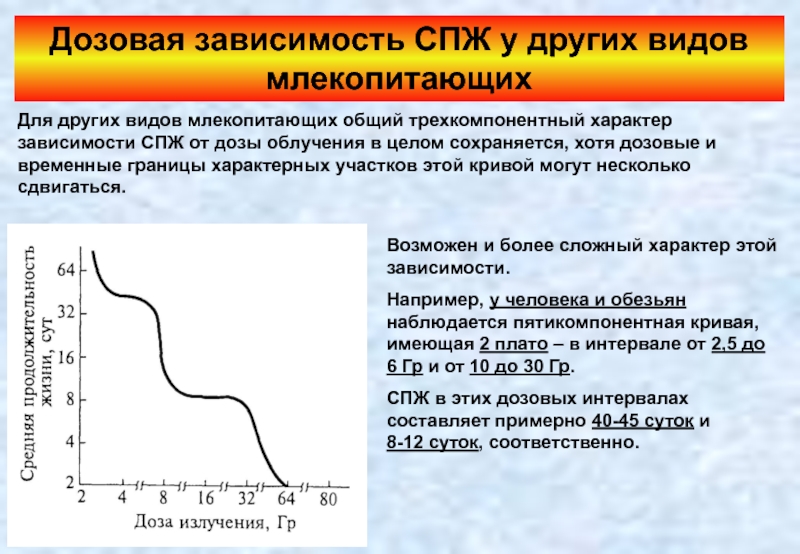
Слайд 54Дозовая зависимость СПЖ у других видов млекопитающих
Для других видов млекопитающих общий
Возможен и более сложный характер этой зависимости.
Например, у человека и обезьян наблюдается пятикомпонентная кривая, имеющая 2 плато – в интервале от 2,5 до 6 Гр и от 10 до 30 Гр.
СПЖ в этих дозовых интервалах составляет примерно 40-45 суток и
8-12 суток, соответственно.
Слайд 55«Смерть под лучем»
При дозах свыше 1000 Гр животные гибнут практически сразу после
«Смерть под лучем» происходит в результате денатурации жизненно важных макромолекул в клетках.
Слайд 56СПЖ в диапазоне доз 1-3 Гр
При дозах от 1 до 3
Однако, СПЖ у них все же понижается – ориентировочно на 2‑5% на каждый грэй по сравнению с нормой.
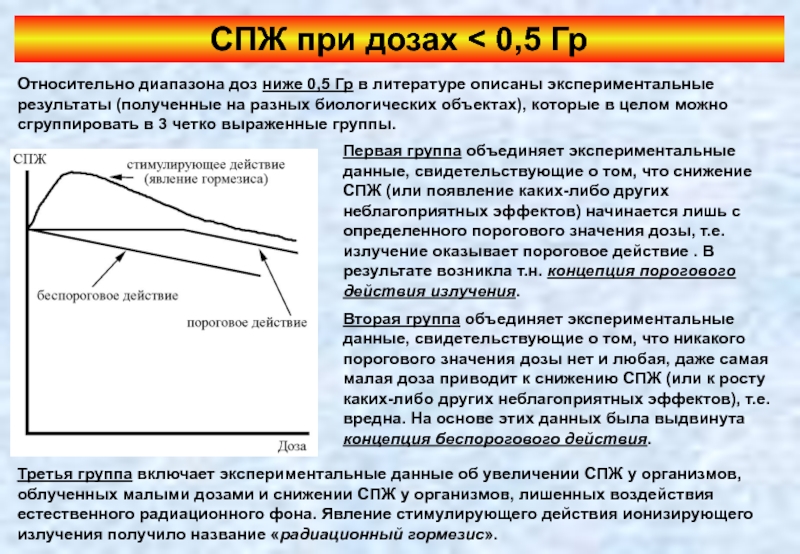
Слайд 57СПЖ при дозах < 0,5 Гр
Первая группа объединяет экспериментальные данные, свидетельствующие
Вторая группа объединяет экспериментальные данные, свидетельствующие о том, что никакого порогового значения дозы нет и любая, даже самая малая доза приводит к снижению СПЖ (или к росту каких-либо других неблагоприятных эффектов), т.е. вредна. На основе этих данных была выдвинута концепция беспорогового действия.
Относительно диапазона доз ниже 0,5 Гр в литературе описаны экспериментальные результаты (полученные на разных биологических объектах), которые в целом можно сгруппировать в 3 четко выраженные группы.
Третья группа включает экспериментальные данные об увеличении СПЖ у организмов, облученных малыми дозами и снижении СПЖ у организмов, лишенных воздействия естественного радиационного фона. Явление стимулирующего действия ионизирующего излучения получило название «радиационный гормезис».
Слайд 58Гормезис
Гормезис (от греч. hórmēsis – быстрое движение, стремление) — стимулирующее действие
Существование явления радиационного гормезиса подтверждено в разных лабораториях и на различных биологических объектах (на позвоночных, насекомых, простейших, растениях).
Т.е. существование явления радиационного гормезиса сомнению не подлежит.
Однако, надо четко понимать, что далеко не всякие стимулирующие эффекты следует трактовать как благотворные.
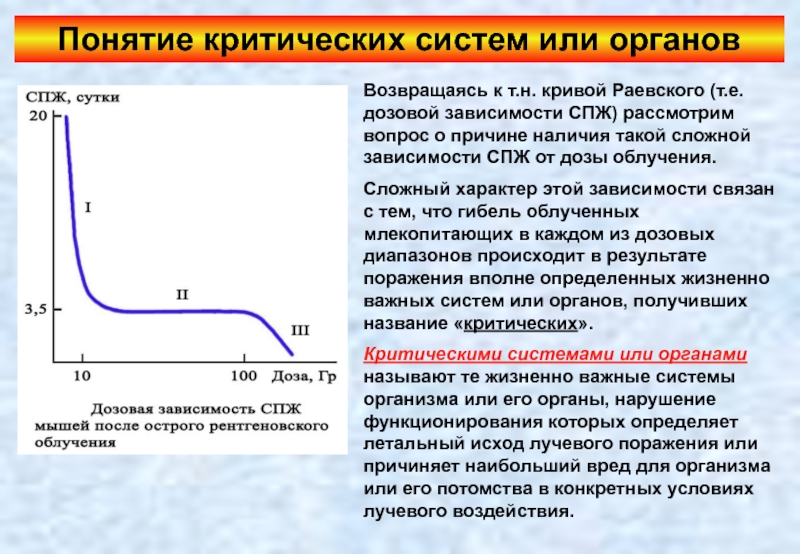
Слайд 59Понятие критических систем или органов
Возвращаясь к т.н. кривой Раевского (т.е. дозовой
Сложный характер этой зависимости связан с тем, что гибель облученных млекопитающих в каждом из дозовых диапазонов происходит в результате поражения вполне определенных жизненно важных систем или органов, получивших название «критических».
Критическими системами или органами называют те жизненно важные системы организма или его органы, нарушение функционирования которых определяет летальный исход лучевого поражения или причиняет наибольший вред для организма или его потомства в конкретных условиях лучевого воздействия.
Слайд 60Радиационные синдромы
В диапазоне доз от 3-4 до 10 Гр основной поражаемой в
В диапазоне доз от 10 до 100 Гр гибель происходит вследствие поражения слизистой кишечника – это т.н. «кишечный», или «желудочно-кишечный синдром».
При дозах, превышающих 100 Гр у млекопитающих развивается «церебральный», или «ЦНС-синдром», обусловленный поражением центральной нервной системы.
Слайд 61Рассмотрим более подробно наиболее часто встречаемые лучевые синдромы – костномозговой (кроветворный)
Слайд 62Кроветворение
Кроветворением (гемопоэзом) называют процесс образования, развития и созревания клеток крови:
эритроцитов
тромбоцитов (тромбоцитопоэз),
лейкоцитов (лейкоцитопоэз):
– гранулоцитов:
• нейтрофилов,
• эозинофилов,
• базофилов;
– агранулоцитов:
• лимфоцитов,
• моноцитов.
Слайд 63Система кроветворения
Система кроветворения включает органы, главной функцией которых является осуществление процесса
У млекопитающих к кроветворным органам относят:
1) костный мозг,
2) селезенку,
3) тимус (вилочковую, или зобную железу),
4) лимфатические узлы.
Основным кроветворным органом является костный мозг, обеспечивающий продуцирование всех клеток крови.
Слайд 64Костный мозг
У взрослого человека и крупных животных костный мозг составляет 4‑5%
Другая часть – желтый костный мозг, большую часть которого представляют жировые клетки, не осуществляет кроветворной функции. Однако, при увеличении потребности организма в клетках крови желтый костный мозг может замещаться красным костным мозгом.
Слайд 65Расположение костного мозга
Красный костный мозг расположен:
в губчатом веществе плоских костей
в эпифизах длинных трубчатых костей,
в телах позвонков.
Желтый костный мозг расположен:
в диафизах трубчатых костей (за исключением верхней трети бедра),
в плоских костях, где его содержится примерно столько же, сколько и красного костного мозга.
У новорожденных детей практически все костномозговые полости содержат красный костный мозг. У грызунов такое распределение костного мозга сохраняется в основном и у взрослых особей.
Слайд 66Кроветворные стволовые клетки – ключевой компонент кроветворения
Кроветворение (гемопоэз) – это сложный
Ключевым элементом кроветворения, являются кроветворные (гемопоэтические) стволовые клетки.
Кроветворные стволовые клетки представляют собой самоподдерживающуюся популяцию полипотентных клеток, являющихся предшественниками всех клеток крови.
Стволовые клетки способны как к симметричному делению (когда обе дочерние клетки остаются стволовыми и пополняют пул стволовых клеток), так и к несимметричному делению (когда одна из дочерних клеток остается стволовой, а другая начинает дифференцироваться).
Красный костный мозг на 10 тыс. клеток содержит ориентировочно лишь 1 гемопоэтическую стволовую клетку.
Слайд 67Правило (закон) Бергонье–Трибондо
Кроветворная ткань представляет собой популяцию активно пролиферирующих клеток –
Именно этот факт и определяет высокую чувствительность системы кроветворения к действию ионизирующих излучений.
Еще в 1906 г. французские исследователи Ж. Бергонье и Л. Трибондо сформулировали положение, известное сейчас как «правило (или закон) Бергонье–Трибондо», согласно которому поражающее действие ионизирующего излучения на клетки тем выше,
чем большей пролиферативной активностью обладают эти клетки,
чем длительнее период их деления (митоза) и
чем менее они дифференцированы.
Сейчас является твердо установленным, что процесс деления клеток является очень радиочувствительной клеточной функцией. Нарушение способности к делению приводит клетки к гибели.
Слайд 68Интерфазная и митотическая (репродуктивная) гибель клеток
В зависимости от того, в какой
Если гибель клеток происходит во время первого после облучения или нескольких последующих митозах, то такую гибель называют «митотической», или «репродуктивной».
Если гибель облученных клеток происходит еще до вступления в процесс митоза (т.е. деления), то такую гибель называют «интерфазной». Интерфазная гибель может наблюдаться как у делящихся, но находящихся вне фазы митоза клеток, так и у клеток, не обладающих способностью к делению.
Для большинства активно пролиферирующих клеток основной формой гибели является митотическая гибель, главная причина которой связана с радиационными повреждениями хромосом.
Митотическую гибель активно пролиферирующих клеток вызывают дозы порядка нескольких грей, тогда как для интерфазной гибели в большинстве случаев необходима гораздо более высокая доза облучения – порядка нескольких десятков грей.
Слайд 69Сколько делящихся клеток красного костного мозга гибнет после облучения?
Стволовые и малодифференцированные
Например, при облучении мышей в дозах 1‑2 Гр гибнет от 50 до 80% стволовых клеток, а при полулетальной дозе (ЛД50), составляющей для мышей примерно 5‑6 Гр, выживают только 2‑3 стволовые клетки из тысячи.
Гибель стволовых и малодифференцированных клеток (т.е. активно делящихся клеток) костного мозга является по форме, в основном, митотической и происходит уже в первые 1‑2 сут. после облучения.
Помимо гибели происходит также временная задержка (на несколько часов) деления даже тех клеток, которые в дальнейшем не гибнут.
Зрелые дифференцированные клетки костного мозга, а также клетки, находящиеся в состоянии созревания (т.е. уже не делящиеся), обладая значительно более высокой радиоустойчивостью, не погибают при дозах облучения порядка нескольких грей и продолжают поступать в периферическую кровь с обычной скоростью.
Слайд 70Опустошение кроветворных органов
В результате постлучевой гибели клеток общее количество клеток костного
При облучении мышей в дозе ЛД50 общее содержание клеток костного мозга в каком-либо костном объеме (например, в бедренной кости) снижается более чем в 10 раз на 4‑8 сутки, некоторое время сохраняется на этом минимальном уровне и в последующие сроки медленно восстанавливается у выживших животных.
Облучение вызывает опустошение и других кроветворных органов. Например, у мышей в результате такого опустошения масса селезенки снижается в 1,5‑2 раза.
В результате опустошения костного мозга и других кроветворных органов начинают происходить изменения в картине периферической крови.
Общая тенденция заключается в уменьшении количества всех типов клеток крови. При этом, однако, у различных форменных элементов крови это снижение осуществляется с разной скоростью и может быть осложнено временными подъемами в некоторые сроки после облучения.
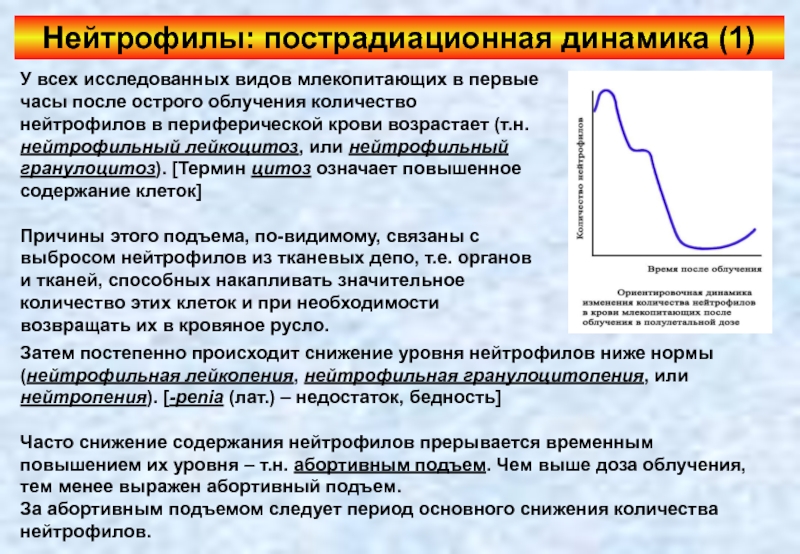
Слайд 71Нейтрофилы: пострадиационная динамика (1)
У всех исследованных видов млекопитающих в первые часы
Причины этого подъема, по-видимому, связаны с выбросом нейтрофилов из тканевых депо, т.е. органов и тканей, способных накапливать значительное количество этих клеток и при необходимости возвращать их в кровяное русло.
Затем постепенно происходит снижение уровня нейтрофилов ниже нормы (нейтрофильная лейкопения, нейтрофильная гранулоцитопения, или нейтропения). [-penia (лат.) – недостаток, бедность]
Часто снижение содержания нейтрофилов прерывается временным повышением их уровня – т.н. абортивным подъем. Чем выше доза облучения, тем менее выражен абортивный подъем.
За абортивным подъемом следует период основного снижения количества нейтрофилов.
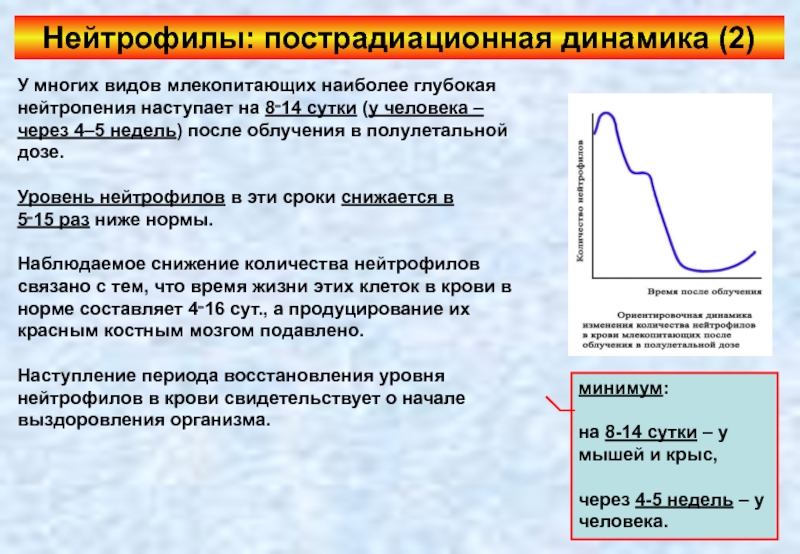
Слайд 72У многих видов млекопитающих наиболее глубокая нейтропения наступает на 8‑14 сутки
Уровень нейтрофилов в эти сроки снижается в 5‑15 раз ниже нормы.
Наблюдаемое снижение количества нейтрофилов связано с тем, что время жизни этих клеток в крови в норме составляет 4‑16 сут., а продуцирование их красным костным мозгом подавлено.
Наступление периода восстановления уровня нейтрофилов в крови свидетельствует о начале выздоровления организма.
Нейтрофилы: пострадиационная динамика (2)
минимум:
на 8-14 сутки – у мышей и крыс,
через 4-5 недель – у человека.
Слайд 73Глубокая нейтропения – основная причина гибели организма
Считают, что именно глубокая нейтропения
основной функцией нейтрофилов является защита организма от инфекции, что осуществляется посредством их фагоцитарной способности,
одной из причин гибели млекопитающих при облучении в диапазоне доз, соответствующих кроветворному синдрому, является развитие инфекции в различных органах и тканях,
сроки гибели организма при кроветворном синдроме хорошо совпадают со сроками развития наиболее глубокой нейтропении.
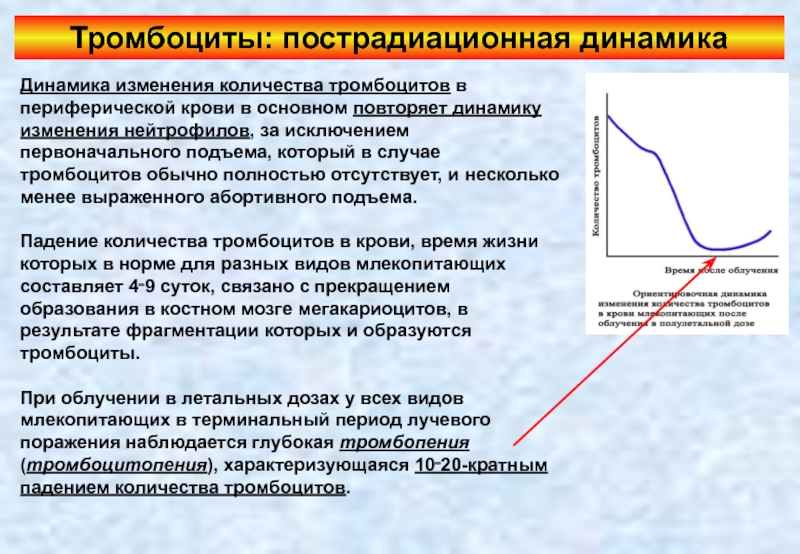
Слайд 74Тромбоциты: пострадиационная динамика
Динамика изменения количества тромбоцитов в периферической крови в основном
Падение количества тромбоцитов в крови, время жизни которых в норме для разных видов млекопитающих составляет 4‑9 суток, связано с прекращением образования в костном мозге мегакариоцитов, в результате фрагментации которых и образуются тромбоциты.
При облучении в летальных дозах у всех видов млекопитающих в терминальный период лучевого поражения наблюдается глубокая тромбопения (тромбоцитопения), характеризующаяся 10‑20-кратным падением количества тромбоцитов.
Слайд 75Важная роль тромбопении в лучевой гибели млекопитающих
Тромбоциты в норме играют важную
в системе свертывания крови,
в обеспечении прочности капилляров.
Глубокое понижение количества тромбоцитов хорошо коррелирует по времени с развитием лучевого геморрагического синдрома, т.е. кровотечениями в разных органах и тканях.
Поэтому считают, что тромбопения играет значительную роль в лучевом нарушении прочности капилляров и в возникновении кровотечений, что способствует проникновению бактерий в ткани и наоборот – из очагов воспаления в кровь и, таким образом, к развитию инфекции в различных органах и тканях и гибели организма.
Слайд 76Лимфоциты: пострадиационная динамика
Наиболее чувствительными к действию ИИ клетками крови являются лимфоциты.
При
В норме время жизни лимфоцитов в крови колеблется от нескольких дней до нескольких месяцев (или даже нескольких лет). Поэтому такая быстрая реакция лимфоцитов крови на облучение связана не с нарушением их продуцирования кроветворными органами, а с их непосредственной высокой радиочувствительностью (несмотря на то, что они являются зрелыми клетками).
Таким образом, лимфоциты, интерфазная гибель которых происходит при относительно низких дозах облучения, являются одним из исключений из правила Бергонье–Трибондо.
Постепенное восстановление числа лимфоцитов в крови начинается уже через 2‑10 дней после облучения. Считают, что лимфопения не играет существенной роль в гибели млекопитающих, т.к. количество лимфоцитов в крови в период гибели животных уже заметно восстанавливается.
Слайд 77Эритроциты: пострадиационная динамика
Содержание эритроцитов в периферической крови млекопитающих после облучения даже
В целом снижение содержания эритроцитов в крови происходит со скоростью примерно 1% в сутки.
Медленный характер снижения содержания эритроцитов связан с относительно высокой продолжительностью их жизни в крови – в норме у многих млекопитающих она составляет примерно 100 сут. (у человека 120-130 сут.).
После острого облучения анемия (т.е. состояние, при котором в крови снижено общее содержание гемоглобина, обычно при одновременном уменьшении общего числа функционально полноценных эритроцитов) к моменту гибели организма не успевает развиться до тяжелой формы (50%-ное и более глубокое снижение содержания гемоглобина) и, следовательно, не является причиной гибели.
Однако, при действии хронического облучения тяжелая анемия может развиться и стать причиной гибели организма.
Слайд 78Основные причины гибели при кроветворном синдроме
Итак, при костномозговом синдроме основными непосредственными
Инфекция и кровоизлияния затрагивают практически каждый орган.
В результате этого гибель организма при костномозговом синдроме связана с обширным повреждением многих органов.
Слайд 80Кишечник
Кишечником называется часть пищеварительного тракта, начинающаяся после желудка и заканчивающаяся заднепроходным
Кишечник включает
тонкую кишку,
толстую кишку,
прямую кишку.
Наиболее радиочувствительным отделом кишечника является тонкая кишка.
Нарушение функционирования тонкой кишки играет исключительно важную роль в радиационном поражении.
Тонкая кишка начинается от желудка и впадает в толстую кишку. Общая ее длина у человека в среднем составляет 5‑7 м. Основная функция тонкой кишки – переваривание и всасывание пищи.
Слайд 81Структура тонкой кишки
В тонкой кишке различают 3 переходящие друг в друга
расположенную сразу после желудка двенадцатиперстную кишку,
тощую кишку,
подвздошную кишку.
Структура этих 3 отделов тонкой кишки, хотя и имеет некоторые различия, в основном одинакова. В поперечном разрезе стенка тонкой кишки состоит из
слизистой оболочки, или просто слизистой (это самая внутренняя оболочка),
подслизистой основы,
мышечной оболочки (это самая внешняя оболочка).
В функциональном отношении основной оболочкой тонкой кишки является слизистая.
Слайд 82Слизистая оболочка тонкой кишки
Для увеличения всасывающей поверхности в слизистой имеются
круговые
кишечные ворсинки и крипты,
микроворсинки.
Круговые складки расположены перпендикулярно к оси кишки и образованы как слизистой, так и подслизистой основой.
Слайд 83Кишечные ворсинки и крипты
Кишечные ворсинки представляют собой пальцевидные выпячивания слизистой, покрытые
У основания ворсинок расположены т.н. кишечные крипты (другое название – Либеркюновы железы), которые представляют собой трубчатые углубления в слизистой, выстланные эпителием.
На дне крипт находятся:
стволовые клетки, предназначенные для восполнения эпителиальных клеток крипт и ворсинок,
железистые клетки, продуцирующие кишечные ферменты.
Слайд 85Всасывающая поверхность тонкой кишки
у человека 400‑500 м2
Наибольшее количество ворсинок находится в
В двенадцатиперстной и подвздошной кишке они короче (до 0,7 мм) и расположены реже (10‑30 ворсинок на 1 мм2).
Пул эпителиальных клеток включает несколько типов клеток, имеющих особенности в расположении и функциях. Большая часть эпителиальных клеток ворсинок представлена каемчатыми эпителиоцитами, клеточная мембрана которых имеет со стороны просвета кишки множество плотнорасположенных выростов – микроворсинок (высотой до 2 мкм, общее количество – 4000 на клетку).
Благодаря наличию складок слизистой, ворсинок и микроворсинок общая всасывающая поверхность тонкой кишки достигает у человека 400‑500 м2.
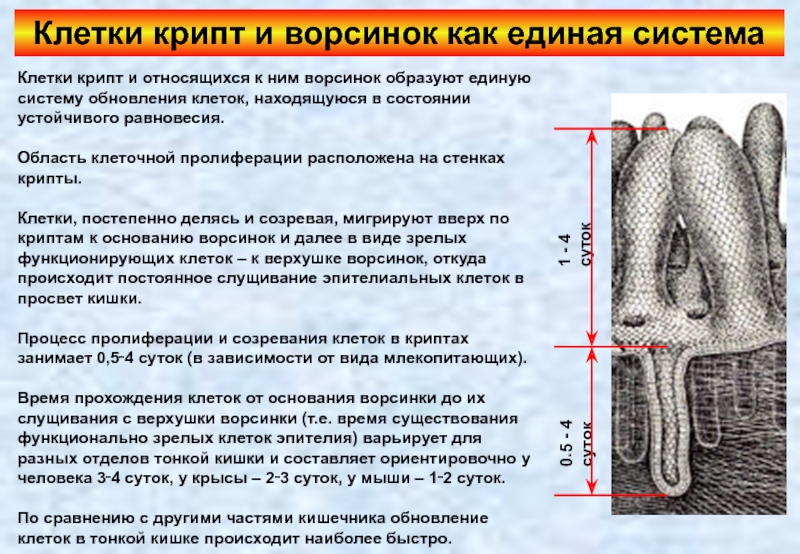
Слайд 86Клетки крипт и ворсинок как единая система
Клетки крипт и относящихся к
Область клеточной пролиферации расположена на стенках крипты.
Клетки, постепенно делясь и созревая, мигрируют вверх по криптам к основанию ворсинок и далее в виде зрелых функционирующих клеток – к верхушке ворсинок, откуда происходит постоянное слущивание эпителиальных клеток в просвет кишки.
Процесс пролиферации и созревания клеток в криптах занимает 0,5‑4 суток (в зависимости от вида млекопитающих).
Время прохождения клеток от основания ворсинки до их слущивания с верхушки ворсинки (т.е. время существования функционально зрелых клеток эпителия) варьирует для разных отделов тонкой кишки и составляет ориентировочно у человека 3‑4 суток, у крысы – 2‑3 суток, у мыши – 1‑2 суток.
По сравнению с другими частями кишечника обновление клеток в тонкой кишке происходит наиболее быстро.
0.5 - 4 суток
1 - 4 суток
Слайд 87Клетки крипт наиболее радиочувствительны
Таким образом, эпителиальные клетки ворсинок и крипт тонкой
Следовательно, в соответствии с правилом Бергонье–Трибондо, клетки слизистой тонкой кишки (а точнее – активно пролиферирующие клетки, расположенные в криптах) являются весьма радиочувствительными.
Под действием ИИ активно пролиферирующие клетки крипт погибают уже при дозах, которые гораздо менее губительны для эпителиальных клеток ворсинок (т.к. эти клетки уже не делятся).
Поэтому после облучения сначала оголяются крипты, а потом и ворсинки, клетки которых проходят обычный жизненный путь от основания до верхушки ворсинки и последующего слущивания в просвет кишки.
Происходит т.н. ОПУСТОШЕНИЕ слизистой.
Слайд 88Опустошение слизистой
После облучения в дозах, превышающих 10 Гр, практически полное опустошение крипт
Этим и объясняется столь короткая СПЖ (например, у мышей – 3,5 сут.) после облучения в дозах, превышающих 10 Гр.
Наиболее радиочувствительным отделом тонкой кишки является двенадцатиперстная кишка.
Слайд 89Главные последствия опустошения слизистой
Опустошение эпителия слизистой тонкой кишки приводит:
к резкому подавлению
к нарушению баланса жидкостей и электролитов,
к развитию инфекции вследствие поступления в кровь и затем в различные органы и ткани кишечных бактерий.
Эти последствия повреждения кишечника совместно с последствиями подавления кроветворения дают комплекс радиационных нарушений, получивший название «кишечный синдром» лучевого поражения.
Слайд 90Основные проявления кишечного синдрома
Для кишечного синдрома характерны следующие проявления:
анорексия (полная потеря
обильная диаррея (понос) в простой или кровавой (вследствие геморрагических явлений) форме,
рвота,
потеря веса,
непереваривание пищи,
глубокое обезвоживание,
уменьшение количества натрия в организме,
вялость и слабость.
Важными для летального исхода могут быть такие механизмы кишечного синдрома как 1) развитие инфекции и 2) нарушение баланса жидкостей и электролитов. Возмещение воды и электролитов, направленное на нормализацию водно-солевого баланса, значительно увеличивает продолжительность жизни. Однако, шансы на выживание при кишечном синдроме гораздо ниже, чем при кроветворном синдроме лучевого поражения.
Гибель большинства млекопитающих при кишечном синдроме наступает через 3‑5 суток (в среднем – 3,5 суток), у человека – через 8‑15 суток.
Слайд 91Снижение клеточности слизистой кишечника
при более низких дозах (не вызывающих развитие кишечного
Следует понимать, что снижение количества клеток эпителия слизистой тонкой кишки наблюдается и при более низких дозах облучения, не приводящих к развитию кишечного синдрома.
Уменьшение числа клеток слизистой можно наблюдать даже при дозе облучения 1‑2 Гр.
Однако, при таких относительно низких дозах облучения клеточность слизистой снижается не очень глубоко и быстро восстанавливается до нормального уровня.
Слайд 92Рассмотренные выше кроветворный и кишечный синдромы лучевого поражения дают яркий пример
Именно в таких тканях облучение вызывает катастрофическое снижение численности клеток, приводящее организм к гибели.
И наоборот, ткани, состоящие из непролиферирующих клеток (например, нервная ткань) являются гораздо более устойчивыми к действию облучения (т.е. радиорезистентными).
Пример этому – церебральный синдром лучевого поражения, обусловленный поражением центральной нервной системы и развивающийся лишь при огромных дозах облучения.
Слайд 94
Лучевая болезнь человека может принимать разнообразные клинические формы в зависимости от
Условия облучения характеризуются следующими основными факторами:
место расположения источника излучения по отношению к облучаемому организму (внешнее облучение или внутреннее облучение от инкорпорированных в организм радионуклидов);
вид ионизирующего излучения (гамма-, бета-, альфа-излучение и др.);
пространственное распределение дозы в организме (равномерное, неравномерное, тотальное, субтотальное, парциальное, местное);
временнóе распределение дозы (мощность дозы, кратковременное, фракционированное, пролонгированное, хроническое облучение);
доза облучения.
Многообразие форм лучевой болезни человека
Слайд 95острая лучевая болезнь (ОЛБ);
хроническая лучевая болезнь (ХЛБ).
Различают 2 основные варианта лучевой
Основные варианты лучевой болезни человека
Слайд 96Острой лучевой болезнью (ОЛБ) называют совокупность клинических синдромов, развивающихся при кратковременном
Острая лучевая болезнь человека
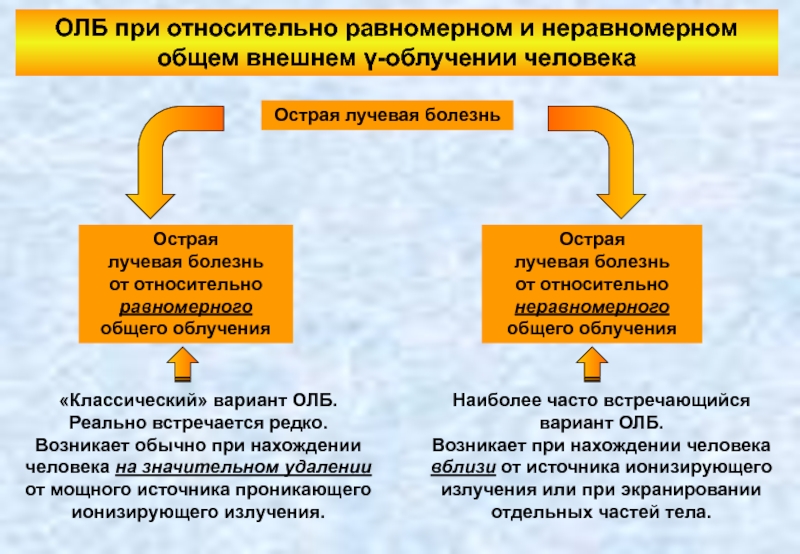
Слайд 97ОЛБ при относительно равномерном и неравномерном общем внешнем γ-облучении человека
Острая лучевая
Острая
лучевая болезнь
от относительно
равномерного общего облучения
Острая
лучевая болезнь
от относительно
неравномерного общего облучения
«Классический» вариант ОЛБ.
Реально встречается редко.
Возникает обычно при нахождении человека на значительном удалении от мощного источника проникающего ионизирующего излучения.
Наиболее часто встречающийся вариант ОЛБ.
Возникает при нахождении человека вблизи от источника ионизирующего излучения или при экранировании отдельных частей тела.
Слайд 98ОЛБ при относительно равномерном
общем облучении
В течении ОЛБ различают 3 периода:
Период формирования.
Период восстановления.
Период исходов и последствий.
Слайд 99Период формирования ОЛБ
Период формирования ОЛБ, в свою очередь, можно разделить на
фаза первичной реакции;
фаза кажущегося клинического благополучия (скрытая, или латентная, фаза);
фаза выраженных клинических проявлений (фаза разгара болезни);
фаза раннего (непосредственного) восстановления.
Фазность периода формирования наиболее четко проявляется при костномозговой форме и частично – при кишечной форме лучевой болезни.
Слайд 100Фаза первичной реакции
Показатели первичной реакции:
тошнота;
рвота (от однократной до многократной и неукротимой),
отсутствие аппетита;
иногда ощущение сухости и горечи во рту;
чувство тяжести в голове, головная боль, общая слабость, сонливость;
шокоподобное состояние;
падение артериального давления;
кратковременная потеря сознания;
понос;
повышенная температура;
в периферической крови в первые сутки после облучения наблюдается нейтрофильный лейкоцитоз и лимфопения.
Первичная реакция возникает в зависимости от дозы через несколько минут или через несколько часов после облучения. Длится от нескольких часов до 3-4 сут.
Слайд 101Фаза кажущегося клинического благополучия
Продолжительность этой фазы зависит от дозы:
может длиться 30
может вообще отсутствовать (при дозах более 10 Гр).
Термин «кажущееся клиническое благополучие» применяется в данном случае из-за отсутствия клинически видимых признаков болезни (включая улучшение самочувствия больного), хотя целый ряд клинических признаков наблюдается все же и в этой фазе, например:
в ранние сроки латентной фазы наблюдается лимфопения;
в средние или поздние сроки латентной фазы наблюдаются:
орофарингеальный синдром (гиперемия и эрозия слизистых рта и глотки),
выпадение волос (при облучении в дозах не менее 4 Гр);
тромбоцитопения и нейтрофильная лейкопения;
подавление ранних стадий сперматогенеза и т.д.
Слайд 102Фаза выраженных клинических проявлений
В зависимости от дозы облучения может наступать либо
Для этой фазы наиболее типичны инфекционные осложнения и кровотечения, протекающие на фоне глубокой нейтрофильной лейкопении и тромбоцитопении.
При более высоких дозах – глубокие кишечные нарушения (энтерит, парез, непроходимость), расстройства центральной регуляции кровообращения, отек мозга.
Слайд 103Фаза раннего восстановления
Фаза раннего восстановления начинается с 45-50 суток после облучения.
Показателями
Продолжительность фазы раннего восстановления
составляет 2-2,5 мес.
К концу 3-го месяца от начала заболевания самочувствие больных становится, как правило, вполне удовлетворительным.
Рост волос возобновляется к 4-му месяцу.
Сперматогенез восстанавливается к 4-6 месяцу.
нормализация температуры тела;
улучшение самочувствия;
улучшение аппетита;
начало восстановление массы тела;
прекращение кровоточивости;
постепенная нормализация морфологических показателей крови (числа лейкоцитов, тромбоцитов, эритроцитов) – у выживших она начинается еще в фазе разгара болезни.
Слайд 104Классификация ОЛБ по степени тяжести
В зависимости от поглощенной дозы излучения различают
1-2 Гр: ОЛБ I степени (легкой степени),
2‑4 Гр: ОЛБ II степени (средней степени),
4‑6 Гр: ОЛБ III степени (тяжелой степени),
свыше 6 Гр: ОЛБ IV степени (крайне тяжелой степени).
Слайд 110Острые лучевые поражения у человека
при неравномерном облучении
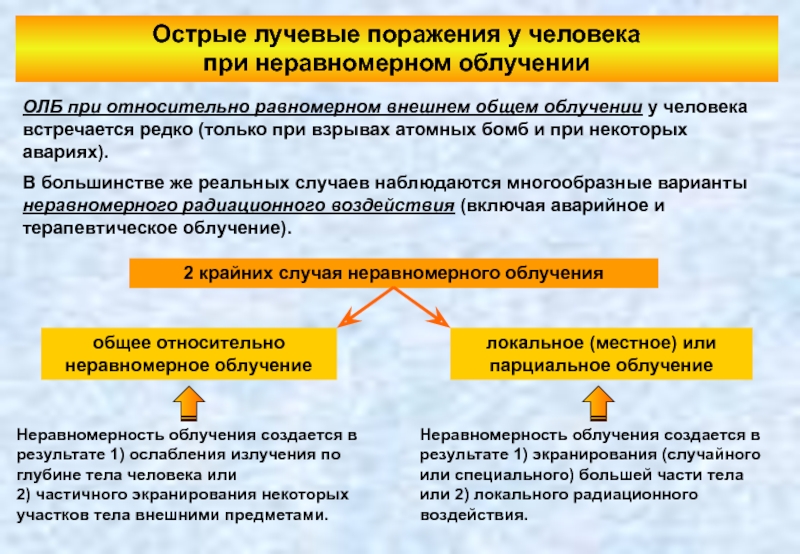
ОЛБ при относительно равномерном
В большинстве же реальных случаев наблюдаются многообразные варианты неравномерного радиационного воздействия (включая аварийное и терапевтическое облучение).
2 крайних случая неравномерного облучения
общее относительно неравномерное облучение
локальное (местное) или парциальное облучение
Неравномерность облучения создается в результате 1) ослабления излучения по глубине тела человека или
2) частичного экранирования некоторых участков тела внешними предметами.
Неравномерность облучения создается в результате 1) экранирования (случайного или специального) большей части тела или 2) локального радиационного воздействия.
Слайд 111Острые лучевые поражения у человека
при локальном (местном) или парциальном облучении
Локальное или
Жизненно важные системы организма или его органы, нарушение функционирования которых причиняет наибольший вред для организма или его потомства в конкретных условиях лучевого воздействия, получили название "КРИТИЧЕСКИХ".
Поэтому при локальном или парциальном облучении критическими могут стать не органы кроветворения или слизистая кишечника, которые являются критическими при общем облучении, а другие органы и ткани, нарушение функционирования которых причиняет наибольший вред в конкретных условиях лучевого воздействия.
Критическими могут быть самые различные органы и ткани, например, кожа, сердце, легкие, хрусталик глаза и т.д.
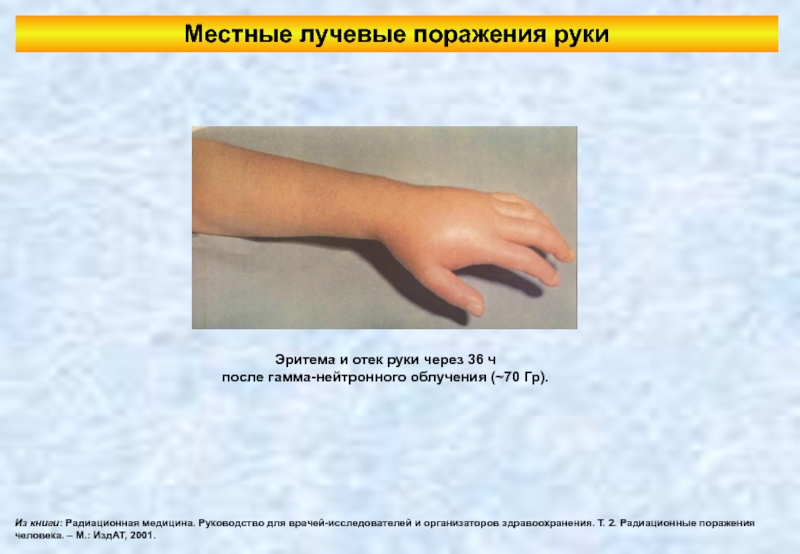
Слайд 112Местные лучевые поражения руки
Эритема и отек руки через 36 ч
после
Из книги: Радиационная медицина. Руководство для врачей-исследователей и организаторов здравоохранения. Т. 2. Радиационные поражения человека. – М.: ИздАТ, 2001.
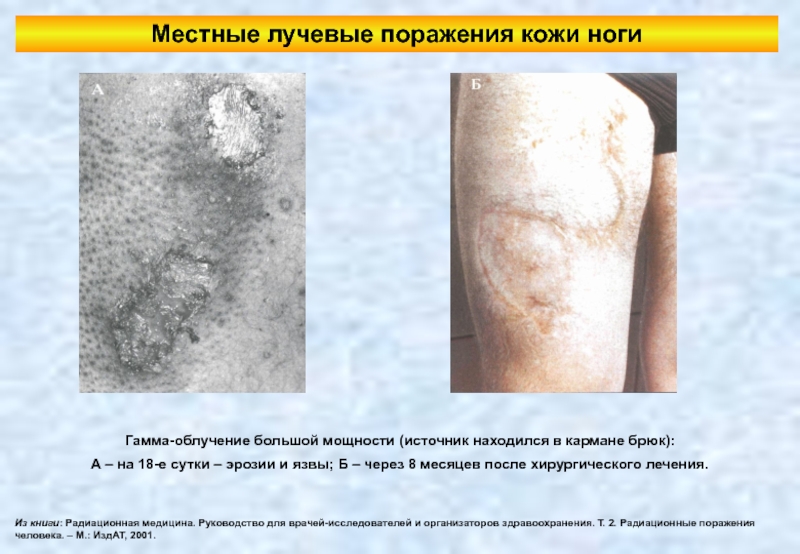
Слайд 113Местные лучевые поражения кожи ноги
Из книги: Радиационная медицина. Руководство для врачей-исследователей
Гамма-облучение большой мощности (источник находился в кармане брюк):
А – на 18-е сутки – эрозии и язвы; Б – через 8 месяцев после хирургического лечения.
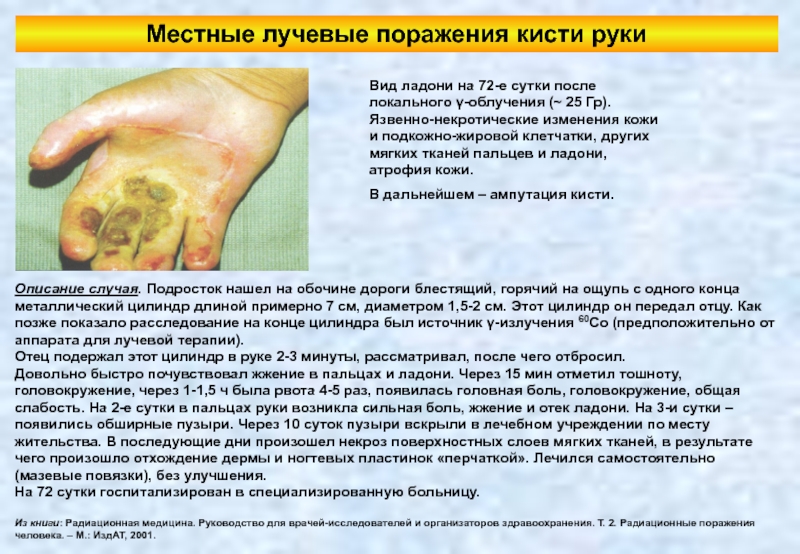
Слайд 114Местные лучевые поражения кисти руки
Вид ладони на 72-е сутки после локального
В дальнейшем – ампутация кисти.
Описание случая. Подросток нашел на обочине дороги блестящий, горячий на ощупь с одного конца металлический цилиндр длиной примерно 7 см, диаметром 1,5-2 см. Этот цилиндр он передал отцу. Как позже показало расследование на конце цилиндра был источник γ-излучения 60Co (предположительно от аппарата для лучевой терапии).
Отец подержал этот цилиндр в руке 2-3 минуты, рассматривал, после чего отбросил.
Довольно быстро почувствовал жжение в пальцах и ладони. Через 15 мин отметил тошноту, головокружение, через 1-1,5 ч была рвота 4-5 раз, появилась головная боль, головокружение, общая слабость. На 2-е сутки в пальцах руки возникла сильная боль, жжение и отек ладони. На 3-и сутки – появились обширные пузыри. Через 10 суток пузыри вскрыли в лечебном учреждении по месту жительства. В последующие дни произошел некроз поверхностных слоев мягких тканей, в результате чего произошло отхождение дермы и ногтевых пластинок «перчаткой». Лечился самостоятельно (мазевые повязки), без улучшения.
На 72 сутки госпитализирован в специализированную больницу.
Из книги: Радиационная медицина. Руководство для врачей-исследователей и организаторов здравоохранения. Т. 2. Радиационные поражения человека. – М.: ИздАТ, 2001.
Слайд 115Местные лучевые поражения кожи и груди
Из книги: Радиационная медицина. Руководство для
Вид пораженной груди на 5-е сутки после облучения (> 100 Гр)
Лучевой некроз левой молочной железы – сухая гангрена (через 2 месяца)
Описание случая. Аварийная ситуация возникла при проведении радиотерапии (тормозное излучение с энергией 15 МэВ) после резекции левой молочной железы по поводу рака. Произошло неконтролируемое значительное увеличение мощности дозы. Локальная расчетная доза на левую грудь была значительно больше 100 Гр.
Слайд 116Местные лучевые поражения при облучении
половых желез
Облучение мужских половых желез вызывает
Однако, примерно до 3 Гр мужская стерильность носит обратимый характер (в течение нескольких месяцев, т.к. срок развития зрелых сперматозоидов составляет 10 недель) и лишь при дозах 3,5‑6 Гр возникает необратимая стерильность.
При облучении женских половых желез стерильность развивается начиная с 2,5‑6 Гр, но имеет исключительно необратимый характер.
Слайд 117Хронической лучевой болезнью (ХЛБ) называют клинический синдром, развивающийся при длительном воздействии
Сроки развития хронической лучевой болезни варьируют от 1 до 10 лет.
Хроническая лучевая болезнь (ХЛБ) человека. Определение
Слайд 118ХЛБ человека. Синдромы
Ведущим синдромом ХЛБ в периоде ее формирования является костномозговой
Наряду с костномозговым синдромом в периоде формирования ХЛБ характерными также являются изменения в нервной системе, проявляющиеся в нарушении нервно-сосудистой регуляции, головных болях, головокружениях, астеническом синдроме (повышенной утомляемости, общей слабости, сонливости), треморе пальцев и других.
Ведущими причинами смерти при ХЛБ являются злокачественные новообразования. Наиболее часто встречаются злокачественные опухоли кожи и костей, рак молочной и щитовидной железы, яичников, легких, а также лейкозы.
Слайд 119Отдаленные последствия облучения
Не надо путать ХЛБ и отдаленные последствия облучения.
Отдаленные последствия
К отдаленным последствиям облучения относятся следующие эффекты:
1). Сокращение продолжительности жизни.
2). Радационная катаракта.
3). Фиброз.
4). Возникновение злокачественных образований.
5). Наследственные заболевания и уродства, возникающие в потомстве облученных родителей.
Слайд 120Терапия острой лучевой болезни
Основное направление в терапии ОЛБ – это борьба
Поэтому первое, что следует предпринять – это оценить, хотя бы ориентировочно, дозу облучения, т.к. сложные терапевтические мероприятия может быть вообще не нужны, если доза весьма низкая, и, напротив, доза настолько высока, что никакая терапия не поможет.
Если полученная больным доза соответствует дозовому диапазону костно-мозговой формы ОЛБ или смешанной кроветворно-кишечной формы ОЛБ, то есть вполне определенная вероятность (либо весьма высокая, либо низкая) благоприятного исхода при осуществлении специализированной медицинской помощи.
Слайд 121Общие принципы терапии ОЛБ
Главная задача терапии ОЛБ – продлить период, в
Восстановление системы кроветворения и, соответственно, исход костно-мозговой формы ОЛБ в первую очередь зависит от количества сохранивших жизнеспособность кроветворных стволовых клеток.
Даже после общего облучения в дозе 10 Гр сохранившиеся в организме кроветворные стволовые клетки способны обеспечить восстановление кроветворения.
НАДО ТОЛЬКО ПОМОЧЬ ОРГАНИЗМУ ПРОДЕРЖАТЬСЯ довольно длительный промежуток времени.
Это время нужно для того, чтобы из малого числа оставшихся стволовых клеток образовался пул такого размера, который позволит части стволовых клеток начать дифференцировку с образованием клеток-предшественников различных ростков кроветворения, которые, в свою очередь, дадут начало клеткам сначала пролиферирующего, затем созревающего и, наконец, функционального пула.
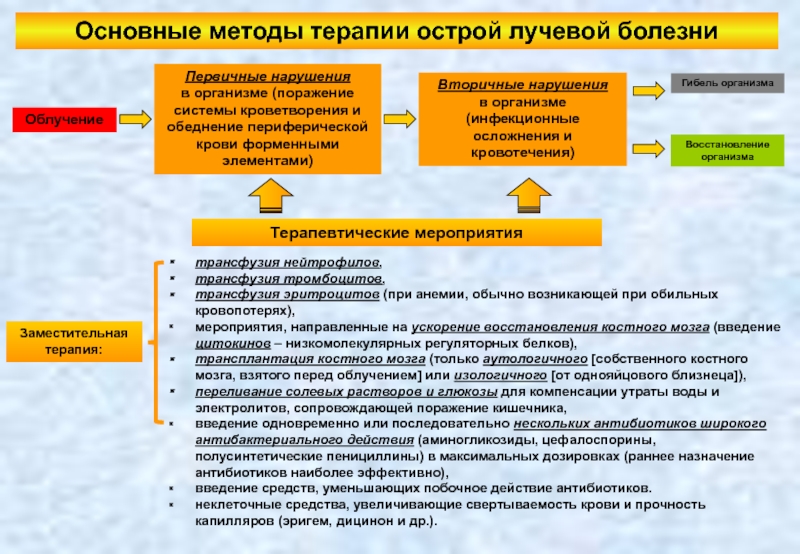
Слайд 122Основные методы терапии острой лучевой болезни
Облучение
Первичные нарушения
в организме (поражение системы
Вторичные нарушения
в организме (инфекционные осложнения и кровотечения)
Гибель организма
Заместительная терапия:
трансфузия нейтрофилов,
трансфузия тромбоцитов,
трансфузия эритроцитов (при анемии, обычно возникающей при обильных кровопотерях),
мероприятия, направленные на ускорение восстановления костного мозга (введение цитокинов – низкомолекулярных регуляторных белков),
трансплантация костного мозга (только аутологичного [собственного костного мозга, взятого перед облучением] или изологичного [от однояйцового близнеца]),
переливание солевых растворов и глюкозы для компенсации утраты воды и электролитов, сопровождающей поражение кишечника,
введение одновременно или последовательно нескольких антибиотиков широкого антибактериального действия (аминогликозиды, цефалоспорины, полусинтетические пенициллины) в максимальных дозировках (раннее назначение антибиотиков наиболее эффективно),
введение средств, уменьшающих побочное действие антибиотиков.
неклеточные средства, увеличивающие свертываемость крови и прочность капилляров (эригем, дицинон и др.).
Терапевтические мероприятия
Восстановление организма