- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Регистрация и лицензирование в сфере обращения лекарственных средств для ветеринарного применения презентация
Содержание
- 1. Регистрация и лицензирование в сфере обращения лекарственных средств для ветеринарного применения
- 2. Основные понятия регистрационное удостоверение ЛП - документ,
- 3. Подача и рассмотрение заявления о государственной
- 4. В заявлении о государственной регистрации ЛП
- 5. необходимость применения ускоренной процедуры экспертизы лекарственных средств
- 6. Референтный лекарственный препарат - лекарственный препарат, который
- 7. На экспертизу различных лекарственных форм одного и
- 8. Экспертиза качества ЛС и экспертиза отношения ожидаемой
- 9. Решение о государственной регистрации В срок,
- 10. Регистрационное удостоверение лекарственного препарата с указанием лекарственных
- 11. В соответствии с изменениями Федерального закона от
- 12. Регистрация лекарственных препаратов за проведение экспертизы качества
- 13. за включение фармацевтической субстанции, не используемой при
- 14. Заявления о подтверждении государственной регистрации лекарственных препаратов
- 15. Приказ Минпромторга России от 14.06.2013 №
- 16. Основные требования правил организации производства и контроля
- 17. Должны быть обеспечены необходимые условия для выполнения
- 18. Персонал должен быть обучен надлежащему выполнению процедур;
- 19. должна быть организована система отзыва любой серии
- 20. Декларация о соответствии - документ, удостоверяющий соответствие
- 21. Подтверждение соответствия на территории РФ может носить
- 22. Постановление Правительства от 01.12.2009 № 892 «Об
- 23. ЕДИНЫЙ ПЕРЕЧЕНЬ ПРОДУКЦИИ, ПОДТВЕРЖДЕНИЕ СООТВЕТСТВИЯ КОТОРОЙ ОСУЩЕСТВЛЯЕТСЯ
- 24. 9386 Бактериофаги (включая для ветеринарии) 9387 Аллергены
- 25. Федеральный закон № 184-ФЗ «О техническом регулировании»
- 26. Декларирование соответствия При декларировании соответствия заявитель на
- 27. Декларация о соответствии должна содержать наименование и
- 28. Оформленная заявителем декларация о соответствии подлежит регистрации
- 29. Сертификат соответствия включает в себя наименование и
- 30. Оборот дезинфицирующих средств В соответствии Федеральным законом
- 31. Правовые основы лицензирования Федеральный закон РФ от
- 32. В соответствии с Постановлением Правительства РФ от
- 33. Лицензирующий орган Лицензирующие органы - уполномоченные федеральные
- 34. Центральный аппарат Федеральной службы по ветеринарному и
- 35. Территориальные управления Федеральной службы по ветеринарному и
- 36. Соискатель лицензии - юридическое лицо или индивидуальный
- 37. наличие у соискателя лицензии работников, заключивших с
- 38. Для получения лицензии соискатель лицензии представляет по
- 39. ИНН, данные документа о постановке соискателя лицензии
- 40. К заявлению прилагаются копии документов, подтверждающих наличие
- 41. Заявление о предоставлении лицензии и прилагаемые к
- 42. Порядок лицензирования В течение трех рабочих дней
- 43. Переоформление лицензии в случаях реорганизации юридического лица
- 44. Действие лицензии приостанавливается лицензирующим органом в следующих
- 45. Действие лицензии прекращается представление лицензиатом в лицензирующий
- 46. Лицензирование деятельности, связанной с оборотом НС, ПВ
- 47. В соответствии с приказом Минсельхоза РФ и
- 48. Кетамин – ПВ Списка II Альфентанил –
- 49. К работе с НС, ПВ и прекурсорами
- 50. Допуск лиц к работе с НС и
- 51. Хранение НС, ПВ и прекурсоров К 1-й
- 52. Ко 2-й категории относятся помещения ветеринарных аптечных
- 53. Постановление Правительства РФ от 06.07.2012 №
- 54. Лицензионными требованиями, предъявляемыми к соискателю лицензии на
- 55. наличие промышленных регламентов, утвержденных руководителем производителя лекарственных
- 56. Проверки соблюдения лицензионных требований и условий Федеральный
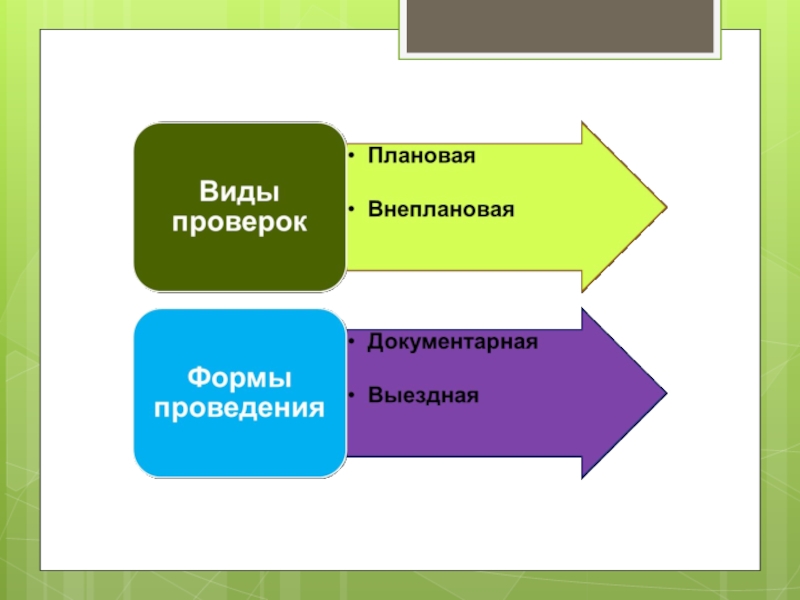
- 58. Плановая проверка Предметом проверки является соблюдение юридическим
- 59. Плановые проверки Плановые проверки проводятся не чаще
- 60. Основанием для включения плановой проверки в ежегодный
- 61. Внеплановая проверка Предметом проверки является соблюдение юридическим
- 62. Основанием для проведения внеплановой проверки является истечение
- 63. Плановая и внеплановая проверки проводятся в форме документарной и выездной проверок
- 64. Документарная проверка Предметом проверки являются сведения, содержащиеся
- 65. Выездная проверка Предметом проверки являются содержащиеся в
- 66. Выездная проверка проводится в случае, если при
- 67. Органы государственного контроля (надзора), органы муниципального контроля
- 68. Лицензирование фармацевтической деятельности и производства лекарственных средств
- 69. Приказ Министерства сельского хозяйства РФ от 15
Слайд 1Регистрация и лицензирование в сфере обращения лекарственных средств для ветеринарного применения
Лектор
Слайд 2Основные понятия
регистрационное удостоверение ЛП - документ, подтверждающий факт государственной регистрации лекарственного
регистрационный номер - кодовое обозначение, присвоенное ЛП при его государственной регистрации
держатель или владелец регистрационного удостоверения лекарственного препарата - разработчик ЛС, производитель ЛС или иное юридическое лицо, обладающее правом владения регистрационным удостоверением, которые несут ответственность за качество, эффективность и безопасность лекарственного препарата
Слайд 3 Подача и рассмотрение заявления о государственной регистрации ЛП для ветеринарного
Для государственной регистрации лекарственного препарата для ветеринарного применения разработчик представляет в уполномоченный федеральный орган исполнительной власти в электронной форме или на бумажном носителе заявление о государственной регистрации лекарственного препарата для ветеринарного применения, а также необходимые документы, из которых формируется регистрационное досье на лекарственный препарат для ветеринарного применения.
Слайд 4 В заявлении о государственной регистрации ЛП указывается
наименование и адрес заявителя,
наименование ЛП для ветеринарного применения (МНН, или группировочное, или химическое и ТН);
перечень действующих и вспомогательных веществ, входящих в состав ЛП, с указанием количества каждого из них;
лекарственная форма, дозировка, способы введения и применения, срок годности ЛП для ветеринарного применения;
фармакотерапевтическая группа;
Слайд 5необходимость применения ускоренной процедуры экспертизы лекарственных средств в целях государственной регистрации
копии документов, подтверждающих уплату государственной пошлины:
за проведение экспертизы качества лекарственного средства и экспертизы отношения ожидаемой пользы к возможному риску применения лекарственного препарата для ветеринарного применения при его государственной регистрации;
за выдачу регистрационного удостоверения лекарственного препарата;
наличие согласия, если с момента регистрации референтного лекарственного препарата для ветеринарного применения прошло менее чем шесть лет.
Слайд 6Референтный лекарственный препарат - лекарственный препарат, который впервые зарегистрирован в РФ,
Слайд 7На экспертизу различных лекарственных форм одного и того же лекарственного препарата
При условии одновременной подачи на экспертизу одной лекарственной формы с различными дозировкой, концентрацией, объемом заявитель представляет одно заявление и регистрационное досье с приложением макетов упаковок на каждую дозировку, каждую концентрацию, каждый объем и каждое количество доз в упаковке.
Слайд 8Экспертиза качества ЛС и экспертиза отношения ожидаемой пользы к возможному риску
Экспертиза, составление комиссиями экспертов заключений и направление таких заключений в уполномоченный федеральный орган исполнительной власти осуществляются в срок, не превышающий 110 рабочих дней со дня получения экспертным учреждением задания уполномоченного федерального органа исполнительной власти
В течение пятнадцати рабочих дней со дня получения решения уполномоченного федерального органа исполнительной власти о проведении экспертиз заявитель представляет в экспертное учреждение образцы ЛП для ветеринарного применения, а также образец фармацевтической субстанции в количествах, необходимых для воспроизведения методов контроля качества
При получении образцов лекарственного препарата и фармацевтической субстанции экспертное учреждение выдает заявителю документ, подтверждающий получение указанных образцов, и в срок, не превышающий трех рабочих дней, уведомляет в письменной форме об этом уполномоченный федеральный орган исполнительной власти
Федеральный закон № 61-ФЗ «Об обращении лекарственных средств»
Слайд 9Решение о государственной регистрации
В срок, не превышающий десяти рабочих дней
Слайд 10Регистрационное удостоверение лекарственного препарата с указанием лекарственных форм и дозировок выдается
Подтверждение государственной регистрации лекарственного препарата осуществляется при выдаче бессрочного регистрационного удостоверения лекарственного препарата в срок, не превышающий девяноста рабочих дней со дня получения соответствующим уполномоченным федеральным органом исполнительной власти заявления о подтверждении государственной регистрации лекарственного препарата для ветеринарного применения.
Слайд 11В соответствии с изменениями Федерального закона от 12.04.2010 № 61-ФЗ «Об
С целью указания в удостоверении указанной информации, необходимо направить в Россельхознадзор информацию о держателе или владельце удостоверения лекарственного препарата, заверенную разработчиком препарата. Кроме того, необходимо представить инструкции по применению и макеты этикеток на препараты.
Слайд 12Регистрация лекарственных препаратов
за проведение экспертизы качества при государственной регистрации - 215
за подтверждение государственной регистрации лекарственного препарата - 70 000 рублей;
за внесение изменений в инструкцию по применению лекарственного препарата - 70 000 рублей (с экспертизой);
за внесение в документы, содержащиеся в регистрационном досье на зарегистрированный лекарственный препарат для ветеринарного применения, изменений, не требующих проведения экспертизы лекарственного средства для ветеринарного применения - 2 600 рублей;
Слайд 13за включение фармацевтической субстанции, не используемой при производстве лекарственных препаратов, в
за выдачу регистрационного удостоверения лекарственного препарата - 10 000 рублей;
за внесение в документы на фармацевтическую субстанцию, произведенную для реализации и включенную в государственный реестр лекарственных средств, изменений, требующих проведения экспертизы лекарственных средств, - 75 000 рублей;
за внесение в документы на фармацевтическую субстанцию, произведенную для реализации и включенную в государственный реестр лекарственных средств, изменений, не требующих проведения экспертизы лекарственных средств, - 5 000 рублей;
за выдачу дубликата регистрационного удостоверения лекарственного препарата - 2 000 рублей.
Слайд 14Заявления о подтверждении государственной регистрации лекарственных препаратов для ветеринарного применения могут
В соответствии с п. 3 ст. 32 Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» при неподтверждении государственной регистрации лекарственного препарата по истечении срока действия регистрационного удостоверения, выданного на пять лет, Россельхознадзор принимает решение об отмене государственной регистрации ЛП и исключении ЛП из государственного реестра ЛС.
Слайд 15Приказ Минпромторга России от 14.06.2013
№ 916
«Об утверждении Правил организации
устанавливает требования к организации производства и контроля качества лекарственных средств для медицинского применения и ветеринарного применения.
Слайд 16Основные требования правил организации производства и контроля качества лекарственных средств
Все производственные
Критические стадии производственного процесса и существенные изменения процесса должны пройти валидацию;
Валидация - документально оформленные действия, дающие высокую степень уверенности в том, что методика, процесс, оборудование, материал, операция или система соответствуют заданным требованиям и их использование будет постоянно приводить к результатам, соответствующим заранее установленным критериям приемлемости
Слайд 17Должны быть обеспечены необходимые условия для выполнения требований Правил, включая наличие:
надлежащим
соответствующих помещений и площадей;
соответствующих оборудования и обслуживания;
соответствующих исходного сырья и упаковочных материалов;
утвержденных процедур и инструкций в соответствии с фармацевтической системой качества;
соответствующих условий хранения и транспортировки;
Инструкции и процедуры должны быть конкретными, изложены в письменной форме ясно и однозначно
Слайд 18Персонал должен быть обучен надлежащему выполнению процедур;
В процессе производства должны составляться
Отклонения должны быть оформлены документально и расследованы с целью определения причины отклонения и осуществления соответствующих корректирующих и предупреждающих действий;
Досье на серию, включая документацию по реализации, должно позволять отслеживать полную историю производства серии, составляться в понятной форме и храниться в доступной форме;
Слайд 19должна быть организована система отзыва любой серии лекарственных средств из обращения;
должны
Слайд 20Декларация о соответствии - документ, удостоверяющий соответствие выпускаемой в обращение продукции
Сертификат соответствия - документ, удостоверяющий соответствие объекта требованиям технических регламентов, положениям стандартов, сводов правил или условиям договоров
Федеральный закон № 184-ФЗ от 27.12.2002 «О техническом регулировании»
Слайд 21Подтверждение соответствия на территории РФ может носить добровольный или обязательный характер
Добровольное
Обязательное подтверждение соответствия осуществляется в формах:
принятия декларации о соответствии;
обязательной сертификации.
Федеральный закон № 184-ФЗ от 27.12.2002 «О техническом регулировании»
Слайд 22Постановление Правительства от 01.12.2009 № 892 «Об утверждении единого перечня продукции,
ЕДИНЫЙ ПЕРЕЧЕНЬ ПРОДУКЦИИ, ПОДЛЕЖАЩЕЙ ОБЯЗАТЕЛЬНОЙ СЕРТИФИКАЦИИ
9384 Вакцины и анатоксины, применяемые в ветеринарии
Сертификаты соответствия на продукцию, выданные до дня вступления в силу данного Постановления, считаются действительными до окончания срока, установленного в них, в пределах срока годности или срока службы продукции, установленных в соответствии с законодательством РФ.
Слайд 23ЕДИНЫЙ ПЕРЕЧЕНЬ
ПРОДУКЦИИ, ПОДТВЕРЖДЕНИЕ СООТВЕТСТВИЯ КОТОРОЙ
ОСУЩЕСТВЛЯЕТСЯ В ФОРМЕ ПРИНЯТИЯ
ДЕКЛАРАЦИИ О СООТВЕТСТВИИ
9300
Препараты и средства химико-фармацевтические для ветеринарии
9350 Витамины, коферменты, ферменты, аминокислоты, органопрепараты (эндокринные препараты)
Витамины синтетические водорастворимые и жирорастворимые для ветеринарии, препараты витаминные для ветеринарии
Аминокислоты, гидролизаты белков и ферменты для ветеринарии
Сок желудочный натуральный "Эквин" (для ветеринарных целей)
9382 Сыворотки, препараты из крови и полученные методом генетической инженерии, применяемые в ветеринарии
Слайд 249386 Бактериофаги (включая для ветеринарии)
9387 Аллергены (включая для ветеринарии)
9439 Инструменты для
9388 Диагностикумы, антигены, тест-системы, применяемые в медицине, препараты диагностические и среды питательные для ветеринарии
Слайд 25Федеральный закон № 184-ФЗ
«О техническом регулировании»
Декларация о соответствии и сертификат соответствия
Слайд 26Декларирование соответствия
При декларировании соответствия заявитель на основании собственных доказательств самостоятельно формирует
В качестве доказательственных материалов используются техническая документация, результаты собственных исследований и измерений и другие документы, послужившие основанием для подтверждения соответствия продукции требованиям технического регламента.
Слайд 27Декларация о соответствии должна содержать
наименование и местонахождение заявителя;
наименование и местонахождение изготовителя;
информацию
наименование технического регламента, на соответствие требованиям которого подтверждается продукция;
указание на схему декларирования соответствия;
заявление заявителя о безопасности продукции при ее использовании в соответствии с целевым назначением и принятии заявителем мер по обеспечению соответствия продукции требованиям технических регламентов;
сведения о проведенных исследованиях и измерениях, сертификате системы менеджмента качества, а также документах, послуживших подтверждением соответствия продукции требованиям технических регламентов;
срок действия декларации о соответствии;
иные предусмотренные техническими регламентами сведения.
Слайд 28Оформленная заявителем декларация о соответствии подлежит регистрации в электронной форме в
Декларация о соответствии и доказательственные материалы хранятся у заявителя в течение десяти лет со дня окончания срока действия такой декларации в случае, если иной срок их хранения не установлен техническим регламентом.
Слайд 29Сертификат соответствия включает в себя
наименование и местонахождение заявителя;
наименование и местонахождение изготовителя
наименование и местонахождение органа по сертификации;
информацию об объекте сертификации;
наименование технического регламента, на соответствие требованиям которого проводилась сертификация;
информацию о проведенных исследованиях и измерениях;
информацию о документах, представленных заявителем в орган по сертификации в качестве доказательств соответствия продукции требованиям технических регламентов;
срок действия сертификата соответствия;
информацию об использовании или о неиспользовании заявителем национальных стандартов, в результате применения которых на добровольной основе обеспечивается соблюдение требований технического регламента.
Слайд 30Оборот дезинфицирующих средств
В соответствии Федеральным законом от 12.04.2010 № 61-ФЗ «Об
В связи с изложенным, деятельность, связанная с оптовой торговлей дезинфицирующими средствами, не лицензируется Россельхознадзором.
Вопросы нормативно-правового регулирования обращения дезинфицирующих средств не входят в компетенцию Россельхознадзора.
Слайд 31Правовые основы лицензирования
Федеральный закон РФ от 04.05.2011 № 99-ФЗ «О лицензировании
Федеральный закон РФ от 26.12.2008 № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»
Постановление Правительства РФ от 22.12.2011 № 1081 «Об утверждении Положения о лицензировании фармацевтической деятельности»
Слайд 32В соответствии с Постановлением Правительства РФ от 22.12.2011 № 1081 лицензированию
Оптовая торговля ЛС для ветеринарного применения
Хранение ЛС и ЛП для ветеринарного применения
Перевозка ЛС и ЛП для ветеринарного применения
Розничная торговля ЛП для ветеринарного применения
Отпуск ЛП для ветеринарного применения
Изготовление ЛП для ветеринарного применения
Слайд 33Лицензирующий орган
Лицензирующие органы - уполномоченные федеральные органы исполнительной власти и (или)
В части деятельности, осуществляемой в сфере обращения лекарственных средств для ветеринарного применения –
Федеральная служба по ветеринарному и фитосанитарному надзору
Слайд 34Центральный аппарат Федеральной службы по ветеринарному и фитосанитарному надзору лицензирует фармацевтическую
организаций оптовой торговли лекарственными средствами для ветеринарного применения;
ветеринарных аптечных организаций, осуществляющих свою деятельность на территории двух или более субъектов Российской Федерации;
индивидуальных предпринимателей, осуществляющих свою деятельность на территории двух или более субъектов РФ;
ветеринарных организаций федеральных органов исполнительной власти.
Примечание:
Приказ Россельхознадзора от 19 апреля 2012 г. № 191 «О лицензировании фармацевтической деятельности»
Слайд 35Территориальные управления Федеральной службы по ветеринарному и фитосанитарному надзору лицензируют розничную
ветеринарными организациями;
ветеринарными аптечными организациями;
индивидуальными предпринимателями.
Примечание:
Приказ Россельхознадзора от 19 апреля 2012 г. № 191 «О лицензировании фармацевтической деятельности»
Слайд 36Соискатель лицензии - юридическое лицо или индивидуальный предприниматель, обратившиеся в лицензирующий
ТРЕБОВАНИЯ К СОИСКАТЕЛЮ
наличие помещений и оборудования, принадлежащих ему на праве собственности или на ином законном основании
наличие у руководителя организации, деятельность которого непосредственно связана с оптовой торговлей лекарственными средствами, их хранением, перевозкой и (или) розничной торговлей лекарственными препаратами, их отпуском, хранением, перевозкой и изготовлением для осуществления фармацевтической деятельности в сфере обращения лекарственных средств для ветеринарного применения - высшего или среднего фармацевтического либо высшего или среднего ветеринарного образования, стажа работы по специальности не менее 3 лет, сертификата специалиста
наличие у индивидуального предпринимателя для осуществления фармацевтической деятельности в сфере обращения лекарственных средств для ветеринарного применения - высшего или среднего фармацевтического либо высшего или среднего ветеринарного образования, сертификата специалиста
а также
Слайд 37наличие у соискателя лицензии работников, заключивших с ним трудовые договоры, деятельность
Слайд 38Для получения лицензии соискатель лицензии представляет по установленной форме в лицензирующий
полное и (в случае, если имеется) сокращенное наименование, в том числе фирменное наименование, и организационно-правовая форма юридического лица, адрес его места нахождения, адреса мест осуществления лицензируемого вида деятельности, государственный регистрационный номер записи о создании юридического лица, данные документа, подтверждающего факт внесения сведений о юридическом лице в единый государственный реестр юридических лиц, а также номера телефона и (в случае, если имеется) адреса электронной почты юридического лица;
ФИО индивидуального предпринимателя, адрес его места жительства, адреса мест осуществления лицензируемого вида деятельности, данные документа, удостоверяющего его личность, государственный регистрационный номер записи о государственной регистрации индивидуального предпринимателя, данные документа, подтверждающего факт внесения сведений об индивидуальном предпринимателе в единый государственный реестр индивидуальных предпринимателей, с указанием адреса места нахождения органа, осуществившего государственную регистрацию, а также номера телефона и (в случае, если имеется) адреса электронной почты индивидуального предпринимателя
Слайд 39ИНН, данные документа о постановке соискателя лицензии на учет в налоговом
лицензируемый вид деятельности, который соискатель лицензии намерен осуществлять, с указанием выполняемых работ, оказываемых услуг, составляющих лицензируемый вид деятельности;
реквизиты документа, подтверждающего факт уплаты государственной пошлины за предоставление лицензии, либо иные сведения, подтверждающие факт уплаты указанной государственной пошлины;
реквизиты документов (наименование органа (организации), выдавшего документ, дата, номер), перечень которых определяется положением о лицензировании конкретного вида деятельности и которые свидетельствуют о соответствии соискателя лицензии лицензионным требованиям.
Слайд 40К заявлению прилагаются
копии документов, подтверждающих наличие у соискателя лицензии на праве
сведения о наличии санитарно-эпидемиологического заключения о соответствии помещений требованиям санитарных правил
копии документов о высшем или среднем фармацевтическом либо высшем или среднем ветеринарном образовании и сертификатов специалистов - для осуществления фармацевтической деятельности в сфере обращения лекарственных средств для ветеринарного применения
копии документов или заверенные в установленном порядке выписки из документов, которые подтверждают наличие необходимого стажа работы по специальности у руководителя организации, индивидуального предпринимателя
опись документов
Слайд 41Заявление о предоставлении лицензии и прилагаемые к нему документы соискатель лицензии
Федеральный закон от 06.04.2011 N 63-ФЗ (ред. от 28.06.2014) «Об электронной подписи»
Слайд 42Порядок лицензирования
В течение трех рабочих дней со дня представления заявления о
В срок, не превышающий сорока пяти рабочих дней со дня приема заявления о предоставлении лицензии и прилагаемых к нему документов, лицензирующий орган осуществляет проверку полноты и достоверности содержащихся в указанных заявлении и документах сведений, в том числе проверку соответствия соискателя лицензии лицензионным требованиям, и принимает решение о предоставлении лицензии или об отказе в ее предоставлении.
Решение о предоставлении лицензии или об отказе в ее предоставлении оформляется приказом (распоряжением) лицензирующего органа.
В течение трех рабочих дней после дня подписания и регистрации лицензии лицензирующим органом она вручается лицензиату или направляется ему заказным почтовым отправлением с уведомлением о вручении.
Слайд 43Переоформление лицензии
в случаях реорганизации юридического лица в форме преобразования, изменения его
в случаях изменения места жительства, имени, фамилии и (в случае, если имеется) отчества индивидуального предпринимателя, реквизитов документа, удостоверяющего его личность,
в случаях изменения адресов мест осуществления юридическим лицом или индивидуальным предпринимателем лицензируемого вида деятельности, перечня выполняемых работ, оказываемых услуг, составляющих лицензируемый вид деятельности.
Слайд 44Действие лицензии приостанавливается лицензирующим органом в следующих случаях
привлечение лицензиата к административной
назначение лицензиату административного наказания в виде административного приостановления деятельности за грубое нарушение лицензионных требований в порядке, установленном законодательством РФ.
Слайд 45Действие лицензии прекращается
представление лицензиатом в лицензирующий орган заявления о прекращении лицензируемого
прекращение физическим лицом деятельности в качестве индивидуального предпринимателя в соответствии с законодательством РФ о государственной регистрации юридических лиц и индивидуальных предпринимателей;
прекращение деятельности юридического лица в соответствии с законодательством РФ о государственной регистрации юридических лиц и индивидуальных предпринимателей;
наличие решения суда об аннулировании лицензии.
Слайд 46Лицензирование деятельности, связанной с оборотом НС, ПВ и их прекурсоров
Постановление Правительства
Приказ Минсельхоза РФ и Минздрава РФ от 29 декабря 2003 г. № 1580/619 «Об утверждении перечня наркотических средств и психотропных веществ, используемых в ветеринарии» (ред. 21.08.2014)
Постановление Правительства РФ от 30 июня 1998 г. № 681 «Об утверждении перечня наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации»
Слайд 47В соответствии с приказом Минсельхоза РФ и Минздрава РФ № 1580/619 Перечень
Кетамин
Кетамина гидрохлорид (калипсол, кеталар)
Альфентанил
Буторфанол
Бупренорфин
Диазепам
Карфентанил
Мидазолам
Налбуфин
Тримеперидин (промедол)
Фенобарбитал
Фентанил
Слайд 48Кетамин – ПВ Списка II
Альфентанил – НС Списка II
Бупренорфин – НС
Карфентанил – НС Списка II
Тримеперидин (промедол) – НС Списка II
Фентанил – НС Списка II
Диазепам – ПВ Списка III
Буторфанол – ПВ Списка III
Мидазолам – ПВ Списка III
Налбуфин – ПВ Списка III
Фенобарбитал – ПВ Списка III
Слайд 49К работе с НС, ПВ и прекурсорами не допускаются
лица, не достигшие
больные наркоманией, токсикоманией, хроническим алкоголизмом
лица, имеющие непогашенную или неснятую судимость за преступление средней тяжести, тяжкое и особо тяжкое преступление или преступление, связанное с незаконным оборотом НС, ПВ и их прекурсоров либо с незаконным культивированием наркосодержащих растений, в том числе совершенное за пределами РФ.
Слайд 50Допуск лиц к работе с НС и ПВ
Федеральный закон от 8
Постановление Правительства РФ от 6 августа 1998 г. № 892 «Об утверждении Правил допуска лиц к работе с наркотическими средствами и психотропными веществами, а также к деятельности, связанной с оборотом прекурсоров наркотических средств и психотропных веществ»
Слайд 51Хранение НС, ПВ и прекурсоров
К 1-й категории относятся помещения производителей и
Слайд 52Ко 2-й категории относятся помещения ветеринарных аптечных организаций, предназначенные для хранения
К 3-й категории относятся помещения медицинских и ветеринарных организаций, предназначенные для хранения 15-дневного запаса НС и ПВ, внесенных в список II перечня, и месячного запаса психотропных веществ, внесенных в список III перечня.
К 4-й категории относятся помещения медицинских и ветеринарных организаций, предназначенные для хранения суточного запаса НС и ПВ, внесенных в список II перечня, и трехдневного запаса психотропных веществ, внесенных в список III перечня.
Слайд 53Постановление Правительства РФ от 06.07.2012 № 686 «Об утверждении Положения о
Производство, хранение и реализация фармацевтических субстанций, получаемых методами химического синтеза, биотехнологического синтеза, методами выделения из химического сырья, методами выделения из источников биологического, животного и растительного происхождения
Производство, хранение и реализация стерильных ЛП с указанием конкретной ЛФ (аэрозоль, гель, крем, линимент, лиофилизированные продукты, мазь, паста, пленка, порошок, р-р, р-р для инъекций, стеклообразная масса, стерильная пористая масса, суспензия, сухая масса, таблетки, эмульсии).
Производство, хранение и реализация нестерильных ЛП с указанием конкретной ЛФ (аэрозоль, бальзам, брикет, гель, гранулы, драже, капли, капсулы, капсулы мягкие, крем, линимент, мазь, масло, микрогранулы, микрокапсулы, настой, настойка, пастилки, паста, порошок, раствор, сироп, спрей, суппозитории, суспензия, таблетки, экстракт, эликсир, эмульсия и др.).
Слайд 54Лицензионными требованиями, предъявляемыми к соискателю лицензии на осуществление деятельности по производству
наличие у соискателя лицензии помещений, зданий, сооружений и иных объектов, технических средств, оборудования и технической документации, принадлежащих ему на праве собственности или на ином законном основании, необходимых для выполнения заявляемых работ, соответствующих установленным требованиям;
соответствие производства лекарственных средств правилам организации производства и контроля качества лекарственных средств;
Слайд 55наличие промышленных регламентов, утвержденных руководителем производителя лекарственных средств (соискателя лицензии) и
наличие уполномоченного лица производителя ЛС, которое при вводе лекарственных средств в гражданский оборот осуществляет подтверждение соответствия требованиям, предъявляемым при госрегистрации ЛС и гарантию качества лекарственных средств, а также которое:
имеет ветеринарное образование, стаж работы не менее чем 5 лет в области производства и контроля качества ЛС;
наличие работников, заключивших трудовые договоры, имеющих ветеринарное образование, ответственных за производство и маркировку лекарственных средств.
Слайд 56Проверки соблюдения лицензионных требований и условий
Федеральный закон от 26 декабря 2008
№ 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»
Слайд 58Плановая проверка
Предметом проверки является соблюдение юридическим лицом, индивидуальным предпринимателем в процессе
Слайд 59Плановые проверки
Плановые проверки проводятся не чаще чем один раз в три
В срок до 1 сентября года, предшествующего году проведения плановых проверок, органы государственного контроля (надзора), органы муниципального контроля направляют проекты ежегодных планов проведения плановых проверок в органы прокуратуры.
О проведении плановой проверки юридическое лицо, индивидуальный предприниматель уведомляются органом государственного контроля (надзора), органом муниципального контроля не позднее чем в течение 3-х рабочих дней до начала ее проведения.
Слайд 60Основанием для включения плановой проверки в ежегодный план проведения плановых проверок
истечение одного года со дня принятия решения о предоставлении лицензии или переоформлении лицензии;
истечение трех лет со дня окончания последней плановой проверки лицензиата;
истечение трех лет со дня государственной регистрации юридического лица, индивидуального предпринимателя.
Слайд 61Внеплановая проверка
Предметом проверки является соблюдение юридическим лицом, индивидуальным предпринимателем обязательных требований
Слайд 62Основанием для проведения внеплановой проверки является
истечение срока исполнения лицензиатом ранее выданного
поступление в органы государственного и муниципального контроля обращений и заявлений граждан и организаций, информации от органов государственной власти, органов местного самоуправления, из средств массовой информации о фактах грубых нарушений лицензиатом лицензионных требований;
истечение срока, на который было приостановлено действие лицензии;
наличие ходатайства лицензиата о проведении лицензирующим органом внеплановой выездной проверки в целях установления факта досрочного исполнения предписания лицензирующего органа;
наличие приказа лицензирующего органа, изданного в соответствии с поручениями Президента РФ, Правительства РФ и на основании требования прокурора о проведении внеплановой проверки в рамках надзора за исполнением законов по поступившим в органы прокуратуры материалам и обращениям.
Слайд 64Документарная проверка
Предметом проверки являются сведения, содержащиеся в документах юридического лица, индивидуального
Организация документарной проверки проводится по месту нахождения органа государственного контроля (надзора), органа муниципального контроля.
Документы представляются в виде копий, заверенных печатью (при ее наличии) и соответственно подписью индивидуального предпринимателя, его уполномоченного представителя, руководителя, иного должностного лица юридического лица, в том числе в форме электронных документов
Слайд 65Выездная проверка
Предметом проверки являются содержащиеся в документах юридического лица, индивидуального предпринимателя
Слайд 66Выездная проверка проводится в случае, если при документарной проверке не удалось
удостовериться
оценить соответствие деятельности юридического лица, индивидуального предпринимателя обязательным требованиям или требованиям, установленным муниципальными правовыми актами, без проведения соответствующего мероприятия по контролю.
Слайд 67Органы государственного контроля (надзора), органы муниципального контроля привлекают к проведению выездной
Слайд 68Лицензирование фармацевтической деятельности и производства лекарственных средств
за предоставление лицензии - 7
за переоформление документа, подтверждающего наличие лицензии, и (или) приложения к такому документу в связи с внесением дополнений в сведения об адресах мест осуществления лицензируемого вида деятельности, о выполняемых работах и об оказываемых услугах в составе лицензируемого вида деятельности 3 500 рублей;
за переоформление документа, подтверждающего наличие лицензии, и (или) приложения к такому документу в других случаях 750 рублей;
за выдачу дубликата документа, подтверждающего наличие лицензии - 750 рублей.
Слайд 69Приказ Министерства сельского хозяйства РФ от 15 апреля 2015 г. №
«Об утверждении Правил хранения лекарственных средств для ветеринарного применения»