- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
З урока по теме презентация
Содержание
- 1. З урока по теме
- 2. Основные положения теории электролитической диссоциации Фарадей Майкл
- 3. Современные приборы – кондуктометры Приборы – кондуктометры, определяют концентрацию растворов кислот, оснований, солей.
- 5. Неэлектролиты
- 6. Атомы и ионы отличаются по: размерам; зарядам;
- 7. Без электрического тока ионы в растворе движутся
- 8. Сванте Август Аррениус-
- 9. Домашнее задание §35,упр.1,2 §36,упр.1,4
- 10. Урок №2. Сила электролитов. Уравнения диссоциации
- 11. + - Механизм диссоциации электролитов с
- 12. + - Механизм диссоциации электролитов с полярной связью Механизм электролитической диссоциации
- 13. Степень электролитической диссоциации. Сильные и слабые
- 14. Степень диссоциации (α) зависит от
- 15. Сильные электролиты (α → 1 или 100%)
- 16. Кислоты, основания и соли с точки зрения
- 17. Уравнение диссоциации сильных оснований (щелочей) NaOH ↔
- 18. Уравнение электролитической диссоциации Zn(OH)2 (без учета
- 19. K2CO3 ↔ 2K+ + CO32- Al2(SO4)3
- 20. Домашнее задание § 36 №4,5,6
- 21. Урок №3. Ионные уравнения
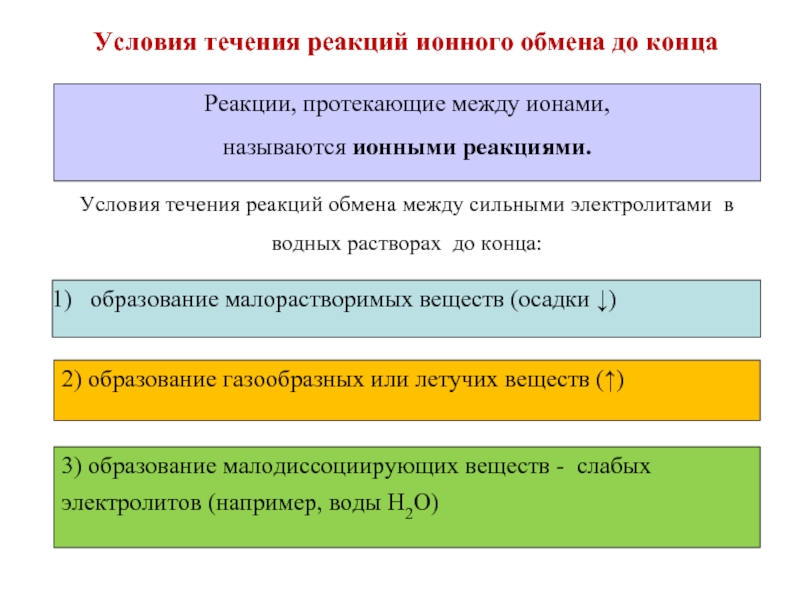
- 22. Условия течения реакций ионного обмена до конца
- 23. Реакции с образованием малорастворимых веществ, выпадающих
- 24. 2. Реакции, протекающие с образованием газообразных
- 25. 3. Реакции, идущие с образованием малодиссоциирующих
- 26. Если исходными веществами реакций обмена являются
- 27. Домашнее задание §37 № 1,2,3
Слайд 1
Урок №1.
Теория электролитической
диссоциации.
Основные положения теории
З урока по теме
Автор: Ким
Учитель химии высшей категории
МБОУ МО г. Нягань «СОШ №6»
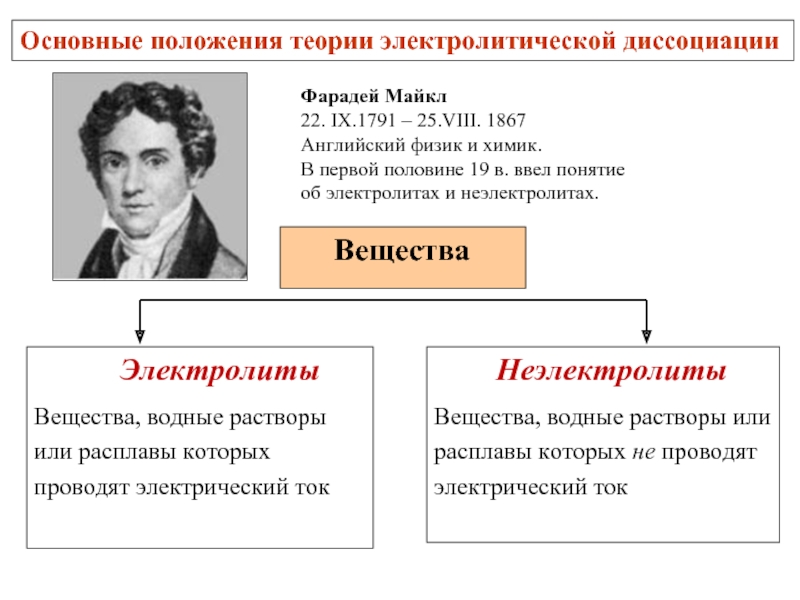
Слайд 2Основные положения теории электролитической диссоциации
Фарадей Майкл
22. IX.1791 – 25.VIII. 1867
Английский физик
В первой половине 19 в. ввел понятие
об электролитах и неэлектролитах.
Слайд 3Современные приборы – кондуктометры
Приборы – кондуктометры, определяют концентрацию растворов кислот, оснований,
Слайд 4 Тип химической связи:
ковалентная сильно полярная
Электролиты
Соли, кислоты, основания
примеры: NaCl, H2SO4, NaOH
Основные положения теории
электролитической диссоциации
Слайд 5
Неэлектролиты
ковалентная неполярная ,
ковалентная малополярная
Кислород O2, азот N2, водород H2
многие органические вещества – спирты, глюкоза, сахароза, бензол и др.
Основные положения теории
электролитической диссоциации
Слайд 6Атомы и ионы отличаются по:
размерам;
зарядам;
активности в химической реакции.
Основные положения теории
электролитической
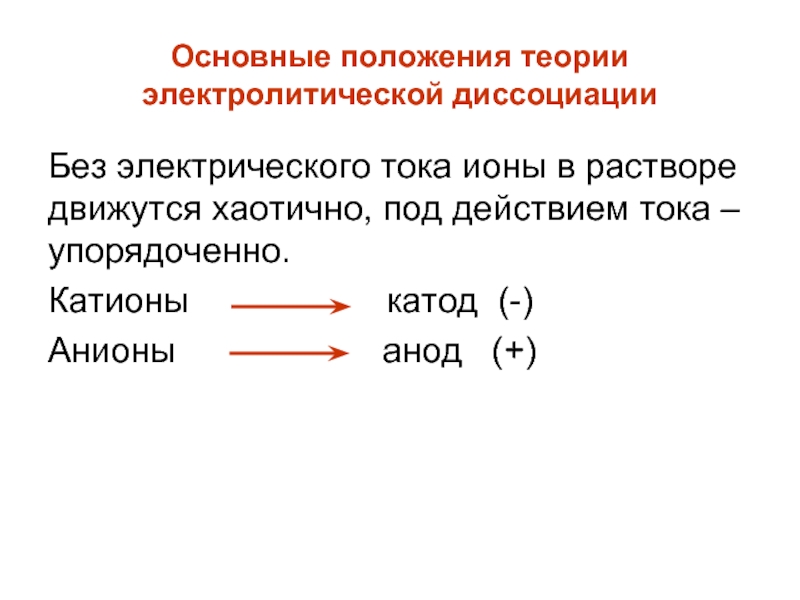
Слайд 7Без электрического тока ионы в растворе движутся хаотично, под действием тока
Катионы катод (-)
Анионы анод (+)
Основные положения теории
электролитической диссоциации
Слайд 8 Сванте Август Аррениус-
Шведский физико-химик.
Автор теории электролитической
диссоциации (1887 г.)
В 1903 г. награжден Нобелевской премией.
Основные положения теории электролитической диссоциации
Слайд 11+ -
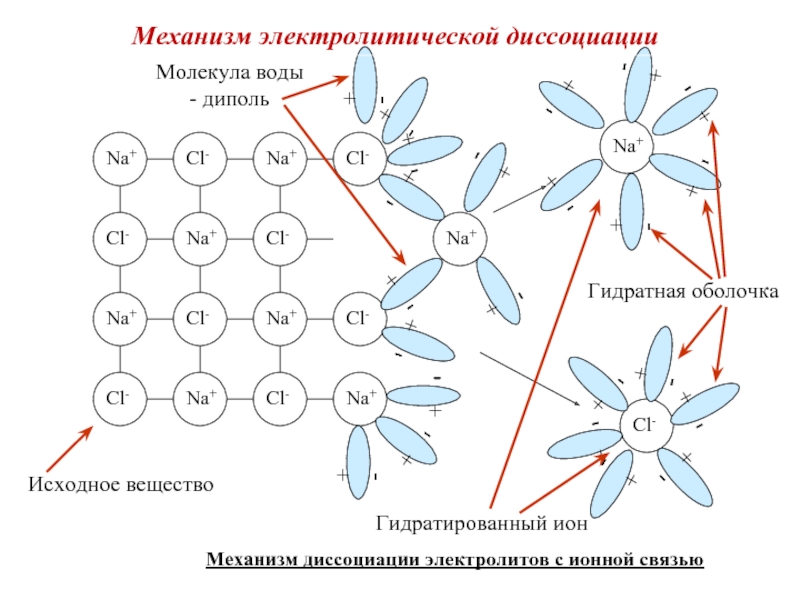
Механизм диссоциации электролитов с ионной связью
Механизм электролитической диссоциации
Исходное вещество
Гидратированный
Гидратная оболочка
Молекула воды
- диполь
Слайд 12+ -
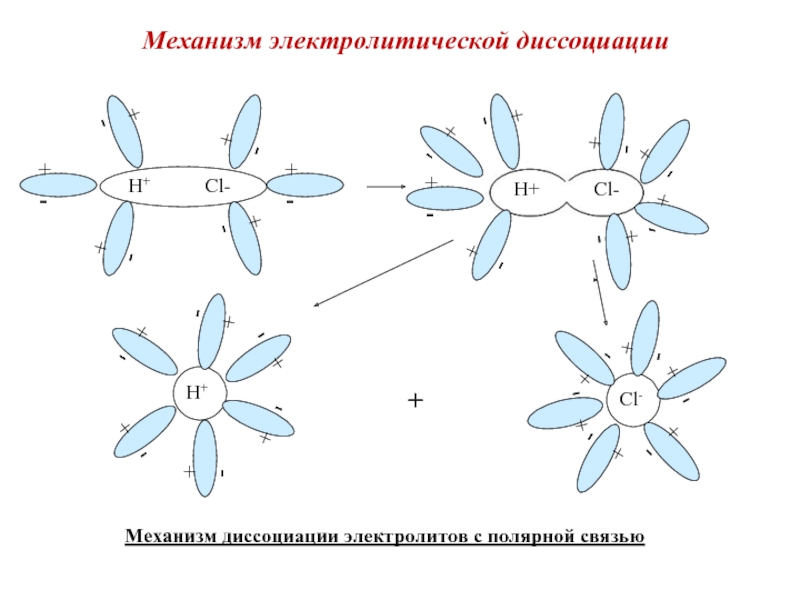
Механизм диссоциации электролитов с полярной связью
Механизм электролитической диссоциации
Слайд 13Степень электролитической диссоциации.
Сильные и слабые электролиты
Степень электролитической диссоциации (α )
– число, показывающее, какая часть молекул распалась на ионы.
число молекул, распавшихся на ионы
общее число растворенных молекул
α =
Слайд 14Степень диссоциации (α) зависит от
природы растворяемого вещества и
концентрации раствора;
температуры.
При разбавлении раствора, α ↑
При ↑ температуры степень диссоциации, как правило, ↑.
Степень электролитической диссоциации.
Сильные и слабые электролиты
Слайд 15Сильные электролиты (α → 1 или 100%)
соли
2) сильные кислоты:
H2SO4,
3) Щелочи – растворимые основания:
NaOH, KOH, LiOH, Ba(OH)2, Ca(OH)2 и др.
Степень электролитической диссоциации.
Сильные и слабые электролиты
Слайд 16Кислоты, основания и соли с точки зрения ТЭД
Уравнение электролитической диссоциации сильных
HCl ↔ H+ + Cl-
H2SO4 ↔ 2H+ + SO42-
Слабые многоосновные кислоты диссоциируют ступенчато.
H2CO3 ↔ H+ + HCO3- 1 ступень
HCO3- ↔ H+ + CO32- 2 ступень (маловероятна)
Кислоты – электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н+
Слайд 17Уравнение диссоциации сильных оснований (щелочей)
NaOH ↔ Na+ + OH-
Ba(OH)2 ↔ Ba2+
Слабые многокислотные основания диссоциируют ступенчато.
Fe(OH)2 ↔ FeOH+ + OH- 1 ступень
FeOH+ ↔ Fe2+ + OH- 2 ступень (маловероятна)
Основания - электролиты, которые при диссоциации образуют только один вид анионов - гидроксид-ионы ОН-.
Кислоты, основания и соли с точки зрения ТЭД
Слайд 18Уравнение электролитической диссоциации Zn(OH)2
(без учета ступенчатого характера)
2H+ + ZnO22- ↔
по типу кислоты по типу основания
Амфотерные гидроксиды – это слабые электролиты,
которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы ОН- ,
т.е. диссоциируют по типу кислоты и по типу основания.
Кислоты, основания и соли с точки зрения ТЭД
Слайд 19K2CO3 ↔ 2K+ + CO32-
Al2(SO4)3 ↔ 2Al3+ + 3SO42-
Средние (нормальные) соли
образующие при диссоциации катионы металла и анионы кислотного остатка.
Кислоты, основания и соли с точки зрения ТЭД
Слайд 22Условия течения реакций ионного обмена до конца
Реакции, протекающие между ионами,
называются
Условия течения реакций обмена между сильными электролитами в водных растворах до конца:
образование малорастворимых веществ (осадки ↓)
2) образование газообразных или летучих веществ (↑)
3) образование малодиссоциирующих веществ - слабых электролитов (например, воды Н2О)
Слайд 23Реакции с образованием малорастворимых веществ,
выпадающих в осадок
молекулярное уравнение:
AgNO3 + HCl
полное ионное уравнение:
Ag+ + NO3- + H+ + Cl- → AgCl↓ + H+ + NO3-
сокращенное ионное уравнение:
Ag+ + Cl- → AgCl↓
Слайд 242. Реакции, протекающие с образованием газообразных
или летучих веществ
молекулярное уравнение:
Na2CO3 +
полное ионное уравнение:
2Na+ + CO32- + 2H+ + 2Cl- → 2Na+ + 2Cl- + CO2↑ + H2O
сокращенное ионное уравнение:
CO32- + 2H+ → CO2↑ + H2O
Слайд 253. Реакции, идущие с образованием малодиссоциирующих
веществ – слабых электролитов
молекулярное уравнение:
NaOH + HCl → NaCl + H2O
полное ионное уравнение:
Na+ + OH- + H+ + Cl- → Na+ + Cl- + H2O
сокращенное ионное уравнение:
OH- + H+ → H2O
Слайд 26Если исходными веществами реакций обмена
являются сильные электролиты, которые при взаимодействии
то такие реакции не протекают.
Например,
2NaCl + Ca(NO3)2 ≠ 2NaNO3 + CaCl2
Обратите внимание!