- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Управление рисками для качества: материалы ICH, ВОЗ и PIC/S А.П. МешковскийПМГМУ им. Сеченоваmeshkvskijj@mail.ru презентация
Содержание
- 1. Управление рисками для качества: материалы ICH, ВОЗ и PIC/S А.П. МешковскийПМГМУ им. Сеченоваmeshkvskijj@mail.ru
- 2. Промышленность в прошлом столетии Вторая мировая война,
- 3. ХХ век: подходы к управлению качеством
- 4. К концу ХХ века Статистические методы и
- 5. Фармсектор: революция регуляторной культуры В фармсекторе
- 6. Основные виды рисков в отрасли Для здоровья
- 7. Виды медицинских рисков связанны с: побочными
- 8. Что такое качество ЛС? Качество: «степень, в
- 9. Начало XXI века риски в
- 10. Американская инициатива в сфере GMP - 2002
- 11. Ответ ЕС и Японии: 2003-2005 новые
- 12. Гармонизированные трехсторонние руководства по качеству ICH Q8(R1)
- 13. Фармацевтическая система качества Разработать
- 14. Риск: определение Риск - комбинация (произведение) вероятности
- 15. Управление рисками – не новое требование В
- 16. Необходимы все три элемента: Q8, Q9 и Q10
- 17. Без одного элемента – неудача (2003)
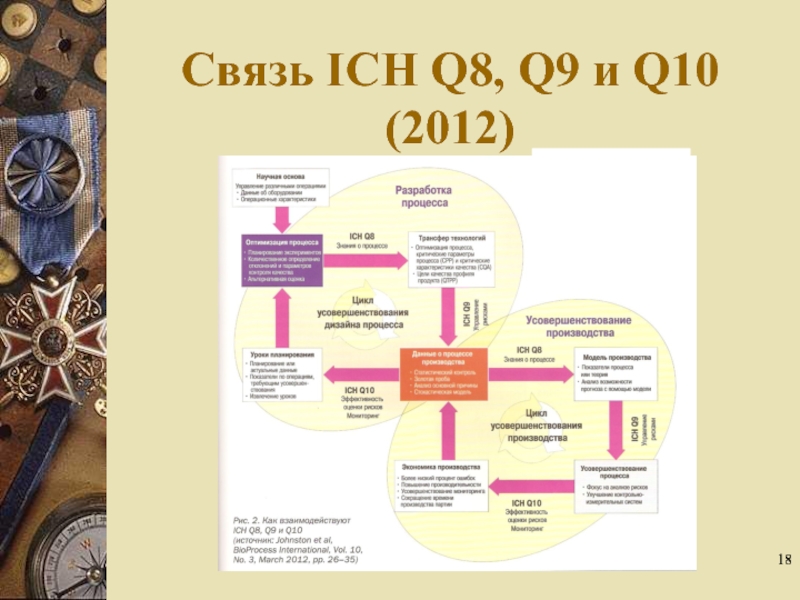
- 18. Связь ICH Q8, Q9 и Q10 (2012)
- 19. Q9: содержание Основные принципы управления рисками Общая
- 20. А.Мешковский - Новая регуляторная культура А.Мешковский -
- 21. Q9 - Общая схема процесса управления
- 22. Q9 - Инструменты управления рисками
- 23. FDA - Классификация рисков качества (для пациента)
- 24. Фирма AstraZeneca: риск отступления от требований
- 25. Бальная оценка компонентов риска
- 26. Бальная оценка компонентов риска 2
- 27. Бальная оценка компонентов риска 3
- 28. Ранжирование рисков
- 29. Управление рисками: применение в производстве классификация
- 30. Необходимо уточнить, что: Практика управления рисками не
- 31. Ситуация в развитых странах В 2008 г.
- 32. Конференция FIP (2005)
- 33. Семинар PIC/S 2006
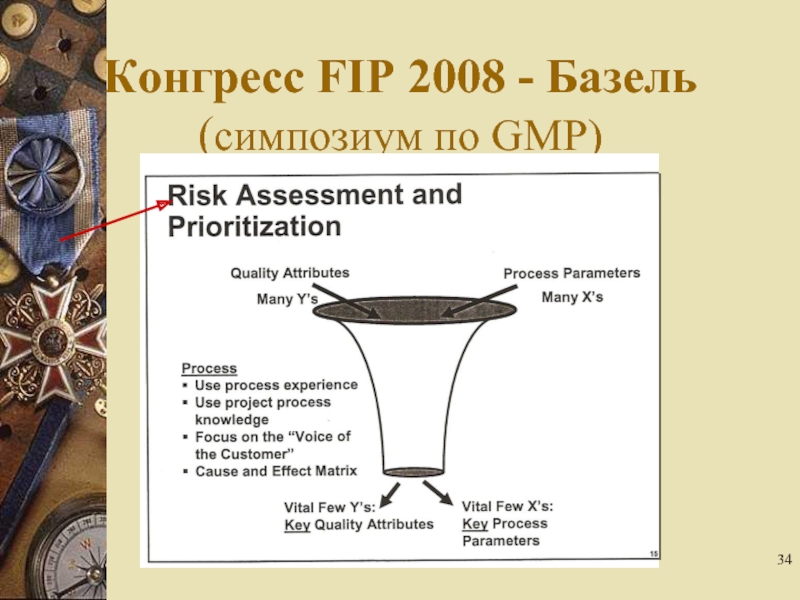
- 34. Конгресс FIP 2008 - Базель (симпозиум по GMP)
- 35. Конгресс FIP 2009 - Стамбул
- 36. Ситуация в России В ГОСТ Р 52537-2006
- 37. Из ГОСТ Р 52537-2006 Система обеспечения качества
- 38. GMP EC – перевод АСИНКОМа
- 39. АСИНКОМ не признает «В последнюю редакцию
- 40. Новые документы по рискам для качества (2012)
- 41. Ссылки на ICH Q9 и Q10
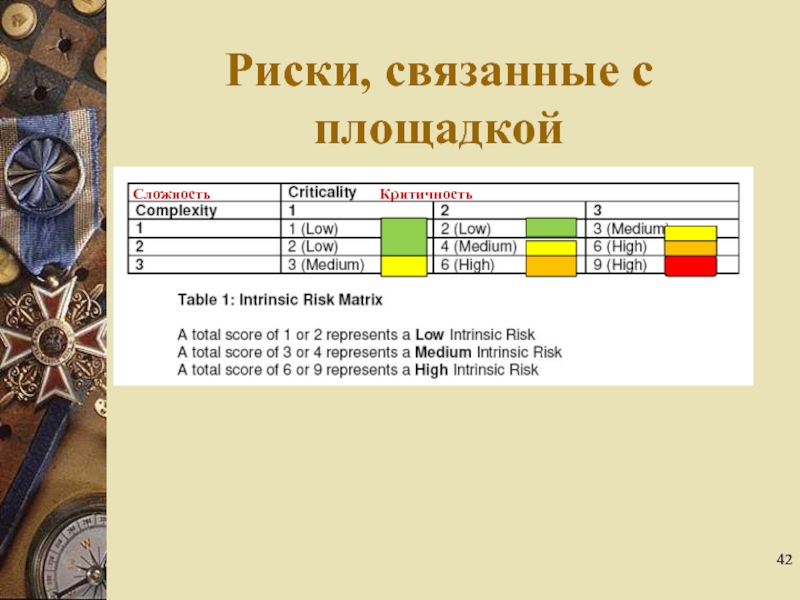
- 42. Риски, связанные с площадкой Критичность Сложность
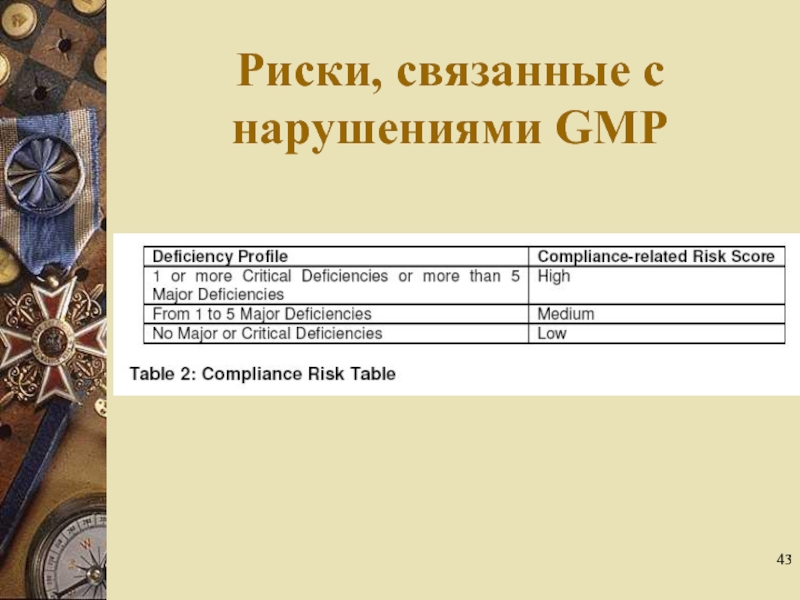
- 43. Риски, связанные с нарушениями GMP
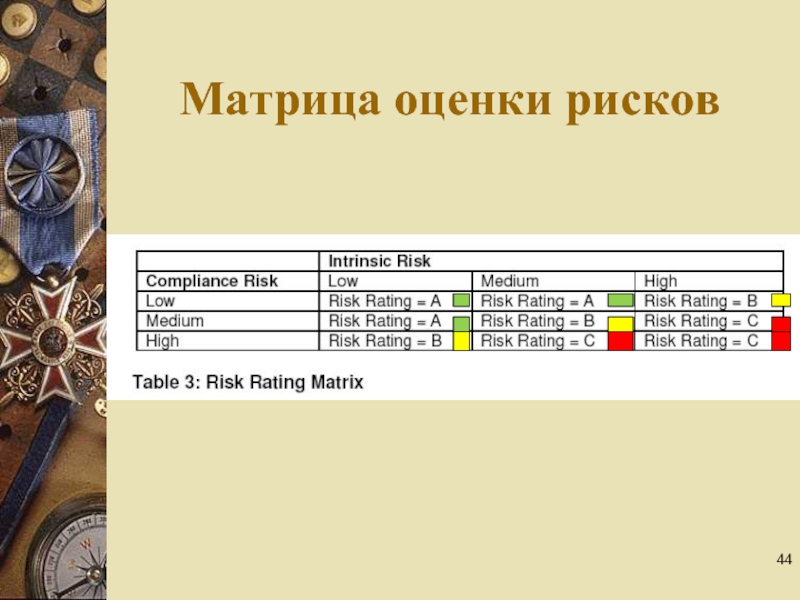
- 44. Матрица оценки рисков
- 45. Зависимость частоты инспекций от ранга риска
- 46. Признание роли новых документов ICH Гармонизированные
- 47. Управление рисками – часть GMP Аспекты
- 48. Как проверяет инспектор? В ходе обследования
- 49. Что проверяет инспектор? Имеется ли официальный
- 50. Рекомендации документ ВОЗ по управлению рисками качества
- 51. Комитет экспертов ВОЗ по спецификациям для фармацевтических
- 52. Общие соображения Все эксперты признали, что управление
- 53. Разъяснения Руководства ICH Q9 Следует поддерживать
- 54. Примеры оценки вероятности
- 55. Примеры оценки тяжести последствий
Слайд 1Управление рисками для качества: материалы ICH, ВОЗ и PIC/S А.П. Мешковский ПМГМУ
Слайд 2Промышленность в прошлом столетии
Вторая мировая война, последующее восстановление промышленного потенциала и
Это затронуло и сферу обеспечения качества
Появились новые подходы к управлению качеством промышленной продукции
Слайд 3 ХХ век: подходы к управлению качеством товаров (и услуг)
Статистическое
Статистический контроль качества Доджа и Ромига (30-е и 40-е годы)
10 шагов к повышению качества Джурана (1974)
14 пунктов Деминга (1982)
«Кайзен» Имаи (1986)
Системы качества (Спайкернел) – ИСО 9000 (50-е годы– 1987 год)
Слайд 4К концу ХХ века
Статистические методы и системы качества получили дальнейшее развитие
Идеи Джурана, Деминга и Имаи начали устаревать
Появились другие подходы: - управление рисками качества (HACCP, FMEA и др.)
- «6 сигм» (6 Sigma)
Усилилась глобализация
Слайд 5Фармсектор: революция
регуляторной культуры
В фармсекторе формируется интегрированная регуляторная культура
От качества через
От «слепого» выполнения официальных требований к политике качества и стандартам, основанным на научных данных; к тому, что нужно потребителю
От разобщения этапов разработки и производства к управлению качеством в течение жизненного цикла продукта
От общих правил GMP к системе качества конкретного предприятия
От боязни перемен к учету рисков и управлению рисками
От традиционной валидации к непрерывной верификации и улучшению
От множества правил GMP (ВОЗ, ЕС, США, Япония, Канада, Австралия, Китай) к единому руководству
Слайд 6Основные виды рисков в отрасли
Для здоровья пациента
(медицинские)
Для бизнеса - экономические,
Для бизнеса – регуляторные
Для окружающей среды
(экологические)
Слайд 7Виды медицинских рисков
связанны с:
побочными действиями
ошибками назначения, отпуска и применения,
качеством ЛС
Слайд 8Что такое качество ЛС?
Качество: «степень, в которой совокупность основополагающих свойств продукта,
Требования: «выраженные или подразумеваемые нужды или ожидания пациентов или их суррогатов (представителей): профессионалов здравоохранения, регуляторных органов». ICH: Q6A, 1999
Слайд 9Начало XXI века
риски в фармсекторе –
модная тема
2003
2005 г. Документы ЕС: риски при регистрации, фармаконадзор.
Слайд 10Американская инициатива в сфере GMP - 2002 г.
Сближение регистрации,
Качество через дизайн, пространство дизайна, РАТ
Управление рисками
Системы качества
Совершенствование практики инспектирования по GMP
Международная гармонизация требований GMP
Международное сотрудничество по всем направлениям
Слайд 12Гармонизированные трехсторонние руководства по качеству
ICH Q8(R1) Фармацевтическая разработка (2005-2007)
ICH Q9 Управление
ICH Q10 Фармацевтическая система качества (2008)
ICH Q11 Разработка и производство субстанций (2012)
ICH Q12 Концепция Руководства по управлению препаратами в течение всего жизненного цикла (сентябрь 2014)
Слайд 13Фармацевтическая
система качества
Разработать гармонизированную (отраслевую) систему качества, применимую в
ICH – «Видение» (новая парадигма)
Выработано в Брюсселе в июне 2003 г.
Слайд 14Риск: определение
Риск - комбинация (произведение) вероятности причинения ущерба и серьезности этого
Иногда к этому добавляется третий параметр: трудность детектирования ущерба.
При этом оценка вероятности связана с прошлым, оценка ущерба лежит в области будущего, а оценка трудности детектирования относится к настоящему.
ICH Q9 касается только рисков для потребителя лекарственных средств, связанных с их качеством
Слайд 15Управление рисками –
не новое требование
В отраслевых нормативах уже содержатся требования учитывать
Так, в Руководстве ЕС по GMP риск для пациента упоминается в преамбуле, во вступлении к разделу 3, в подразделах 3.1; 3.6; 3.8; 3.17; 3.38 и т.п.
Слайд 19Q9: содержание
Основные принципы управления рисками
Общая схема процесса управления рисками
Терминология
Некоторые методики
Примеры того,
Слайд 20А.Мешковский - Новая регуляторная культура
А.Мешковский - Новая регуляторная культура
Q9: основные принципы
Оценка
Уровень усилий, степень формализации и документирования в процессе управления рисками в сфере качества должны соответствовать уровню риска.
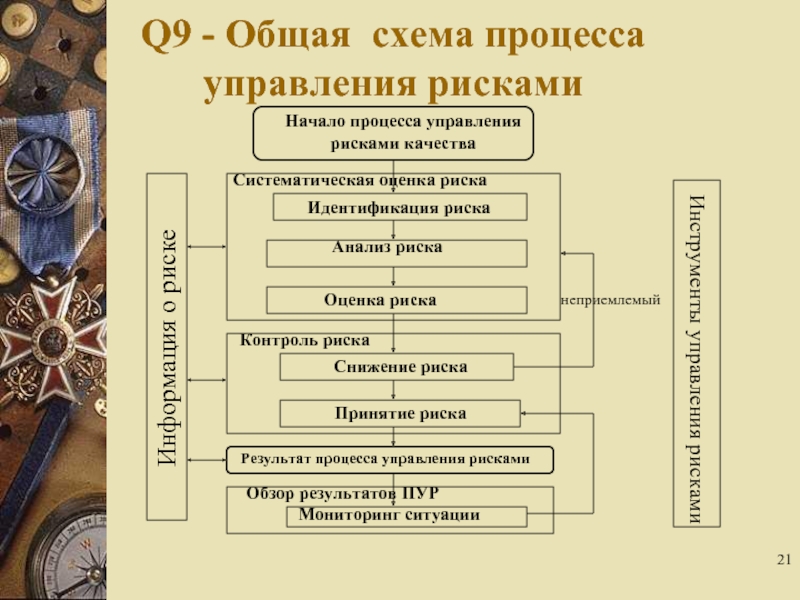
Слайд 21Q9 - Общая схема процесса
управления рисками
Инструменты управления рисками
Информация о риске
Начало
рисками качества
Идентификация риска
Анализ риска
Оценка риска
Снижение риска
Принятие риска
Результат процесса управления рисками
Мониторинг ситуации
Обзор результатов ПУР
Систематическая оценка риска
Контроль риска
неприемлемый
Слайд 22Q9 - Инструменты
управления рисками
Простые методы (схемы, диаграммы: Ишикава)
FMEA –
FMECA - Анализ критичности отказов
FTA – Анализ дерева ошибок
HACCP (ХАССП) – Критические контрольные точки
HAZOP - Исследования опасностей и пригодности к эксплуатации
PHA – Предварительное исследование опасностей
Ранжирование рисков
Статистические методы (карты Шухарта и др.)
Другие (матрицы рисков, дерево событий и др.)
Слайд 23FDA - Классификация рисков качества (для пациента)
Вероятность ущерба
Тяжесть ущерба
Высокий
(госпитализация)
Средний
(остр. заболев.)
Низкий
(беспокойство)
Низкая
Средняя
Высокая
1 уровень риска
2 уровень риска
3 уровень риска
Очень высокий
(Смерть)
Очень
высокая
Очень
низкая
Слайд 24 Фирма AstraZeneca:
риск отступления от требований
Вероятность отказа (P)
Тяжесть последствий (S)
Сложность выявления
Бальная оценка риска = P·S·D
Слайд 29Управление рисками:
применение в производстве
классификация дефектов продукции: критические, существенные и прочие
определение приоритетов в планах валидации, самоинспектирования
Определение объема работы по расследованию отклонений и корректирующим действиям (САРА)
Слайд 30Необходимо уточнить, что:
Практика управления рисками не дает оснований для отступления от
Однако она может с успехом использоваться при пересмотре этих требований
с тем, чтобы они отражали реальный риск для пациента, а не достижения технологии или аналитической химии.
Слайд 31Ситуация в развитых странах
В 2008 г. ICH Q9 включен в руководства
Однако ведущие производители начали работу по его внедрению
Инспекторы начали интересоваться ходом внедрения
Слайд 36Ситуация в России
В ГОСТ Р 52537-2006 «Система обеспечения качества» включена своя
Однако в ГОСТ Р 52249-2009 документ ICH Q9 не включен со ссылкой на негативное мнение неких «специалистов»
Слайд 39
АСИНКОМ не признает
«В последнюю редакцию правил GMP ЕС введено приложение 20
Этот текст изложен неконкретно и непригоден к практическому применению.
В связи с этим приложение 20 в текст нового стандарта не включено»
Слайд 46Признание роли
новых документов ICH
Гармонизированные трехсторонние руководства по качеству ICH Q8(R1)
Слайд 47Управление рисками – часть GMP
Аспекты управления рисками в сфере качества
должны
содержания любых инспекций по GMP, как для
готовых продуктов, так и для АФИ. Существование
этой памятной записки не означает необходимости
проведения специальных инспекций по управлению
рисками качества.
Слайд 48Как проверяет инспектор?
В ходе обследования необходимо предусмотреть
время для оценки системы
качества
. Во время общего обследования инспектор должен
суметь определить, каким образом компания
интегрировала систему управления рисками
качества, не выделяя специально такую проверку в
самостоятельный раздел обследования.
Слайд 49Что проверяет инспектор?
Имеется ли официальный контролируемый документ с
изложением политики
Есть ли свидетельства того, что высшее руководство
привержено этой программе?
Определены ли функции и ответственность лиц, участвующих
в этой программе?
Организовано ли планирование действий по УРК?
Осуществляется ли мониторинг и оценка действий по УРК?
Действия по УРК утверждаются и доводятся до сотрудников?
Включаются ли действия по УРК в программы обучения?
Методы управления рисками качества отобраны
и применяются?
Слайд 51Комитет экспертов ВОЗ по спецификациям для фармацевтических препаратов
47-ой доклад
Серия технических докладов
2013 г.
Приложение 2
Слайд 52Общие соображения
Все эксперты признали, что управление рисками для качества в будущем
УРК – процесс, важный для всех стран
Должен содействовать пониманию и снижению уровня риска с помощью соответствующих эффективных методов
Относится к исследованиям, разработке, получению сырья, производству, упаковке, контролю, хранению и распределению
Слайд 53Разъяснения Руководства ICH Q9
Следует поддерживать корпоративную культуру, направленную на производство
УРК позволяет вводить изменения в систему обеспечения качества
В перспективе может содействовать переходу к выпуску продукции в реальном времени