- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕМА УРОКА:КИСЛОТЫ презентация
Содержание
- 1. ТЕМА УРОКА:КИСЛОТЫ
- 2. ЦЕЛЬ УРОКА познакомить учащихся с новым классом неорганических соединений - кислоты
- 3. ПРОВЕРКА ЗНАНИЙ 1. Из предложенного перечня веществ
- 4. На какие группы можно разделить основания? Как это можно определить, не проводя опыт?
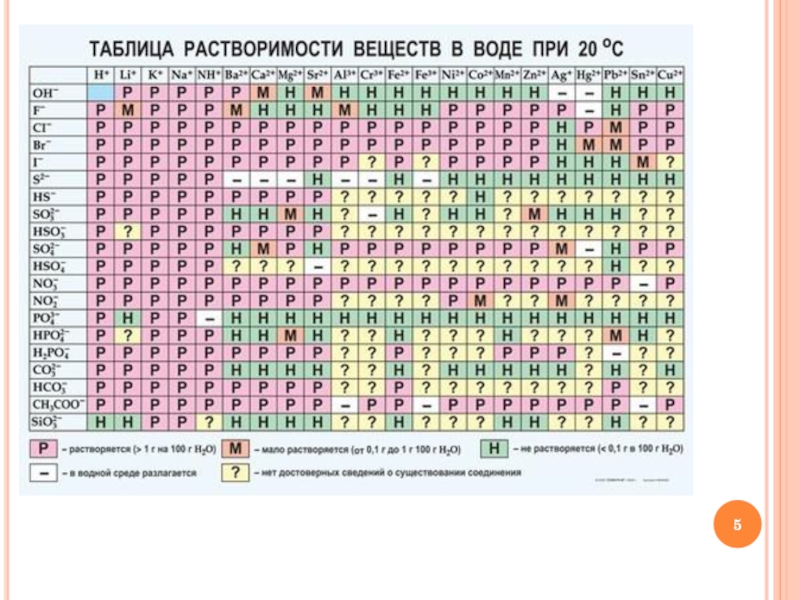
- 6. КЛАССИФИКАЦИЯ ОСНОВАНИЙ ПО РАСТВОРИМОСТИ
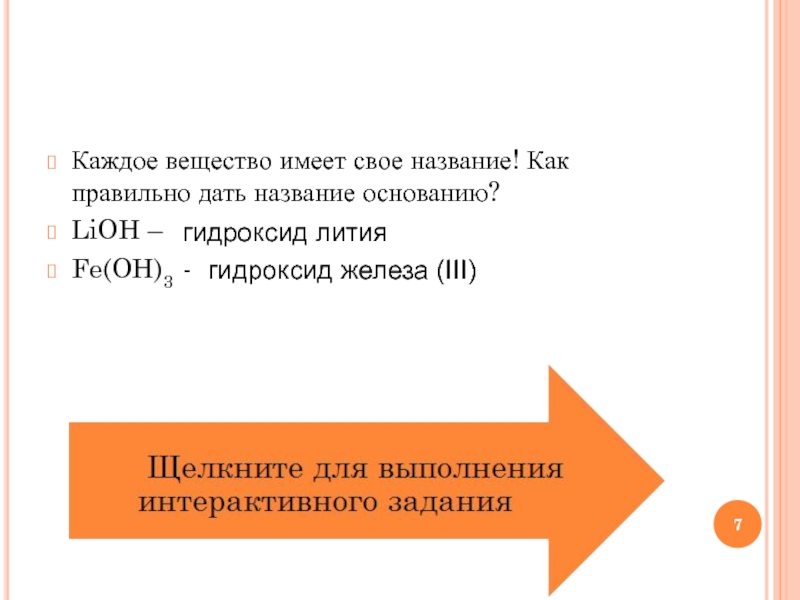
- 7. Каждое вещество имеет свое название! Как правильно
- 8. Каждому основанию соответствует оксид. Что является обязательным условием данного соответствия?
- 9. ПРОБЛЕМА Оксидам металлов соответствуют основания, а оксидам неметаллов?
- 10. Лимонная Яблочная
- 11. ИНДИКАТОРЫ Индикаторы – это вещества, которые изменяют свою окраску в растворах щелочей и кислот
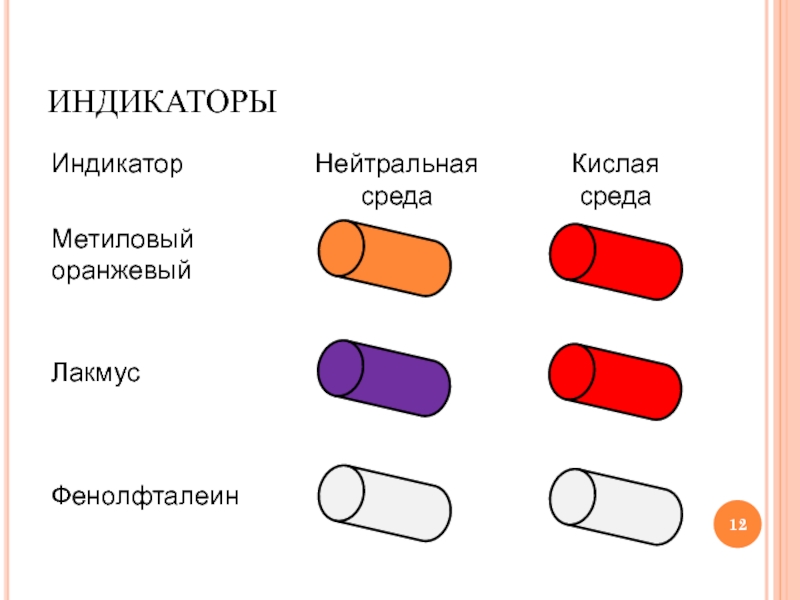
- 12. ИНДИКАТОРЫ Индикатор Метиловый оранжевый Нейтральная среда
- 13. СОСТАВ КИСЛОТ HCl H2SO4 HNO3 H2S H3PO4
- 14. КЛАССИФИКАЦИЯ КИСЛОТ По числу атомов водорода (т.е.
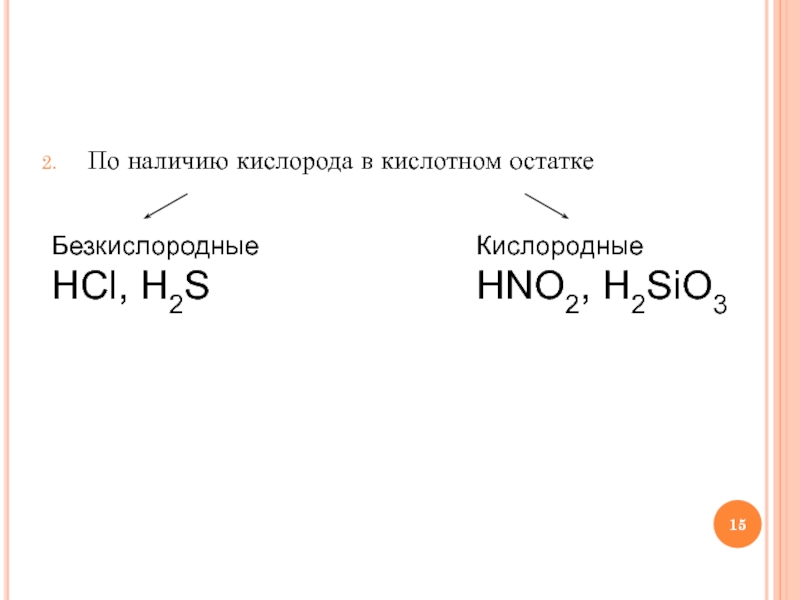
- 15. По наличию кислорода в кислотном остатке Безкислородные HCl, H2S Кислородные HNO2, H2SiO3
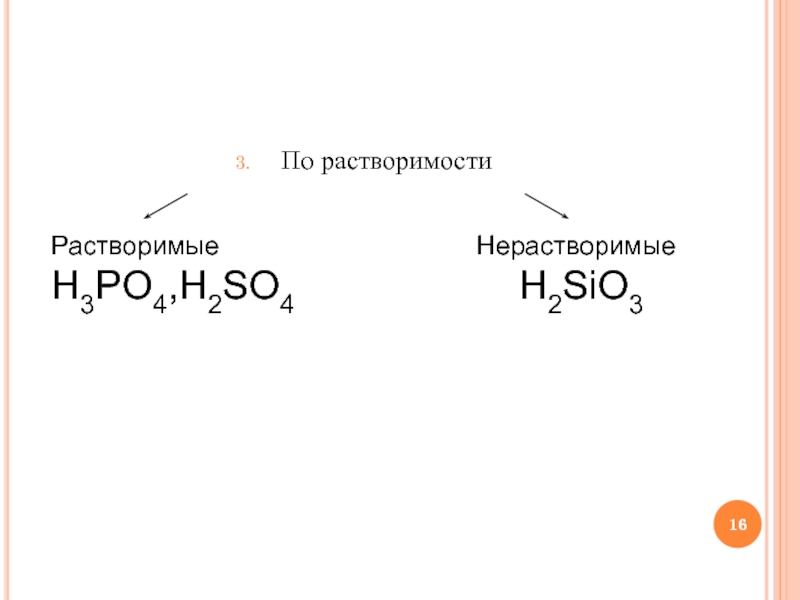
- 16. По растворимости Растворимые H3PO4,H2SO4 Нерастворимые H2SiO3
- 17. ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОТ Жидкие: HCl – соляная,
- 18. ОПРЕДЕЛЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ И ЗАРЯДОВ ИОНОВ
- 19. ВАЖНЕЙШИЕ КИСЛОТЫ Молочная кислота – скисание молока
- 20. ПРАВИЛА РАЗБАВЛЕНИЯ КИСЛОТ Кислоту в воду!!!
- 21. ЗАКРЕПЛЕНИЕ Лабораторный опыт «Определение раствора кислоты с помощью индикатора»
- 22. ДОМАШНЕЕ ЗАДАНИЕ §20. упр. 1,3,5
Слайд 3ПРОВЕРКА ЗНАНИЙ
1. Из предложенного перечня веществ выпишите формулы оснований:
CuO ,
Mn2O7, N2O3, HNO3, H2SO3, H2S, Fe(OH)2, NaOH, A1(OH)3, Ca3(PO4)2, ZnI2, Mg(NO2)2.
2. Дайте им название.
3. Составьте формулы оксидов, соответствующие этим основаниям.
2. Дайте им название.
3. Составьте формулы оксидов, соответствующие этим основаниям.
Слайд 7Каждое вещество имеет свое название! Как правильно дать название основанию?
LiOH –
Fe(OH)3 -
гидроксид лития
гидроксид железа (III)
Слайд 8Каждому основанию соответствует оксид. Что является обязательным условием данного соответствия?
Слайд 11ИНДИКАТОРЫ
Индикаторы – это вещества, которые изменяют свою окраску в растворах щелочей
и кислот
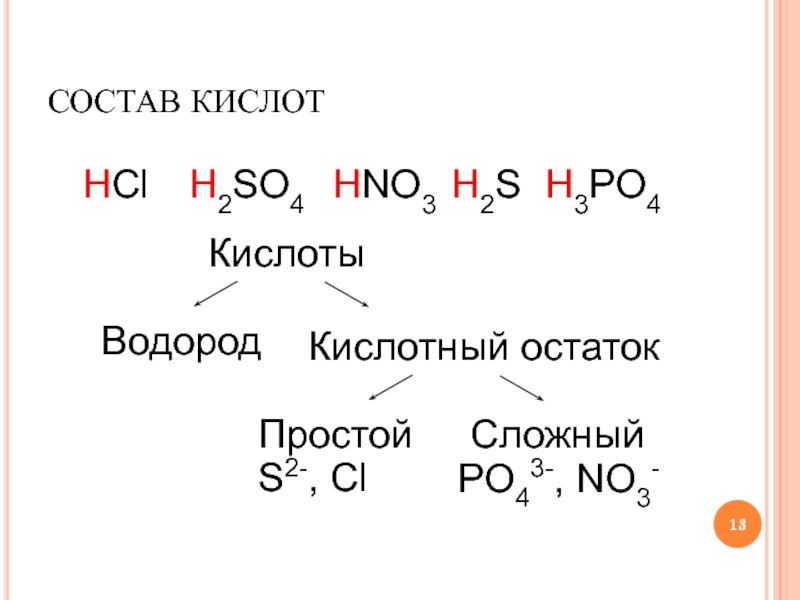
Слайд 13СОСТАВ КИСЛОТ
HCl
H2SO4
HNO3
H2S
H3PO4
Кислоты
Водород
Кислотный остаток
Простой
Сложный
S2-, Cl
PO43-, NO3-
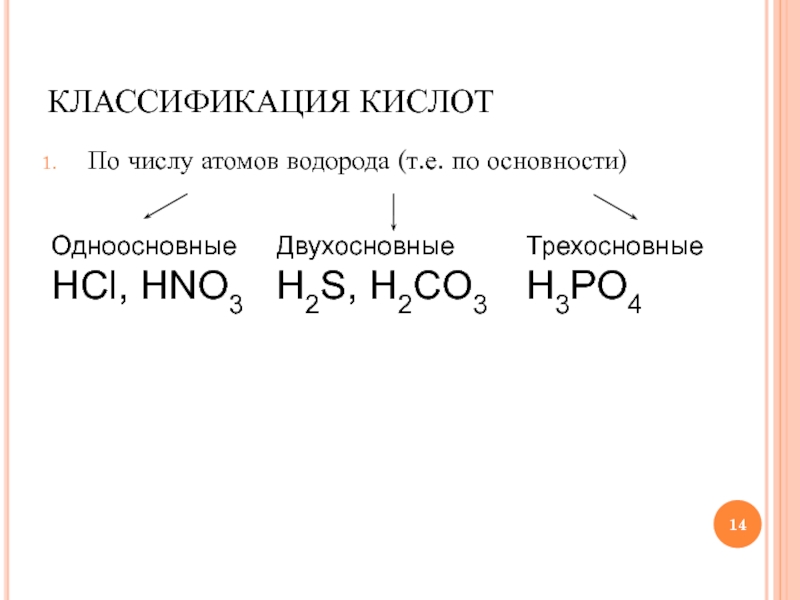
Слайд 14КЛАССИФИКАЦИЯ КИСЛОТ
По числу атомов водорода (т.е. по основности)
Одноосновные
HCl, HNO3
Двухосновные
H2S, H2CO3
Трехосновные
H3PO4
Слайд 17ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОТ
Жидкие: HCl – соляная, H2SO4 – серная.
Твердые: стеариновая, борная
H2CO3
– угольная кислота
H2SO3 – сернистая кислота
H2CO3 H2O + CO2
H2SO3 H2O + SO2
H2SO3 – сернистая кислота
H2CO3 H2O + CO2
H2SO3 H2O + SO2
Слайд 18ОПРЕДЕЛЕНИЕ СТЕПЕНЕЙ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ И ЗАРЯДОВ ИОНОВ КИСЛОТ
Водород в кислотах всегда
заряжен +1.
Численное значение заряда кислотного остатка всегда равно числу атомов водорода в молекуле, т. е. основности данной кислоты.
Примеры:
HNO3 HCl
H2S, Н2СО3
Численное значение заряда кислотного остатка всегда равно числу атомов водорода в молекуле, т. е. основности данной кислоты.
Примеры:
HNO3 HCl
H2S, Н2СО3
Слайд 19ВАЖНЕЙШИЕ КИСЛОТЫ
Молочная кислота – скисание молока
Щавелевая – в листьях щавеля
Серная H2SO4
Получают
Соляная HCl искусственным
Азотная HNO3 путем
Наиболее часто используют серную кислоту H2SO4
Соляная HCl искусственным
Азотная HNO3 путем
Наиболее часто используют серную кислоту H2SO4