- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕМА УРОКА: СВОЙСТВА И ПРИМЕНЕНИЕ ПРЕДЕЛЬНЫХ ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ презентация
Содержание
- 1. ТЕМА УРОКА: СВОЙСТВА И ПРИМЕНЕНИЕ ПРЕДЕЛЬНЫХ ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ
- 2. История открытия и физические свойства муравьиной кислоты
- 3. История открытия и физические свойства уксусной кислоты
- 4. Химические свойства предельных одноосновных карбоновых кислот
- 5. Действие индикаторов
- 6. Предельные одноосновные карбоновые кислоты взаимодействуют с 1. Металлами
- 7. Взаимодействие с металлами
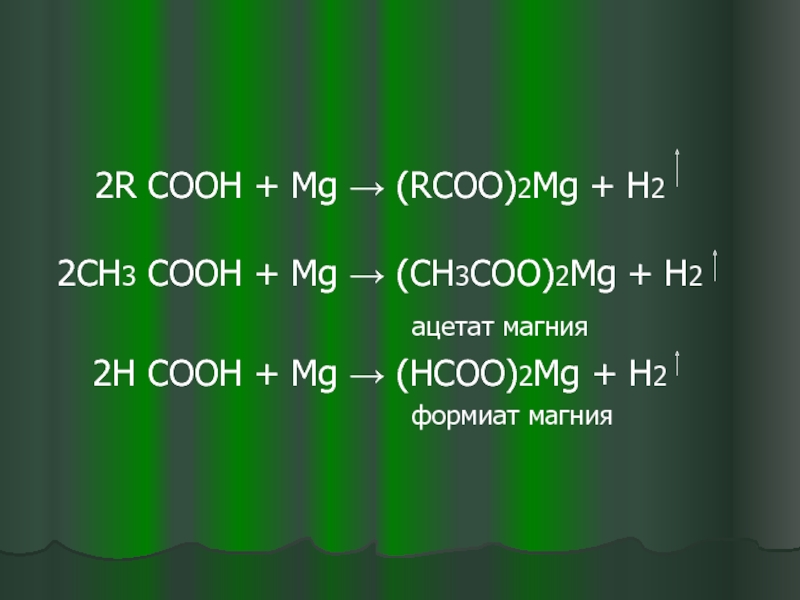
- 8. 2R COOH + Mg →
- 9. 2.Оксидами металлов, 3.Основаниями
- 10. Взаимодействие с основаниями
- 11. 2RCOOH + NaOH → RCOONa + H2O
- 12. 4. Солями, образованными
- 13. Взаимодействие со спиртами
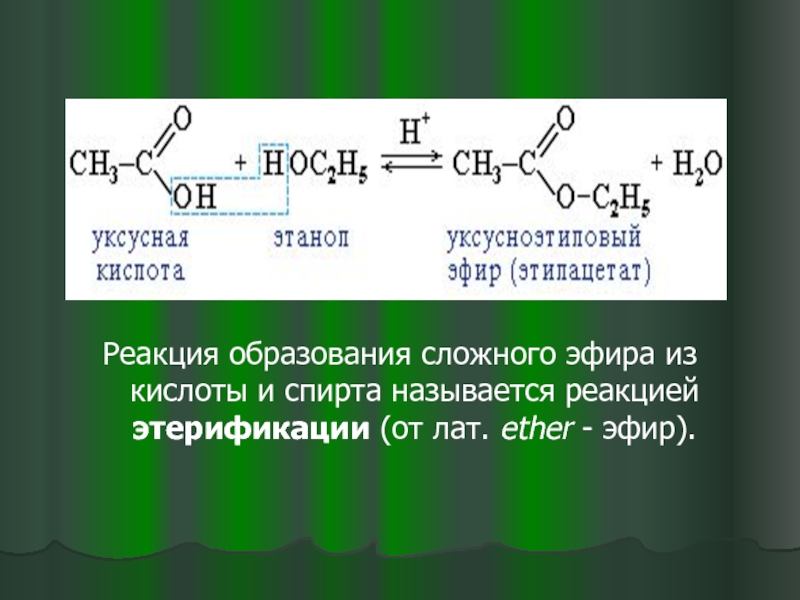
- 14. Реакция образования
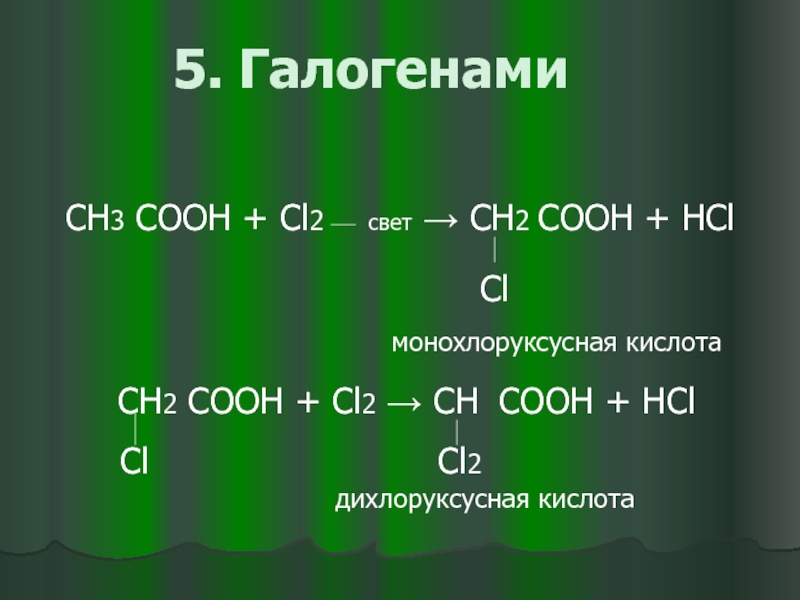
- 15. 5. Галогенами СН3 COOH +
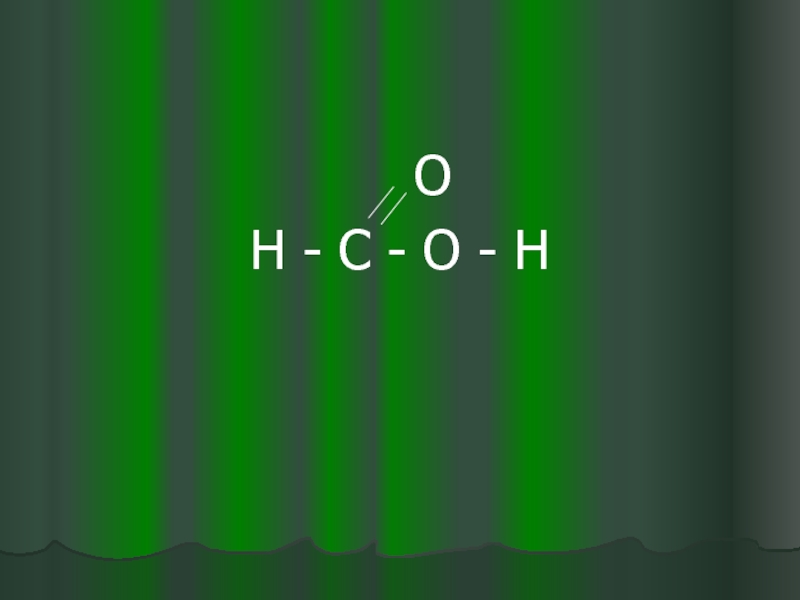
- 16. О Н - С - О - Н
- 17. Специфические свойства муравьиной кислоты
- 18. Реакции окисления 1.Раствором перманганата калия 5НCOOH +
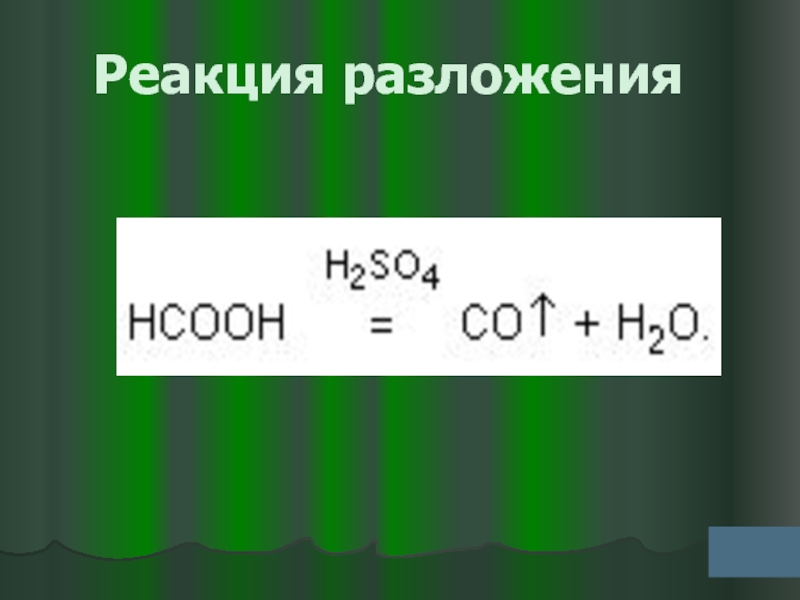
- 19. Реакция разложения
- 20. 6. Реакция горения
- 21. Реакция горения карбоновых кислот
- 22. СН3 COOH + 2О2 → 2 СО2 + 2 Н2О
- 23. Практическое применение муравьиной и уксусной кислот
- 24. Название соли муравьиной и уксусной кислот
- 27. Общее название химической реакции между карбоновой кислотой
- 30. При взаимодействии уксусной кислоты с
- 33. Муравьиная кислота способна разлагаться под действием концентрированной
- 36. Какое утверждение верно Муравьиная кислота – самая
- 39. Специфическим свойством муравьиной кислоты является реакция «серебряного
- 42. Домашнее задание § 20 стр. 178-182, подготовиться
- 43. Муравьиная и уксусная кислоты – едкие вещества.
Слайд 8
2R COOH + Mg → (RCOO)2Mg + H2
2СН3 COOH + Mg → (СН3COO)2Mg + H2
ацетат магния
2Н COOH + Mg → (НCOO)2Mg + H2
формиат магния
Слайд 12 4. Солями, образованными летучими кислотными
2RCOOH + Na2 СO3 → 2RCOONa + СО2 + H2O
2СН3COOH + Na2 СO3 → 2СН3COONa + СО2 +
+ H2O
Слайд 14
Реакция образования сложного эфира из кислоты и спирта называется реакцией
Слайд 15
5. Галогенами
СН3 COOH + Cl2 свет → СН2 COOH +
Cl
монохлоруксусная кислота
СН2 COOH + Cl2 → СН COOH + HCl
Cl Сl2
дихлоруксусная кислота
Слайд 18Реакции окисления
1.Раствором перманганата калия
5НCOOH + 2KMnO4+ 3H2SO4 → 5CO2 +
+K2
2.С гидроксидом диамминсеребра(I)[Аg(NН3)2]ОН
- Реакция «серебряного зеркала»
Слайд 24Название соли муравьиной и уксусной кислот
Метилат и этилат
Формиат и ацетат
Фенолят и
Формиат и этилат
Слайд 27Общее название химической реакции между карбоновой кислотой и спиртом
Реакция нейтрализации
Реакция
Реакция этерификации
Реакция гидрирования
Слайд 30 При взаимодействии уксусной кислоты с цинком образуются:
2 СН3 COOH
2 СН3 COOH + Zn → (СН3COO)2Zn + H2
2 НCOOH + Zn → (НCOO)2Zn + H2О
2 Н COOH + Zn → (НCOO)2Zn + H2
Слайд 33Муравьиная кислота способна разлагаться под действием концентрированной серной кислоты на
Воду и
Воду и углерод
Угарный газ и водород
Воду и угарный газ
Слайд 36Какое утверждение верно
Муравьиная кислота – самая сложная и при этом самая
Муравьиная кислота – самая простая и при этом самая сильная карбоновая кислота.
Муравьиная кислота – самая простая и при этом самая слабая карбоновая кислота
Слайд 39Специфическим свойством муравьиной кислоты является реакция «серебряного зеркала». Это объясняется тем,
Карбоновой кислотой и альдегидом
Карбоновой кислотой и спиртом
Кетоном и альдегидом
Карбоновой кислотой и спиртом
Слайд 42Домашнее задание
§ 20 стр. 178-182, подготовиться к практической работе № 5
Решить задачу
Слайд 43Муравьиная и уксусная кислоты – едкие вещества.
Их пары раздражают слизистые оболочки
Они хорошо растворимы в воде.
Водные растворы кислот – кислые.
Большинство карбоновых кислот реагируют с металлами, гидроксидами металлов с образованием солей.