Подготовили: Касымова Д., Кадирова С., Каримбаева Д.
Проверил: Дауренбеков К.Н.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
СРСтема: Буферные системы, их биологическое и практическое значение презентация
Содержание
- 1. СРСтема: Буферные системы, их биологическое и практическое значение
- 2. План: Введение 1. Определение, классификация,
- 3. Введение Буферные системы – совокупность нескольких
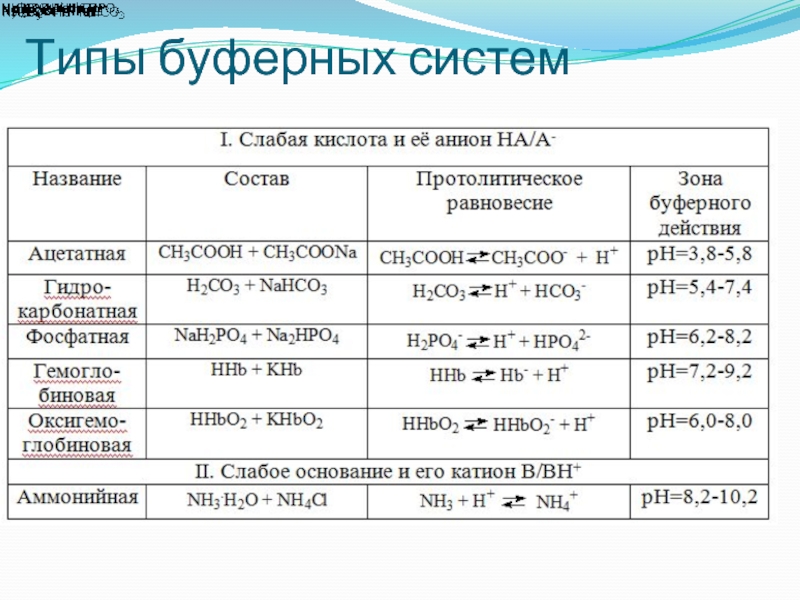
- 5. Типы буферных систем
- 6. Механизм буферного действия Рассмотрим ацетатный буфер, который
- 7. Как видим, сильная соляная кислота заменяется эквивалентным
- 8. Вывод формулы рН буферных систем.
- 9. рН буферного раствора. Пример Чему равен рН буферного
- 10. Для нахождения рН буферного раствора,
- 12. Буферные системы организма человека гидрокарбонатная, гидрофосфатная, белковая гидрокарбонатная, гемоглобиновая, гидрофосфатная
- 13. Свойство буферных систем Соотношение компонентов. Как следует
- 14. Свойство буферных систем Разбавление раствора. Если буферный
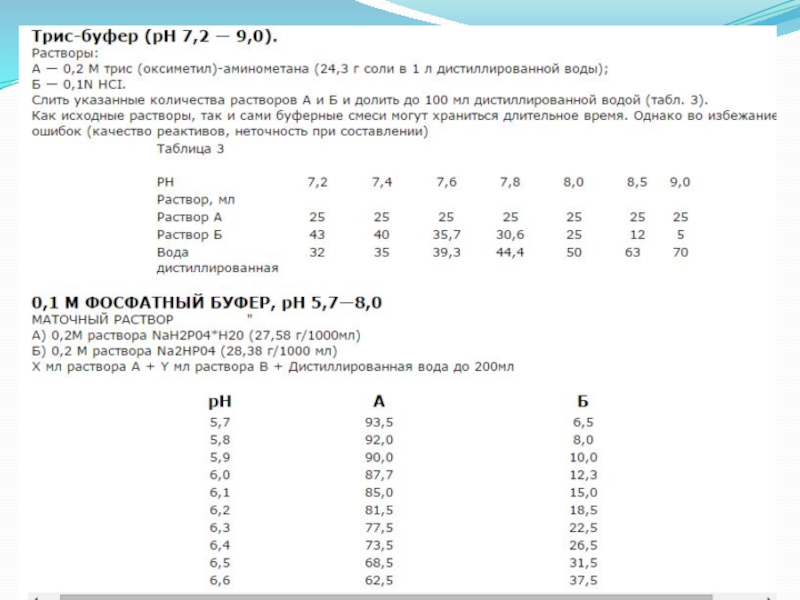
- 15. Способы приготовления буферных растворов
- 17. Буферная емкость Способность буферных растворов противостоять изменению
- 19. Буферная ёмкость определяется двумя факторами: 1)Концентрацией кислотно-основной
- 20. Медико-биологическое значение буферных систем. В организме образуются
- 21. Заключение: Буферные системы широко распространены в природе:
- 22. Список использованной литературы: 1)Горн М.М., Хейтц У.
Слайд 1СРС
тема: Буферные системы, их биологическое и практическое значение
Южно-Казахстанская Государственная фармацевтическая академия
Кафедра
Слайд 2План:
Введение
1. Определение, классификация, состав буферной системы.
2. Механизм буферного действия.
3.
4. Свойства буферных систем:
воздействие на рН соотношения компонентов;
воздействие на рН разбавления раствора.
5. Способы приготовления буферных растворов
6. Буферная емкость
7. Медико-биологическое значение буферных систем.
Заключение
Список использованной литературы
Слайд 3Введение
Буферные системы – совокупность нескольких веществ в растворе, сообщающих ему
Слайд 4
1. Определение, классификация, состав буферной системы
Буферными системами называют
Способность сохранять постоянное значение рН называется буферным действием. Буферные системы по составу бывают двух типов:
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
Например ацетатный буфер состоит из уксусной кислоты и ее натриевой соли (ацетата натрия), аммиачный - из гидроксида аммония и хлорида аммония, в состав гидрокарбонатного буфера входят угольная кислота и гидрокарбонат натрия. Буферными свойствами обладают растворы солей многоосновных кислот, например, фосфатный буфер содержит гидрофосфат и дигидрофосфат натрия или калия.
Слайд 6Механизм буферного действия
Рассмотрим ацетатный буфер, который содержит ионы:
Если к нему
Слайд 7Как видим, сильная соляная кислота заменяется эквивалентным количеством слабой уксусной кислотой,
Щелочь заменяется эквивалентным количеством соли, не влияющей на рН раствора.
Вывод: в БС кислотный компонент нейтрализует щелочь, а основный компонент нейтрализует сильную кислоту, поэтому рН БС практически не изменяется.
Слайд 8Вывод формулы рН буферных систем.
Уравнение Гендерсона-Гассельбаха
[ CH3COOH ] = C кислоты;
–
[
+
СН3СОО
–
СН3СООН СН3СООNa
Н+
Na+ + CH3COO–
в общем случае
рН = рКа + lg
[ сопряженное основание ]
[ кислота ]
Ка =
[ H+ ] [ CH3COO– ]
3
[ CH COOH ]
= 1.75 10
.
–5 ; отсюда [ H+ ] = Ka
[ CH3COOH ]
[ CH3COO– ]
или
pH = pKa + lg
–
[ CH3COO ]
[ CH3COOH ]
a
– lg [ H+ ] = –lg K –lg
3
[ CH COO– ]
[ CH3COOH ]
Слайд 9рН буферного раствора. Пример
Чему равен рН буферного раствора, образовавшегося при смешении 30
Kа = 1,74 ⋅ 10–5.
Рассчитаем объем буферного раствора (V) по формуле:
Получаем:
V = 30 + 50 = 80 (мл).
Вычислим молярную концентрацию уксусной кислоты (СН3СООН) и молярную концентрацию ацетата калия (СН3СООK) в буферной смеси, полученной путем смешения растворов уксусной кислоты (СН3СООН) и ацетата калия (СН3СООK):
СМ (СН3СООН) = (Vисх. (СН3СООН) ⋅ СМ,исх.(СН3СООН)) / V = (30 ⋅ 0,1) / 80 = 0,0375 (М),
СМ (СН3СООK) = (Vисх. (СН3СООK) ⋅ СМ,исх.(СН3СООK)) / V = (50 ⋅ 0,3) / 80 = 0,1875 (М).
Слайд 10
Для нахождения рН буферного раствора, рассчитаем равновесную концентрацию ионов водорода по
где Ka – константа диссоциации слабой кислоты.
Получаем:
[H+] = 1,74 ⋅ 10–5 ⋅ 0,0375 / 0,1875 = 3,48 ⋅ 10–6 (моль/л).
Вычислим рН буферного раствора по формуле:
Получаем:
рН = –lg3,48 ⋅ 10–6 = 5,46
Ответ:
рН буферного раствора равен 5,46.
Слайд 12Буферные системы организма человека
гидрокарбонатная, гидрофосфатная, белковая
гидрокарбонатная, гемоглобиновая, гидрофосфатная
рН = 7.40 ± 0.05; a(H+) =
Артериальная кровь:
рН = 7.38 – 7.42.
Плазмакрови
❖
❖
Венозная кровь: рН 7.36 – 7.40.
Внутриклеточные жидкости: рН = 6.8 – 7.8.
гидрокарбонатная, гидрофосфатная, белковая, гемоглобиновая
(В. А. Попков, С.А. Пузаков, 2007, 605−612; В. И. Слесарев, 2000, 197−207; А. С. Ленский, И. Ю. Белавин, С. Ю. Быликин, 2008, 316−321)
Буферные системы крови
Плазма крови Эритроциты
17
Слайд 13Свойство буферных систем
Соотношение компонентов.
Как следует из уравнения Гендерсона-Хассельбаха, рН буферного раствора
Поэтому, в случае кислотно-солевой буферной системы, увеличение концентрации кислоты или снижение концентрации соли сдвигает рН раствора в кислую сторону. При этом изменение соотношения концентраций в 10 раз сдвигает рН на единицу.
Аналогичные явления наблюдаются в щелочно-солевых буферных системах.
Слайд 14Свойство буферных систем
Разбавление раствора.
Если буферный раствор разбавить в 10-20 раз, то
Естественно, какое-то небольшое изменение рН происходит, ибо с уменьшением концентрации увеличивается степень диссоциации кислоты, а уменьшение концентрации соли меняет степень ее гидролиза.
Свойством буферных систем сохранять постоянство рН при разбавлении широко пользуются при проведении анализов биологических жидкостей. Небольшие их количества можно разбавить водой до нужного объема.
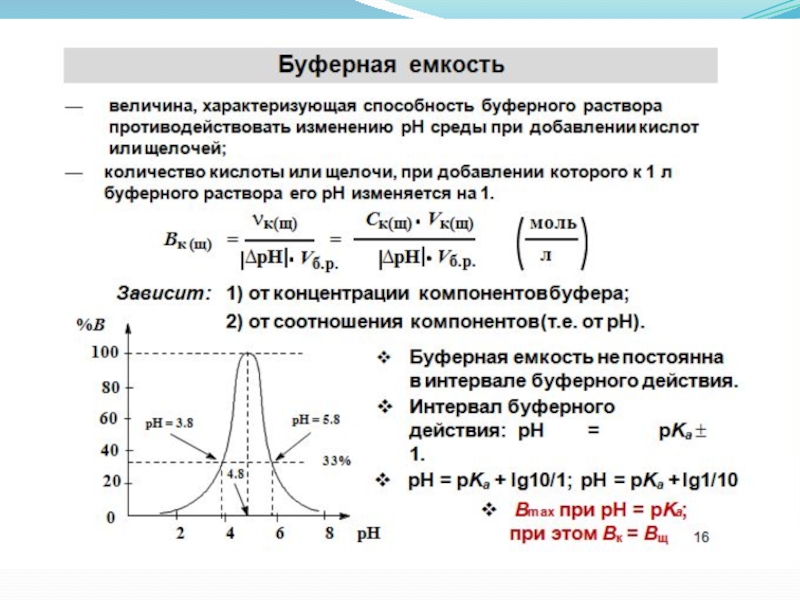
Слайд 17Буферная емкость
Способность буферных растворов противостоять изменению рН при добавлении сильных кислот
Практически буферную ёмкость определяют титрованием точно отмеренного объёма буферного раствора сильной кислотой (HCl) или щелочью (KOH, NaOH) в присутствии кислотно – основных индикаторов.
Величина буферной ёмкости рассчитывается по формулам:
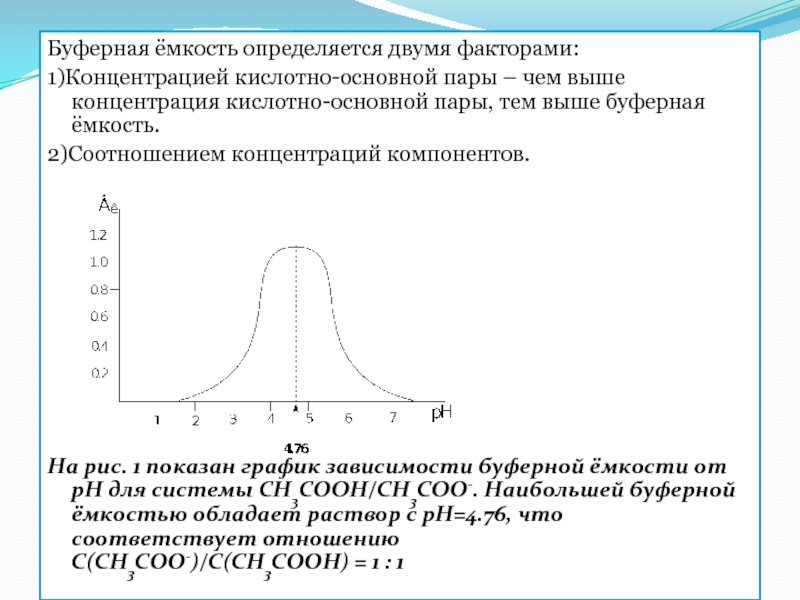
Слайд 19Буферная ёмкость определяется двумя факторами:
1)Концентрацией кислотно-основной пары – чем выше концентрация
2)Соотношением концентраций компонентов.
На рис. 1 показан график зависимости буферной ёмкости от рН для системы CH3COOH/CH3COO-. Наибольшей буферной ёмкостью обладает раствор с рН=4.76, что соответствует отношению С(CH3COO-)/С(CH3COOH) = 1 : 1
Слайд 20Медико-биологическое значение буферных систем.
В организме образуются большие количества кислых продуктов. Например
Слайд 21Заключение:
Буферные системы широко распространены в природе: они находятся в водах мирового
Слайд 22Список использованной литературы:
1)Горн М.М., Хейтц У. И., Сверинген П. Л. Водно-электролитный
2)Березов Т. Т., Коровкин Б. Ф. Биологическая химия.- М.: Медицина, 1998.- 704 с.
3)Долгов В. В., Киселевский Ю. В., Авдеева Н.А., Holden Е., Moran В. Лабораторная диагностика кислотно-основного состояния.- 1996.- 51 с.
4)Единицы СИ в медицине: Пер. с англ. / Отв. ред. Меньшиков В. В.- М.: Медицина, 1979.- 85 с.
5)Зеленин К. Н. Химия.- СПб: Спец. литература, 1997.- С. 152-179.
6)Основы физиологии человека: Учебник / Под ред. Б.И.Ткаченко - СПб., 1994.- Т. 1.- С. 493-528.






![Вывод формулы рН буферных систем.Уравнение Гендерсона-Гассельбаха[ CH3COOH ] = C кислоты;–[ CH3COO ] = C соли+СН3СОО–СН3СООН](/img/tmb/2/175341/a8f398b293e665988a162317bab42cce-800x.jpg)