- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Спирты презентация
Содержание
- 1. Спирты
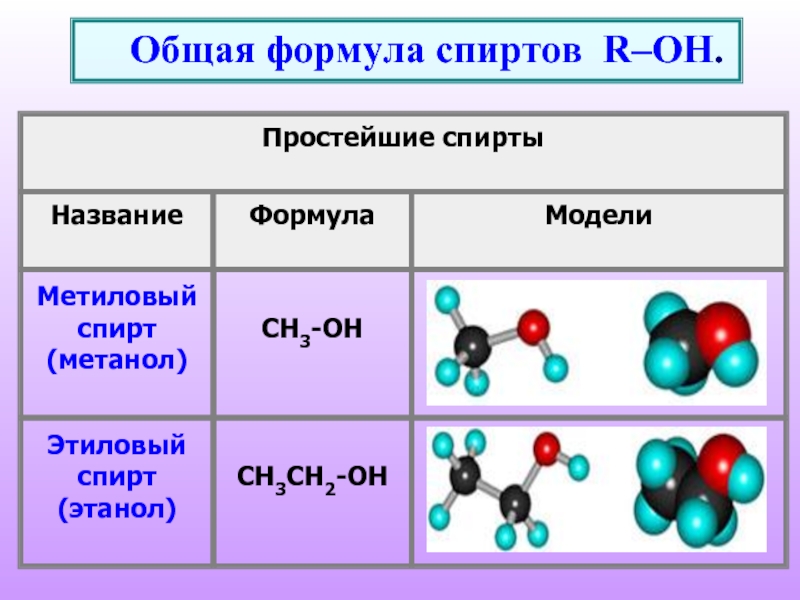
- 2. Общая формула спиртов R–OH.
- 3. Классификация спиртов По числу
- 4. Глицерин - простейший трехатомный спирт. Применяется в
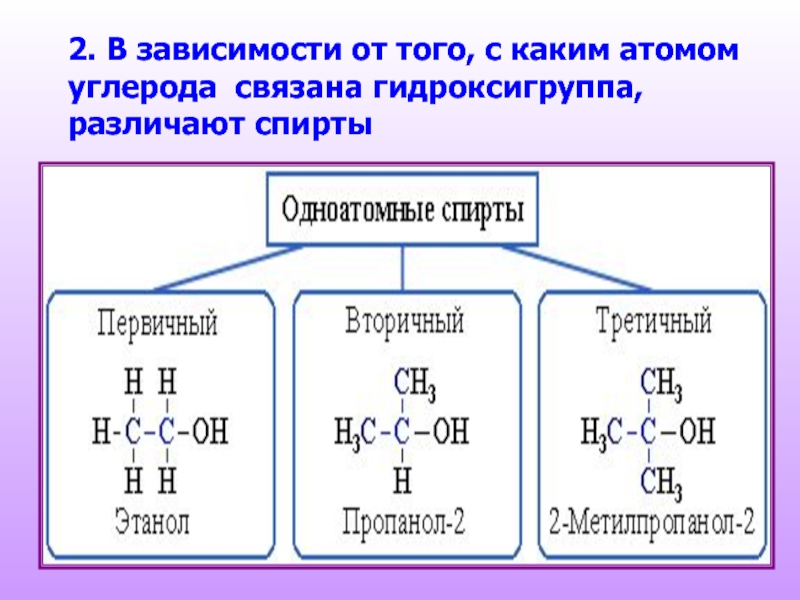
- 5. 2. В зависимости от того, с каким
- 6. 3. По строению радикалов, связанных с атомом
- 7. Номенклатура спиртов Систематические названия даются
- 8. Изомерия спиртов Cтруктурная изомерия: Межклассовая
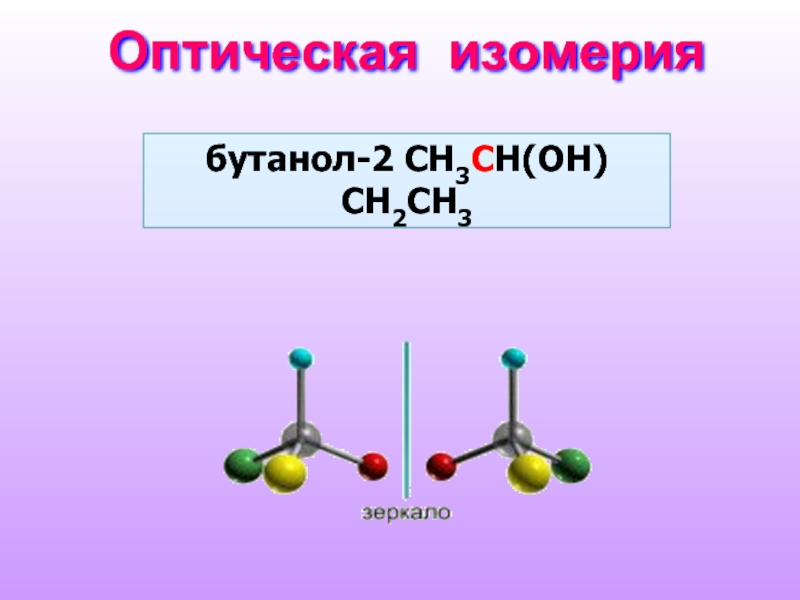
- 9. Оптическая изомерия бутанол-2 СH3CH(OH)СH2CH3
- 10. Строение гидроксильной группы Полярная связь
- 11. Водородные связи и физические свойства Следствием
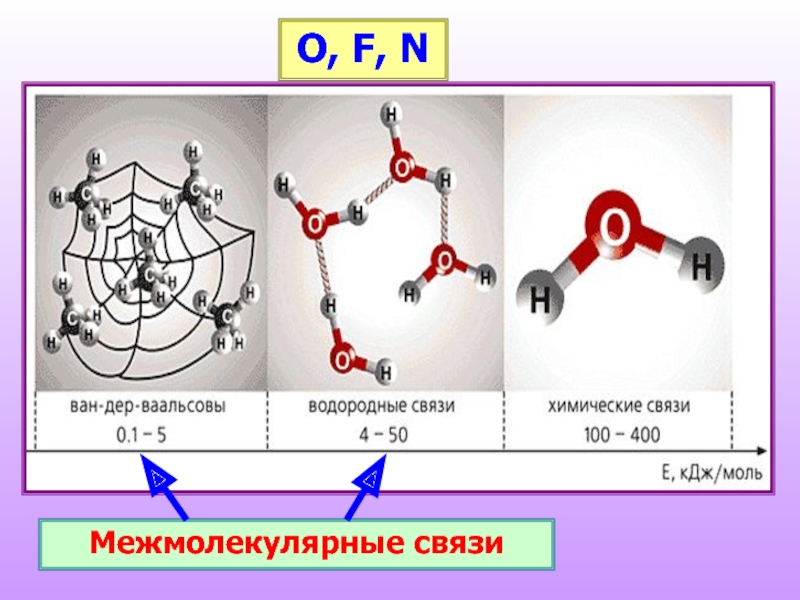
- 12. Межмолекулярные связи O, F, N
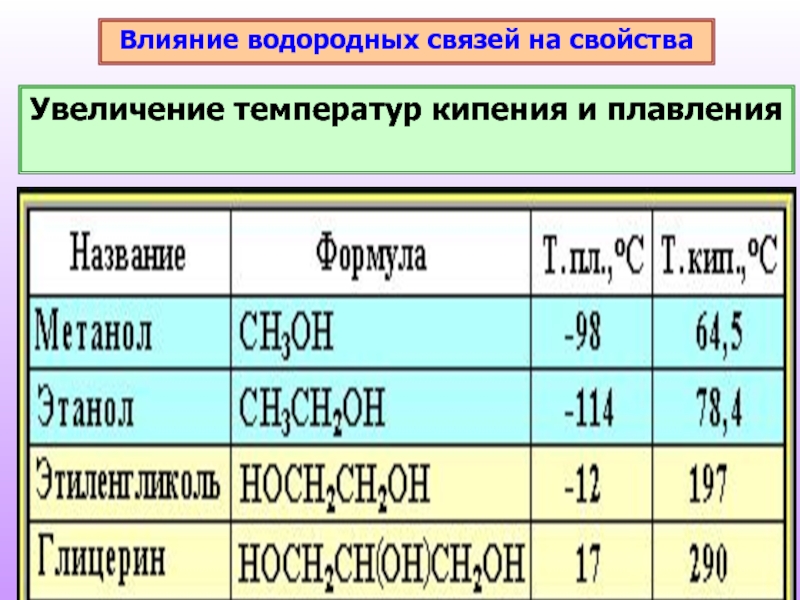
- 13. Влияние водородных связей на свойства Увеличение температур кипения и плавления
- 14. Образование водородных связей с молекулами воды способствует
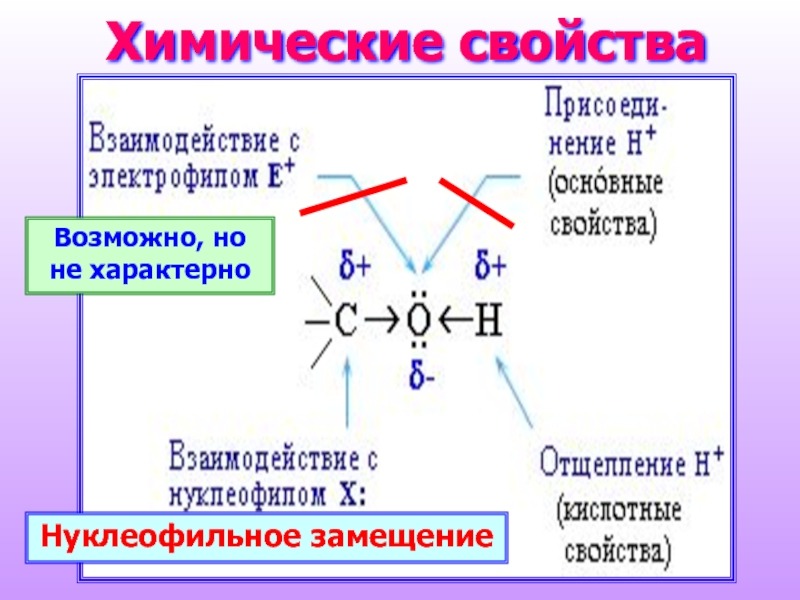
- 15. Химические свойства Нуклеофильное замещение Возможно, но не характерно
- 16. Реакции по связи О–Н CH3OH >
- 17. 2R–OH + 2Na → 2RONa + H2
- 18. Многоатомные спирты реагируют с гидроксидами тяжелых металлов
- 19. Реакция этрификации
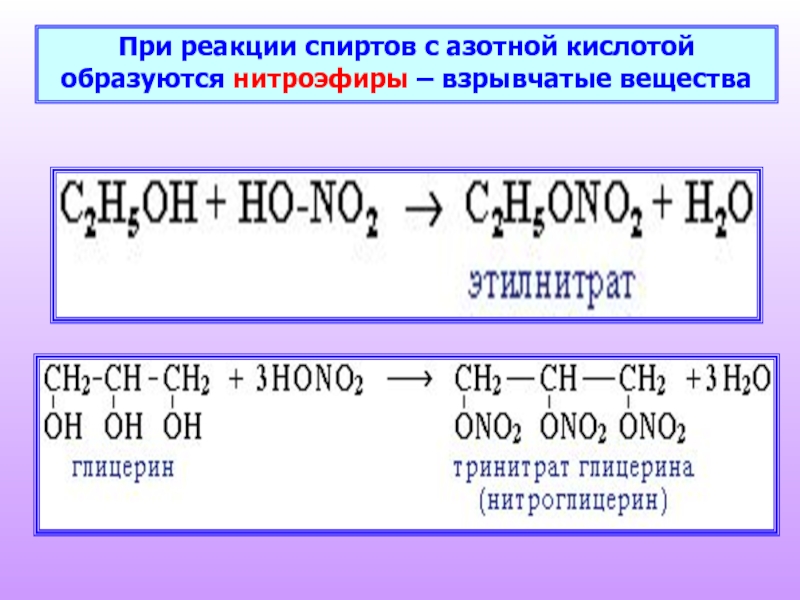
- 20. При реакции спиртов с азотной кислотой образуются нитроэфиры – взрывчатые вещества
- 21. Окисление Окислители - KMnO4 , K2Cr2O7,
- 22. Реакции по связи С–О нуклеофильное замещение
- 23. Реакции дегидратации спиртов Внутримолекулярная дегидратация
- 24. 2. Межмолекулярная дегидратация спиртов происходит при температуре
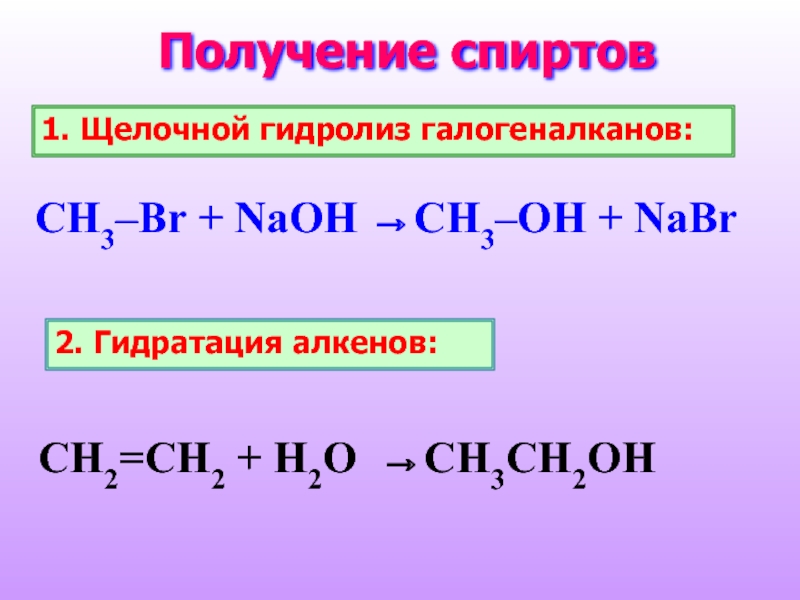
- 25. Получение спиртов 1. Щелочной гидролиз галогеналканов:
- 26. Простые эфиры R'–O–R" CH3OCH3 - диметиловый эфир
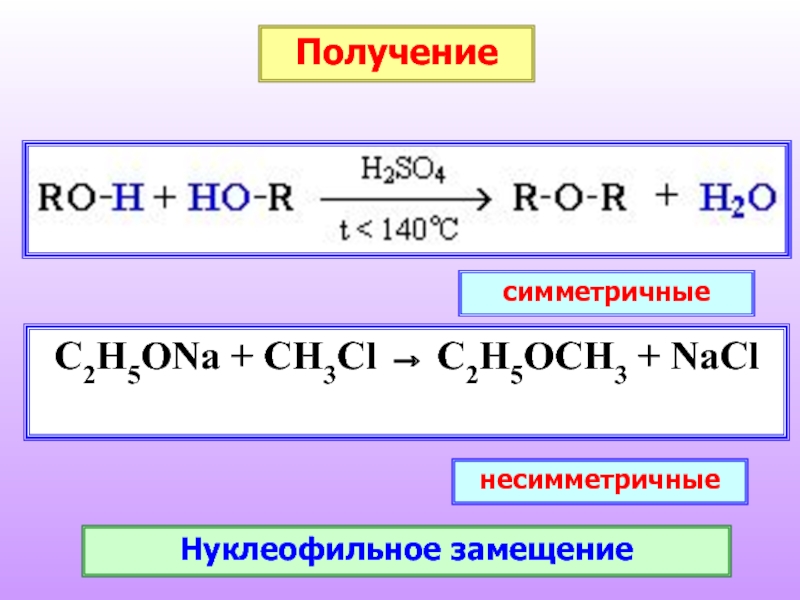
- 27. Получение
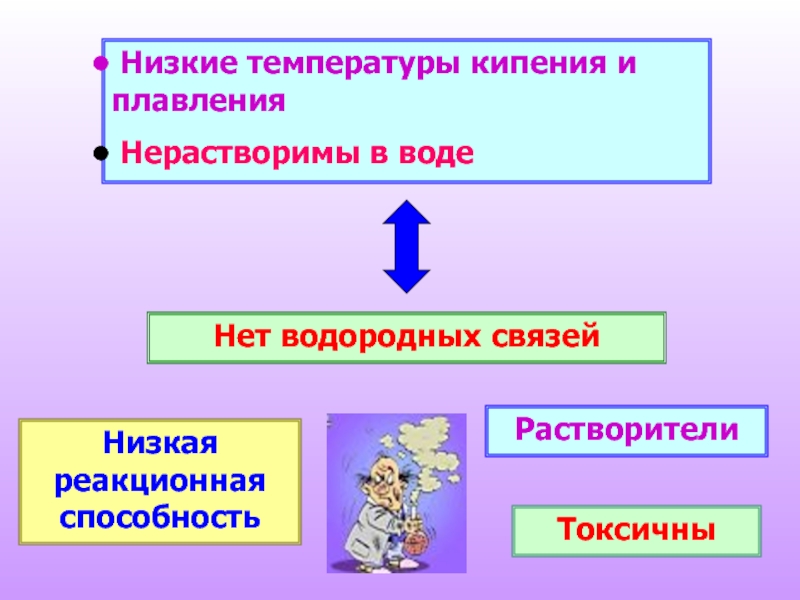
- 28. Низкие температуры кипения и плавления
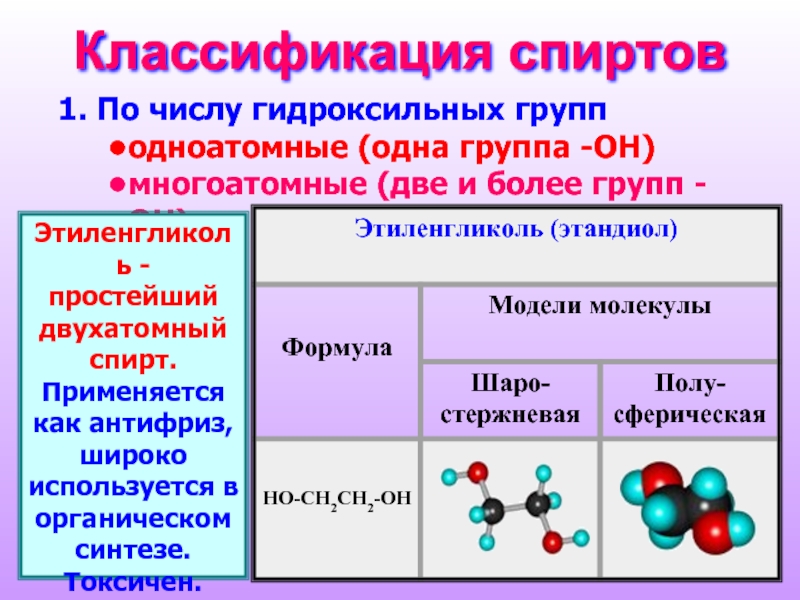
Слайд 3Классификация спиртов
По числу гидроксильных групп
одноатомные (одна группа -ОН)
многоатомные (две
Этиленгликоль - простейший двухатомный спирт. Применяется как антифриз, широко используется в органическом синтезе. Токсичен.
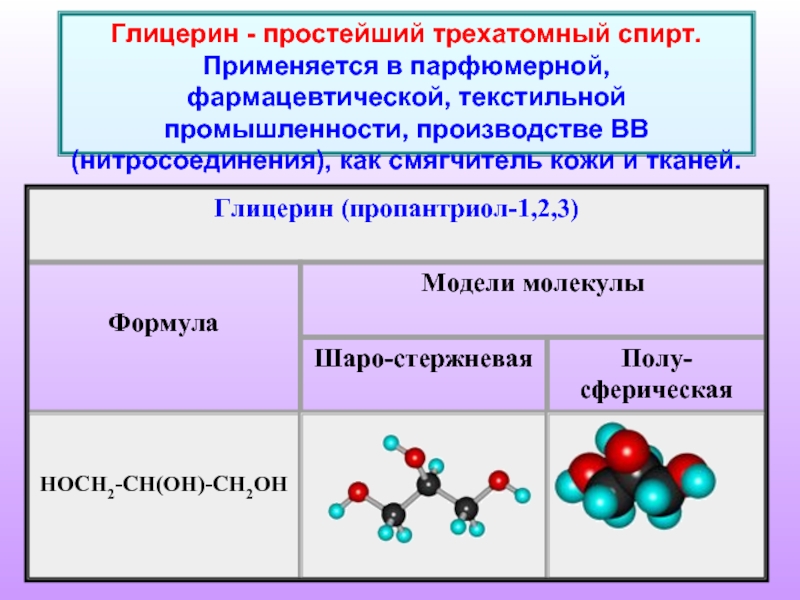
Слайд 4Глицерин - простейший трехатомный спирт. Применяется в парфюмерной, фармацевтической, текстильной промышленности,
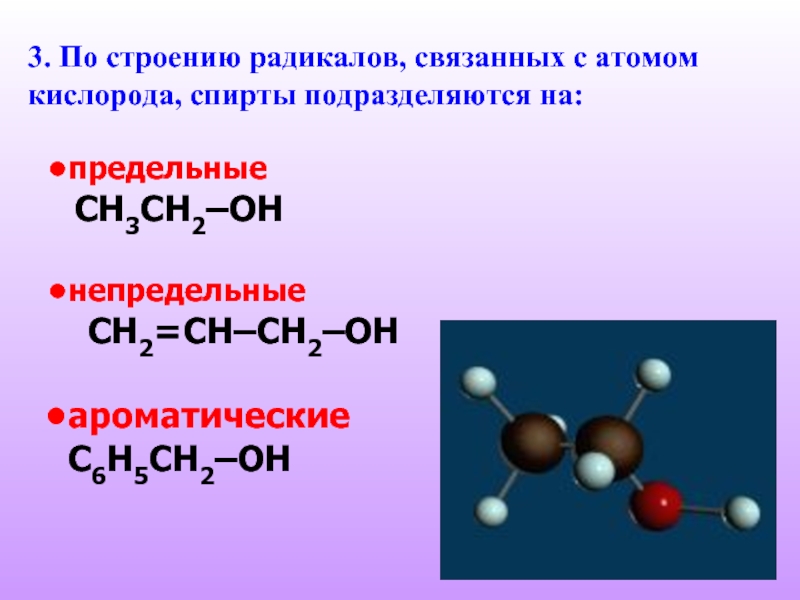
Слайд 63. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на:
предельные
СH3CH2–OH
непредельные
CH2=CH–CH2–OH
ароматические
C6H5CH2–OH
Слайд 7Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса
Нумерация ведется от ближайшего к ОН-группе конца цепи.
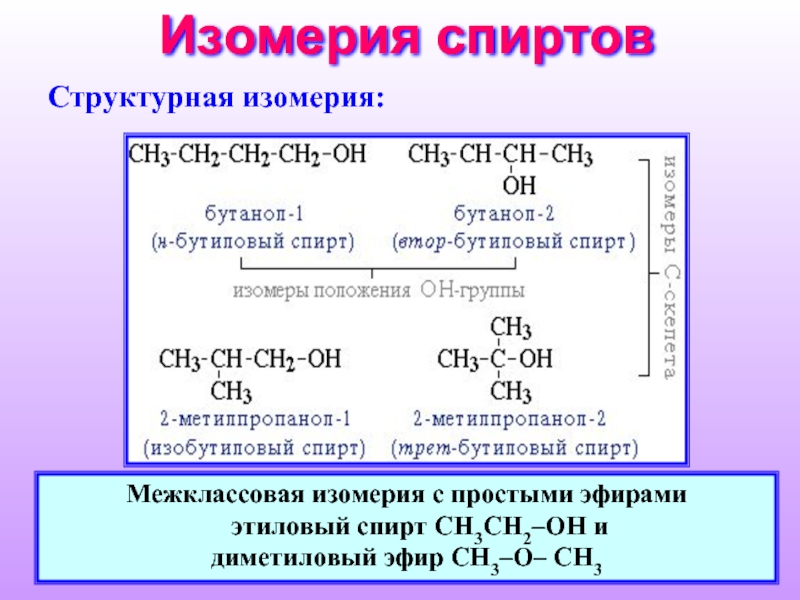
Слайд 8Изомерия спиртов
Cтруктурная изомерия:
Межклассовая изомерия с простыми эфирами
этиловый спирт СН3CH2–OH и
диметиловый эфир
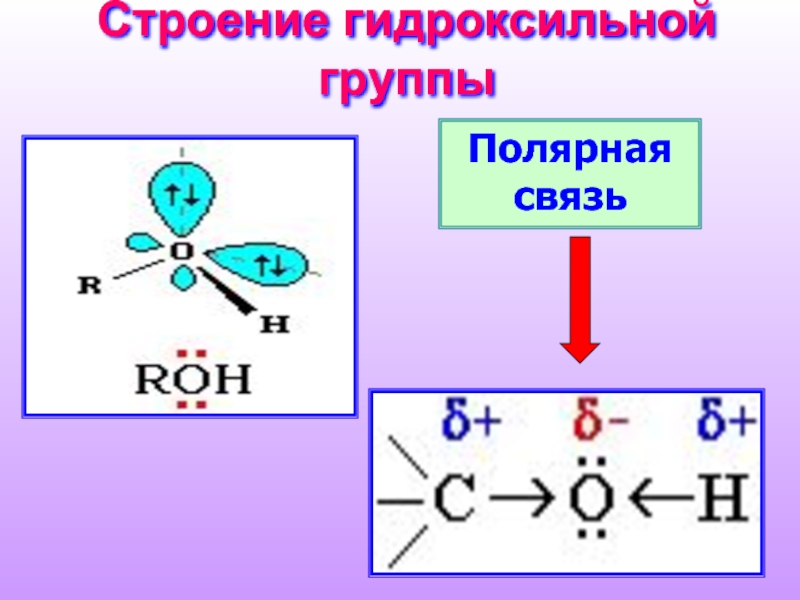
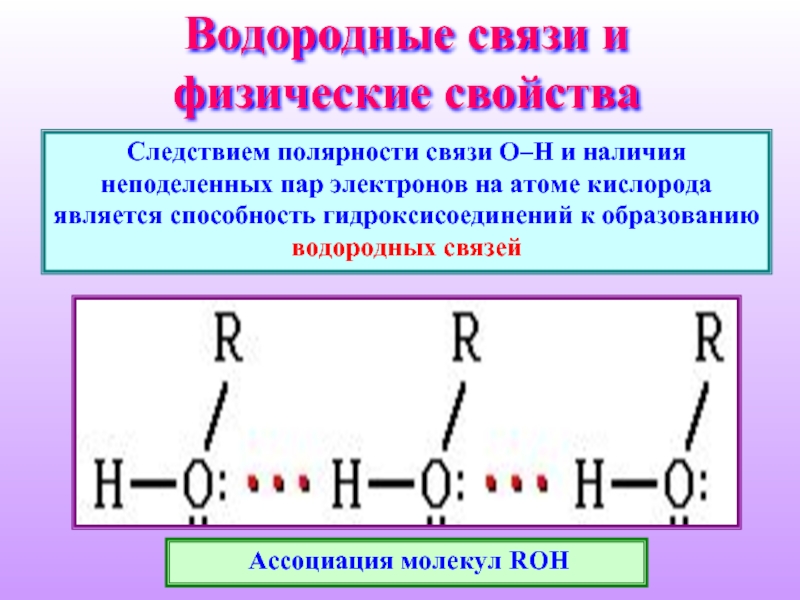
Слайд 11Водородные связи и физические свойства
Следствием полярности связи О–Н и наличия неподеленных
Ассоциация молекул ROH
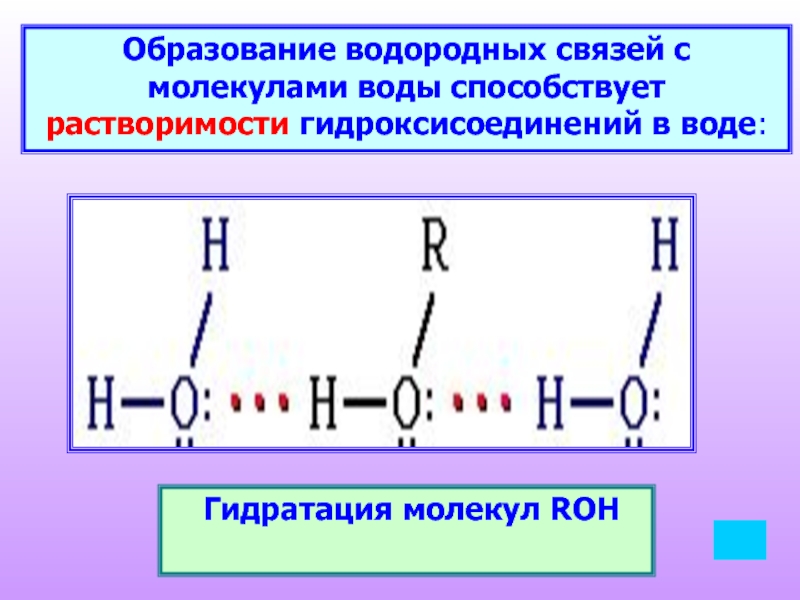
Слайд 14Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
Гидратация молекул ROH
Слайд 16Реакции по связи О–Н
CH3OH > первичные > вторичные > третичные
реакции замещения атома водорода на металл (кислотные свойства);
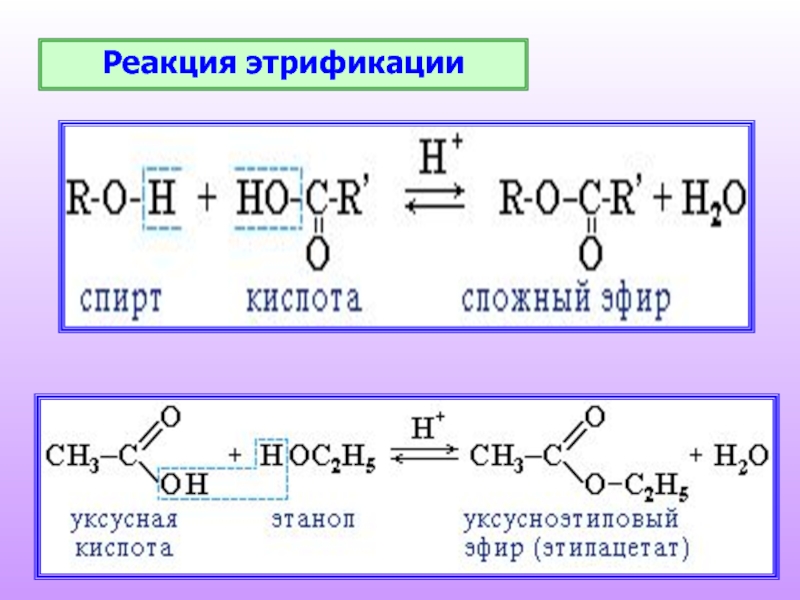
реакции замещения атома водорода на остаток кислоты (образование сложных эфиров);
реакции отщепления водорода при окислении и дегидрировании.
Реакционная способность
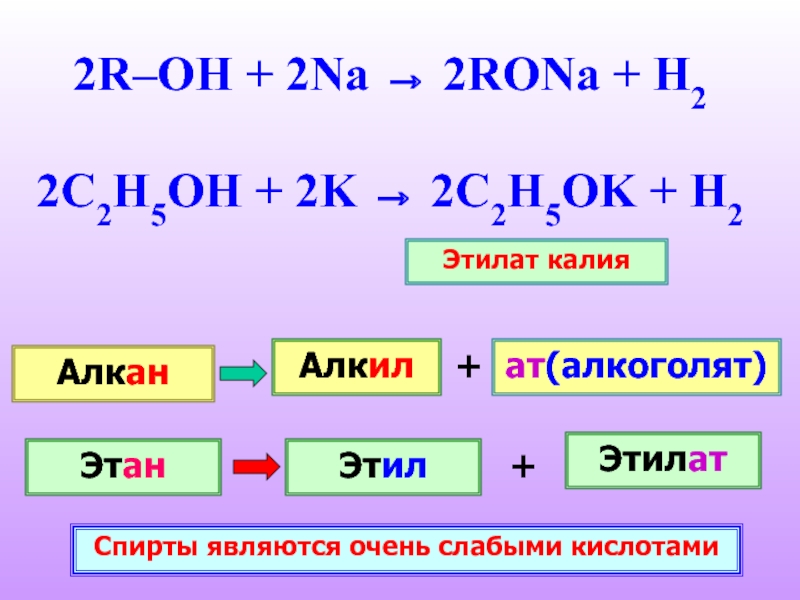
Слайд 172R–OH + 2Na → 2RONa + H2
2C2H5OH + 2K → 2C2H5OK
Этилат калия
Алкан
Алкил
ат(алкоголят)
Этан
Этил
Этилат
+
+
Спирты являются очень слабыми кислотами
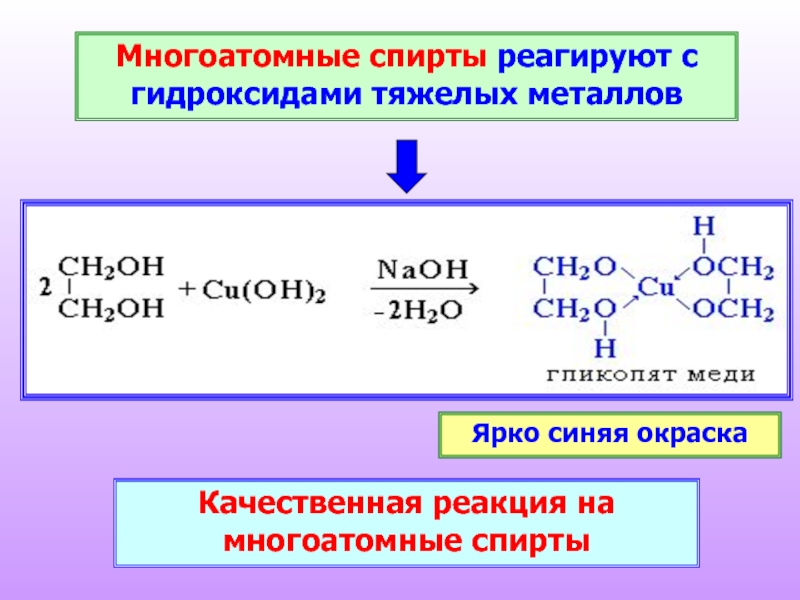
Слайд 18Многоатомные спирты реагируют с гидроксидами тяжелых металлов
Качественная реакция на многоатомные спирты
Ярко
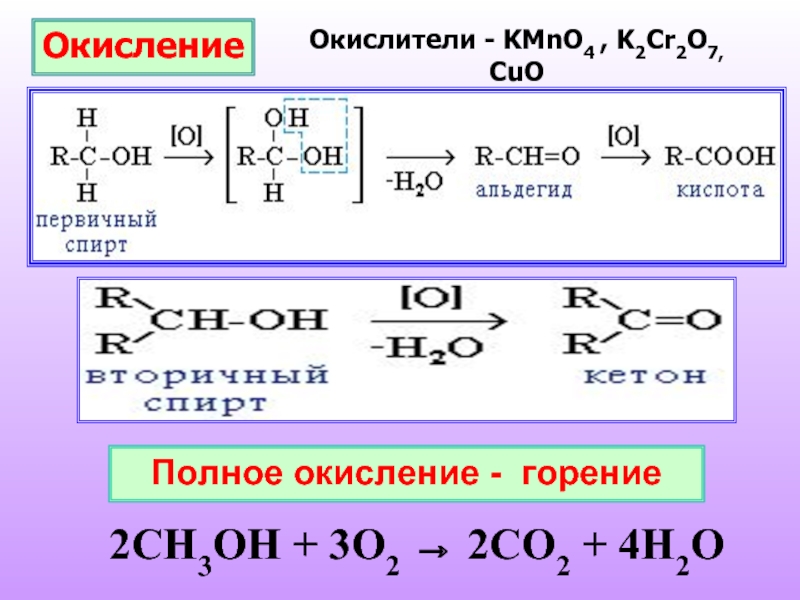
Слайд 21Окисление
Окислители - KMnO4 , K2Cr2O7, CuO
Полное окисление - горение
2CH3OH
Слайд 22Реакции по связи С–О
нуклеофильное замещение - SN :
внутримолекулярная дегидратация спиртов –
межмолекулярная дегидратация – образование простых эфиров
Реакционная способность спиртов в реакциях по связи С-О:
третичные > вторичные > первичные > CH3OH
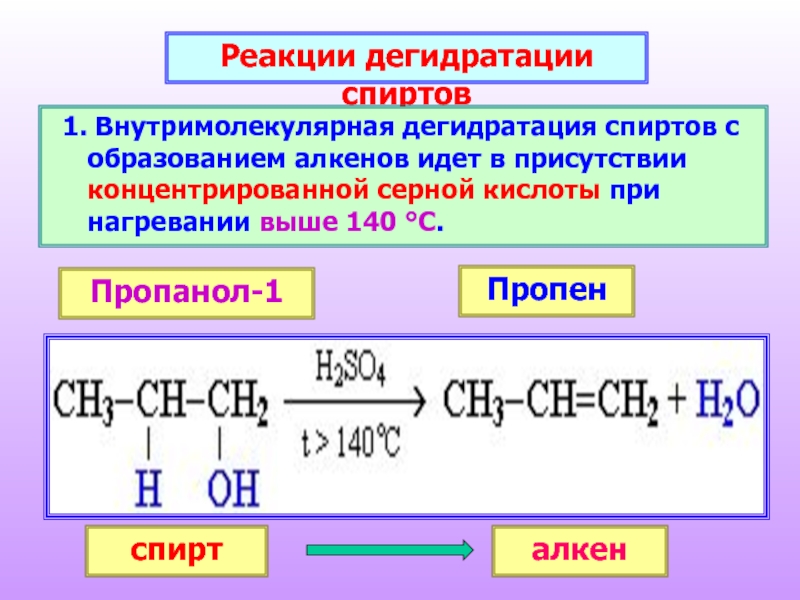
Слайд 23Реакции дегидратации спиртов
Внутримолекулярная дегидратация спиртов с образованием алкенов идет
спирт
алкен
Пропанол-1
Пропен
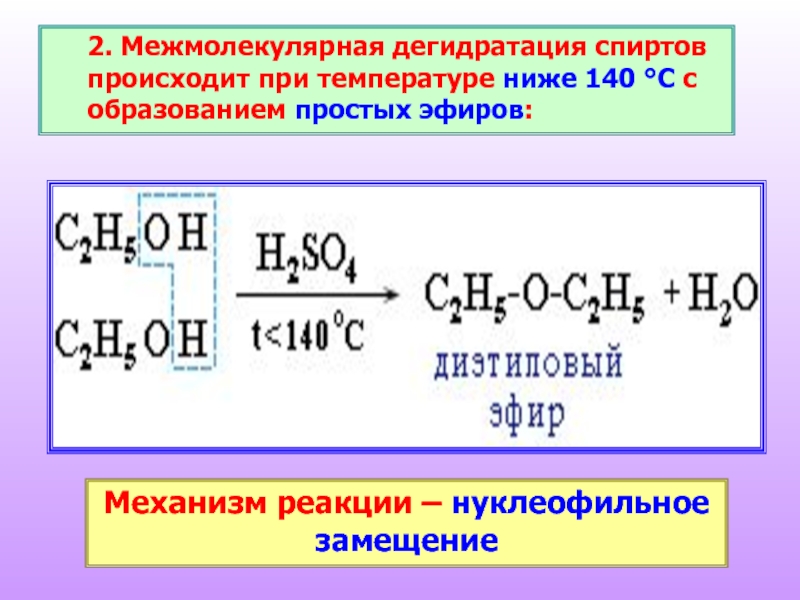
Слайд 242. Межмолекулярная дегидратация спиртов происходит при температуре ниже 140 °С с
Механизм реакции – нуклеофильное замещение
Слайд 25Получение спиртов
1. Щелочной гидролиз галогеналканов:
CH3–Br + NaOH →CH3–OH +
2. Гидратация алкенов:
CH2=CH2 + H2O →CH3CH2OH
Слайд 26Простые эфиры
R'–O–R"
CH3OCH3 - диметиловый эфир
C2H5OCH3 - метилэтиловый эфир
R' и R"
Номенклатура
Слайд 27
Получение
C2H5ONa + CH3Cl → C2H5OCH3 + NaCl
симметричные
несимметричные
Нуклеофильное замещение
Слайд 28 Низкие температуры кипения и плавления
Нерастворимы в воде
Нет водородных связей
Низкая
Растворители
Токсичны