МОУ Аннинская средняя общеобразовательная школа № 1
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Состав и химические свойства кислот презентация
Содержание
- 1. Состав и химические свойства кислот
- 2. Задачи урока продолжать знакомить учащихся с кислотами,
- 3. О чем идет речь? (Актуализация
- 4. О чем идет речь? Если формулы
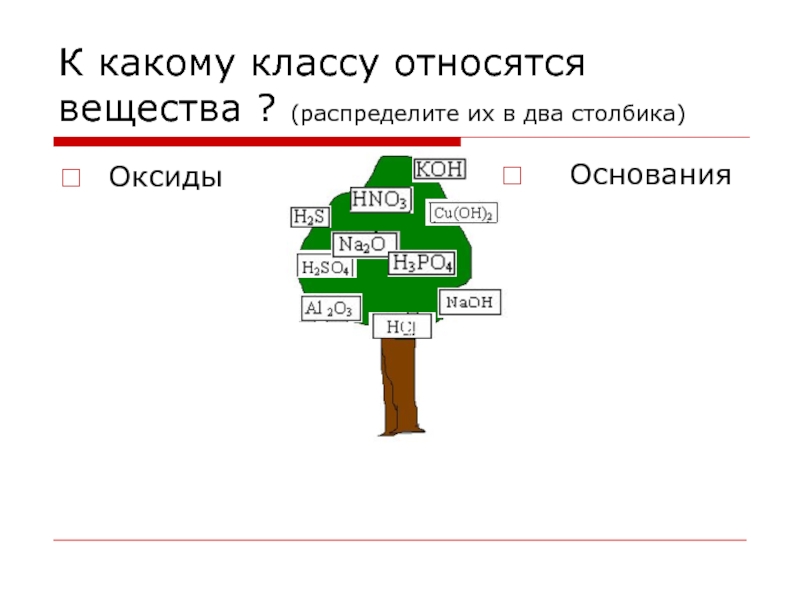
- 5. К какому классу относятся вещества ? (распределите их в два столбика) Оксиды Основания
- 6. Какие вещества остались на «дереве»? Чем
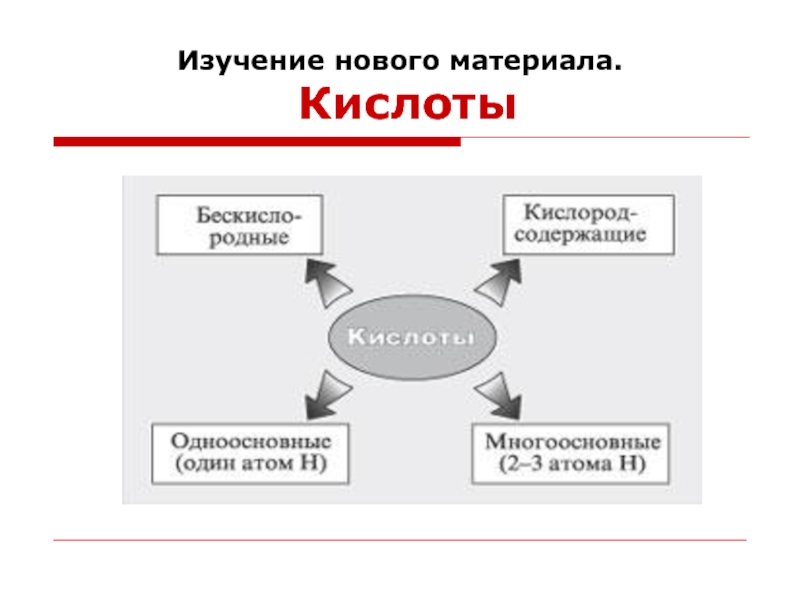
- 7. Изучение нового материала. Кислоты
- 8. Нахождение кислот в природе и их применение.
- 9. «Парад кислот» (органические кислоты) Муравьиная кислота.
- 10. Муравьиная кислота. Растет крапива у
- 11. Лимонная кислота. Лимонной кислоте повсюду место
- 12. Уксусная кислота Уксус нам в быту
- 13. Молочная кислота. Молочная кислота распространена в
- 14. «Парад кислот» (неорганические кислоты) Соляная кислота. Угольная кислота. Фтороводородная кислота. Серная кислота.
- 15. Соляная кислота. В желудочном соке я
- 16. Угольная кислота. Не ищите меня вы
- 17. Фтороводородная кислота. Фтороводородной зовусь я кислотой.
- 18. Серная кислота. Я – мать всех
- 19. Как работать с кислотами?
- 20. Как работать с кислотами?
- 21. Правила работы с кислотами Проявлять осторожность. При
- 22. “I n d I c a t o r” = указатель
- 23. Лабораторный опыт №9 «Распознавание кислот с
- 24. Отгадайте загадки: От щелочи я желт, как
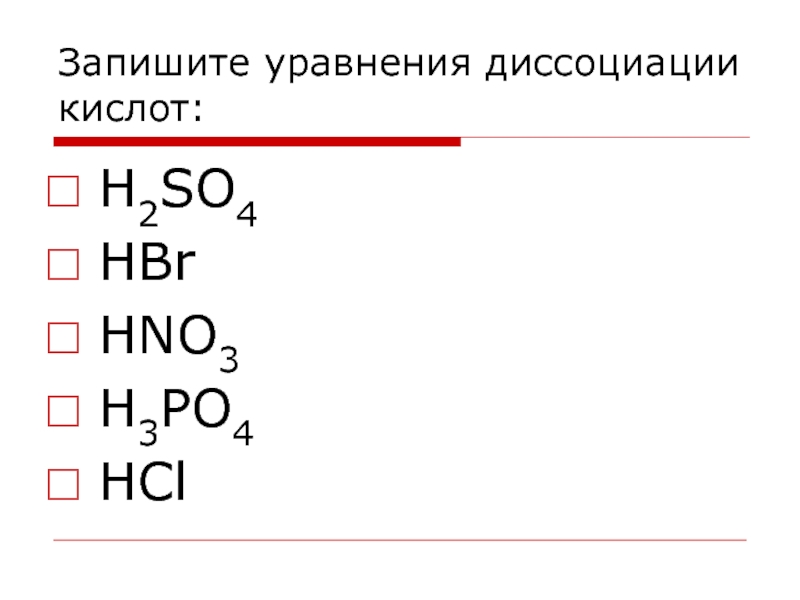
- 25. Запишите уравнения диссоциации кислот: H2SO4 НBr НNO3 Н3PO4 HCl
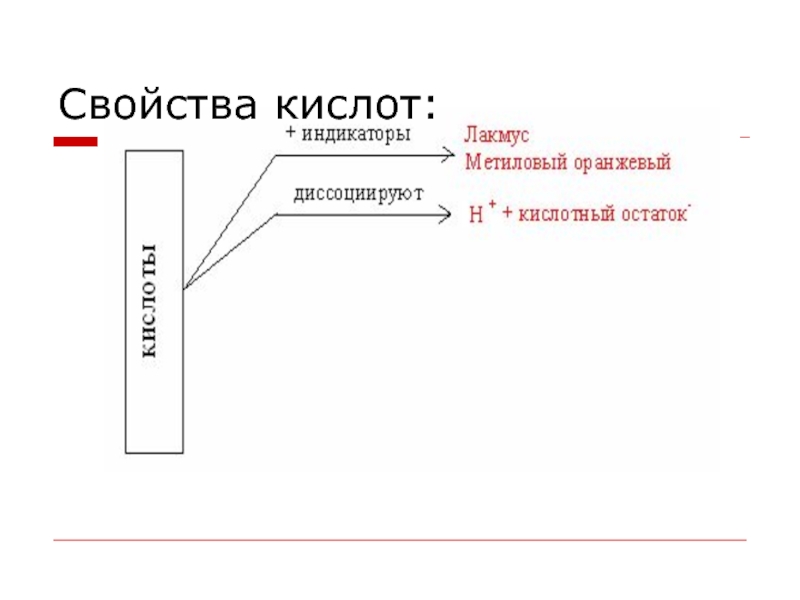
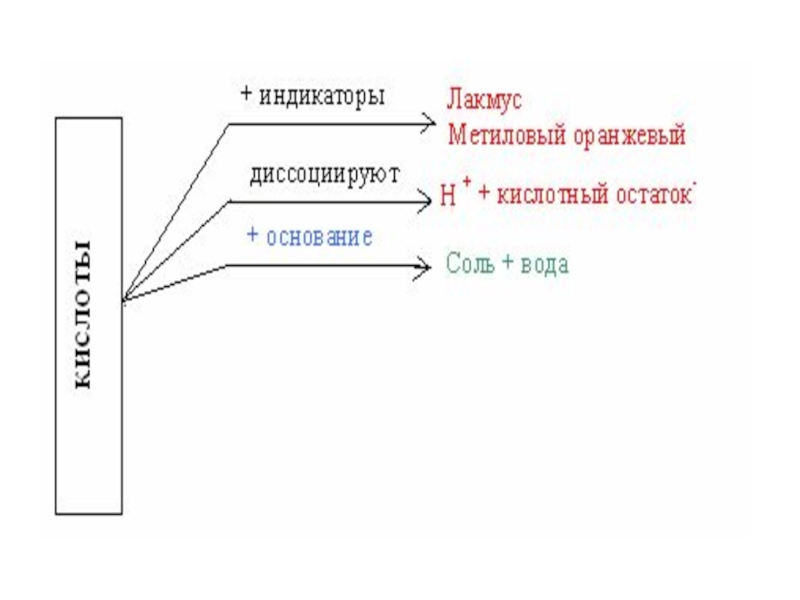
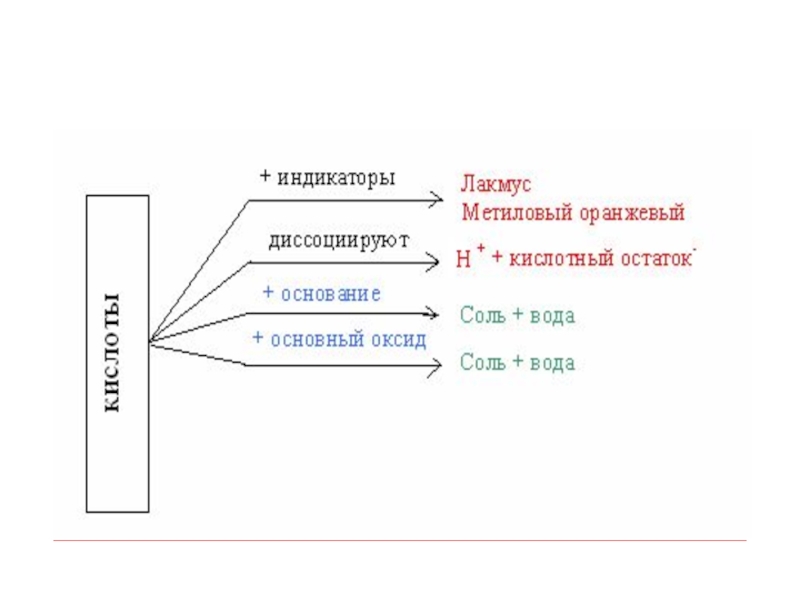
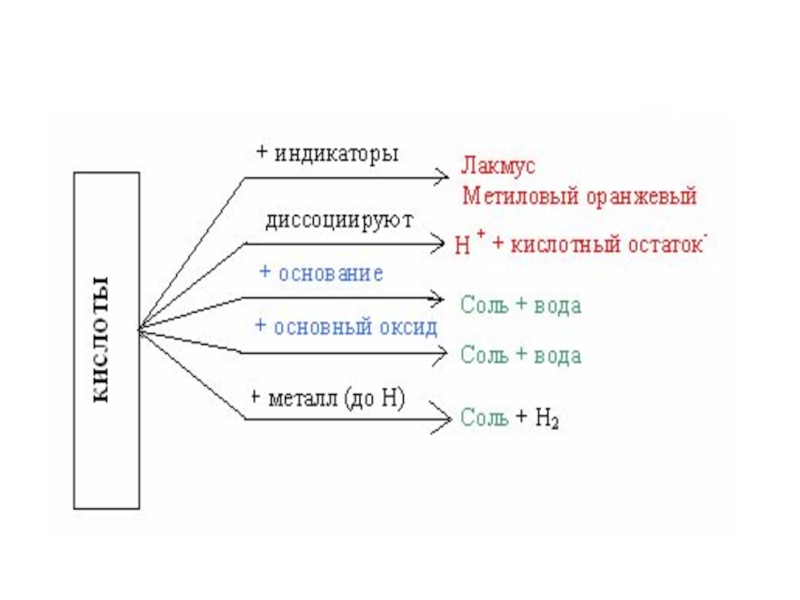
- 26. Свойства кислот:
- 29. Химические свойства кислот
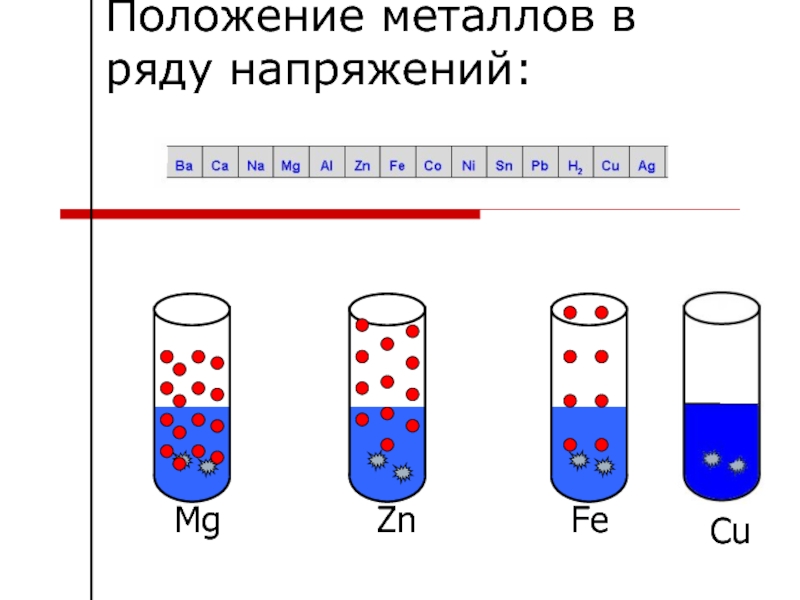
- 31. Реакция кислот с металлами
- 32. Реакция азотной кислоты с металлами
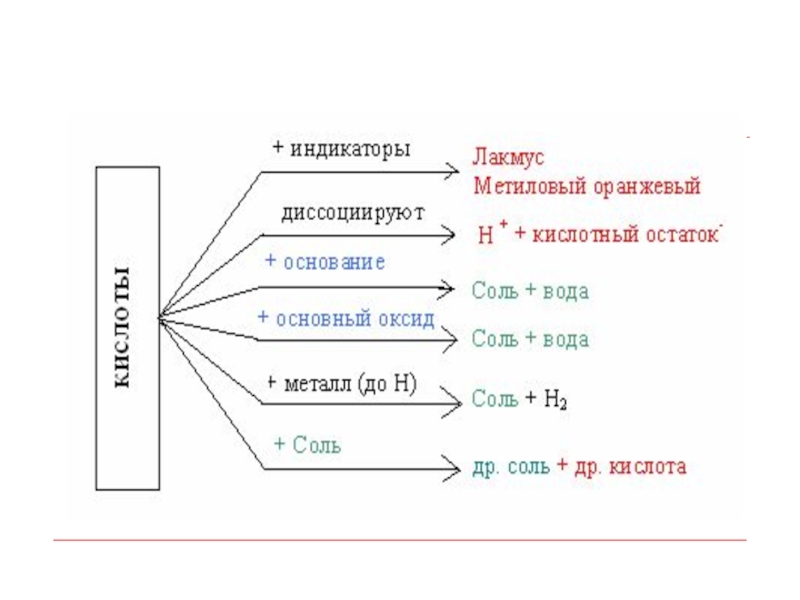
- 35. Реакции с солями: Идут, если выделяется газ
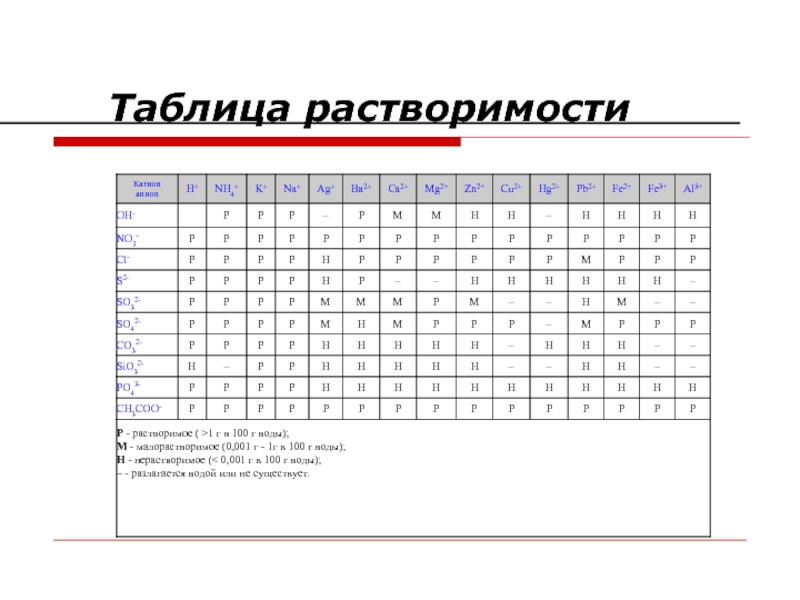
- 36. Таблица растворимости
- 37. Закрепление полученных знаний. Написать уравнения реакции, указать
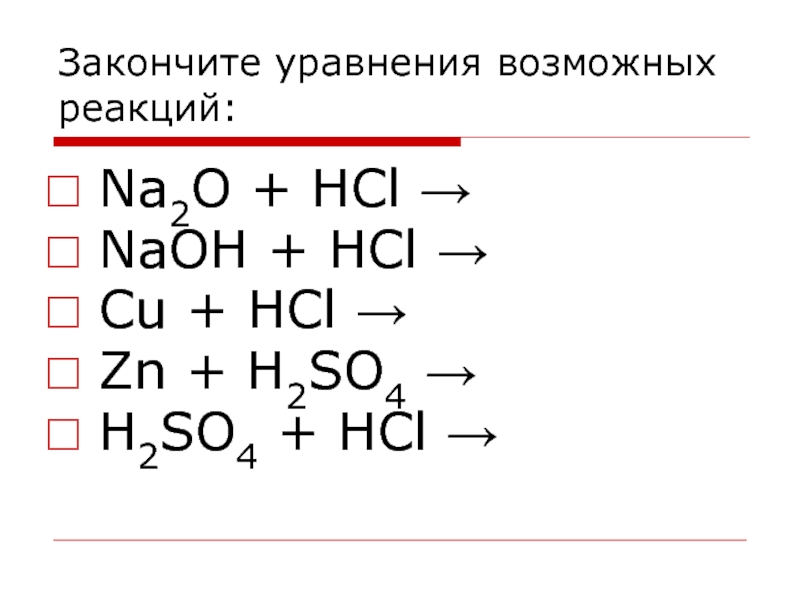
- 38. Закончите уравнения возможных реакций: Na2O + HCl
- 39. Домашнее задание: § 46.2 упр 1,2, стр 187
Слайд 2Задачи урока
продолжать знакомить учащихся с кислотами, с их составом , классификацией,
с нахождением в природе и применением некоторых кислот, изучать отношение кислот к индикаторам; познакомить с химическими свойствами кислот.
Совершенствовать навыки работы с лабораторным оборудованием, дополнить знания учащихся о правилах работы в химическом кабинете; развивать умение наблюдать, делать выводы; продолжать развивать умение составлять химические формулы, записывать уравнения реакций, расставлять коэффициенты, решать задачи по химическим уравнениям.
Формировать мировоззренческие понятия о познаваемости природы.
Совершенствовать навыки работы с лабораторным оборудованием, дополнить знания учащихся о правилах работы в химическом кабинете; развивать умение наблюдать, делать выводы; продолжать развивать умение составлять химические формулы, записывать уравнения реакций, расставлять коэффициенты, решать задачи по химическим уравнениям.
Формировать мировоззренческие понятия о познаваемости природы.
Слайд 3 О чем идет речь?
(Актуализация знаний).
Если в паре элементов
Кислород вторым стоит,
Ты же знаешь, эта пара
Называется ...................
Чем отличаются эти вещества от других классов веществ?
Слайд 4О чем идет речь?
Если формулы начало
Представляется с металла
ОН- красуется затем,
Вещества знакомы
всем.
Не надо придумывать им название,
Ведь эти вещества ....................
Не надо придумывать им название,
Ведь эти вещества ....................
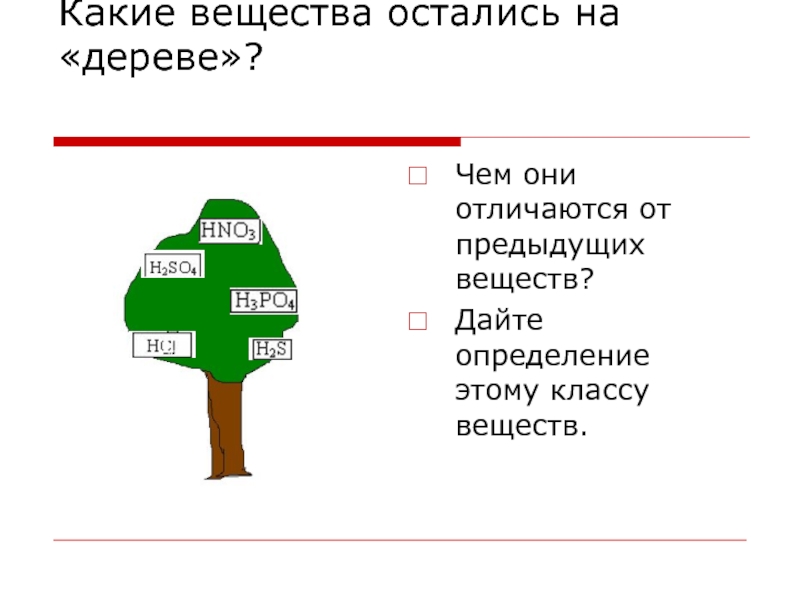
Слайд 6Какие вещества остались на «дереве»?
Чем они отличаются от предыдущих веществ?
Дайте
определение этому классу веществ.
Слайд 8Нахождение кислот в природе и их применение.
Для чего необходимо изучать кислоты?
Где
кислоты встречаются в природе? (подсказка на столе)
Некоторые кислоты могут употребляться в пищу. Какие это кислоты? (подсказка на столе)
Почему эти кислоты названы органическими?
Где они образуются?
Некоторые кислоты могут употребляться в пищу. Какие это кислоты? (подсказка на столе)
Почему эти кислоты названы органическими?
Где они образуются?
Слайд 9«Парад кислот»
(органические кислоты)
Муравьиная кислота.
Лимонная кислота.
Уксусная кислота.
Молочная кислота.
Слайд 10Муравьиная кислота.
Растет крапива у забора,
Которая уж очень больно жжется.
Не нужно
точных здесь приборов
То с муравьиной кислотой вам встретиться придется.
И муравьи защищаются от нападений,
Разбрызгивая кислоту за мгновение.
То с муравьиной кислотой вам встретиться придется.
И муравьи защищаются от нападений,
Разбрызгивая кислоту за мгновение.
Слайд 11Лимонная кислота.
Лимонной кислоте повсюду место есть:
В плодах крыжовника ее не счесть.
В
малине, хвое, соке свекловичном
Имеется она в наличии.
Конечно и лимончик золотой, Насыщен лимонной кислотой.
Конечно и лимончик золотой, Насыщен лимонной кислотой.
Слайд 12Уксусная кислота
Уксус нам в быту знаком –
За обеденным столом.
Уксусная кислота человеку
нужна –
Используется в промышленности она:
Для приготовления синтетического волокна,
Для консервирования мясных и рыбных продуктов,
Для консервирования овощей и фруктов.
Слайд 13Молочная кислота.
Молочная кислота распространена в природе:
Мы в кислом молоке ее находим,
И
в наших мышцах есть ее немало.
Она является продуктом расщепления животного крахмала,
Когда при физической нагрузке человек переутомляется.
Молочная кислота в кожевенном производстве применяется,
В красильном деле и в медицине употребляется.
Слайд 14«Парад кислот»
(неорганические кислоты)
Соляная кислота.
Угольная кислота.
Фтороводородная кислота.
Серная кислота.
Слайд 15Соляная кислота.
В желудочном соке я нахожусь
И этим я очень сильно горжусь.
Не
съешь без меня ты ни хлеб, ни варенье –
Играю я важную роль в пищеваренье.
Губительна я для бактерий плохих,
Ферменты мне рады – активизирую я их.
Играю я важную роль в пищеваренье.
Губительна я для бактерий плохих,
Ферменты мне рады – активизирую я их.
Слайд 16Угольная кислота.
Не ищите меня вы в природе
При плохой и хорошей
погоде.
Я с вами со всеми рядом
В бутылке с лимонадом.
Впервые Джозеф Пристли растворил
В воде углекислый газ.
Так он газировку получил,
Которой наслаждаемся сейчас.
В бутылке только нахожусь,
Лишь стоит крышку отвернуть
Я сразу быстро разложусь.
Быть слабой кислотой – вот моя суть.
Да, кислота я слабая, сразу разлагаюсь,
Но соли мои славятся, в них я продолжаюсь.
Я с вами со всеми рядом
В бутылке с лимонадом.
Впервые Джозеф Пристли растворил
В воде углекислый газ.
Так он газировку получил,
Которой наслаждаемся сейчас.
В бутылке только нахожусь,
Лишь стоит крышку отвернуть
Я сразу быстро разложусь.
Быть слабой кислотой – вот моя суть.
Да, кислота я слабая, сразу разлагаюсь,
Но соли мои славятся, в них я продолжаюсь.
Слайд 17Фтороводородная кислота.
Фтороводородной зовусь я кислотой.
Что делать можно вам со мной?
Меня не
храните в стеклянном сосуде – Его я расплавлю. Никто не осудит.
Художники это взяли на вооружение,
Теперь на стекле я рисую творения.
Художники это взяли на вооружение,
Теперь на стекле я рисую творения.
Слайд 18Серная кислота.
Я – мать всех кислот, и вы – мои дети.
Оставьте
все домыслы глупые эти.
Да, каждый из вас имеет значение.
Но я – вот Веней кислотного творения.
Люблю я воду очень сильно
И пью всегда ее очень обильно,
Ее забираю я ото всюду
Не хватит – органику обугливать буду.
Я главная в производстве удобрений.
В очистке нефти от воды.
В аккумуляторах работаю без лени,
Красители и шелк – моих трудов плоды.
Без ложной скромности скажу я всегда –
Я самая сильная кислота.
Да, каждый из вас имеет значение.
Но я – вот Веней кислотного творения.
Люблю я воду очень сильно
И пью всегда ее очень обильно,
Ее забираю я ото всюду
Не хватит – органику обугливать буду.
Я главная в производстве удобрений.
В очистке нефти от воды.
В аккумуляторах работаю без лени,
Красители и шелк – моих трудов плоды.
Без ложной скромности скажу я всегда –
Я самая сильная кислота.
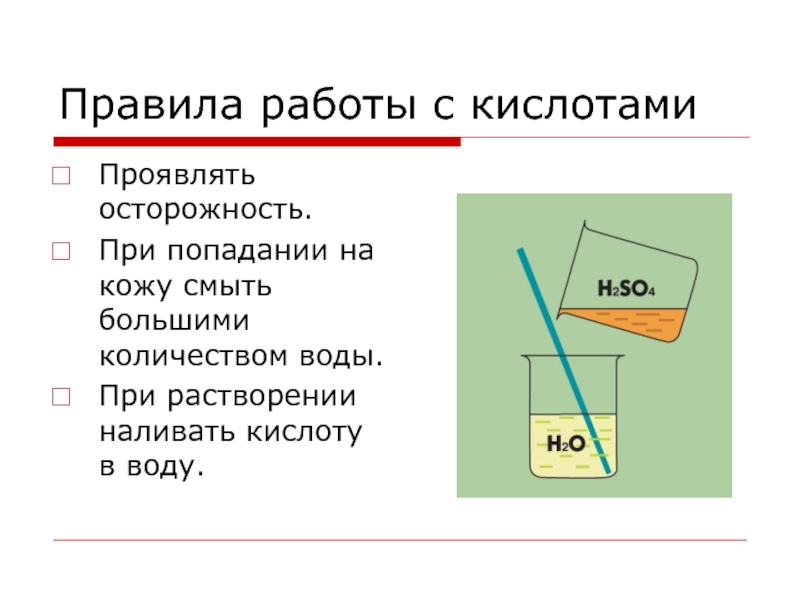
Слайд 21Правила работы с кислотами
Проявлять осторожность.
При попадании на кожу смыть большими количеством
воды.
При растворении наливать кислоту в воду.
При растворении наливать кислоту в воду.
Слайд 23Лабораторный опыт №9
«Распознавание кислот с помощью индикаторов».
На столах находятся
три пробирки под номерами. Определить с помощью индикатора, в пробирке под каким номером находится кислота?
Слайд 24Отгадайте загадки:
От щелочи я желт, как в лихорадке,
Краснею от кислот, как
от стыда,
И я бросаюсь в воду без оглядки,
Чтоб не могла заесть меня среда.
Попасть в кислоту – для него неудача, Но он перетерпит без вздоха, без плача, Зато в щелочах у такого блондина Начнется не жизнь, а сплошная малина.
Попасть в кислоту – для него неудача, Но он перетерпит без вздоха, без плача, Зато в щелочах у такого блондина Начнется не жизнь, а сплошная малина.
Слайд 35Реакции с солями:
Идут, если выделяется газ
H2S↑,
H2SO3 → H2O + SO2↑,
H2CO3 → H2O + CO2↑
Идут, если выпадает осадок
смотрите таблицу растворимости солей
H2CO3 → H2O + CO2↑
Идут, если выпадает осадок
смотрите таблицу растворимости солей
Слайд 37Закрепление полученных знаний.
Написать уравнения реакции, указать тип каждой:
Na + Н3PO4 ...
,
Mg + НBr ... ,
K2O + НNO3 ... ,
Cu(OH)2 + НNO3 ... .
Mg + НBr ... ,
K2O + НNO3 ... ,
Cu(OH)2 + НNO3 ... .
Слайд 38Закончите уравнения возможных реакций:
Na2O + HCl →
NaOH + HCl →
Cu +
HCl →
Zn + H2SO4 →
H2SO4 + HCl →
Zn + H2SO4 →
H2SO4 + HCl →