- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Широко распростирает химия руки свои в дела человеческие презентация
Содержание
- 1. Широко распростирает химия руки свои в дела человеческие
- 2. Что мы узнаем? (план урока) Как классифицируют
- 3. Классификация неорганических веществ
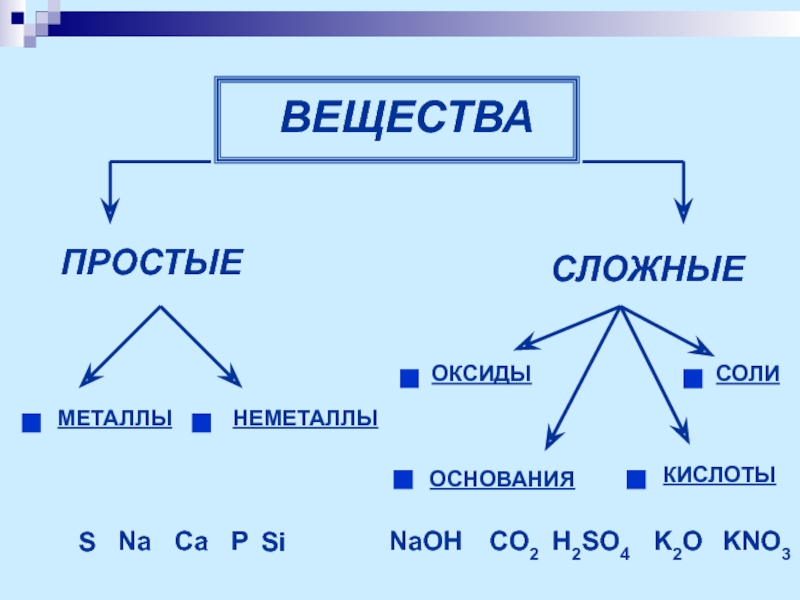
- 4. ВЕЩЕСТВА ПРОСТЫЕ СЛОЖНЫЕ ОКСИДЫ
- 5. Оксиды Оксиды – бинарные соединения элементов с
- 6. Классификация оксидов оксиды Основные
- 7. Основные оксиды – оксиды металлов, которым соответствуют
- 8. Волшебный цветок ? основные кислотные
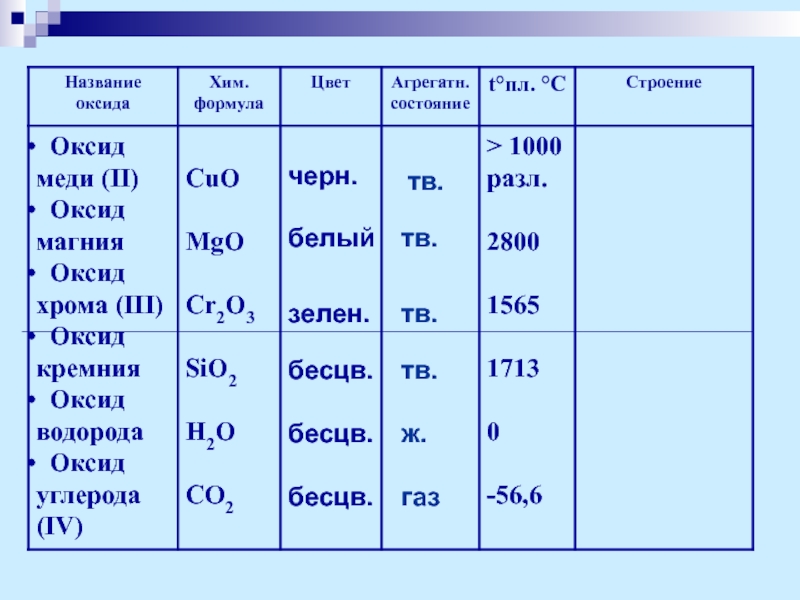
- 9. Физические свойства оксидов
- 10. черн. белый зелен. бесцв. бесцв. бесцв. тв. тв. тв. тв. ж. газ
- 11. Получение оксидов
- 12. Реакции окисления (горения) Задание. Составьте уравнения реакций
- 13. Применение оксидов
- 14. Единственное вещество, которое встречается на Земле во
- 15. Содержание воды в природе Запасы воды на
- 16. Расход воды в мире (в м3 на человека в сутки)
- 17. Оксид кремния (IV) SiO2 Кварц, кремень, горный
- 18. ОКСИД ХРОМА (III) - Cr2O3 Используют
- 19. Проверь себя: Исключи лишнее:
- 20. Желаю успеха! Домашнее задание: с.68 –
Слайд 2Что мы узнаем?
(план урока)
Как классифицируют вещества?
Как отличить оксиды от других веществ?
Какие
Как получают оксиды?
Где применяются оксиды?
Чему мы научимся?
Составлять формулы оксидов.
Определять характер оксидов по формуле.
Составлять уравнения реакций горения.
Слайд 5Оксиды
Оксиды – бинарные соединения элементов с кислородом в степени окисления -2.
Задание:
1 в. - натрия; фосфора.
2 в. - кальция; серы.
Проверь себя: Na2O; P2O5
CaO; SO3
Если в паре элементов кислород вторым стоит,
то запомни: эта пара называется оксид.
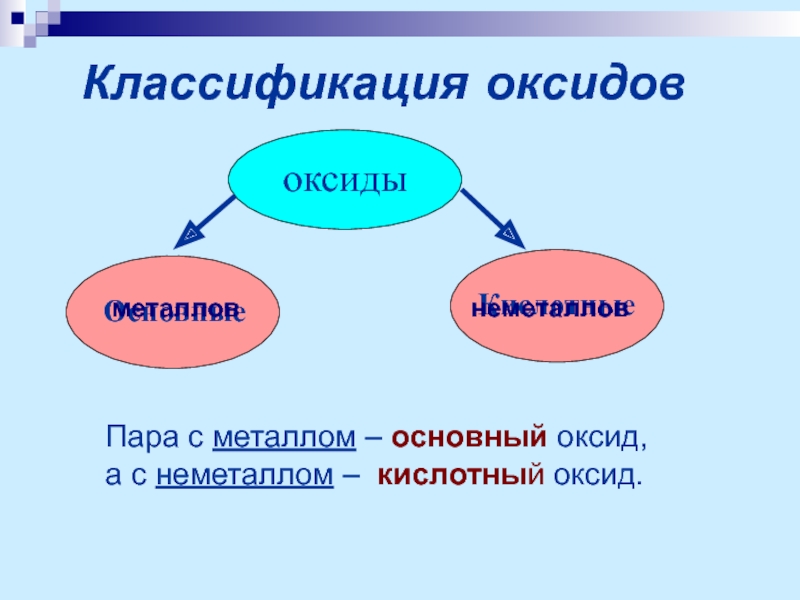
Слайд 6Классификация оксидов
оксиды
Основные
Кислотные
Пара с металлом – основный оксид,
а с неметаллом – кислотный
металлов
неметаллов
Слайд 7Основные оксиды – оксиды металлов, которым соответствуют основания.
Кислотные оксиды – оксиды
Na2O; CaO.
P2O5; SO3.
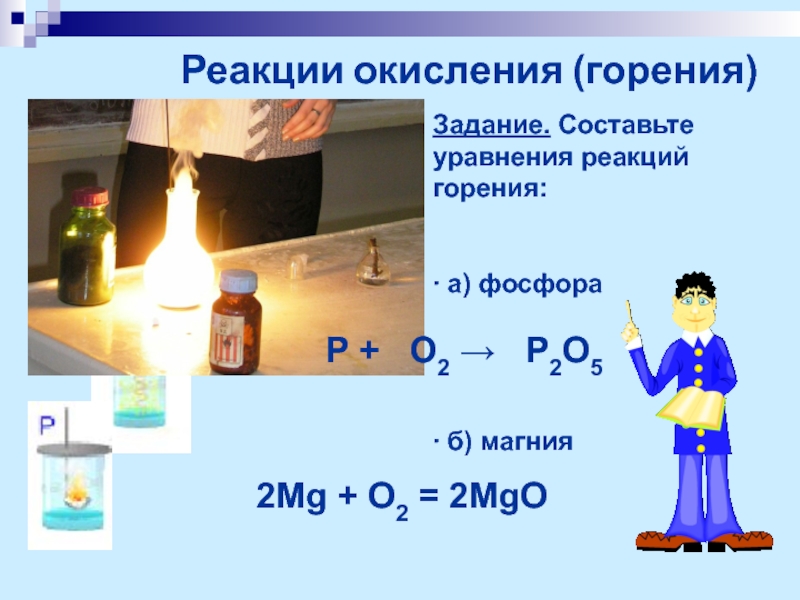
Слайд 12Реакции окисления (горения)
Задание. Составьте уравнения реакций горения:
∙ а) фосфора
∙ б) магния
2Mg
лучина
Р + О2 → Р2О5
Слайд 14Единственное вещество, которое встречается на Земле во всех трех агрегатных состояниях
Твердый
Жидкой водой наполнен Мировой океан, поверхностные воды суши и подземные воды
Водяной пар входит в состав атмосферы
Оксид водорода
- вода
(Н2О)
Слайд 15Содержание воды в природе
Запасы воды на Земле 1млн 454тыс м3
из них
Вода - это самое распространенное на Земле вещество.
Слайд 17Оксид кремния (IV) SiO2
Кварц, кремень, горный хрусталь, аметист, яшма, опал —
Слайд 18ОКСИД ХРОМА (III) - Cr2O3
Используют как пигмент при изготовлении декоративного зеленого
Паста ГОИ (“Государственный оптический институт”) на основе Cr2O3 применяется для шлифовки и полировки оптических изделий, в ювелирном деле.
Слайд 19Проверь себя:
Исключи лишнее:
1.CO2
2.NaOH
3.CaO
4.SiO2
2.P2O5
1.К2О
4.CuO
2.OF2
3.N2O5
Составь
а) алюминия;
б) метана - СН4