- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы презентация
Содержание
- 1. Щелочные металлы
- 2. Щелочны́е мета́ллы — элементы главной подгруппы первой
- 3. Получение щелочных металлов Щелочные металлы всегда находятся
- 4. История открытия Литий Натрий Рубидий Калий Цезий Франций
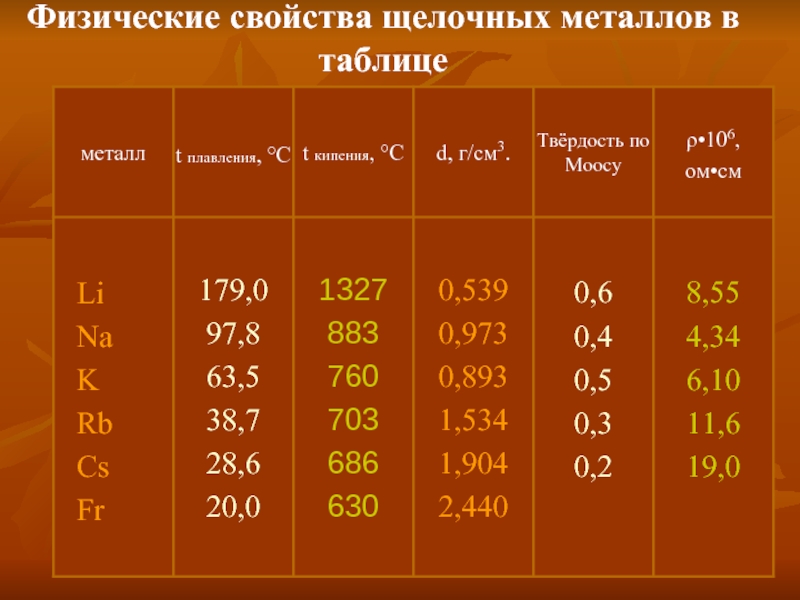
- 5. Физические свойства Щелочные металлы – серебристо-белые вещества,
- 6. Физические свойства щелочных металлов в таблице
- 7. Оксиды и гидроксиды щелочных металлов Оксиды Гидроксиды Оксид лития Оксид натрия
- 8. Реагирование с водой Характерная черта щелочных металлов
- 9. Презентацию подготовили Бернштейн Антон – главный научный
- 10. Литий Литий был открыт в 1817 шведским
- 11. Натрий Природные соединения Натрия — поваренная соль
- 12. Рубидий Рубидий открыли в 1861 Р. Бунзен
- 13. Калий Некоторые соединения Калия (например, поташ, добывавшийся
- 14. Цезий Цезий открыт в 1860 Р. В.
- 15. Франций Существование и главные свойства самого тяжёлого
- 16. Оксиды Оксиды щелочных металлов – соединения их
- 17. Образование оксидов Оксид лития образуется при реакции
- 18. Гидроксиды Гидроксиды щелочных металлов, кроме Li, термостойки
- 19. Образование гидроксидов Обратная реакция: оксид+вода=гидроксид K2O +
- 20. Реакции с кислотами 2KOH + H2SO4 =
- 21. Реакции с солями 2NaOH + CuSO4
- 22. Реакции с кислотными оксидами 2KOH + SiO2
Слайд 2Щелочны́е мета́ллы — элементы главной подгруппы первой группы Периодической Системы. Название
Слайд 3Получение щелочных металлов
Щелочные металлы всегда находятся в соединениях в виде положительно
Слайд 5Физические свойства
Щелочные металлы – серебристо-белые вещества, кроме
цезия, который имеет золотистый цвет.
температурами плавления и плотностью.
Сверху вниз по группе уменьшаются температуры плавления
и кипения, увеличивается плотность металлов. Все эти металлы
кристаллизуются в объемноцентрированные кубические ячейки.
Параметры ячеек увеличиваются, а следовательно, силы связи
уменьшаются сверху вниз. Отсюда и уменьшение температуры
плавления. Но масса ядер растет, несмотря на увеличение объема.
У калия происходит резкое увеличение радиуса атома по
сравнению с натрием, и влияние объема оказывается
преобладающим над массой, что приводит к резкому снижению
плотности.
Получение сплава натрия и калия.
Оба металла свободно нарезаются ножом
Слайд 8Реагирование с водой
Характерная черта щелочных металлов – очень активная, до горения
2Na + 2H2O = 2NaOH + H2
2K + 2H2O = 2KOH + H2
Образуется гидроксид и водород
Взаимодействие с водой
Слайд 9Презентацию подготовили
Бернштейн Антон – главный научный редактор
Пирожков Виктор – технический редактор
Маслацов Николай – история открытия;
Бердников Александр – оксиды и гидроксиды;
Применко Алена – получение;
Арсланова Ксения – физические свойства;
Бернштейн и Пирожков – химические свойства;
Иллюстрации: Пирожков Виктор, Арсланова Ксения
Рассказывал Бернштейн Антон, Маслацов Николай
Слайд 10Литий
Литий был открыт в 1817 шведским химиком А. Арфведсоном в минерале
Мягкий щелочной металл серебристо-белого цвета.
Слайд 11Натрий
Природные соединения Натрия — поваренная соль NaCl, сода Na2CO3 — известны
Натрий - мягкий щелочной металл серебристо-белого цвета
Натрий – мягкий металл, его можно резать ножом.
Слайд 12Рубидий
Рубидий открыли в 1861 Р. Бунзен и Г. Кирхгоф при спектральном
Мягкий, серебристо-белый,
очень химически активный металл
Слайд 13Калий
Некоторые соединения Калия (например, поташ, добывавшийся из древесной золы) были известны
Калий
мягкий щелочной металл серебристо-белого цвета.
Слайд 14Цезий
Цезий открыт в 1860 Р. В. Бунзеном и Г. Р. Кирхгофом
Цезий 99,99999% в ампуле
Мягкий щелочной металл золотисто-белого цвета
Слайд 15Франций
Существование и главные свойства самого тяжёлого аналога щелочных металлов были предсказаны
Франций - щелочной металл, обладающий как радиоактивностью, так и высокой химической активностью . Не имеет стабильных изотопов
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов
Уран(235),
из которого поучают франций
Слайд 16Оксиды
Оксиды щелочных металлов – соединения их с О вида Ме2О:
Na+ Na+ Li+ Li+
Оксиды основные, так как им соответсвуют гидроксиды NaOH; LiOH.
Слайд 17Образование оксидов
Оксид лития образуется при реакции лития с кислородом:
4Li + O2=2Li2O
Образование остальных оксидов рассмотрим на примере натрия:
I 2Na + O2 = Na2O2 (пероксид Na–O–О–Na)
II 2Na + Na2O2 = 2Na2O (t)
I – активная стадия
II – прокаливание
Также образуются разложением солей (карбонатов и сульфитов) кислородосодержащих кислот с соответствующими металлами:
K2CO3 K2O + CO2 Li2SO3 Li2O + SO2 (t)
Слайд 18Гидроксиды
Гидроксиды щелочных металлов, кроме Li, термостойки и не разрушаются от температуры.
Гидроксиды
Кислотами
Кислотными оксидами
Солями (если образуется нерастворимое основание).
Слайд 19Образование гидроксидов
Обратная реакция: оксид+вода=гидроксид
K2O + H2O= 2KOH
Гидроксиды щелочных металлов – соединения
Na – O – H Li – O – H
Горение калия(фиолетовым цветом)
Слайд 21Реакции с солями
2NaOH + CuSO4 Cu(OH)2 + Na2SO4
Горение щелочных металлов
Литий - красным цветом
Натрий – желтым или оранжевым