- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы презентация
Содержание
- 1. Щелочные металлы
- 2. Общая характеристика L I Na
- 3. Физические свойства В свободном состоянии эти
- 4. Открытие металлов 1807г Гемфри Деви провёл
- 5. Получение металлов Электролиз расплавов хлоридов и гидроксидов этих металлов 4 KOH= 4K +O2 +H2O
- 6. Химические свойства Реакция с кислородом 4Li+O2=2Li2O
- 7. Взаимодействие с водой происходит по общей схеме. Me +2H2O =2MeOH +H2
- 8. Едкие щёлочи . Гидроксиды щелочных металлов называют
- 9. Получение гидроксидов металлов 2Na Cl электролиз 2Na
- 10. Химические свойства 2NaOH+Cl2=NaCl+NaClO+H2O холодный раствор 6NaOH+3Cl2=5NaCl+NaClO3+2H2O
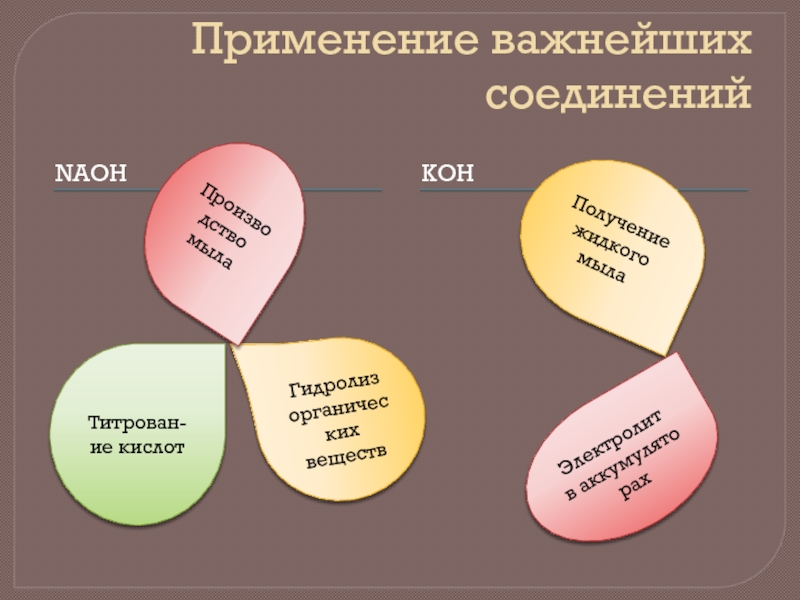
- 11. Применение важнейших соединений NAOH KOH
- 12. Спасибо за внимание
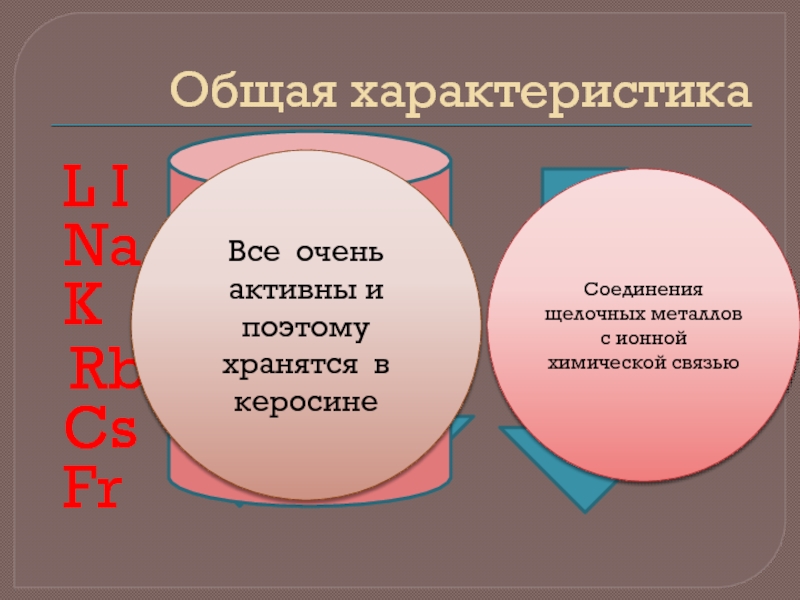
Слайд 2Общая характеристика
L I
Na
K
Rb
Cs
Fr
Заряд ядра
Радиус
атома
Металлические свойства
nS 1
Все очень активны и поэтому хранятся в керосине
Соединения щелочных металлов с ионной химической связью
Слайд 3Физические свойства
В свободном состоянии эти элементы представляют металлы мягкие, быстро
Д.И. Менделеев «Основы химии»
Образцы металлов
Цезий
рубидий калий натрий
Литий настолько лёгок, что плавает в керосине
Слайд 4Открытие металлов
1807г Гемфри Деви провёл электролиз едкого натра и едкого кали
1860- 1861г немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф изучая спектральный анализ алюмосиликата обнаружили два новых элемента рубидий
и цезий, названных по цвету линий спектра тёмно-красный и небесно-голубой
В 1939г французский радиохимик Маргарет Пере в продуктах распада изотопа урана -235 обнаружил новый радиоактивный элемент и назвал его в честь своей родины – Францием.
Слайд 5Получение металлов
Электролиз расплавов хлоридов и гидроксидов этих металлов
4 KOH= 4K +O2
Слайд 6Химические свойства
Реакция с кислородом
4Li+O2=2Li2O оксид лития
2Na+O2=Na2O2 пероксид натрия
K
2Na+S=Na2S сульфид натрия
6Na+N2=Na3N нитрид натрия
2Na+H2+2NaH гидрид натрия
Реакции с галогенами
2Na+Cl2=2NaCl
Слайд 8Едкие щёлочи
.
Гидроксиды щелочных металлов называют едкими щёлочами. Они представляют собой белые
( исключение гидроксид лития). А так же в спирте.
Гидроксид натрия впервые был обнаружен в соде в 1736г французским химиком Луи Дюамелем Дю Монсо. Это вещество образуется при гидролизе соды
В XVIII в. едкий натр получали, действием на сульфат натрия оксидом свинца
Na2CO3 +H2O=NaHCO3+NaOH
Na2SO4+PbO+H2O=PbSO4 +2NaOH
Другим способом получения едкого натра служило взаимодействие соды с известью
Ca(OH)2 +Na2CO3=CaCO3+2NaOH
Слайд 9Получение гидроксидов металлов
2Na Cl электролиз 2Na (Hg катод)+ Cl2(анод)
Амальгамный (ртутный способ), на ртутном катоде вместо катионов водорода разряжаются катионы натрия чему способствует образование амальгамы, далее её обрабатывают водой и получают гидроксид натрия
Слайд 10Химические свойства
2NaOH+Cl2=NaCl+NaClO+H2O холодный раствор
6NaOH+3Cl2=5NaCl+NaClO3+2H2O горячий раствор
NaOH + HCl=NaCl+H2O
2NaOH+2NO2=NaNO2+NaNO3+H2O
2NaOH+CO2=Na2CO3+H2O недостаток CO2
NaOH+CO2=NaHCO3 избыток CO2