Работа выполнена
Учителем химии школы №473
Волковой И.А.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы презентация
Содержание
- 1. Щелочные металлы
- 2. Li Na K Rb Cs Fr
- 3. Физические свойства щелочных металлов: Серебристого цвета
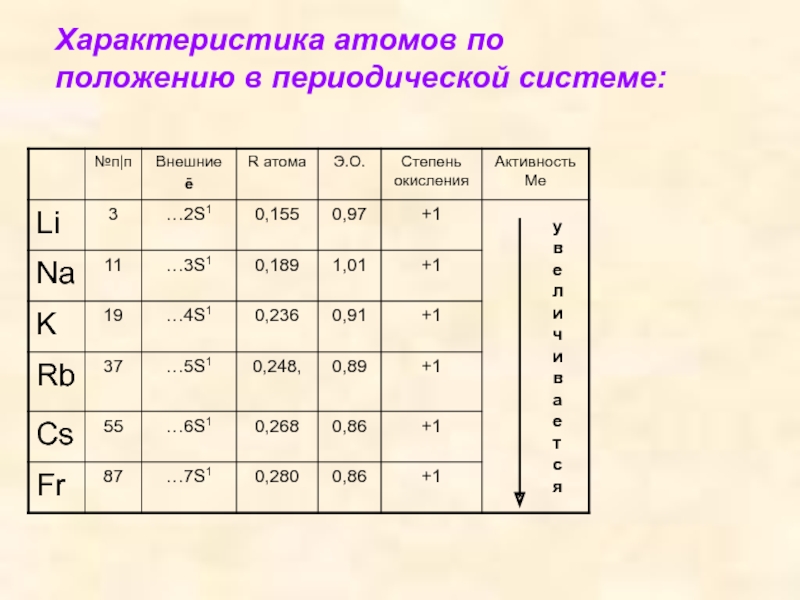
- 4. Характеристика атомов по положению в периодической системе: увеличивается
- 5. Химические свойства щелочных металлов: Взаимодействие с кислородом:
- 6. Взаимодействие с неметаллами: С водородом:
- 7. Взаимодействие с водой: Посмотрите опыт! 2Li
- 8. Важнейшими соединениями калия являются: -сильвинит
- 9. Тестовые вопросы: Блок А Блок C Блок B
- 10. 1. Щелочные металлы по строению атома относятся
- 11. Найти соответствие между: Li2O, Na2O2,, KO2 и
- 12. Решите переход, выполните возможные окислительно- восстановительные или
- 13. СПАСИБО ЗА ВНИМАНИЕ!
Слайд 1Щелочные металлы
элементы
I группы
Слайд 3Физические свойства щелочных металлов:
Серебристого цвета
Мягкие, легко режутся ножом
Твердость от Li →
Легче воды
Низкие t0 плавления и кипения
Слайд 5Химические свойства щелочных металлов:
Взаимодействие с кислородом:
4Li + O2 = 2Li2O
2Na + O2 = Na2O2 (пероксид натрия)
K + O2 = KO2 (надпероксид калия)
горение лития
Про горении солей щелочных металлов пламя окрашивается:
Li+1-малиновый цвет
Na+1-желтый цвет
K+1-сине-фиолетовый цвет
Rb+1-темно-красный цвет
Cs+1-голубой цвет
Слайд 6Взаимодействие с неметаллами:
С водородом: 2Me + H2 = 2MeH
С серой: 2Me + S = Me2S (сульфиды)
С азотом: 2Me + N2 = 2Me3N (нитриды)
С галогенами: 2Ме + Сl2 = 2MeCl (галогениды)
Слайд 7Взаимодействие с водой:
Посмотрите опыт!
2Li + 2H2O = 2LiOH + H2↑
2Na +
2K + 2H2O = 2KOH + H2↑
Взаимодействие с соляной кислотой:
2Na + 2HCl = 2NaCl + H2↑
2K + 2HCl = 2KCl + H2↑
Слайд 8
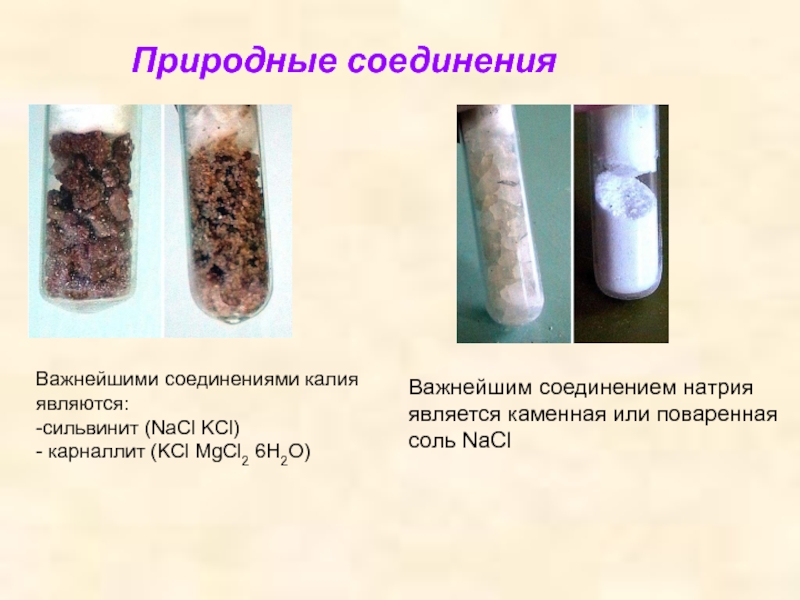
Важнейшими соединениями калия являются:
-сильвинит (NaCl KCl)
- карналлит (KCl MgCl2 6H2O)
Природные
Важнейшим соединением натрия является каменная или поваренная соль NaCl
Слайд 101. Щелочные металлы по строению атома относятся к элементам:
А) p-элементам;
Б) s-элементам
В)
2. Электроотрицательность металлов в группе сверху вниз:
А) увеличивается:
Б) не меняется
В) уменьшается
3. При взаимодействии с водой щелочные металлы образуют:
А) оксиды и водород;
Б) щелочи и водород;
В) не взаимодействуют с водой
4) При прохождении химических реакций щелочные металлы являются:
А) восстановителями;
Б) окислителями;
В) не изменяют степень окисления.
Слайд 11Найти соответствие между:
Li2O, Na2O2,, KO2 и названиями: пероксид Na, надпероксид калия,
оксид лития.
2. Найти соответствие между:
Li …7S1
Rb и …2S1
Fr …5S1
. 3.Выбрать и записать возможное уравнение реакции между слежующими веществами:
Na + H2O
Cu + H2O
Ag + H2O
Слайд 12Решите переход, выполните возможные окислительно- восстановительные или ионные уравнения:
Na→NaH→NaOH→NaAlO2
2. Пероксид натрия применяется на подводных лодках для поглощения углекислого газа и пополнения запаса кислорода в воздухе. Какой объем газа может вступить в реакцию с 78 кг пероксида натрия и какой объем (н.у.) кислорода при этом образуется?