- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
S = k?nG презентация
Содержание
- 1. S = k?nG
- 2. План лекции Второе начало термодинамики. Необратимость тепловых
- 3. Демонстрации Жидкий азот Тепловые двигатели различных конструкций.
- 4. Необратимые процессы Трение – работа переходит в
- 5. Второе начало термодинамики – закон возрастания энтропии
- 6. Термодинамическое определение энтропии dS = δQ/T Изменение
- 7. Энтропия идеального газа δQ = TdS =
- 8. Возрастание энтропии при смешении газов ΔS1 =
- 9. Энтропия – мера вероятности. Статистическое определение энтропии.
- 10. Что такое тепловая машина Назначение тепловой машина
- 11. Схема циклической тепловой и холодильной машины Коэффициент
- 12. Машина Карно – машина с максимальным КПД
- 13. Цикл Карно: две изотермы – две адиабаты
- 14. КПД машины Карно η = A/QH =
- 15. Цикл Карно в координатах (S,T) QH =
- 16. Второе начало термодинамики – закон возрастания энтропии
- 17. Цикл Карно: две изотермы – две адиабаты
- 18. Второе начало термодинамики Невозможен процесс, единственным результатом
- 19. Эквивалентность формулировок Невозможен процесс Клаузиуса ≡ Невозможен
- 20. Первая теорема Карно КПД всех тепловых
- 21. Вторая теорема Карно КПД любой машины, работающей
Слайд 2План лекции
Второе начало термодинамики. Необратимость тепловых процессов
Расширение идеального газа в пустоту
Энтропия:
термодинамическое и статистическое определения. Закон возрастания энтропии.
Энтропия идеального газа. Возрастание энтропии при смешении газов.
Тепловые машины. Цикл Карно.
Энтропия идеального газа. Возрастание энтропии при смешении газов.
Тепловые машины. Цикл Карно.
Слайд 4Необратимые процессы
Трение – работа переходит в тепло.
Теплообмен между горячим и
холодным телом.
Расширение газа в пустоту.
Диффузия – процесс необратимый: сахар в чае никогда не соберётся в кусок.
Расширение газа в пустоту.
Диффузия – процесс необратимый: сахар в чае никогда не соберётся в кусок.
Слайд 5Второе начало термодинамики – закон возрастания энтропии
При любых процессах, протекающих в
термодинамических изолированных системах, энтропия либо остаётся неизменной, либо возрастает: ΔS ≥ 0.
В состоянии равновесия энтропия замкнутой системы достигает максимума и никакие макроскопические процессы в такой системе невозможны.
В состоянии равновесия энтропия замкнутой системы достигает максимума и никакие макроскопические процессы в такой системе невозможны.
Слайд 6Термодинамическое определение энтропии dS = δQ/T
Изменение энтропии при обратимом переходе из
одного состояния в другое равна приведённому количеству теплоты:
dS = δQ/T; ΔS = ∫δQ/T
Пример: переход теплоты Q от горячего (T2) к холодному (T1) телу: ΔS = ∫δQ/T = ΔS2 + ΔS1 = -Q/T2 + Q/T1 = Q(T2 – T1)/T2T1 > 0 – энтропия возросла →
процесс необратимый: обратный процесс невозможен.
Пример: переход теплоты Q от горячего (T2) к холодному (T1) телу: ΔS = ∫δQ/T = ΔS2 + ΔS1 = -Q/T2 + Q/T1 = Q(T2 – T1)/T2T1 > 0 – энтропия возросла →
процесс необратимый: обратный процесс невозможен.
Слайд 7Энтропия идеального газа
δQ = TdS = CvdT + PdV ⇨
TdS
= CvdT/T + P/TdV = CvdT/T + R/VdV ⇨
S = S(V,T) = CVℓnT + RℓnV + const
S = S(P,T) = CPℓnT - RℓnP + const
S = S(P,V) = CVℓnP + CPℓnV + const
S = S(V,T) = CVℓnT + RℓnV + const
S = S(P,T) = CPℓnT - RℓnP + const
S = S(P,V) = CVℓnP + CPℓnV + const
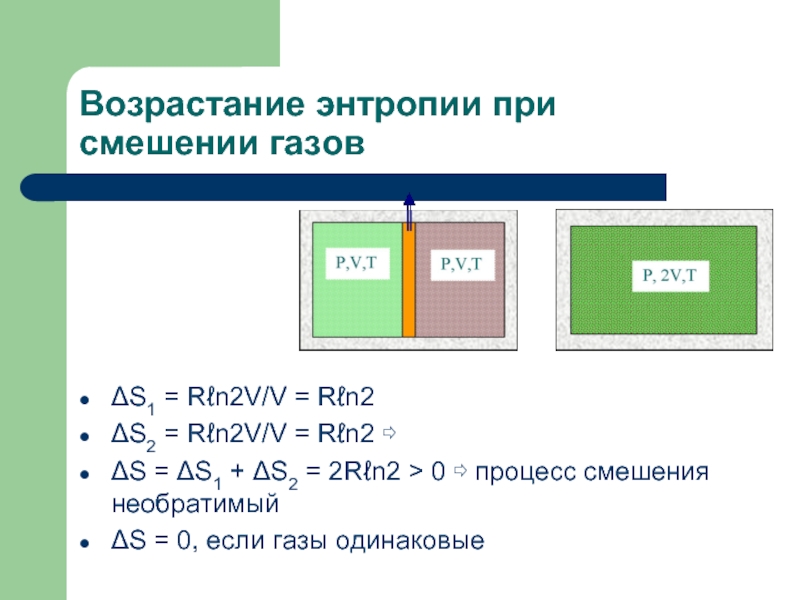
Слайд 8Возрастание энтропии при смешении газов
ΔS1 = Rℓn2V/V = Rℓn2
ΔS2 = Rℓn2V/V
= Rℓn2 ⇨
ΔS = ΔS1 + ΔS2 = 2Rℓn2 > 0 ⇨ процесс смешения необратимый
ΔS = 0, если газы одинаковые
ΔS = ΔS1 + ΔS2 = 2Rℓn2 > 0 ⇨ процесс смешения необратимый
ΔS = 0, если газы одинаковые
Слайд 9Энтропия – мера вероятности.
Статистическое определение энтропии.
Статистическое определение энтропии:
S = kℓnw,
где w - вероятность данного состояния
w ~ G – статистический вес (или термодинамическая вероятность) = число способов, реализующих данное макросостояние.
Закон возрастания энтропии – соответствует переходу системы в более вероятное состояние. Максимально вероятным является состояние равновесия.
Переход в равновесное состояние – это переход в состояние с наибольшим статистическим весом.
w ~ G – статистический вес (или термодинамическая вероятность) = число способов, реализующих данное макросостояние.
Закон возрастания энтропии – соответствует переходу системы в более вероятное состояние. Максимально вероятным является состояние равновесия.
Переход в равновесное состояние – это переход в состояние с наибольшим статистическим весом.
Слайд 10Что такое тепловая машина
Назначение тепловой машина – превращать тепло в механическую
работу
Циклически действующую тепловую машину можно создать только за счёт неравновесной системы тел (второе начало термодинамики)
Циклически действующую тепловую машину можно создать только за счёт неравновесной системы тел (второе начало термодинамики)
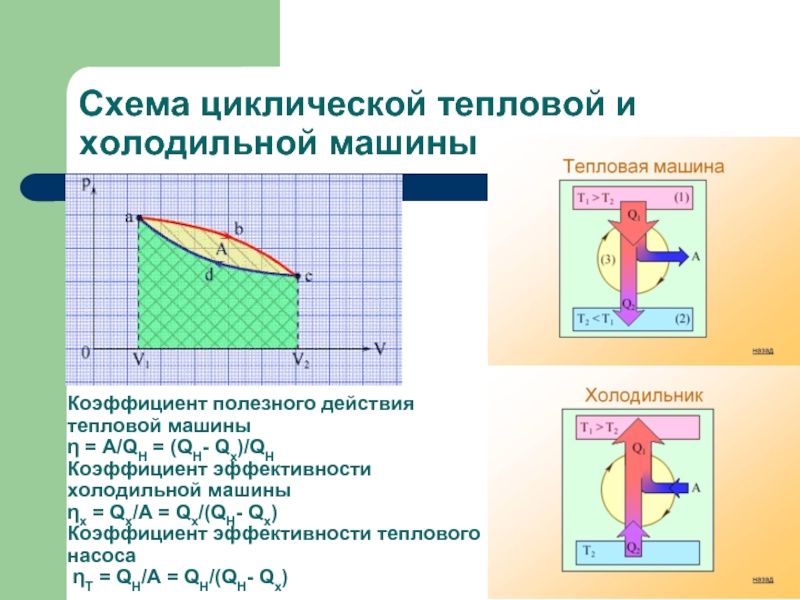
Слайд 11Схема циклической тепловой и холодильной машины
Коэффициент полезного действия тепловой машины
η =
A/QH = (QH- Qx)/QH
Коэффициент эффективности холодильной машины ηх = Qх/A = Qх/(QH- Qx)
Коэффициент эффективности теплового насоса ηT = QH/A = QH/(QH- Qx)
Коэффициент эффективности холодильной машины ηх = Qх/A = Qх/(QH- Qx)
Коэффициент эффективности теплового насоса ηT = QH/A = QH/(QH- Qx)
Слайд 12Машина Карно – машина с максимальным КПД
Максимальную работу даёт обратимая
машина. В обратимой машине:
нет теплообмена между горячим и холодным телом
нет процессов расширения в пустоту
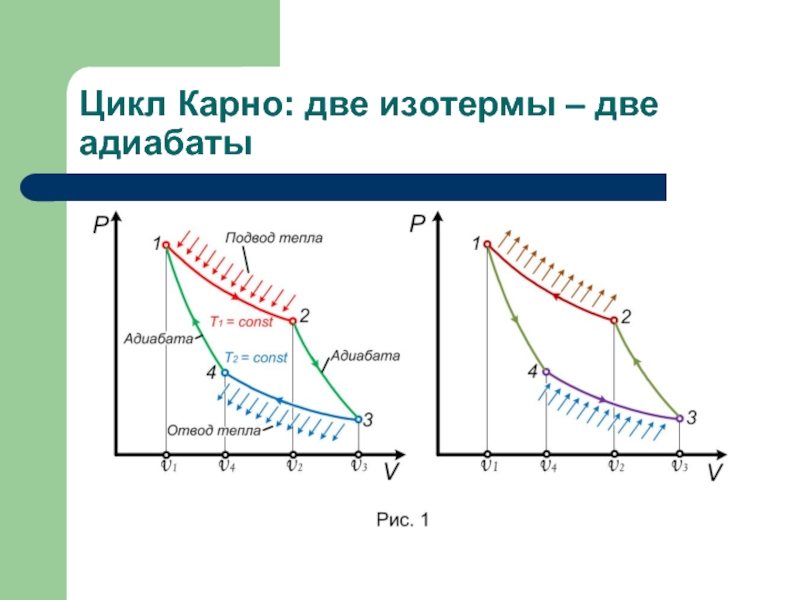
Машина Карно:
нагреватель с TH
холодильник TX
рабочее тело.
Единственный обратимый процесс для машины – цикл Карно: две изотермы + две адиабаты нет теплообмена между горячим и холодным телом + нет процессов расширения в пустоту
В таком цикле энтропия системы не изменяется: ΔS = ΔSH + ΔSX = 0
нет теплообмена между горячим и холодным телом
нет процессов расширения в пустоту
Машина Карно:
нагреватель с TH
холодильник TX
рабочее тело.
Единственный обратимый процесс для машины – цикл Карно: две изотермы + две адиабаты нет теплообмена между горячим и холодным телом + нет процессов расширения в пустоту
В таком цикле энтропия системы не изменяется: ΔS = ΔSH + ΔSX = 0
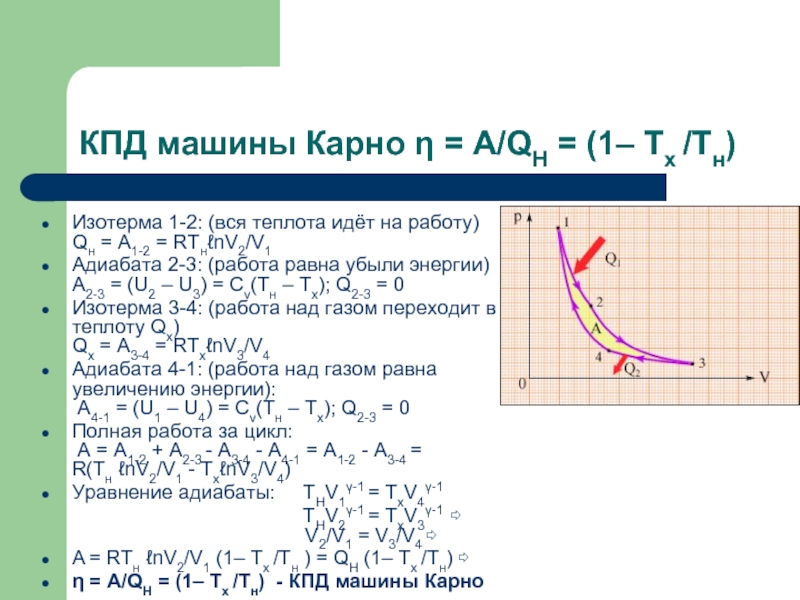
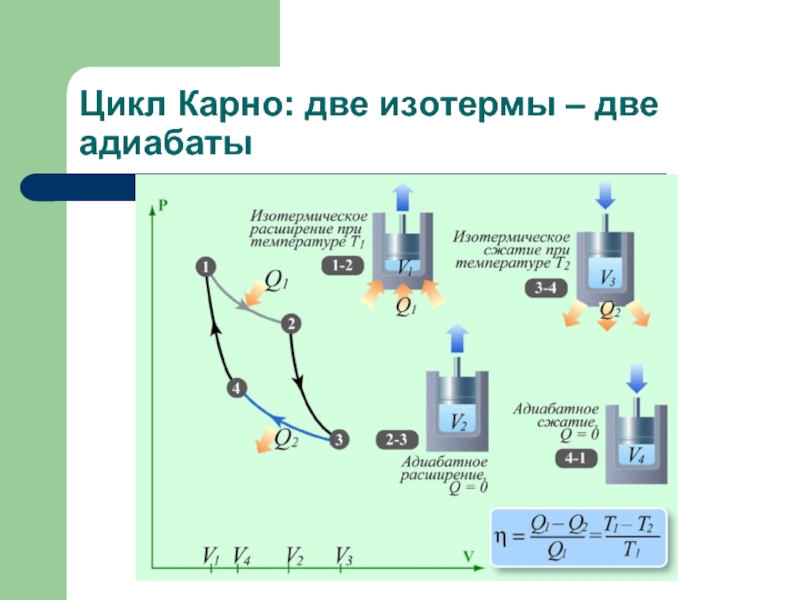
Слайд 14КПД машины Карно η = A/QH = (1– Tx /Tн)
Изотерма 1-2:
(вся теплота идёт на работу)
Qн = A1-2 = RTнℓnV2/V1
Адиабата 2-3: (работа равна убыли энергии) A2-3 = (U2 – U3) = Cv(Tн – Tx); Q2-3 = 0
Изотерма 3-4: (работа над газом переходит в теплоту Qx) Qx = A3-4 = RTxℓnV3/V4
Адиабата 4-1: (работа над газом равна увеличению энергии): A4-1 = (U1 – U4) = Cv(Tн – Tx); Q2-3 = 0
Полная работа за цикл: A = A1-2 + A2-3 - A3-4 - A4-1 = A1-2 - A3-4 = R(Tн ℓnV2/V1 - TxℓnV3/V4)
Уравнение адиабаты: THV1γ-1 = TxV4γ-1
THV2γ-1 = TxV3γ-1 ⇨ V2/V1 = V3/V4 ⇨
A = RTн ℓnV2/V1 (1– Tx /Tн ) = QH (1– Tx /Tн) ⇨
η = A/QH = (1– Tx /Tн) - КПД машины Карно
Адиабата 2-3: (работа равна убыли энергии) A2-3 = (U2 – U3) = Cv(Tн – Tx); Q2-3 = 0
Изотерма 3-4: (работа над газом переходит в теплоту Qx) Qx = A3-4 = RTxℓnV3/V4
Адиабата 4-1: (работа над газом равна увеличению энергии): A4-1 = (U1 – U4) = Cv(Tн – Tx); Q2-3 = 0
Полная работа за цикл: A = A1-2 + A2-3 - A3-4 - A4-1 = A1-2 - A3-4 = R(Tн ℓnV2/V1 - TxℓnV3/V4)
Уравнение адиабаты: THV1γ-1 = TxV4γ-1
THV2γ-1 = TxV3γ-1 ⇨ V2/V1 = V3/V4 ⇨
A = RTн ℓnV2/V1 (1– Tx /Tн ) = QH (1– Tx /Tн) ⇨
η = A/QH = (1– Tx /Tн) - КПД машины Карно
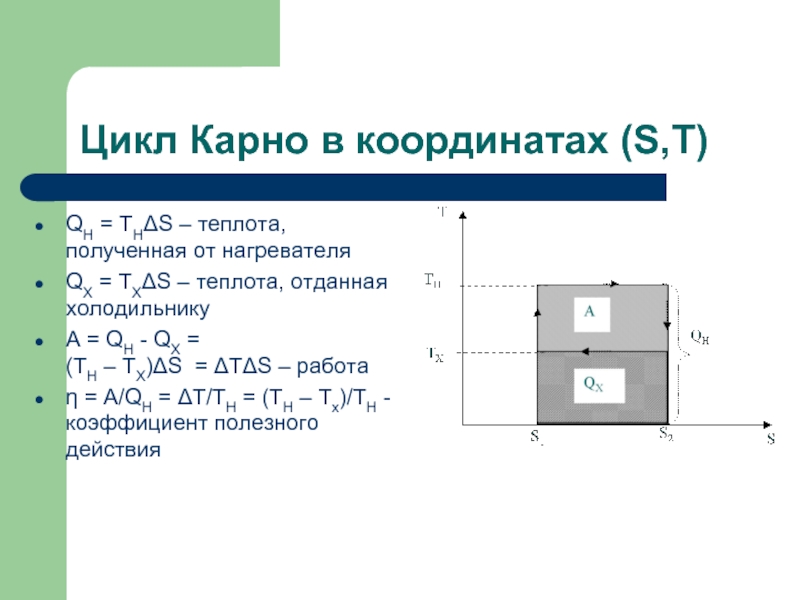
Слайд 15Цикл Карно в координатах (S,T)
QH = THΔS – теплота, полученная от
нагревателя
QХ = TХΔS – теплота, отданная холодильнику
A = QH - QХ = (TH – TХ)ΔS = ΔTΔS – работа
η = A/QH = ΔT/TH = (TH – Tx)/TH - коэффициент полезного действия
QХ = TХΔS – теплота, отданная холодильнику
A = QH - QХ = (TH – TХ)ΔS = ΔTΔS – работа
η = A/QH = ΔT/TH = (TH – Tx)/TH - коэффициент полезного действия
Слайд 16Второе начало термодинамики – закон возрастания энтропии
В замкнутой системе энтропия S
при любом реальном процессе либо возрастает, либо остаётся неизменной
ΔS ≥ 0;
для обратимых процессов. ΔS = 0
В состоянии равновесия S → max энтропия замкнутой системы достигает максимума и никакие макроскопические процессы в такой системе невозможны.
для обратимых процессов. ΔS = 0
В состоянии равновесия S → max энтропия замкнутой системы достигает максимума и никакие макроскопические процессы в такой системе невозможны.
Слайд 18Второе начало термодинамики
Невозможен процесс, единственным результатом которого была бы передача теплоты
от тела холодного к телу горячему. (Р. Клаузиус, 1850 г.)
Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара (В. Томсон (лорд Кельвин), 1851 г.)
Невозможно построить периодически действующую машину, единственным результатом которой было бы поднятие груза за счёт охлаждения теплового резервуара (Планк)
Невозможен вечный двигатель второго рода (т.е. двигатель, работающий только за счёт охлаждения теплового резервуара).(В. Оствальд)
Невозможен круговой процесс, единственным результатом которого было бы производство работы за счёт охлаждения теплового резервуара (В. Томсон (лорд Кельвин), 1851 г.)
Невозможно построить периодически действующую машину, единственным результатом которой было бы поднятие груза за счёт охлаждения теплового резервуара (Планк)
Невозможен вечный двигатель второго рода (т.е. двигатель, работающий только за счёт охлаждения теплового резервуара).(В. Оствальд)
Слайд 19Эквивалентность формулировок
Невозможен процесс Клаузиуса ≡
Невозможен процесс Томаса-Планка
Доказательство:
Допустим удалось поднять тело, превратив
тепло, полученное от одного теплового резервуара в работу. Тело падает и нагревает более горячее тело: получили невозможный процесс Клаузиуса.
Слайд 20Первая теорема Карно
КПД всех тепловых машин, работающих по циклу Карно
между двумя термостатами, равны, независимо от устройства машины и от рода рабочего тела: ηкарно = (Tн – Tx)/Tн
Доказательство: «плохую» машину Карно запускаем по холодильному циклу, используя работу «хорошей» машины. Например, «плохая» машина забирает от холодильника 5 Дж, 5 Дж работы берёт от «хорошей» машины и 10 Дж отдаёт нагревателю. «Хорошая» машина от нагревателя берёт 9 Дж и холодильнику возвращает 4 Дж. Результат – невозможный процесс Клаузиуса.
Доказательство: «плохую» машину Карно запускаем по холодильному циклу, используя работу «хорошей» машины. Например, «плохая» машина забирает от холодильника 5 Дж, 5 Дж работы берёт от «хорошей» машины и 10 Дж отдаёт нагревателю. «Хорошая» машина от нагревателя берёт 9 Дж и холодильнику возвращает 4 Дж. Результат – невозможный процесс Клаузиуса.
Слайд 21Вторая теорема Карно
КПД любой машины, работающей не по циклу Карно, не
может превышать КПД машины Карно с теми же тепловыми резервуарами.
Доказательство: запустим машину Карно по холодильному циклу и при этом она, например, забирает от холодильника 5 Дж и отдаёт нагревателю 10 Дж, используя 5 Дж работы от «хорошей» необратимой машины, которая забирает от нагревателя 9 Дж, а холодильнику возвращает 4 Дж. Результат – невозможный процесс Клаузиуса.
Доказательство: запустим машину Карно по холодильному циклу и при этом она, например, забирает от холодильника 5 Дж и отдаёт нагревателю 10 Дж, используя 5 Дж работы от «хорошей» необратимой машины, которая забирает от нагревателя 9 Дж, а холодильнику возвращает 4 Дж. Результат – невозможный процесс Клаузиуса.