- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Реакции перекисного окисления липидов презентация
Содержание
- 1. Реакции перекисного окисления липидов
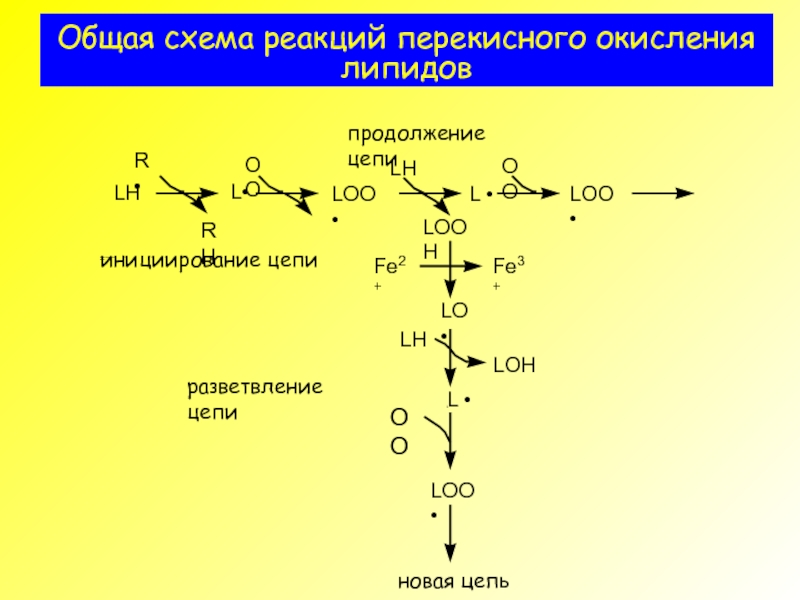
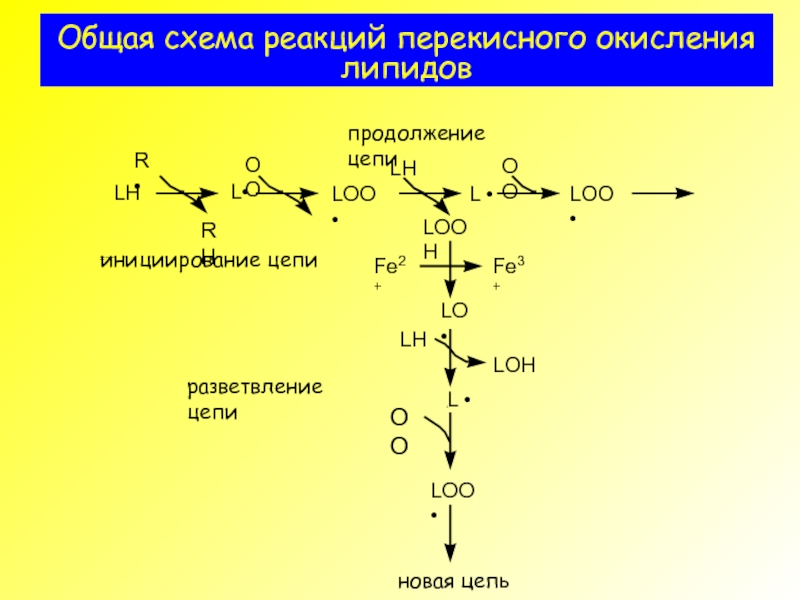
- 2. Общая схема реакций перекисного окисления липидов
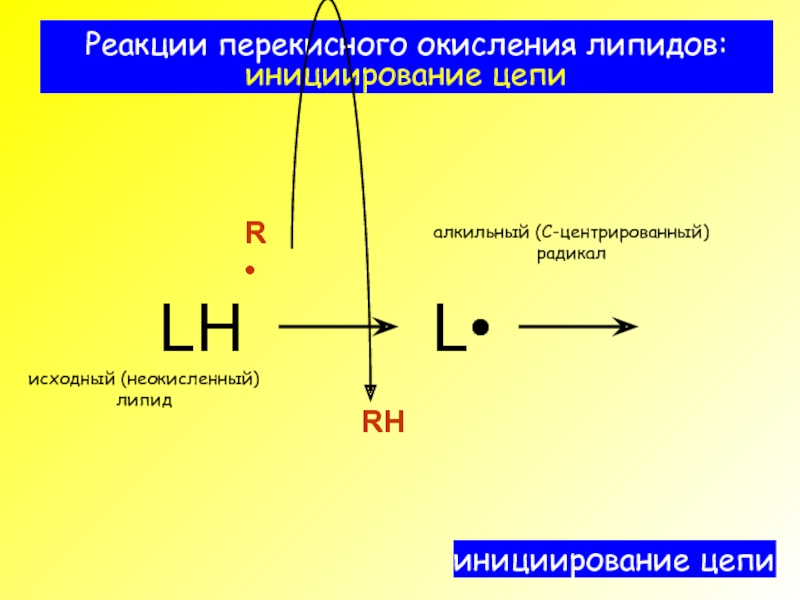
- 3. Реакции перекисного окисления липидов: инициирование цепи
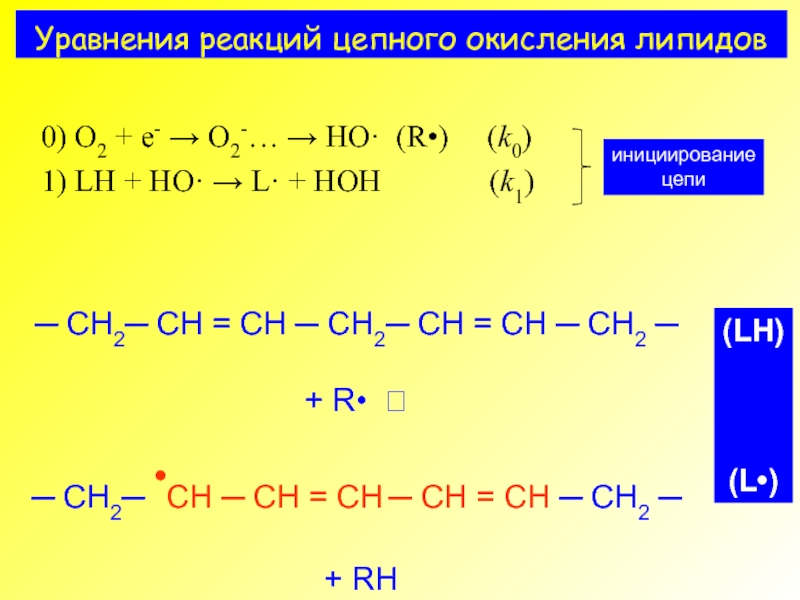
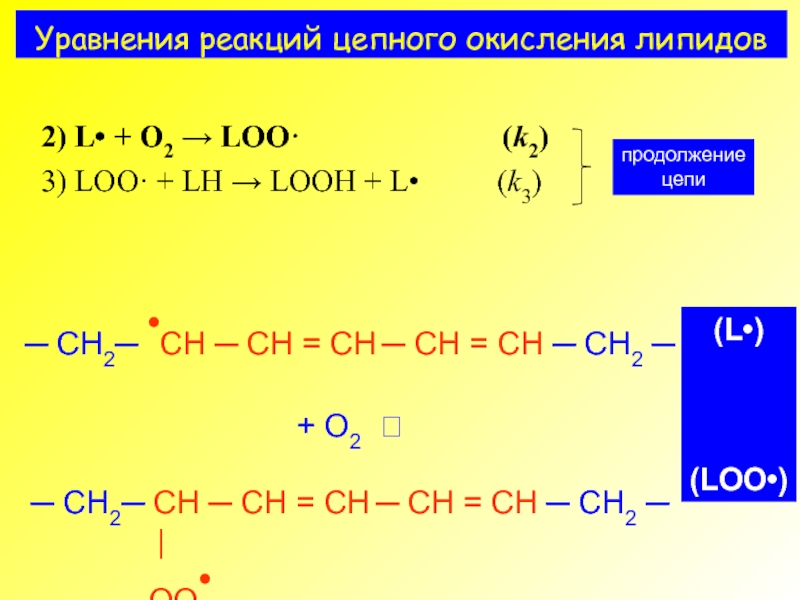
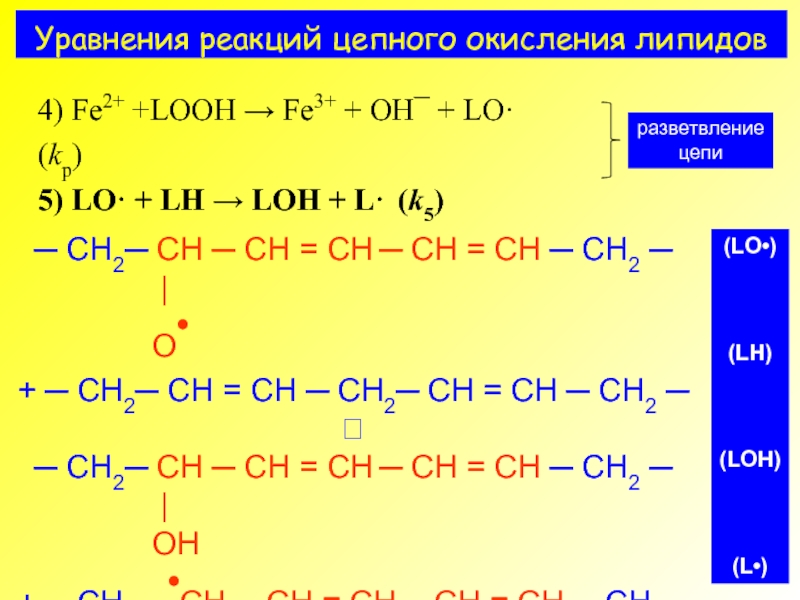
- 4. Уравнения реакций цепного окисления липидов
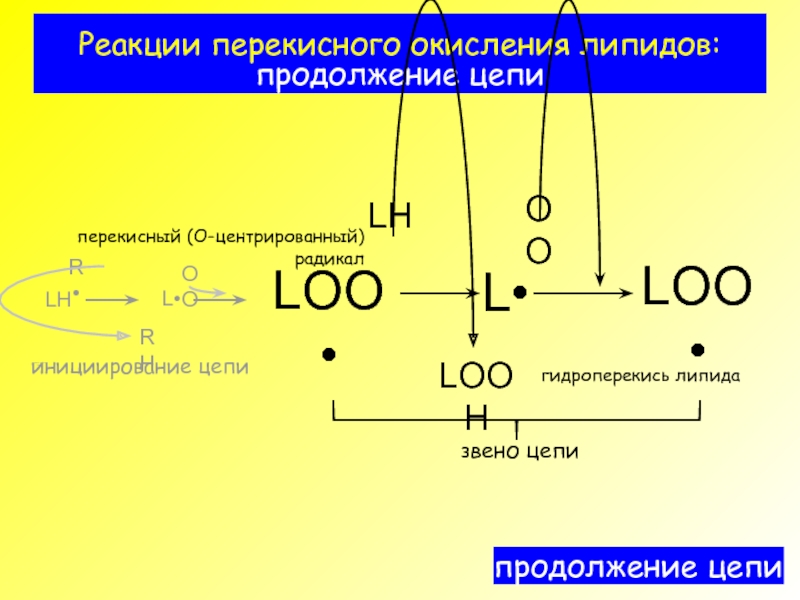
- 5. Реакции перекисного окисления липидов: продолжение цепи
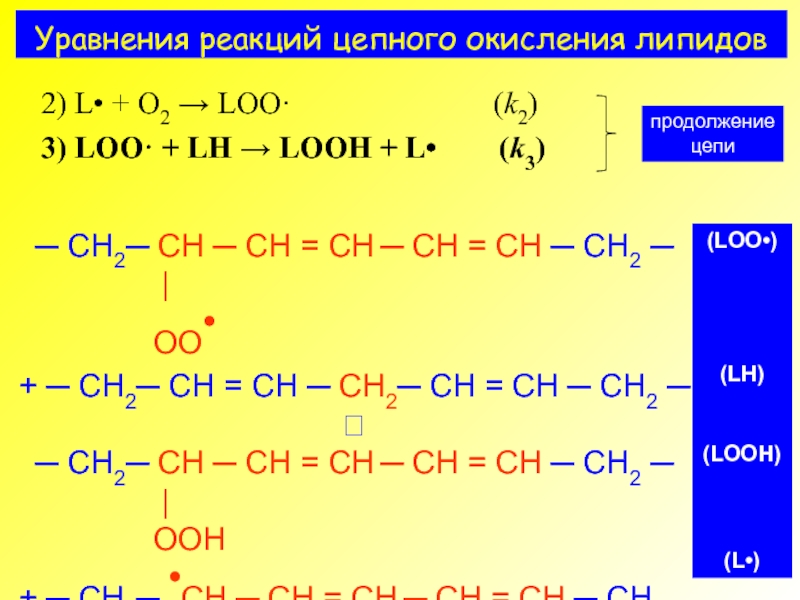
- 6. Уравнения реакций цепного окисления липидов
- 7. Уравнения реакций цепного окисления липидов
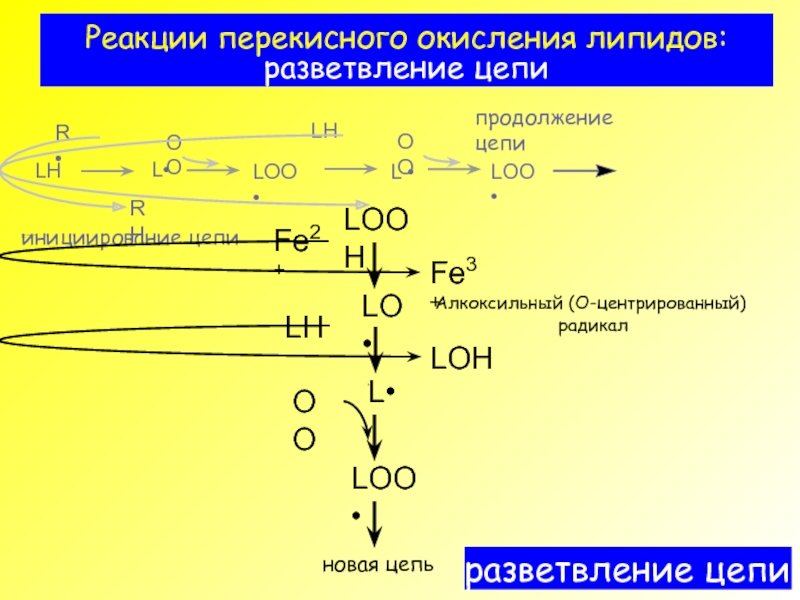
- 8. Реакции перекисного окисления липидов: разветвление цепи
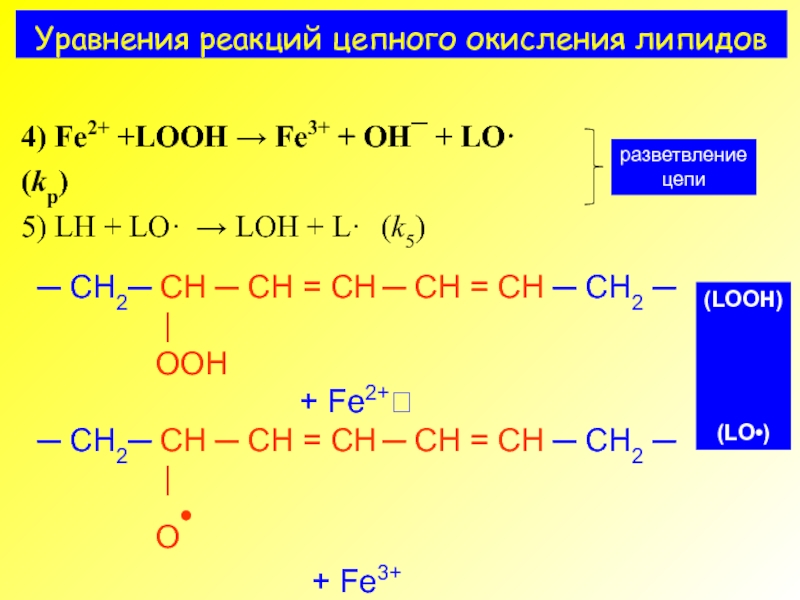
- 9. Уравнения реакций цепного окисления липидов
- 10. Уравнения реакций цепного окисления липидов
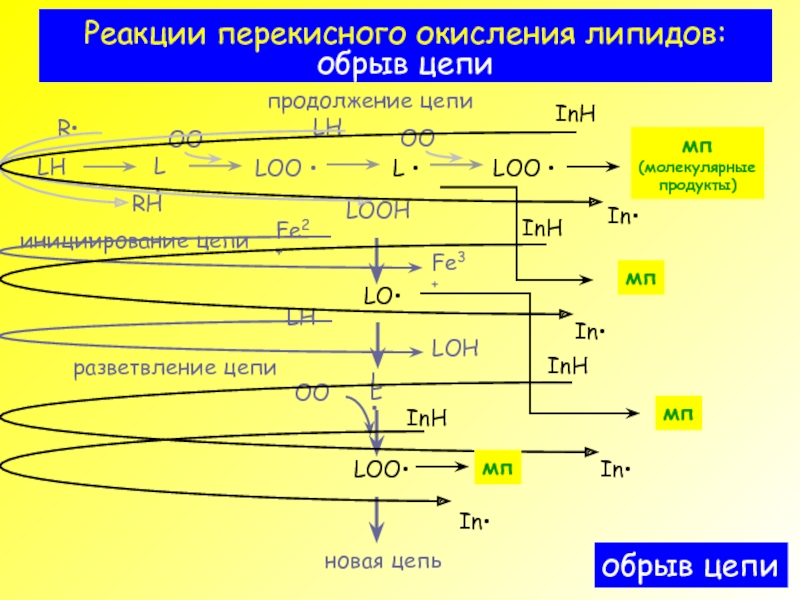
- 11. Реакции перекисного окисления липидов: обрыв цепи
- 12. Уравнения реакций цепного окисления липидов
- 13. Общая схема реакций перекисного окисления липидов
- 14. Уравнения реакций цепного окисления липидов
- 15. Уравнения реакций цепного окисления липидов
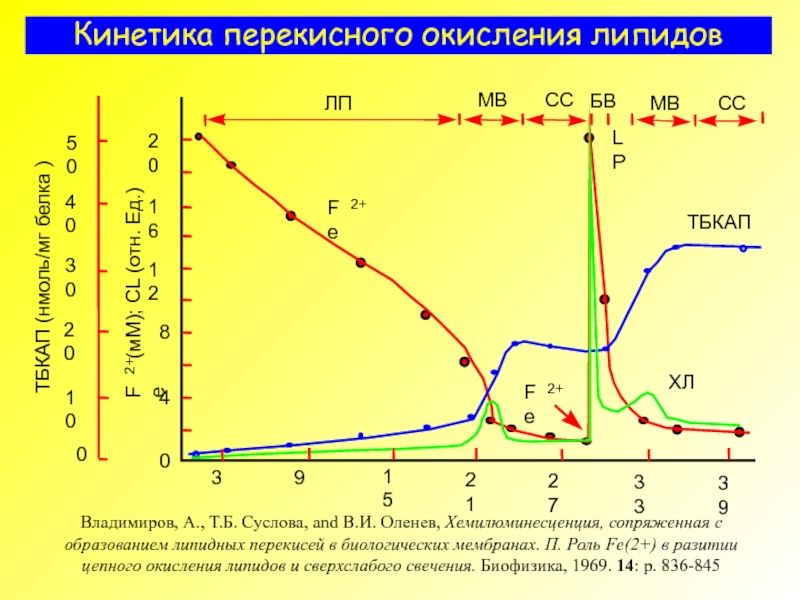
- 16. Кинетика перекисного окисления липидов Владимиров, А., Т.Б.
- 17. Упрощение схемы химических реакций Правило 1: Скорость
- 18. Скорость нескольких последовательных реакций равна скорости самой
- 19. Уравнения реакций цепного окисления липидов
- 20. Скорость нескольких последовательных реакций равна скорости самой
- 21. Уравнения реакций цепного окисления липидов
- 22. Скорость нескольких последовательных реакций равна скорости самой
- 23. Уравнения реакций цепного окисления липидов
- 24. Пример 4: Вместо четырех реакций обрыва цепи
- 25. Уравнения реакций цепного окисления липидов
- 26. Упрощенная схема реакций перекисного окисления липидов из
- 27. Пример 5: Скорость реакции обрыва цепей определяется
- 28. Упрощенная схема реакций перекисного окисления липидов из
- 29. Дифференциальные уравнения кинеткики в системе трех реакций
- 30. Стационарное приближение Боденштейна – Семенова
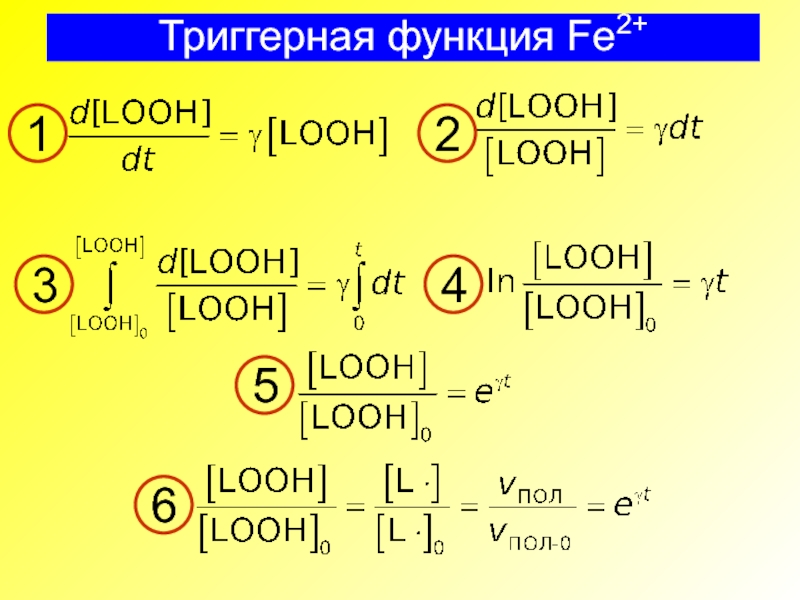
- 31. Триггерная функция Fe2+ 1 2 3 4 5 6
- 32. Триггерная функция Fe2+ При γ = 0
- 33. Железо как про- и антиоксидант
- 34. Вопросы к зачету Кинетика реакций цепного окисления
Слайд 16Кинетика перекисного окисления липидов
Владимиров, А., Т.Б. Суслова, and В.И. Оленев, Хемилюминесценция,
Слайд 17Упрощение схемы химических реакций
Правило 1: Скорость нескольких последовательных реакций равна скорости
Правило 2: Скорость нескольких параллельных реакций в наибольшей мере определяется скоростью самой быстрой из них.
Иногда можно пренебречь остальными реакциями при расчетах.
Для упрощения системы химических реакций используют два правила химической кинетики:
Слайд 18Скорость нескольких последовательных реакций равна скорости самой медленной из них.
Пример 1:
Примечание:
На кинетику процесса в целом не влияют те продукты, которые не участвуют в дальнейших реакциях. Поэтому на схеме реакций мы можем их не указывать.
0) O2 + e- → O2-… → HO· (R•) (k0)
Слайд 20Скорость нескольких последовательных реакций равна скорости самой медленной из них.
Пример 2:
2) L• + O2 → LOO· (k2)
оставляем одну:
Слайд 22Скорость нескольких последовательных реакций равна скорости самой медленной из них.
Пример 3:
4) Fe2+ +LOOH → Fe3+ + OH¯ + LO· (kp)
5) LH + LO· → LOH + L· (k5)
разветвление
цепи
оставляем одну:
4) Fe2+ +LOOH → Fe3+ + OH¯ + LO· (kp)
Слайд 24Пример 4: Вместо четырех реакций обрыва цепи оставим две, идущие в
Скорость нескольких параллельных реакций в наибольшей мере определяется скоростью самой быстрой из них.
6) LOO· + LOO· → МП + hν (k6)
9) L· + Fe2+ + H+ → Fe3+ + LH (k9)
Слайд 26Упрощенная схема реакций перекисного окисления липидов из 5 реакций
O2 + е-
L· + O2 (+ LH) → LOOH + L· (k2) Fe2+ + LOOH + LH → Fe3+ + LOH + OH¯ + L· (kp) LOO· + LOO· → L=O + LOH + фотон (k6)
Fe2+ + L· + H+ → Fe3+ + LH (k9)
Слайд 27Пример 5: Скорость реакции обрыва цепей определяется двумя параллельно идущими реакциями:
Fe2+
При наличии Fe2+ скорость первой реакции гораздо выше, чем второй. Поэтому пока есть Fe2+, основная реакция обрыва цепи – это реакция:
Fe2+ + L· + H+ → Fe3+ + LH (k9)
Скорость нескольких параллельных реакций в основном определяется самой быстрой из них.
Слайд 28Упрощенная схема реакций перекисного окисления липидов из 3 реакций
L· + O2
Слайд 32Триггерная функция Fe2+
При γ = 0
При [Fe2+] > [Fe2+] *, γ
γ = kp([Fe2+]* – [Fe2+])
При [Fe2+] < [Fe2+] *, γ > 0
1
2
3
4
5
6
Слайд 33Железо как про- и антиоксидант
[Fe2+] > [Fe2+] *
γ < 0
[Fe2+]
γ > 0
Скорость цепного окисления
Слайд 34Вопросы к зачету
Кинетика реакций цепного окисления липидов
Кривые кинетики цепного окисления липидов
Уравнения реакций цепного окисления липидов
Скорости парциальных реакций цепного окисления
Упрощение схемы химических реакций. Скорость системы параллельных реакций. Примеры из кинеткики цепных реакций.
Упрощение схемы химических реакций. Скорость системы последовательных реакций. Примеры из кинеткики цепных реакций
Упрощение схемы химических реакций. Как из системы из 9 реакций мы приходим к системе из 5 реакций?
Алгоритм расчета кривых кинетики реакции на ЭВМ.
Аналитическое решение уравнений кинетики ПОЛ. Дальнейшее упрощение системы реакций (от 5 до 3).
Дифференциальные уравнения кинетики в системе трех реакций. Стационарное приближение Боденштейна – Семенова. Условия его применимости.
Зависимость скорости реакции пероксидации от концентрации ионов железа. Понятие "критической концентрации" железа.
Тригерная функция Fe2+. Железо как про- и антиоксидант.


















![Триггерная функция Fe2+При γ = 0При [Fe2+] > [Fe2+] *, γ < 0γ = kp([Fe2+]*](/img/tmb/3/269078/e862c96a6c5e1b5f802bab38b5fd591a-800x.jpg)
![Железо как про- и антиоксидант[Fe2+] > [Fe2+] *γ < 0[Fe2+] < [Fe2+] *γ > 0Скорость](/img/tmb/3/269078/a4e834923d24e0c737bb2f13965a8386-800x.jpg)






