- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация к уроку по теме: презентация
Содержание
- 1. Презентация к уроку по теме:
- 3. Кислоты Тема урока: «Химические свойства кислот с
- 4. Кислота, когда здорова, Угостить друзей готова Тем,
- 5. а) НСl, H2SO4; H3PO4; HClO4
- 6. Задачи урока Образовательная: изучить химические свойства кислот
- 7. Планируемые результаты обучения В результате изучения данного
- 8. Лабораторный опыт №3 Каковы химические свойства кислот? Почему кислоты обладают сходными химическими свойствами?
- 9. Правила техники безопасности Осторожно обращайтесь с
- 10. Цели: проделать реакции, характерные для кислот
- 11. Взаимодействие кислот с индикаторами Красный
- 12. Взаимодействие кислот с металлами
- 13. Взаимодействие кислот с основными оксидами
- 14. Взаимодействие кислот с основаниями
- 15. Взаимодействие кислот с солями
- 16. Содержание I. Определение кислот. II. Химические свойства
- 17. «Воспоминание о лете» Погадаем на ромашке:
- 18. «Сами трудясь, вы многое сделаете для себя
- 19. О кислотных дождях Оксиды азота, серы содержатся
- 20. Кислотные
- 21. Кислоты - это электролиты, которые диссоциируют с
- 22. Опыт 1 Кислоты взаимодействуют: II. Химические свойства
- 23. Опыт 2 2) с металлами, стоящими в
- 24. 3) с основными оксидами с образованием соли
- 25. 4) с основаниями с образованием соли и
- 26. 5) с солями (реакция возможна, если выпадает
- 27. Литература: Мартыненко Б.В. Кислоты – основания. Аликберова
- 28. Спасибо за внимание
Слайд 1Презентация к уроку по теме:
«Химические свойства кислот с позиции теории электролитической
Класс – 9, базовый уровень.
Учитель МОУ Березовская основная школа Малоярославского района . Холявчук Н.А.
Слайд 3Кислоты
Тема урока:
«Химические свойства кислот с позиции теории электролитической диссоциации».
«От кислых
В. Шекспир
Слайд 4Кислота, когда здорова,
Угостить друзей готова
Тем, что ей дала природа -
Катионом водорода!
Н+
Н+
Н+
Н+
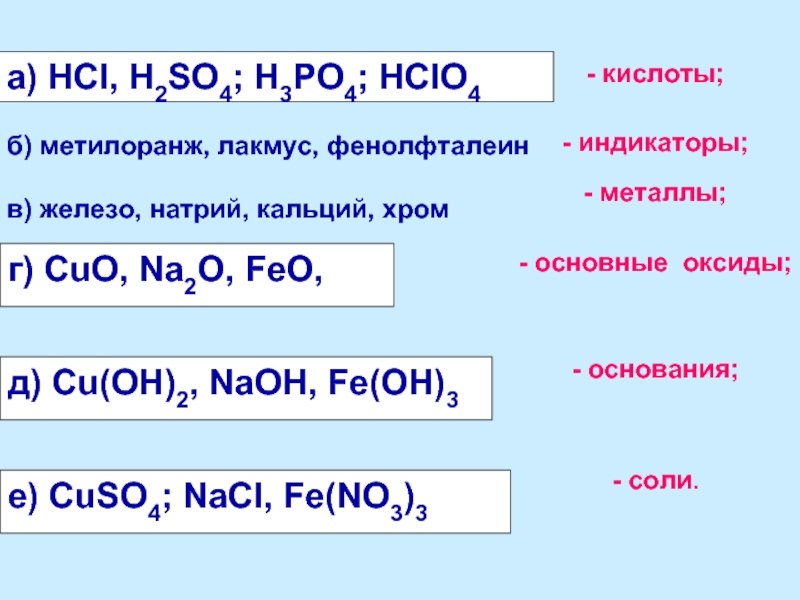
Слайд 5а) НСl, H2SO4; H3PO4; HClO4
- кислоты;
- индикаторы;
- металлы;
- основные оксиды;
- основания;
- соли.
г) СuO, Na2O, FeO,
д) Сu(OH)2, NaOH, Fe(OH)3
е) СuSO4; NaCl, Fe(NO3)3
б) метилоранж, лакмус, фенолфталеин
в) железо, натрий, кальций, хром
Слайд 6Задачи урока
Образовательная: изучить химические свойства кислот с позиции теории электролитической диссоциации.
2. Развивающие (формирование и развитие образовательных компетенций):
а) учебно-познавательных: развитие навыков самостоятельной познавательной деятельности; умения ставить познавательную задачу, умения добывать знания, выделять главное, обобщать, делать выводы, проводить самопроверку и самооценку;
б) коммуникативных: навыков работы в паре, взаимодействия с другими людьми, умения ответить на поставленный вопрос;
в) информационных: проводить материальное и знаковое моделирование, выделять существенные признаки химических реакций, извлекать необходимую информацию из проводимого эксперимента; оформлять и представлять результаты своей работы.
3. Воспитательные: воспитывать сознательное отношение к учебному труду, чувство ответственности, развивать интерес к знаниям.
4. Здоровьесберегающие: закрепить навыки безопасного обращения с реактивами.
Слайд 7Планируемые результаты обучения
В результате изучения данного материала учащиеся должны:
Знать:
а) определение понятий
Уметь (владеть способами познавательной деятельности):
а) составлять уравнения электролитической диссоциации кислот, оснований, солей; б) уравнения реакций ионного обмена; в) проводить реакции ионного обмена, подтверждающие химические свойства кислот, соблюдая правила безопасного обращения с реактивами и выявлять признаки наблюдаемых химических реакций; г) пользоваться таблицей растворимости.
Слайд 8Лабораторный опыт №3
Каковы химические свойства кислот?
Почему кислоты обладают сходными химическими
Слайд 9
Правила техники безопасности
Осторожно обращайтесь с химическим оборудованием!
Запрещается пробовать вещества на вкус
Слайд 10Цели:
проделать реакции, характерные для кислот на примере серной кислоты, соляной
сделать вывод о химических свойствах кислот,
закрепить навыки безопасного обращения с реактивами.
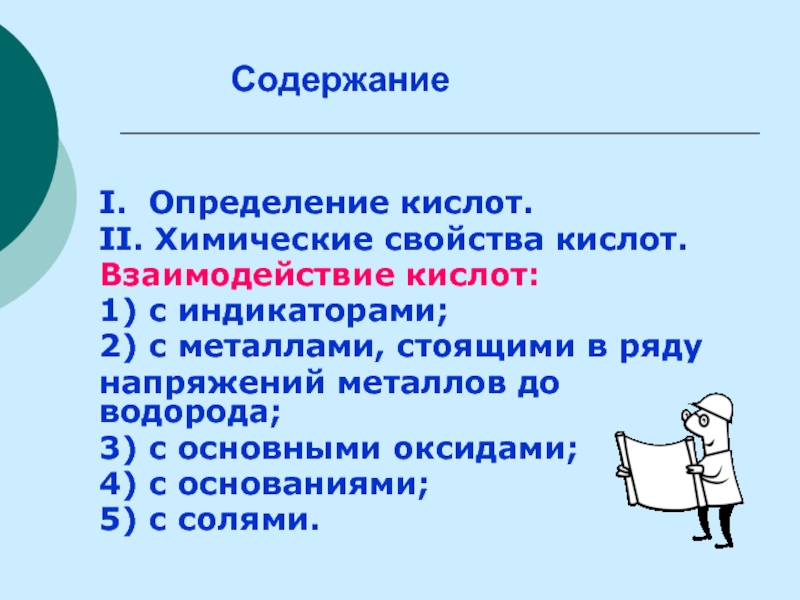
Слайд 16Содержание
I. Определение кислот.
II. Химические свойства кислот.
Взаимодействие кислот:
1) с индикаторами;
2) с металлами,
напряжений металлов до водорода;
3) с основными оксидами;
4) с основаниями;
5) с солями.
Слайд 17«Воспоминание о лете»
Погадаем на ромашке:
«Взаимодействует – не взаимодействует?»
Задание
С какими из веществ взаимодействует
серная кислота?
Слайд 18«Сами трудясь, вы многое сделаете для себя и для близких, а
Д.И. Менделеев
Слайд 19О кислотных дождях
Оксиды азота, серы содержатся в выхлопных газах реактивных двигателей
Слайд 20
Кислотные дожди виноваты в исчезновении рыбы
Такие дожди вымывают из
почвы питательные вещества,
без которых растениям грозит голодная смерть. Многие растения погибают, если увеличивается кислотность почвы. Оксид серы, кроме того, прямо повреждает зелень.
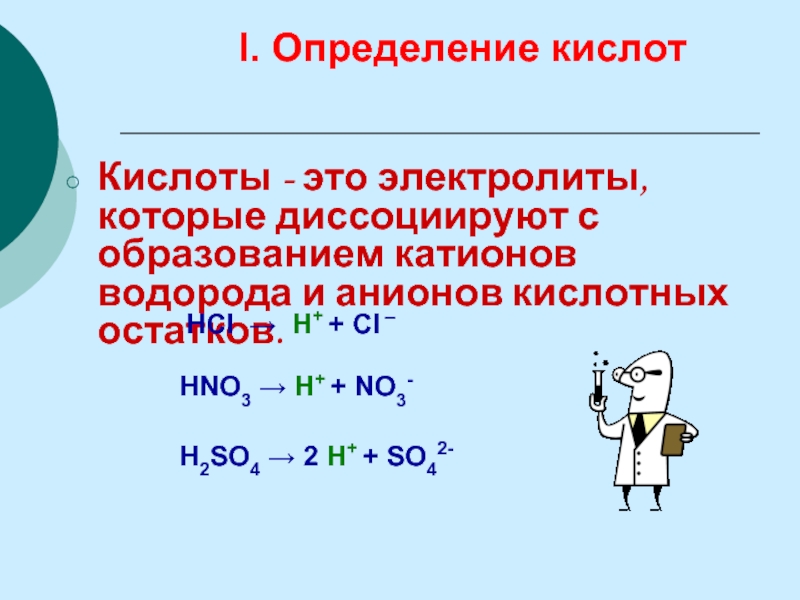
Слайд 21Кислоты - это электролиты, которые диссоциируют с образованием катионов водорода и
I. Определение кислот
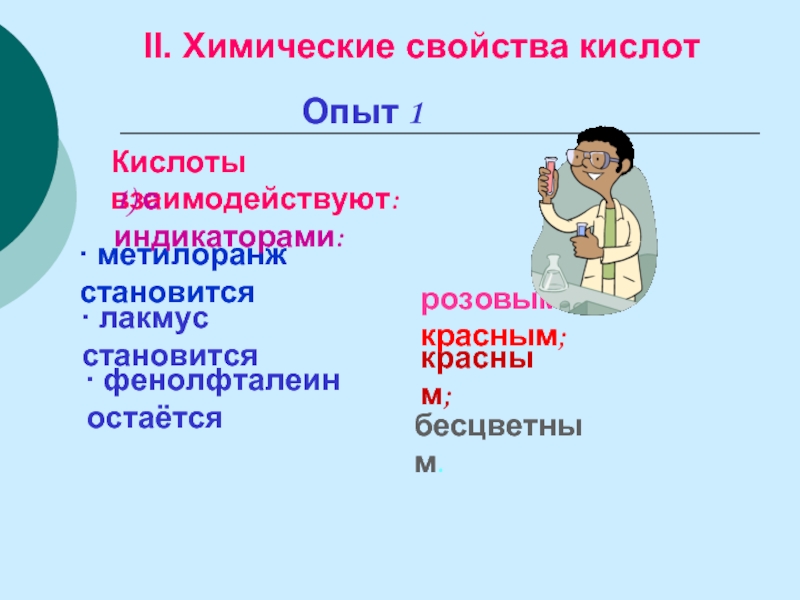
Слайд 22Опыт 1
Кислоты взаимодействуют:
II. Химические свойства кислот
∙ метилоранж становится
∙ фенолфталеин остаётся
розовым или красным;
∙ лакмус становится
красным;
бесцветным.
1) с индикаторами:
Слайд 23Опыт 2
2) с металлами, стоящими в ряду напряжений металлов до водорода
Кислоты взаимодействуют:
Слайд 243) с основными оксидами с образованием соли и воды
СаО + 2НСl
СаО + 2Н+ + 2Сl - → Ca 2+ + 2Сl - + H2O
СаО + 2Н+ → Ca 2+ + H2O
Опыт 3
Кислоты взаимодействуют:
Слайд 254) с основаниями с образованием соли и воды
Cu (OH)2 + 2HCl
Cu (OH)2 + 2Н+ + 2Сl - → Cu 2+ + 2Cl - + H2O
Cu (OH)2 + 2Н+ → Cu 2+ + H2O
Опыт 4
Кислоты взаимодействуют:
Слайд 265) с солями (реакция возможна, если выпадает осадок или выделяется газ)
СаСО3 + 2Н+ + 2Сl- → Ca 2+ + 2Сl- + CO2+ H2O
СаСО3 + 2Н+ → Ca 2+ + CO2↑ + H2O
Опыт 5
Кислоты взаимодействуют:
Слайд 27Литература:
Мартыненко Б.В. Кислоты – основания.
Аликберова Л.Ю.Занимательная химия.-М.:Аст-Пресс, 1999.
Савина Л.А. Я познаю
При создании слайдов была использована информация сети Интернет и электронной энциклопедии Кирилла и Мефодия «Уроки химии. 8-9 класс».
Материал может быть использован на уроках химии:
в 8 классе – по теме: «Кислоты»,
в 9 классе – по теме: «Химические свойства кислот с позиции теории электролитической диссоциации».