- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Практическая работа №1 презентация
Содержание
- 1. Практическая работа №1
- 2. ЛСМ к практической работе Цель
- 3. Инструкция к практической работе №1
- 4. Практическая работа №1 Цель работы Оборудование
- 5. Практическая работа №2 Получение водорода и определение его свойств
- 6. Инструкция к практической работе №2 Цель
- 7. Практическая работа №2 Цель работы Оборудование
- 8. Практическая работа №3 Получение и свойства кислорода
- 9. Инструкция к практической работе №3
- 10. Практическая работа №3 Цель работы Оборудование
- 11. Практическая работа №4 Условия протекания химических реакций
- 12. Инструкция к практической работе №4
- 13. Практическая работа №4 Цель работы Оборудование
- 14. Практическая работа №5 Свойства кислот, оснований, оксидов
- 15. Инструкция к практической работе №5
- 16. Практическая работа №5 Цель работы Оборудование Реактивы
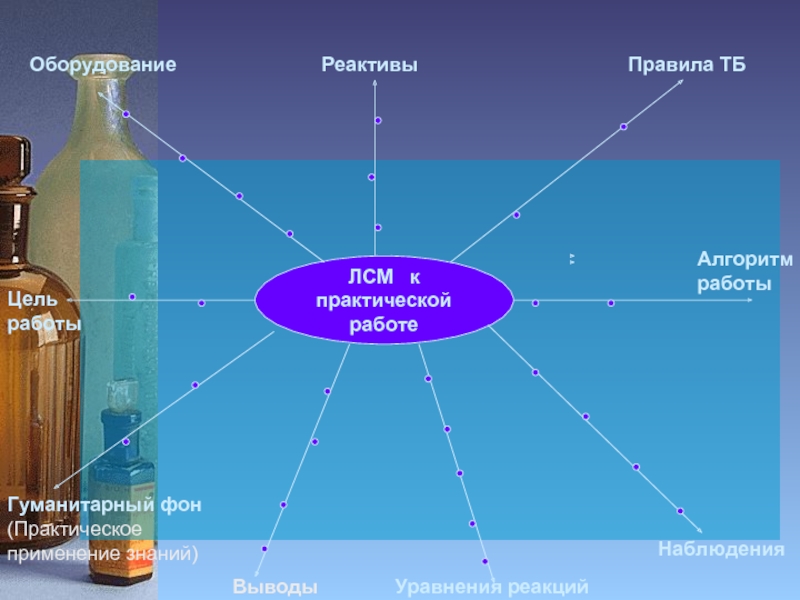
Слайд 2ЛСМ к
практической работе
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Выводы
Алгоритм
работы
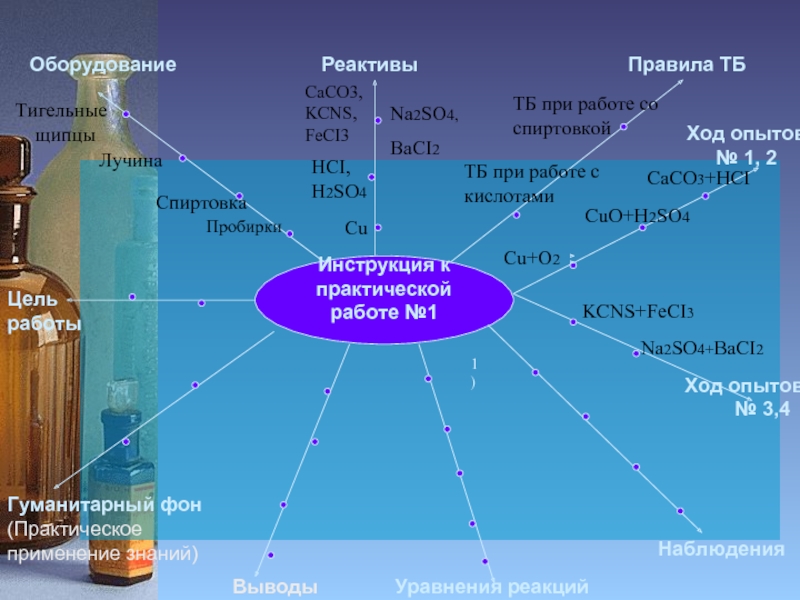
Слайд 3
Инструкция к
практической работе №1
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Ход
Пробирки
Спиртовка
Лучина
Тигельные
щипцы
Cu
HCI,
H2SO4
CaCO3,
KCNS,
FeCI3
Na2SO4,
BaCI2
ТБ при работе со спиртовкой
ТБ при работе с
кислотами
Выводы
Ход опытов
№ 3,4
Cu+O2
CaCO3+HCI
CuO+H2SO4
KCNS+FeCI3
Na2SO4+BaCI2
1)
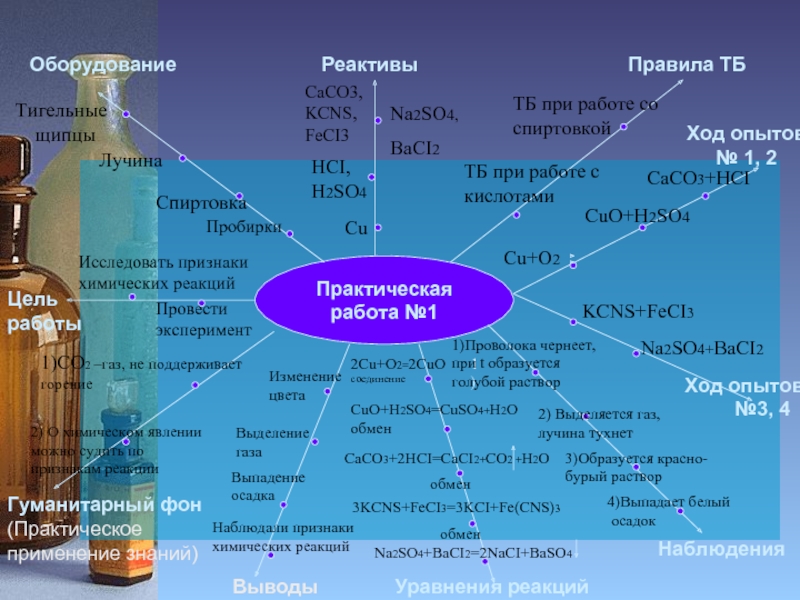
Слайд 4
Практическая работа №1
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Ход опытов
Исследовать признаки
химических реакций
Пробирки
Спиртовка
Провести эксперимент
Лучина
Тигельные
щипцы
Cu
HCI,
H2SO4
CaCO3,
KCNS,
FeCI3
Na2SO4,
BaCI2
ТБ при работе со спиртовкой
ТБ при работе с
кислотами
Выводы
Ход опытов
№3, 4
Cu+O2
CaCO3+HCI
CuO+H2SO4
KCNS+FeCI3
Na2SO4+BaCI2
1)
1)Проволока чернеет, при t образуется голубой раствор
2) Выделяется газ,
лучина тухнет
3)Образуется красно-бурый раствор
4)Выпадает белый
осадок
2Cu+O2=2CuO соединение
CuO+H2SO4=CuSO4+H2O
обмен
CaCO3+2HCI=CaCI2+CO2 +H2O
обмен
3KCNS+FeCI3=3KCI+Fe(CNS)3
обмен
Na2SO4+BaCI2=2NaCI+BaSO4
Изменение цвета
Выделение
газа
Выпадение осадка
Наблюдали признаки
химических реакций
1)CO2 –газ, не поддерживает
горение
2) О химическом явлении можно судить по признакам реакции
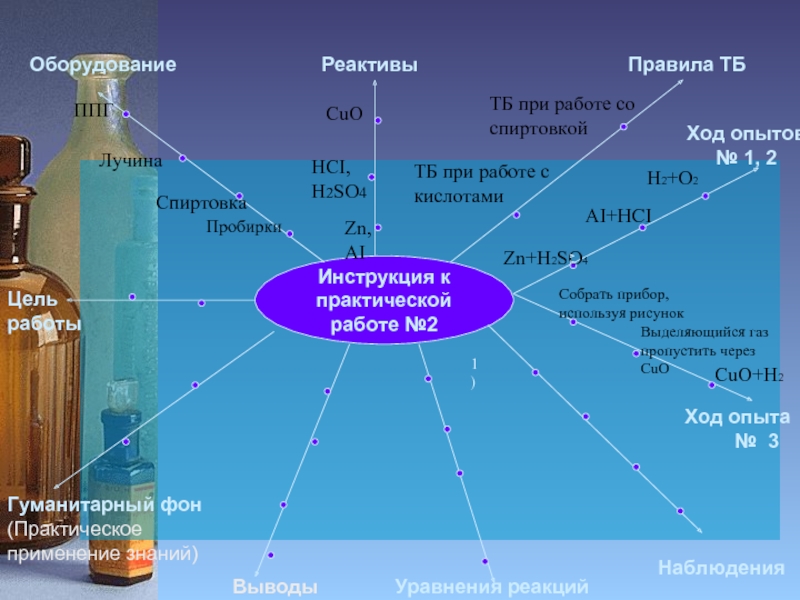
Слайд 6
Инструкция к
практической работе №2
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Ход опытов
Пробирки
Спиртовка
Лучина
ППГ
Zn, АI
HCI,
H2SO4
CuO
ТБ при работе со спиртовкой
ТБ при работе с
кислотами
Выводы
Ход опыта
№ 3
Zn+H2SO4
H2+O2
AI+HCI
Собрать прибор,
используя рисунок
Выделяющийся газ пропустить через CuO
1)
CuO+H2
Слайд 7
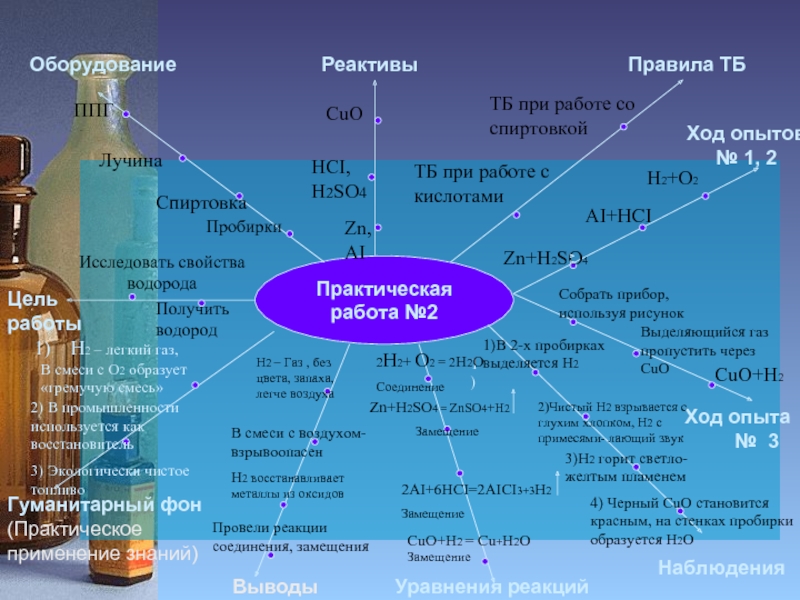
Практическая работа №2
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Ход опытов
Исследовать свойства
водорода
Пробирки
Спиртовка
Получить водород
Лучина
ППГ
Zn, АI
HCI,
H2SO4
CuO
ТБ при работе со спиртовкой
ТБ при работе с
кислотами
Выводы
Ход опыта
№ 3
Zn+H2SO4
H2+O2
AI+HCI
Собрать прибор,
используя рисунок
Выделяющийся газ пропустить через CuO
1)
1)В 2-х пробирках выделяется Н2
2)Чистый Н2 взрывается с глухим хлопком, Н2 с примесями- лающий звук
3)Н2 горит светло-желтым пламенем
4) Черный CuO становится
красным, на стенках пробирки
образуется H2O
Zn+H2SO4 = ZnSO4+H2
Замещение
CuO+H2 = Cu+H2O
Замещение
2AI+6HCI=2AICI3+3H2
Замещение
Н2 – Газ , без цвета, запаха,
легче воздуха
В смеси с воздухом-
взрывоопасен
Н2 восстанавливает металлы из оксидов
Провели реакции соединения, замещения
H2 – легкий газ,
В смеси с О2 образует
«гремучую смесь»
2) В промышленности используется как восстановитель
3) Экологически чистое топливо
CuO+H2
2H2+ O2 = 2H2O
Соединение
Слайд 9
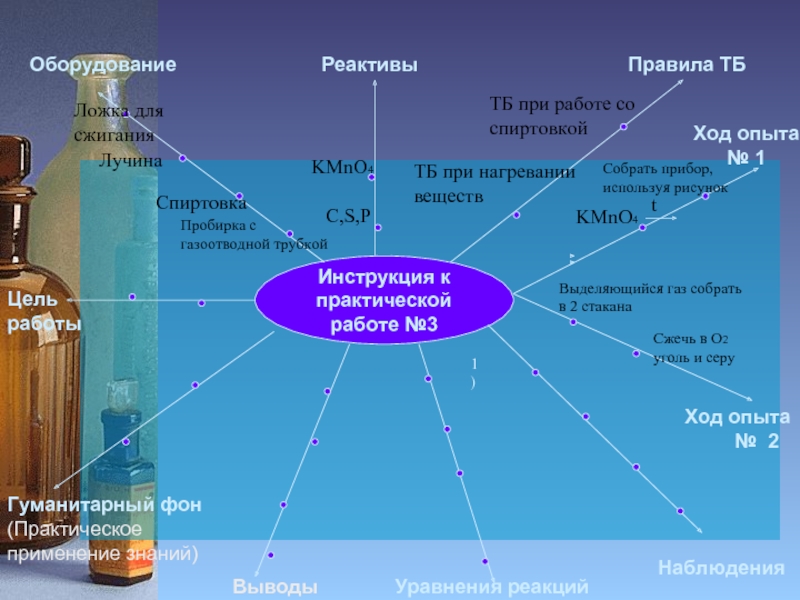
Инструкция к
практической работе №3
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Ход
Пробирка с
газоотводной трубкой
Спиртовка
Лучина
Ложка для сжигания
C,S,P
KMnO4
ТБ при работе со спиртовкой
ТБ при нагревании
веществ
Выводы
Ход опыта
№ 2
Собрать прибор,
используя рисунок
Выделяющийся газ собрать в 2 стакана
1)
KMnO4
t
Сжечь в О2
уголь и серу
Слайд 10
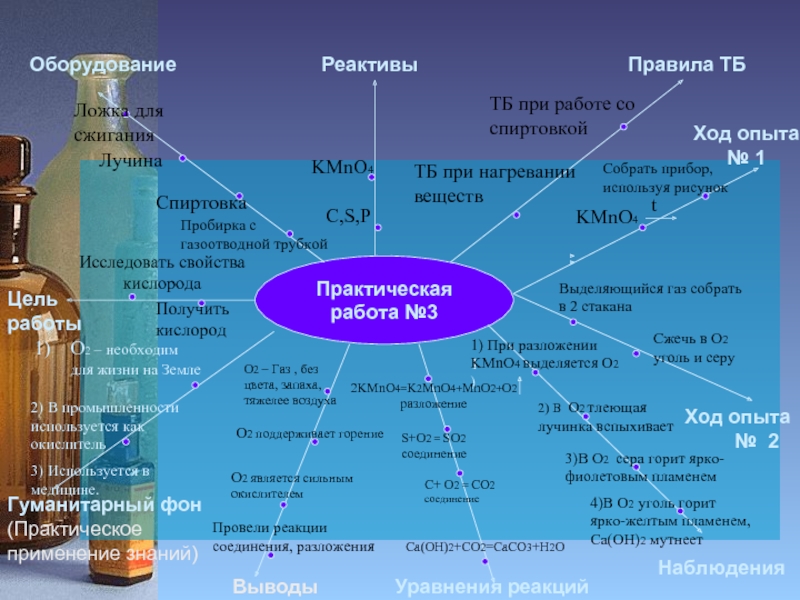
Практическая работа №3
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Ход опыта
Исследовать свойства
кислорода
Пробирка с
газоотводной трубкой
Спиртовка
Получить кислород
Лучина
Ложка для сжигания
C,S,P
KMnO4
ТБ при работе со спиртовкой
ТБ при нагревании
веществ
Выводы
Ход опыта
№ 2
Собрать прибор,
используя рисунок
Выделяющийся газ собрать в 2 стакана
1)
1) При разложении KMnO4 выделяется O2
2) В O2 тлеющая лучинка вспыхивает
3)В О2 сера горит ярко-фиолетовым пламенем
4)В О2 уголь горит
ярко-желтым пламенем,
Ca(OH)2 мутнеет
O2 – Газ , без цвета, запаха, тяжелее воздуха
О2 поддерживает горение
О2 является сильным окислителем
Провели реакции соединения, разложения
О2 – необходим для жизни на Земле
2) В промышленности используется как окислитель
3) Используется в медицине.
KMnO4
t
Сжечь в О2
уголь и серу
2KMnO4=K2MnO4+MnO2+O2 разложение
S+O2 = SO2
соединение
С+ O2 = CO2
соединение
Сa(OH)2+CO2=CaCO3+H2O
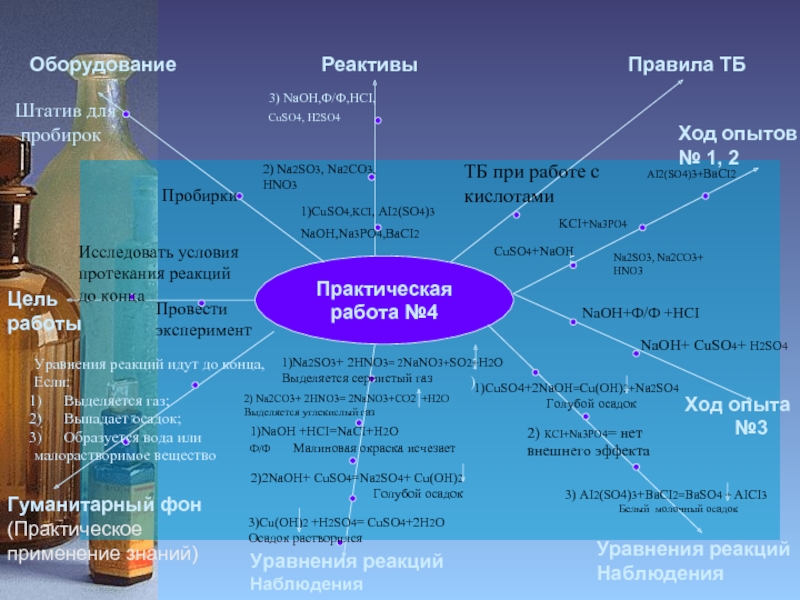
Слайд 12
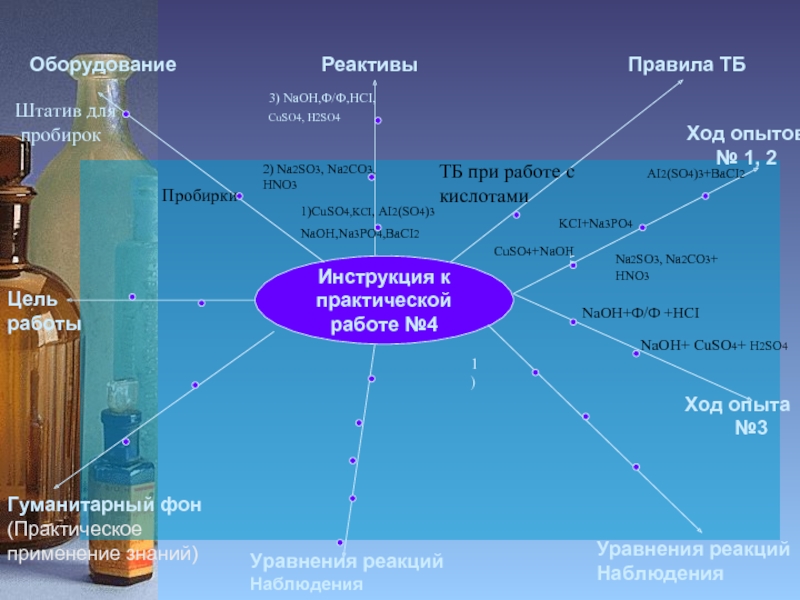
Инструкция к
практической работе №4
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Уравнения
Наблюдения
Ход опытов № 1, 2
Пробирки
Штатив для
пробирок
1)CuSO4,KCI, AI2(SO4)3
NaOH,Na3PO4,BaCI2
2) Na2SO3, Na2CO3,
HNO3
ТБ при работе с кислотами
Ход опыта
№3
AI2(SO4)3+BaCI2
KCI+Na3PO4
NaOH+Ф/Ф +HCI
NaOH+ CuSO4+ H2SO4
1)
3) NaOH,Ф/Ф,HCI,
CuSO4, H2SO4
CuSO4+NaOH
Na2SO3, Na2CO3+
HNO3
Слайд 13
Практическая работа №4
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения
Уравнения реакций
Наблюдения
Ход опытов
Исследовать условия
протекания реакций
до конца
Пробирки
Провести эксперимент
Штатив для
пробирок
1)CuSO4,KCI, AI2(SO4)3
NaOH,Na3PO4,BaCI2
2) Na2SO3, Na2CO3,
HNO3
ТБ при работе с
кислотами
Ход опыта
№3
AI2(SO4)3+BaCI2
KCI+Na3PO4
NaOH+Ф/Ф +HCI
NaOH+ CuSO4+ H2SO4
1)
1)CuSO4+2NaOH=Cu(OH)2+Na2SO4 Голубой осадок
2) KCI+Na3PO4= нет внешнего эффекта
3) AI2(SO4)3+BaCI2=BaSO4 + AICI3
Белый молочный осадок
2) Na2СO3+ 2HNO3= 2NaNO3+СO2 +H2O Выделяется углекислый газ
3) NaOH,Ф/Ф,HCI,
CuSO4, H2SO4
CuSO4+NaOH
Na2SO3, Na2CO3+
HNO3
1)Na2SO3+ 2HNO3= 2NaNO3+SO2+H2O Выделяется сернистый газ
1)NaOH +HCI=NaCI+H2O Ф/Ф Малиновая окраска исчезает
2)2NaOH+ CuSO4=Na2SO4+ Cu(OH)2
Голубой осадок
3)Cu(OH)2 +H2SO4= CuSO4+2H2O
Осадок растворился
Уравнения реакций идут до конца,
Если:
Выделяется газ;
Выпадает осадок;
Образуется вода или
малорастворимое вещество
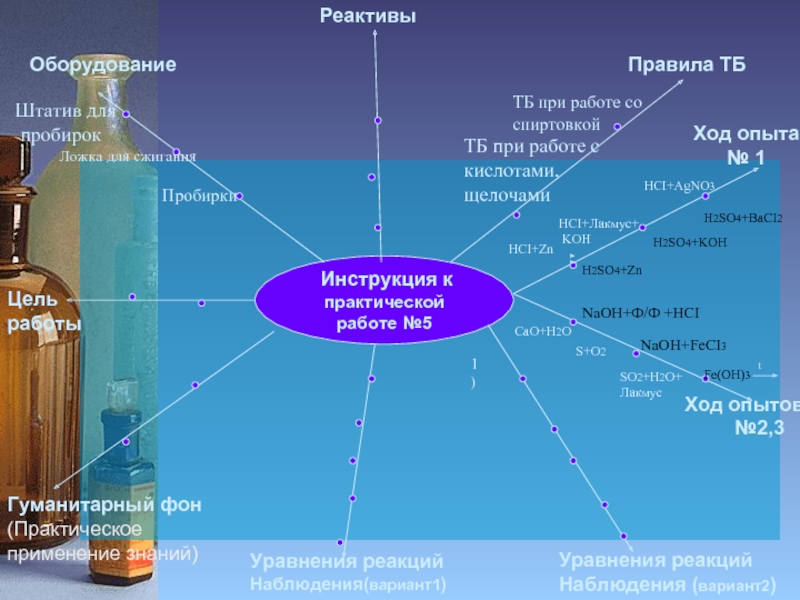
Слайд 15 Инструкция к
практической работе №5
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения
Наблюдения(вариант1)
Уравнения реакций
Наблюдения (вариант2)
Ход опыта № 1
Пробирки
Штатив для
пробирок
ТБ при работе со спиртовкой
ТБ при работе с
кислотами,
щелочами
Ход опытов
№2,3
HCI+AgNO3
HCI+Лакмус+
KOH
NaOH+Ф/Ф +HCI
NaOH+FeCI3
1)
Ложка для сжигания
HCI+Zn
H2SO4+Zn
H2SO4+KOH
H2SO4+BaCI2
Fe(OH)3
t
CaO+H2O
S+O2
SO2+H2O+
Лакмус
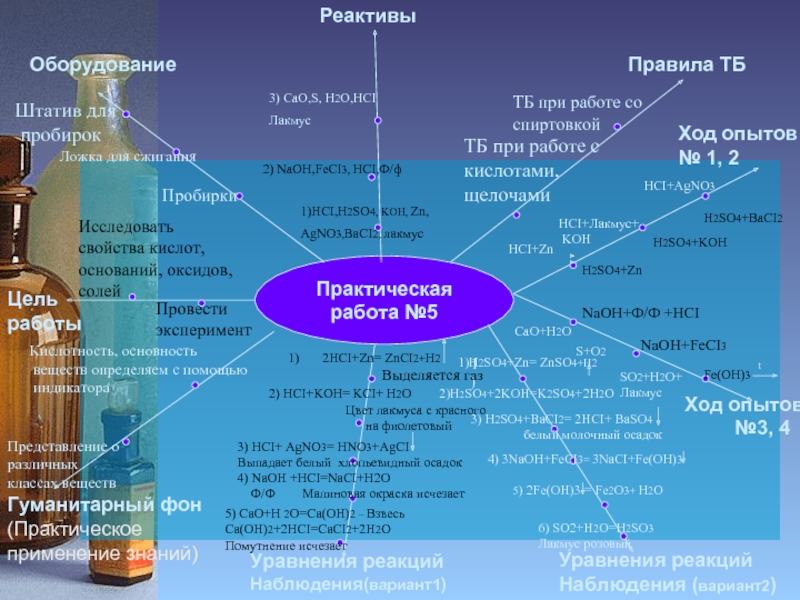
Слайд 16Практическая работа №5
Цель работы
Оборудование
Реактивы
Правила ТБ
Гуманитарный фон
(Практическое применение знаний)
Уравнения реакций
Наблюдения(вариант1)
Уравнения реакций
Наблюдения (вариант2)
Ход
Исследовать свойства кислот, оснований, оксидов, солей
Пробирки
Провести эксперимент
Штатив для
пробирок
1)HCI,H2SO4, KOH, Zn,
AgNO3,BaCI2, лакмус
2) NaOH,FeCI3, HCI,Ф/ф
ТБ при работе со спиртовкой
ТБ при работе с
кислотами,
щелочами
Ход опытов
№3, 4
HCI+AgNO3
HCI+Лакмус+
KOH
NaOH+Ф/Ф +HCI
NaOH+FeCI3
1)
3) CaO,S, H2O,HCI
Лакмус
Ложка для сжигания
HCI+Zn
H2SO4+Zn
H2SO4+KOH
H2SO4+BaCI2
Fe(OH)3
t
CaO+H2O
S+O2
SO2+H2O+
Лакмус
2HCI+Zn= ZnCI2+H2
Выделяется газ
2) HCI+KOH= KCI+ H2O
Цвет лакмуса с красного
на фиолетовый
3) HCI+ AgNO3= HNO3+AgCI
Выпадает белый хлопьевидный осадок
4) NaOH +HCI=NaCI+H2O
Ф/Ф Малиновая окраска исчезает
5) CaO+H 2O=Ca(OH)2 – Взвесь
Ca(OH)2+2HCI=CaCI2+2H2O
Помутнение исчезает
1)H2SO4+Zn= ZnSO4+H2
2)H2SO4+2KOH=K2SO4+2H2O
3) H2SO4+BaCI2= 2HCI+ BaSO4
белый молочный осадок
4) 3NaOH+FeCI3= 3NaCI+Fe(OH)3
5) 2Fe(OH)3 = Fe2O3+ H2O
6) SO2+H2O=H2SO3
Лакмус розовый
Кислотность, основность
веществ определяем с помощью
индикатора
Представление о различных классах веществ