- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Подготовка к ГИА по химии презентация
Содержание
- 1. Подготовка к ГИА по химии
- 2. Работа с материалом Для начала работы нажмите
- 3. Инструкция Часть А состоит из 15 заданий.
- 4. А1 А2 А3 А4 А5 А6 А7
- 5. На приведённом рисунке Следующее задание К
- 6. В каком ряду химических элементов усиливаются неметаллические
- 7. Какой вид химической связи в молекуле фтора?
- 8. В каком соединении степень окисления азота равна
- 9. Вещества, формулы которых – ZnO и Na2SO4,
- 10. Признаком протекания химической реакции между оксидом меди
- 11. Ионы Br− образуются при диссоциации вещества, формула
- 12. Газ выделяется при взаимодействии 1) MgCl2 и
- 13. Не реагируют друг с другом 1) хлор
- 14. Оксид цинка реагирует с каждым веществом пары
- 15. В реакцию с соляной кислотой вступает 1)
- 16. Среди веществ: NaCl, Na2S, Na2SO4 – в
- 17. Верны ли суждения о химическом загрязнении окружающей
- 18. получают 1) хлор 2) аммиак 3) кислород
- 19. Массовая доля азота в нитрате алюминия равна
- 20. В каких рядах химические элементы расположены в
- 21. Для этанола верны следующие утверждения: 1) в
- 22. Установите соответствие между схемой химической реакции и
- 23. Установите соответствие между названием вещества и реагентами,
- 24. Дана схема превращений: CaO → X
- 25. 170 г раствора нитрата серебра смешали с
- 26. Для определения качественного состава неизвестной соли учащимся
- 27. Количество электронных слоев (энергетических уровней) равно номеру
- 28. Объяснение А2 К объяснению А3 К
- 29. Фтор F2 – ковалентная неполярная связь Объяснение
- 30. Объяснение А4 К объяснению А5 К
- 31. Объяснение А5 К объяснению А6 К
- 32. Объяснение А6 К объяснению А7 К
- 33. Объяснение А7 К объяснению А8 К
- 34. Объяснение А8 К объяснению А9 К
- 35. Cl2 Объяснение А9 К объяснению А10
- 36. Объяснение А10 К объяснению А11 К
- 37. Объяснение А11 К объяснению А12 К
- 38. Объяснение А12 К объяснению А13 К
- 39. Объяснение А13 К объяснению А14 К
- 40. Объяснение А14 К объяснению А15 К
- 41. Объяснение А15 К объяснению B1 К
- 42. Объяснение B1 К объяснению B2 К
- 43. Объяснение B2 К объяснению B3 К
- 44. Объяснение B3 К объяснению B4 К
- 45. Объяснение B4 К объяснению C1 К
- 46. Объяснение C1 К объяснению C2 К
- 47. Объяснение C2 К объяснению C3 К
- 48. Объяснение C3 К выбору задания При
Слайд 1Подготовка к ГИА по химии
Демо-версия 2012-проект
Автор: Репетацких Дмитрий Николаевич
Магнитогорск, 2011
Слайд 2Работа с материалом
Для начала работы нажмите кнопку F5 на клавиатуре или
Для перемещения между слайдами используйте гиперссылки
Для перемещения по слайду используйте либо стрелку вправо на клавиатуре, либо левую кнопку мыши, либо колесико прокрутки
Слайд 3Инструкция
Часть А состоит из 15 заданий. На каждое задание только 1
Часть В состоит из 4 заданий. На задания B1 и B2 правильными являются 2 ответа. В заданиях B3 и B4 требуется установить соответствие.
Часть С состоит из 3 заданий без вариантов ответа.
Желаю успеха
Слайд 5На приведённом рисунке
Следующее
задание
К выбору
задания
Задание A1
К объяснению A1
изображена модель атома
1)
2) азота
3) магния
4) фтора
Слайд 6В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых
1) алюминий → фосфор → хлор
2) фтор → азот → углерод
3) хлор → бром → иод
4) кремний → сера → фосфор
Следующее
задание
К выбору
задания
Задание A2
К объяснению A2
Слайд 7Какой вид химической связи в молекуле фтора?
1) ионная
2) ковалентная полярная
3) ковалентная
4) металлическая
Следующее
задание
К выбору
задания
Задание A3
К объяснению A3
Слайд 8В каком соединении степень окисления азота равна +3?
1) Na3N
2) NH3
3) NH4Cl
4)
Следующее
задание
К выбору
задания
Задание A4
К объяснению A4
Слайд 9Вещества, формулы которых – ZnO и Na2SO4, являются соответственно
1) оснόвным оксидом
2) амфотерным гидроксидом и солью
3) амфотерным оксидом и солью
4) оснόвным оксидом и основанием
Следующее
задание
К выбору
задания
Задание A5
К объяснению A5
Слайд 10Признаком протекания химической реакции между оксидом меди и водородом является
1) появление
2) изменение цвета
3) выпадение осадка
4) выделение газа
Следующее
задание
К выбору
задания
Задание A6
К объяснению A6
Слайд 11Ионы Br− образуются при диссоциации вещества, формула которого –
1) AlBr3
2) CH3Br
3)
4) Br2
Следующее
задание
К выбору
задания
Задание A7
К объяснению A7
Слайд 12Газ выделяется при взаимодействии
1) MgCl2 и Ba(NO3)2
2) Na2CO3 и CaCl2
3) NH4Cl
4) CuSO4 и KOH
Следующее
задание
К выбору
задания
Задание A8
К объяснению A8
Слайд 13Не реагируют друг с другом
1) хлор и водород
2) кислород и кальций
3)
4) железо и сера
Следующее
задание
К выбору
задания
Задание A9
К объяснению A9
Слайд 14Оксид цинка реагирует с каждым веществом пары
1) Na2O и H2O
2) SiO2
3) NaOH и HCl
4) HNO3 и O2
Следующее
задание
К выбору
задания
Задание A10
К объяснению A10
Слайд 15В реакцию с соляной кислотой вступает
1) нитрат серебра
2) нитрат бария
3) серебро
4)
Следующее
задание
К выбору
задания
Задание A11
К объяснению A11
Слайд 16Среди веществ: NaCl, Na2S, Na2SO4 – в реакцию с раствором Cu(NO3)2
1) только Na2S
2) NaCl и Na2S
3) Na2S и Na2SO4
4) NaCl и Na2SO4
Следующее
задание
К выбору
задания
Задание A12
К объяснению A12
Слайд 17Верны ли суждения о химическом загрязнении окружающей среды и его последствиях?
А.
Б. Наличие неорганических кислот в промышленных стоках положительно влияет на жизнедеятельность рыб в водоёмах.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Следующее
задание
К выбору
задания
Задание A13
К объяснению A13
Слайд 18получают
1) хлор
2) аммиак
3) кислород
4) хлороводород
В приборе, изображённом на рисунке,
Следующее
задание
К выбору
задания
Задание A14
К объяснению A14
Слайд 19Массовая доля азота в нитрате алюминия равна
1) 19,7%
2) 27,2%
3) 36,8%
4) 54,9%
Следующее
задание
К выбору
задания
Задание A15
К объяснению A15
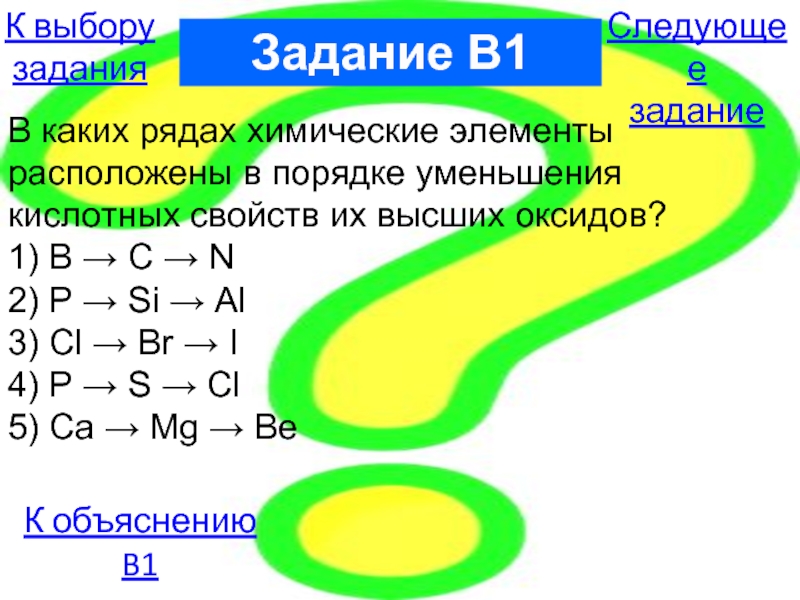
Слайд 20В каких рядах химические элементы расположены в порядке уменьшения
кислотных свойств их
1) В → C → N
2) P → Si → Al
3) Cl → Br → I
4) P → S → Cl
5) Ca → Mg → Be
Следующее
задание
К выбору
задания
Задание B1
К объяснению B1
Слайд 21Для этанола верны следующие утверждения:
1) в состав молекулы входит один атом
2) атомы углерода в молекуле соединены двойной связью
3) является жидкостью (н.у.), хорошо растворимой в воде
4) вступает в реакцию с активными металлами
5) сгорает с образованием угарного газа и водорода
Следующее
задание
К выбору
задания
Задание B2
К объяснению B2
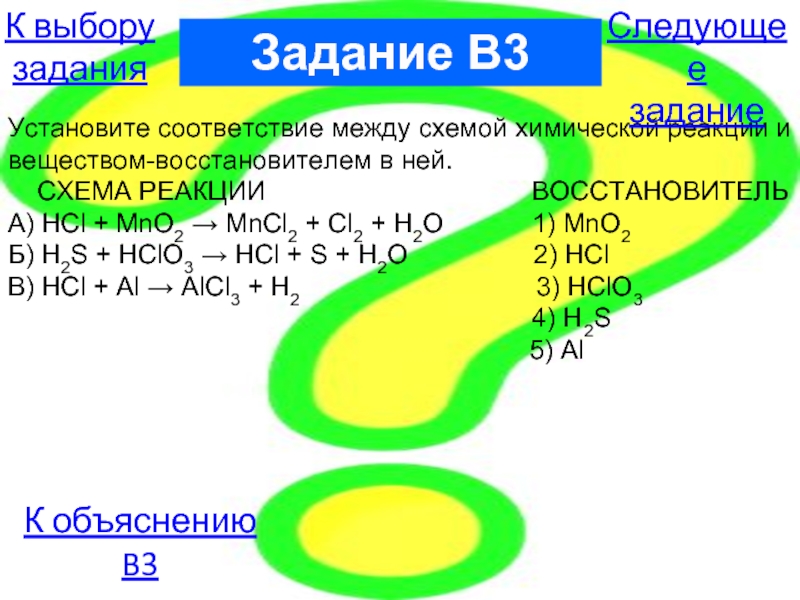
Слайд 22Установите соответствие между схемой химической реакции и веществом-восстановителем в ней.
СХЕМА РЕАКЦИИ ВОССТАНОВИТЕЛЬ
А) HCl + MnO2 → MnCl2 + Cl2 + H2O 1) MnO2
Б) H2S + HClO3 → HCl + S + H2O 2) HCl
В) HCl + Al → AlCl3 + H2 3) HClO3
4) H2S
5) Al
Следующее
задание
К выбору
задания
Задание B3
К объяснению B3
Слайд 23Установите соответствие между названием вещества и реагентами, с которыми это вещество
НАЗВАНИЕ ВЕЩЕСТВА РЕАГЕНТЫ
А) сера 1) CO2, Na2SO4(р-р)
Б) оксид цинка 2) HCl, NaOH(р-р)
В) хлорид алюминия 3) AgNO3(р-р), KOH(р-р)
4) H2SO4(конц.), О2
Следующее
задание
К выбору
задания
Задание B4
К объяснению B4
Слайд 24Дана схема превращений:
CaO → X
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
Следующее
задание
К выбору
задания
Задание C1
К объяснению C1
Слайд 25170 г раствора нитрата серебра смешали с избытком раствора хлорида натрия.
Следующее
задание
К выбору
задания
Задание C2
К объяснению C2
Слайд 26Для определения качественного состава неизвестной соли учащимся выдали белое кристаллическое вещество,
и смесь нагрели. При этом выделился газ с резким запахом. Другую часть соли растворили в воде и к полученному раствору прилили прозрачный раствор нитрата серебра. Образовался белый «творожистый» осадок.
Запишите химическую формулу и название выданной соли. Составьте два уравнения реакций, которые были проведены в процессе её распознавания.
К выбору
задания
Задание C3
К объяснению C3
Слайд 27Количество электронных слоев (энергетических уровней) равно номеру периода (напр., у фосфора
Количество электронов во внешнем электронном слое
(внешнем энергетическом уровне) для элементов главных подгрупп равно номеру группы (напр., у аргона их 8, т.к. главная подгруппа восьмой группы)
Количество протонов равно порядковому номеру (напр., у аргона 18 протонов)
Заряд ядра атома равен порядковому номеру (напр., у Ar №18)
Общее количество электронов равно заряду ядра (напр., у аргона 18 электронов)
Количество нейтронов считается: масса атома минус порядковый номер
(напр., у аргона: 40 – 18 = 22 нейтрона)
Объяснение А1
К объяснению
А2
К выбору
задания
В первом электронном слое помещается 2 электрона, во втором 8
Атом состоит из ядра и электронной оболочки. Ядро состоит из протонов и нейтронов
- атом содержит 9 электронов.
Этот атом фтор (№9 в табл.Менделеева)
Слайд 28Объяснение А2
К объяснению
А3
К выбору
задания
Чем ближе к Fr, тем:
- больше
сильнее металлические свойства
-меньше электро-отрицательность
Чем ближе к F, тем:
- меньше радиус атома
сильнее неметал-
лические свойства
- больше электро-отрицательность
-у металлов: сильнее основные свойства гидроксида
Чем ближе к At, тем:
-у неметаллов: сильнее кислотные свойства бескисло-родных кислот
- сильнее кислотные свойства оксидов
1) алюминий → фосфор → хлор
- приближение к F, неметал-
лические свойства усиливаются
2) фтор → азот → углерод
- отдаление от F, неметаллические свойства ослабевают
3) хлор → бром → иод
- отдаление от F, неметаллические свойства ослабевают
4) кремний → сера → фосфор
- закономерности нет (от Si к S неметаллические свойства усиливаются, от S к P ослабевают
Слайд 29Фтор F2 – ковалентная неполярная связь
Объяснение А3
К объяснению
А4
К выбору
задания
Ионная
Металлическая связь – металлы. Примеры: Ba, Al
Ковалентная полярная связь – между разными неметаллами. Примеры: SO2, HBr
Ковалентная неполярная связь – между одинаковыми неметаллами. Примеры: O3, H2
Слайд 30Объяснение А4
К объяснению
А5
К выбору
задания
Валентность – это число связей, которыми
У Н валентность всегда равна 1, степень окисления почти всегда +1
Степень окисления – это условный заряд атома. Пример: Na+1
Сумма степеней окисления всех атомов в молекуле равна 0
У О валентность всегда равна 2, степень окисления почти всегда -2
У щелочных (Li, Na, K, Rb, Cs и Fr) металлов степень окисления всегда +1, валентность 1; у щелочноземельных металлов (Ca, Sr, Ba, Ra) степень окисления всегда +2, валентность 2
1) Na3 N
-3
+1
2) N H3
-3
+1
3) NH4Cl
-
+
4+
В соединениях двух элементов отрицательную степень окисления проявляет элемент, который ближе к F
1-
3-
-3
4) H N O2
+
1+
-2
4-
3+
+3
Слайд 31Объяснение А5
К объяснению
А6
К выбору
задания
Оксиды – состоят из двух элементов,
Кислоты – состоят из H+ и кислотного остатка
Основания – состоят из металла и OH-
Щелочи – гидроксиды щелочных и щелочноземельных металлов
Соли – состоят из металла и кислотного остатка
Кислые соли – состоят из металла, H+ и кислотного остатка
Основные соли – из металла, OH- и кислотного остатка
Амфотерные оксиды: BeO, ZnO, Al2O3
Основные оксиды: оксиды металлов
Несолеобразующие оксиды: N2O, NO, CO
Кислотные оксиды: оксиды неметаллов
ZnO
- амфотерный оксид
Na2SO4
- соль
Слайд 32Объяснение А6
К объяснению
А7
К выбору
задания
Химические процессы –
изменения состава веществ
-
Физические процессы –
без изменения веществ
- выпадение осадка;
- ржавление металлов;
- скисание молока;
- растворение в кислоте;
- горение …
- растворение в воде;
- изменение агрегатного состояния (кипение, замерзание, конденсация)
- изменение формы, размера …
Запах не появляется (ни вода, ни медь не пахнут)
CuO + H2 =
H2O
+
Cu
Цвет с черного (CuO) меняется на красновато-коричневый (Cu)
Осадок не выпадает
Газ не выделяется
Слайд 33Объяснение А7
К объяснению
А8
К выбору
задания
1) AlBr3 ↔ Al3+ + 3Br-
Диссоциируют
Диссоциация – это распад молекул электролита на ионы.
Например: H2SO4 ↔ 2H+ +SO42- H2SiO3 ↔
Диссоциация может происходить ступенчато. Например:
1) H2SO4 ↔ H+ +HSO4- 2) HSO4- ↔ H+ + SO42-
образуются ионы Br-
2) CH3Br ≠
органические вещества не диссоциируют
3) NaBrO ↔ Na+ + BrO-
ионы Br- не образуются
4) Br2 ≠
неметаллы не диссоциируют
Слайд 34Объяснение А8
К объяснению
А9
К выбору
задания
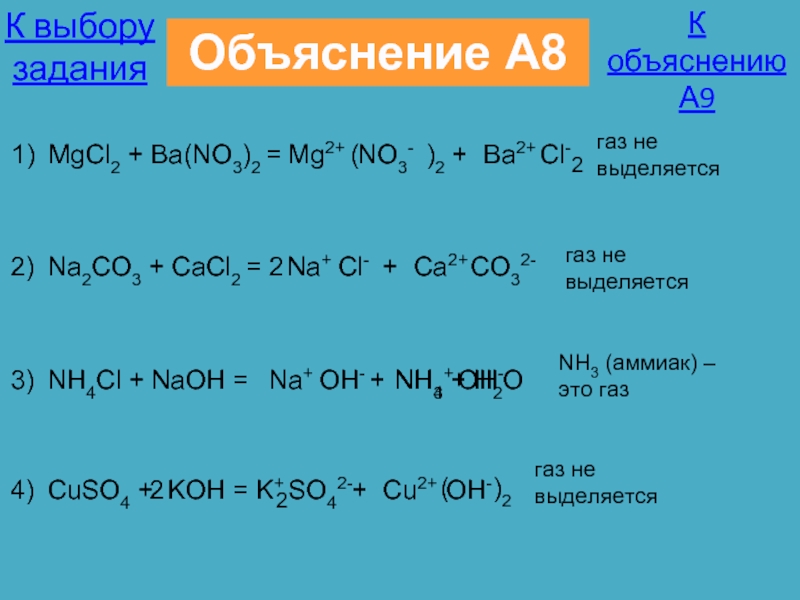
MgCl2 + Ba(NO3)2 =
Mg2+
NO3-
1)
(
+
Ba2+
Cl-
2
газ не выделяется
Na2CO3 + CaCl2 =
Na+
Cl-
2)
+
Ca2+
CO32-
NH3 (аммиак) – это газ
2
NH4Cl + NaOH =
3)
Na+
OH-
+
NH4+
OH-
NH3 + H2O
CuSO4 + KOH =
K+
SO42-
4)
+
Cu2+
OH-
2
газ не выделяется
( )2
газ не выделяется
2
Слайд 35Cl2
Объяснение А9
К объяснению
А10
К выбору
задания
1)
+
H2
=
Неметаллы могут реагировать между собой.
H+
Cl-
2
O2
2)
+
Ca
=
Металлы
Ca2+
O2-
2
2
N2
3)
+
≠
H2O
Некоторые неметаллы (F2, Cl2, Br2) реагируют с водой, азот не реагирует
Fe
4)
+
S
=
Металлы реагируют с неметаллами.
Fe2+
S2-
Слайд 36Объяснение А10
К объяснению
А11
К выбору
задания
1)
ZnO
+
Na2O
=
Na2ZnO2
Амфотерные оксиды
Оксид цинка ZnO – амфотерный оксид
ZnO
+
H2O
≠
Оксиды реагируют с водой только если получается растворимый гидроксид
2)
ZnO
+
SiO2
=
ZnSiO3
Амфотерные оксиды могут реагировать с кислотными
ZnO
+
Ag
≠
Ag – менее активный металл, чем Zn
3)
ZnO
+
NaOH
=
Na2ZnO2
+
H2O
2
Амфотерные оксиды могут реагировать с основаниями
ZnO
+
HCl
=
Zn2+
Cl-
2
+
H2O
2
Амфотерные оксиды могут реагировать с кислотами
4)
ZnO
+
HNO3
=
Zn2+
NO3-
( )2
+
H2O
2
Амфотерные оксиды могут реагировать с кислотами
ZnO
+
O2
≠
Оксиды реагируют с кислородом, если элемент находится не в максимальной степ.окисл.
Слайд 37Объяснение А11
К объяснению
А12
К выбору
задания
1)
HCl
+
AgNO3
=
Ag+
Cl-
+
H+
NO3-
↓
Реакции обмена возможны, если получается осадок,
2)
HCl
+
Ba(NO3)2
≠
Реакции обмена возможны, если получается осадок, газ или вода
3)
HCl
+
Ag
≠
Неокислительные кислоты с металлами правее H нет реагируют
4)
HCl
+
SiO2
≠
HCl – кислота, SiO2 – кислотный оксид
Слайд 38Объяснение А12
К объяснению
А13
К выбору
задания
NaCl
+
Cu(NO3)2
≠
Реакции обмена возможны, если получается осадок,
Na2S
+
Cu(NO3)2
=
Cu2+
S2-
+
Na+
NO3-
2
Реакции обмена возможны, если получается осадок, газ или вода
Na2SO4
+
Cu(NO3)2
≠
Реакции обмена возможны, если получается осадок, газ или вода
↓
Слайд 39Объяснение А13
К объяснению
А14
К выбору
задания
А. Повышенное содержание в атмосфере оксидов
Верное суждение. Например, оксиды азота могут реагировать с водой с образованием кислот
Б. Наличие неорганических кислот в промышленных стоках положительно влияет на жизнедеятельность рыб в водоёмах.
Неверное суждение. Рыбы живут при определенной кислотности. Повышенная кислотность приводит к их гибели
Слайд 40Объяснение А14
К объяснению
А15
К выбору
задания
Рассмотрим рисунок.
Выделяющийся газ находится в контакте
Хлор, аммиак и хлороводород растворимы в воде
Кислород в воде растворяется плохо, его можно собирать методом вытеснения воды
Слайд 41Объяснение А15
К объяснению
B1
К выбору
задания
Массовая доля ω – это отношение
ω (N в Al(NO3)3)
=
27
42
144
По таблице Менделеева масса атома алюминия – 27, атома азота – 14, атома кислорода – 16. В Молекуле Al(NO3)3 1 атом алюминия, 3 атома азота и 9 атомов кислорода.
42
213
=
0,197
=
19,7%
Слайд 42Объяснение B1
К объяснению
B2
К выбору
задания
Чем ближе к Fr, тем:
- больше
сильнее металлические свойства
-меньше электро-отрицательность
Чем ближе к F, тем:
- меньше радиус атома
сильнее неметал-
лические свойства
- больше электро-отрицательность
1) В → C → N
-у металлов: сильнее основные свойства оксида и гидроксида
Чем ближе к At, тем:
-у неметаллов: сильнее кислотные свойства бескисло-родных кислот
- сильнее кислотные свойства оксидов и кислородсодержа-щих кислот
- приближение к F, кислотные свойства оксидов усиливаются, основные ослабевают
2) P → Si → Al
- приближение к Fr, кислотные свойства оксидов ослабевают, основные усиливаются
3) Cl → Br → I
- приближение к Fr, кислотные свойства оксидов ослабевают, основные усиливаются
4) P → S → Cl
- приближение к F, кислотные свойства оксидов усиливаются, основные ослабевают
5) Ca → Mg → Be
- приближение к Fr, кислотные свойства оксидов ослабевают, основные усиливаются
Слайд 43Объяснение B2
К объяснению
B3
К выбору
задания
Этанол CH3-CH2-OH:
- бесцветная жидкость со слабым
- неограниченно растворяется в воде;
- оказывает опьяняющее действие;
- уничтожает бактерии (дезинфицирует);
- горит: C2H5OH+O2→2CO2+3H2O
реагирует с активными металлами, напр.: 2C2H5OH+2Na=2C2H5ONa+H2
1) в состав молекулы входит один атом углерода - неверно
2) атомы углерода в молекуле соединены двойной связью - неверно
3) является жидкостью (н.у.), хорошо растворимой в воде - верно
4) вступает в реакцию с активными металлами – верно
5) сгорает с образованием угарного газа и водорода - неверно
Слайд 44Объяснение B3
К объяснению
B4
К выбору
задания
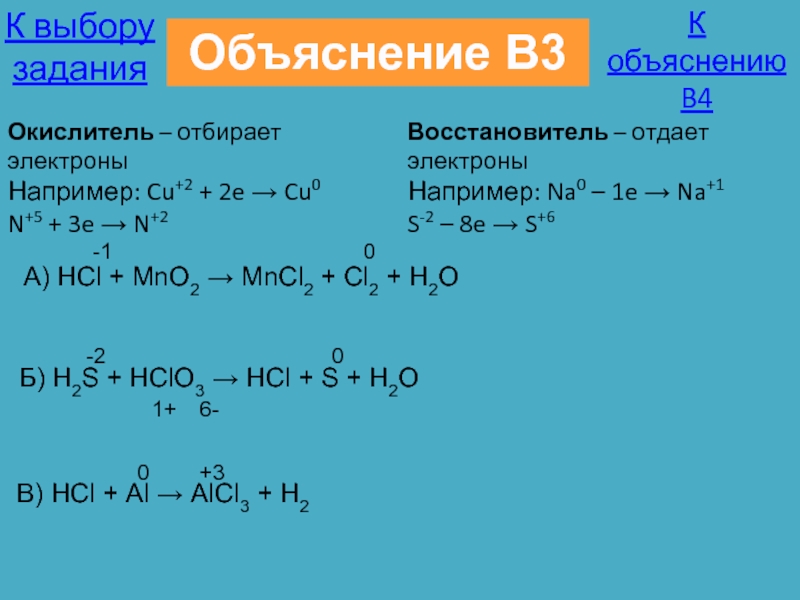
A) HCl + MnO2 → MnCl2
-1
0
Окислитель – отбирает электроны
Например: Cu+2 + 2e → Cu0
N+5 + 3e → N+2
Восстановитель – отдает электроны
Например: Na0 – 1e → Na+1
S-2 – 8e → S+6
Б) H2S + HClO3 → HCl + S + H2O
6-
-2
1+
0
В) HCl + Al → AlCl3 + H2
0
+3
Слайд 45Объяснение B4
К объяснению
C1
К выбору
задания
А)
S
+
CO2
≠
с оксидами из неметаллов реагируют только
S
+
Na2SO4
≠
неметаллы с солями не реагируют
S
+
HCl
≠
неметаллы с соляной кислотой не реагируют
S
+
NaOH
≠
неметаллы с основаниями не реагируют
S
+
AgNO3
≠
неметаллы с солями не реагируют
S
+
KOH
≠
неметаллы с основаниями не реагируют
S
+
H2SO4 (конц.)
=
SO2 + H2O
В H2SO4 сера находится в степени окисления +6. Она может окислить S0 до промежуточной степени окисления +4
S
+
O2
=
SO2
неметаллы реагируют между собой
Б)
ZnO
+
CO2
=
ZnCO3
амфотерные оксиды реагируют с кислотными
ZnO
+
Na2SO4
≠
оксиды с солями не реагируют
ZnO
+
HCl
=
ZnCl2
+
H2O
2
амфотерные оксиды реагируют с кислотами
ZnO
+
NaOH
=
Na2ZnO2
+
H2O
2
амфотерные оксиды реагируют с основаниями
ZnO
+
AgNO3
≠
оксиды с солями не реагируют
ZnO
+
KOH
=
K2ZnO2
+
H2O
2
амфотерные оксиды реагируют с основаниями
ZnO
+
H2SO4
=
ZnSO4
+
H2O
амфотерные оксиды реагируют с кислотами
ZnO
+
CO2
≠
с кислородом реагируют оксиды, в которых элемент находится не в максимальной степени окисления
В)
AlCl3
+
CO2
≠
соли с оксидами не реагируют
AlCl3
+
Na2SO4
≠
реакции обмена возможны, если получается осадок, газ или вода
AlCl3
+
HCl
≠
реакции обмена возможны, если получается осадок, газ или вода
AlCl3
+
NaOH
=
Al(OH)3
+
NaCl
3
3
↓
реакции обмена возможны, если получается ↓, ↑ или вода
AlCl3
+
AgNO3
=
Al(NO3)3
+
AgCl
3
3
↓
реакции обмена возможны, если получается ↓, ↑ или вода
AlCl3
+
KOH
=
Al(OH)3
+
KCl
3
3
↓
реакции обмена возможны, если получается ↓, ↑ или вода
AlCl3
+
H2SO4
≠
реакции обмена возможны, если получается осадок, газ или вода
AlCl3
+
O2
≠
соли с кислородом не реагируют
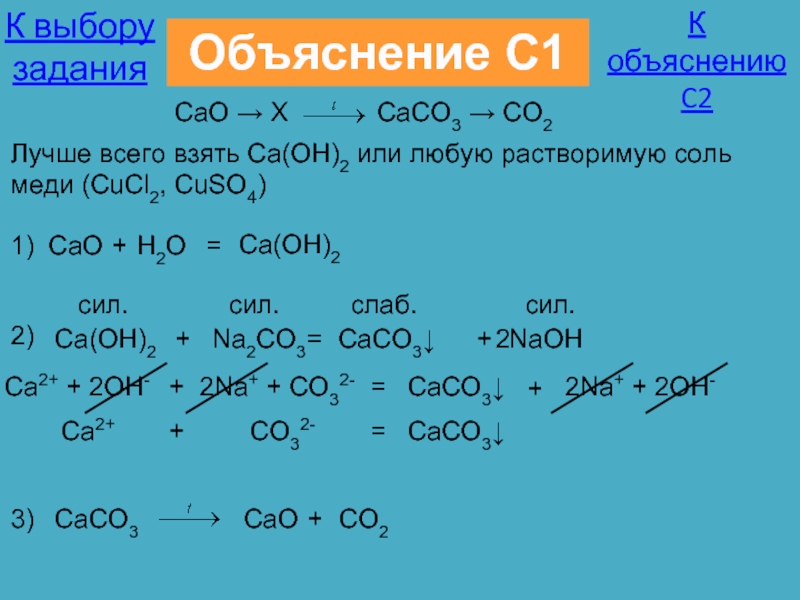
Слайд 46Объяснение C1
К объяснению
C2
К выбору
задания
CaO → X
Лучше всего взять Ca(OH)2 или любую растворимую соль меди (CuCl2, CuSO4)
1)
CaO
+
H2O
=
Ca(OH)2
2)
Ca(OH)2
+
=
CaCO3↓
Na2CO3
+
NaOH
2
сил.
сил.
слаб.
сил.
Ca2+ + 2OH-
+
2Na+ + CO32-
=
CaCO3↓
+
2Na+ + 2OH-
Ca2+
+
CO32-
=
CaCO3↓
3)
CaCO3
CaO
+
CO2
Слайд 47Объяснение C2
К объяснению
C3
К выбору
задания
Дано:
m(AgNO3)=170 г
m(осадка)=8,61 г
ω (AgNO3) -
Решение:
AgNO3
+
NaCl
=
AgCl
+
NaNO3
Найдем количество известного вещества
n(AgCl) =
m
M
=
8,61
143,5
=
0,06
моль
Найдем количество неизвестного вещества
n(AgCl)
1
=
n(AgNO3)
1
n(AgNO3)
=
n(AgCl)
1
1
=
1
0,06
1
=
0,06
моль
m(AgNO3)=
n
M
Молярная масса. Считается по таблице Менделеева
=
0,06
108
35,5
170
=
10,2
г
ω (K2CO3) =
mв
mр
=
10,2
170
=
0,06
=
6%
Ответ: 6%
108
14
48
Известное вещество – AgCl (осадок). Его 8,61 г. Для AgNO3 известна только масса раствора.
Слайд 48Объяснение C3
К выбору
задания
При реакции с гидроксидом кальция может выделяться только
Значит вещество содержит NH4+
NH4Cl
+
Ca(OH)2
=
CaCl2
+
NH4OH
NH3↑ + H2O
При реакции с нитратом серебра может выделяться только хлорид серебра (белый творожистый осадок)
Значит вещество содержит Cl-
Значит это вещество – NH4Cl
2
2
2
NH4Cl
+
AgNO3
=
NH4NO3
+
AgCl↓